多奈哌齐(donepezil, Don)和加兰他敏(galan tamine, Gal)作为乙酰胆碱酯酶抑制剂(acetylcholi nesterase inhibitors, AChEIs), 是广泛应用于轻、中度阿尔茨海默病和血管性痴呆治疗、改善患者认知能力和全脑功能的药物, 它们的临床作用机制被认为是基于其胆碱酯酶抑制活性, 提高突触间隙的乙酰胆碱水平, 从而发挥提高记忆能力和改善认知损伤的作用效果。近年来有研究表明, 多奈哌齐和加兰他敏可以减轻氧糖剥夺导致的神经元损伤并减小脑缺血动物的脑梗死体积[1, 2]。然而, 值得注意的是, 有研究[3]表明多奈哌齐的这种神经保护作用可能并不完全依赖于其胆碱酯酶抑制活性或N型受体激动活性, 因为它的神经保护作用并不能被M型受体阻断剂东莨菪碱和N型受体阻断剂美加明所阻断。因此, 提示多奈哌齐和加兰他敏发挥脑缺血保护作用的机制可能十分复杂。
长期以来, 脑缺血机制的研究一直围绕着以“神经元为中心”的学术体系而展开, 但是基于该观点的大量临床试验表明, 大部分神经保护剂在脑缺血导致的神经损伤和促进功能恢复中并没有表现出理想的临床疗效, 提示单纯用神经元损伤机制并不能完全解释脑缺血的复杂机制, 需要对脑缺血状态下神经元所处的环境进行全面研究。脑缺血损伤过程中所有细胞类型(包括胶质细胞和血管内皮细胞等)均会受影响, 因此, 值得思考的问题是: ① 脑缺血后非神经元细胞的状态或和功能的改变是否影响神经元?② 同样地, 脑缺血后神经元的损伤是否也可影响其他细胞类型的状态或功能?
星形胶质细胞作为脑内数量最多的细胞类型, 有其重要的生理和病理学意义。星形胶质细胞在脑缺血后大量活化, 表现出多种调节功能, 包括K+的缓冲、谷氨酸再摄取、自由基清除、营养支持和炎症反应等, 其中一些功能对神经元的存活是有利的。因此, 深入研究脑缺血后星形胶质细胞与神经元之间的相互作用机制对脑缺血的治疗具有重要的意义。
因此, 本课题组成功地建立了体外大鼠神经元-星形胶质细胞共培养模型, 并在该共培养模型的基础上研究Don和Gal对氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation, OGD/R)所致神经元凋亡的保护作用及其可能的作用机制, 以阐明Don和Gal发挥脑缺血保护作用的机制。
材料与方法动物 新生24 h内的Wistar乳鼠(SPF级), 购于北京维通利华实验动物技术有限公司, 动物证号SCXK (京) 2011-0011。全部实验和操作过程均符合中国医学科学院、北京协和医学院动物保护委员会规定的相关条例。
药品和试剂 Don和Gal均购于中国食品药品检定研究院。DMEM/F12培养基、DMEM培养基、Neurobasal-A培养基、B27、Annexin V/PI细胞凋亡流式检测试剂盒均购自Invitrogen公司; BDNF和NGF的ELISA试剂盒购自武汉博士德生物公司; 磷酸化TrkA/B (p-TrkA/B)抗体、磷酸化Akt (p-Akt)抗体、磷酸化ERK (p-ERK)抗体、磷酸化CREB (p-CREB)抗体和PI3K (p85) 抗体均购自Cell Signaling Technology公司; 抗小鼠IgG和抗兔IgG购自中山金桥生物公司; 阿糖胞苷购自Sigma-Aldrich公司。
星形胶质细胞的原代培养 将新生24 h内的Wistar乳鼠的皮层组织取出, 将其中的脑膜剥除, 并在37 ℃下经0.25%胰酶消化20 min, 终止消化后并离心, 并将沉淀重悬于10%胎牛血清的DMEM/F12培养基, 接种于包被多聚赖氨酸的培养瓶中, 置于37 ℃培养箱中进行培养。接种24 h后, 换全液。之后每3天进行半量换液。约12天后, 待星形胶质细胞铺满培养瓶底部时, 使用0.25%胰酶消化3~5 min, 并收集星形胶质细胞, 以每毫升4×105个的细胞密度接种于transwell (Corning, 0.4 μm, 3460) 的上室, 备用[4]。
大鼠皮层神经元的原代培养 按照改进后的Kaech等[5]报道的方法, 从新生24 h内的Wistar乳鼠分离大鼠海马神经元。取出乳鼠的海马组织, 将其中的脑膜剥除, 并在37 ℃下经0.25%胰酶消化20 min以获得神经元。然后, 将神经元悬浮于含有10%马血清和10%胎牛血清的DMEM培养基中并接种于经多聚赖氨酸包被的transwell下室, 接种密度为每毫升4×105个。4 h后换液, 更换培养基为加入2% B27的Neurobasal-A培养基。于第2天加入10 μmol·L-1阿糖胞苷, 并于第3天换全液以弃去阿糖胞苷。同时, 放入接种有星形胶质细胞的transwell的上室, 进行神经元-星形胶质细胞共培养。培养至第7天, 进行后续实验。
神经元-星形胶细胞共培养体系 按上述方法进行星形胶质细胞原代培养, 10~12天后将分离纯化后的星形胶质细胞经0.125%胰酶消化, 调整密度为每毫升5×105个, 接种于transwell培养皿上, 培养基更换为共培养用培养基(Neurobasal-A+2% B27+0.5 mmol·L-1 GlutaMax), 备用。神经元按上述方法培养至第5天时, 将已制备好的含有星形胶质细胞层的transwell上室插入至接种有神经元的transwell下室的上方, 以形成神经元-星形胶质细胞共培养体系, 共培养3天后进行相关实验研究。
OGD/R模型 将待进行OGD/R处理的共培养体系使用无糖D-Hank’s液洗涤2遍, 更换培养基为无糖DMEM培养基; 将共培养体系放入37 ℃含有94% N2、5% CO2和1% O2的三气培养箱中(Thermo Scientific公司), 维持2 h时间后, 将细胞培养基更换为正常的共培养用培养基, 并将其放入37 ℃含氧浓度正常且CO2含量为5%的细胞培养箱中进行复氧, 继续培养24 h。
流式细胞术 将经OGD/R处理的(OGD/R组)和未经正常培养的(对照组)共培养体系中的神经元和单独培养的神经元分别使用0.125%胰酶进行消化, PBS洗2~3次, 制成单细胞悬液, 800 r·min-1离心5 min, 使细胞沉淀, 并使用Annexin V/PI细胞凋亡流式检测试剂盒内1×Annexin V结合缓冲液使细胞重悬, 调整细胞密度至每毫升1×106个, 体积为100 μL; 在每100 μL细胞悬液中加入1×Annexin V工作液5 μL和1×PI工作液1 μL, 室温避光孵育15 min; 孵育结束, 加入1×Annexin V结合缓冲液400 μL, 轻轻混匀后置于冰上; 将细胞悬液转至流式检测管内, 上机检测, FL1检测530 nm激发光, FL3检测 > 575 nm的激发光。
ELISA检测 细胞经相应处理后(对照组和OGD/R组), 收集细胞上清液, 8 000 r·min-1离心3 min, 除去细胞碎片, 使用大鼠BDNF和NGF ELISA试剂盒检测细胞上清中BDNF和NGF的含量。经处理后的神经元或星形胶质细胞加入细胞裂解液, 置冰上裂解30 min, 12 000 ×g离心10 min, 所得上清即为胞浆蛋白。采用BCA法对胞浆蛋白进行蛋白定量。并采用大鼠BDNF和NGF ELISA试剂盒检测胞浆蛋白中BDNF和NGF的含量。
Western blot分析 接种于transwell的神经元或星形胶质细胞, 经相应处理后每孔加入细胞裂解液200~300 μL, 置冰上裂解30 min, 12 000 ×g离心10 min, 所得上清即为细胞总蛋白, 以上操作均在4 ℃进行。采用BCA法进行蛋白定量。然后, 进行SDS-PAGE电泳, 随后转到PVDF膜上。5% BSA封闭2 h后, 4 ℃下与p-TrkA/B、p-CREB、p-Akt、p-ERK和PI3K (p85) 杂交过夜, 常温下孵育二抗2 h, TBST洗涤3次, 加入ECL发光液, 放入LAS-3000凝胶成像仪进行检测。用Bio-rad quantity one密度分析软件对图像中蛋白条带进行灰度分析。目的蛋白相对含量=目的条带灰度值/ β-actin条带灰度值。
统计分析 所有结果以means ± SEM表示。采用单因素方差分析(one-way ANOVA), 结合Dunnett’s post hoc test检验, 比较各组间差异, P < 0.05认为存在显著性差异。
结果 1 星形胶质细胞减少OGD/R诱导的神经元凋亡在中枢神经系统中, 星形胶质细胞始终伴随着神经元的整个发育过程, 所以神经元与星形胶质细胞之间的相互作用对于阐明神经系统疾病的机制十分重要, 特别是对于脑缺血损伤。因此, 本研究通过使用transwell小室建立神经元-星形胶质细胞共培养体系, 同时建立体外OGD/R模型以模拟脑缺血条件。
研究中应用Annexin V/PI流式细胞术对OGD/R后神经元的凋亡情况进行考察, 结果如图 1所示。与对照组相比, OGD/R后单独培养的神经元和共培养体系中的神经元均出现明显的凋亡。OGD/R后单独培养的神经元的凋亡率从8.8%增加至44.8%, 而OGD/R后共培养体系中的神经元的凋亡率从10.5%增加至27.8%, 并且与单独培养的神经元相比, 共培养体系中神经元的凋亡率降低了17.0% (P < 0.01)。提示在OGD/R过程中, 星形胶质细胞对神经元的凋亡起到了保护作用。
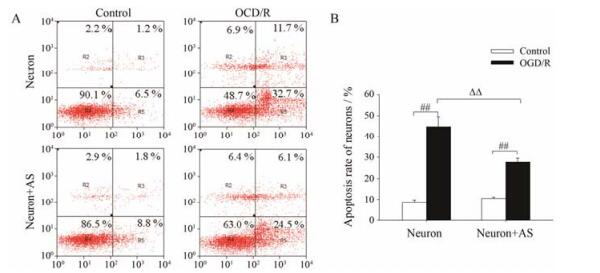
|
Figure 1 Effect of oxygen-glucose deprivation/reoxygenation (OGD/R) on neuron apoptosis in neurons mono-culture (Neuron) and neuron-astrocyte co-culture (Neuron+AS) system. Neuron apoptosis were examined by flow cytometry analysis. A: Representative flow cytometry analysis of neuron apoptosis. B: Quantitative determination of apoptotic rate of neurons. Values were expressed as percentages compared to the control group (set to 100%), and represented as mean ± SEM (n = 4). ##P < 0.01 vs control group; ΔΔP < 0.01 vs OGD/R group of Neuron |
另外, 采用Hoechst 33342荧光染色法检测神经元凋亡的情况, 其结果与上述流式的结果趋势相一致(数据未给出)。
2 Don和Gal通过星形胶质细胞发挥神经元保护作用为了探索Don和Gal在星形胶质细胞存在下对OGD/R诱导的神经元凋亡的作用, 在OGD/R刺激的同时分别向神经元-星形胶质细胞共培养体系中加入Don (1和10 μmol·L-1)和Gal (1和10 μmol·L-1), 并使用Annexin V/PI流式细胞术检测OGD/R后神经元的凋亡, 结果如图 2A所示。经OGD/R刺激后, 共培养体系中神经元的凋亡率为27.8%, 而加入Don (10 μmol·L-1)使共培养体系中神经元的凋亡率降低至20.5%。然而, 在没有星形胶质细胞的存在下, 即在单独培养的神经元体系中, Don (10 μmol·L-1)使OGD/R诱导的神经元凋亡率降低至25.8% (图 2B), 表明Don对OGD/R导致的神经元凋亡的保护作用, 部分与星形胶质细胞相关。
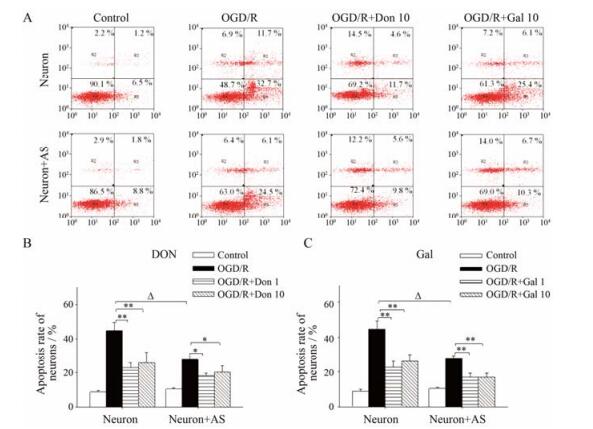
|
Figure 2 Donepezil (Don, 1 or 10 μmol·L-1) and galantamine (Gal, 1 or 10 μmol·L-1) inhibited OGD/R-induced neuron apoptosis in Neuron and Neuron+AS system. Neuron apoptosis were examined by flow cytometry analysis. A: Representative flow cytometry analysis of neuron apoptosis. B, C: Quantitative determination of apoptotic rate of neurons. Values were expressed as percentages compared to the control group (set to 100%), and represented as mean ± SEM (n = 4). **P < 0.01 vs OGD/R group; ΔP < 0.05 vs OGD/R group of Neuron |
Gal也表现出与Don相似的结果, 具体如图 2C所示, 加入Gal (10 μmol·L-1)使共培养体系中神经元的凋亡率降低至17.0%, 在没有星形胶质细胞的存在下, Gal (10 μmol·L-1)使OGD/R诱导的神经元凋亡率降低至26.1%。这表明Gal对OGD/R导致的神经元凋亡的保护作用也可能与星形胶质细胞相关。
另外, 采用Hoechst 33342荧光染色法检测神经元凋亡的情况, 其结果与上述流式的结果趋势相一致(数据未给出)。
3 Don和Gal对OGD/R后神经元凋亡通路相关蛋白的影响为了进一步探索Don和Gal抗凋亡作用的具体机制, 用Western blot法考察其对OGD/R后共培养体系中神经元内caspase 3、Bcl-2和Bax的影响(图 3)。与OGD/R组相比, Don (10 μmol·L-1)和Gal (10 μmol·L-1)可以明显降低神经元内cleaved-caspase 3的表达, 并显著增加抗凋亡蛋白Bcl-2的表达, 而对Bax蛋白表达均没有明显的作用。以上结果表明, Don和Gal可以通过降低OGD/R后神经元内cleaved-caspase 3的水平并提高抗凋亡蛋白Bcl-2的表达而发挥抗神经元凋亡作用。
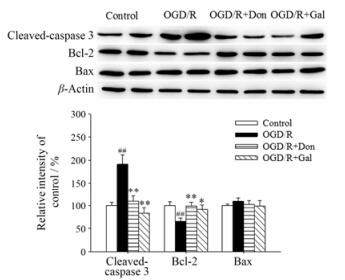
|
Figure 3 Don (10 μmol·L-1) and Gal (10 μmol·L-1) reduced cleaved-caspase 3 and increased Bcl-2 expression in neurons after OGD/R in Neuron+AS system. Quantified results were normalized to β-actin expression. Values were expressed as percentages compared to the control group (set to 100%), and represented as mean ± SEM (n = 8). ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs OGD/R group |
星形胶质细胞的一个重要功能是通过分泌神经营养因子(如BDNF和NGF等), 为神经元提供营养支持。因此, 使用ELISA法检测OGD/R后单独的神经元培养上清和共培养体系上清中BDNF和NGF的水平, 以说明BDNF和NGF分泌的情况。同时, 还分别检测了OGD/R后神经元和星形胶质细胞的胞浆中BDNF和NGF的水平, 以说明两者的合成情况。
图 4A~D显示, 在单独培养的神经元体系和单独培养的星形胶质细胞体系中, OGD/R导致神经元分泌和合成BDNF和NGF的量明显减少, 而星形胶质细胞分泌和合成的BDNF和NGF代偿性增加。并且, 与OGD/R组相比, Don和Gal仅可以轻度促进神经元合成和分泌BDNF和NGF。然而, 在神经元-星形胶质细胞共培养体系中, 与OGD/R组相比, Don和Gal均可以明显增加BDNF和NGF的分泌, 特别是可以明显促进星形胶质细胞合成BDNF和NGF; 同时在一定程度上也促进BDNF和NGF在神经元内的合成, 但是它们在星形胶质细胞中合成的量远远高于在神经元中合成的量。这提示, Don和Gal在正常情况下对神经营养因子的影响不大, 但在氧糖剥夺后显著增强星形胶质细胞合成BDNF和NGF的功能, 对神经元凋亡发挥保护作用。
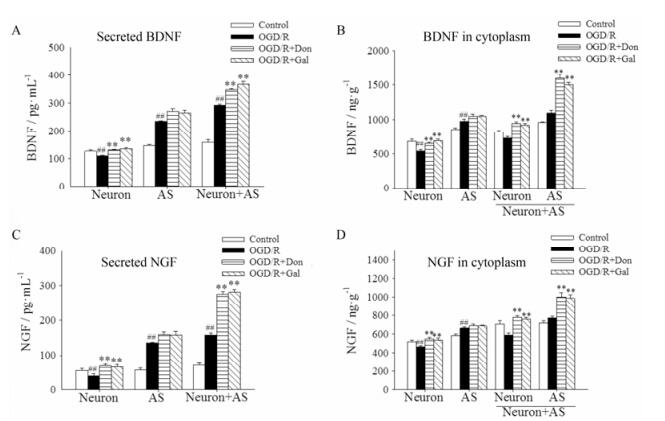
|
Figure 4 Don (10 μmol·L-1) and Gal (10 μmol·L-1) promoted BDNF and NGF synthesis and secretion from astrocytes after OGD/R in Neuron-AS system. A-D: Levels of BDNF and NGF assayed by ELISA analysis. Values were expressed as mean ± SEM (n = 6). ##P < 0.01 vs control group; **P < 0.01 vs OGD/R group |
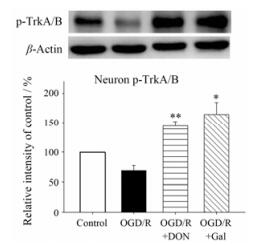
BDNF和NGF作为中枢神经系统常见的神经营养因子, 对病理状态下神经元的损伤具有明显的保护作用, BDNF和NGF与神经元表面的特异性受体Trk结合以后, 使其磷酸化, 继而激活神经元内多种信号通路, 从而发挥保护神经元和抗凋亡的作用。因此, 考察了Don和Gal对神经元表面TrkA/B受体表达的作用(图 5)。结果表明, 与对照组相比, OGD/R后神经元-星形胶质细胞共培养体系中, 神经元表面的磷酸化Trk受体水平显著降低, 降低了30.6%, 给予Don和Gal均可显著升高磷酸化Trk受体的水平, 分别升高了75.2%和95.1%。
|
Figure 5 Don (10 μmol·L-1) and Gal (10 μmol·L-1) up-regulated p-TrkA/B expression levels on neurons after OGD/R in Neuron-AS system. Quantified results were normalized to β-actin expression. Values were expressed as percentages compared to the control group (set to 100%), and represented as mean ± SEM (n = 8). *P < 0.05, **P < 0.01 vs OGD/R group |
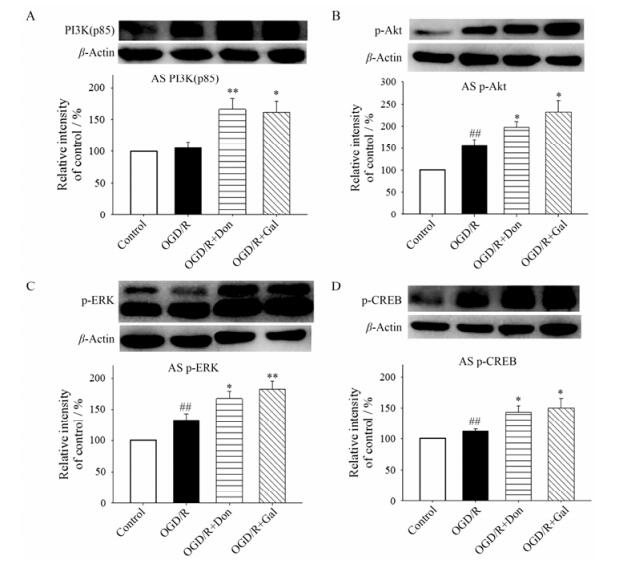
以上结果表明, Don和Gal主要通过影响OGD/R后星形胶质细胞合成BDNF和NGF对神经元凋亡发挥保护作用, 进一步对星形胶质细胞内神经营养相关信号通路进行考察, 通过图 6A~D可见, 与OGD/R组相比, Don和Gal均可以明显上调神经元-星形胶质细胞共培养体系中星形胶质细胞内PI3K (p85)、p-Akt、p-ERK和p-CREB蛋白的表达水平。这说明Don和Gal促进OGD/R损伤后神经元-星形胶质细胞共培养体系中BDNF和NGF的分泌和合成机制可能与上调共培养体系中星形胶质细胞内磷酸化Akt、ERK和CREB水平相关。
|
Figure 6 Don (10 μmol·L-1) and Gal (10 μmol·L-1) up-regulated PI3K/Akt and ERK signaling pathway in astrocytes after OGD/R in Neuron-AS system. A-D: Representative Western blot of PI3K (p85), p-Akt (Ser437), p-CREB and p-ERK, as well as their quantified results. Quantified results were normalized to β-actin expression. Values were expressed as percentages compared to the control group (set to 100%), and represented as mean ± SEM (n = 8). ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs OGD/R group |
为了深入研究乙酰胆碱酯酶抑制剂Don和Gal对脑缺血后神经元损伤的保护作用机制, 本研究使用插入式培养皿法(transwell)建立体外大鼠皮层神经元-星形胶质细胞共培养体系, 在该共培养体系中神经元和星形胶质细胞分泌的各种离子、营养物质和细胞因子等可自由通过插入式培养皿的微孔膜在细胞间进行交换[6, 7], 为更好地研究神经元与星形胶质细胞之间的相互作用奠定了基础。
此外, 本研究还成功地构建了体外OGD/R模型, 该模型通过直接通入不同浓度的N2和CO2混合气体或其他惰性气体, 造成低氧或缺氧环境, 同时剥夺培养基中的糖分以模拟在体脑缺血损伤过程, 经过一定的OGD干预后, 将细胞转移至正常氧浓度环境并更换正常培养基, 以模拟再灌注损伤。该模型具有制作方便、干扰因素少、效果可靠和重复性强等优点。Annexin V/PI流式细胞仪检测结果表明, 与对照组相比, OGD/R后单独培养的神经元及共培养体系中的神经元均出现明显的凋亡, 但与单独培养的神经元相比, 共培养体系中神经元的凋亡率降低了17.1% (P < 0.01), 说明在共培养体系中星形胶质细胞对神经元的凋亡发挥了明显的保护作用。
在已成功构建的神经元-星形胶质细胞共培养体系及体外OGD/R模型的基础上, 进一步研究了Don和Gal在星形胶质细胞存在下对OGD/R诱导的神经元凋亡的作用。结果发现, 与单独培养的神经元体系相比, 在星形胶质细胞存在的情况下Don和Gal均可以进一步降低OGD/R诱导的神经元凋亡率, 表明Don和Gal对OGD/R导致的神经元凋亡的保护作用, 部分与星形胶质细胞有关。
在凋亡过程中, caspase 3被认为是最终的凋亡执行者, 而Bcl-2蛋白质家族则是控制线粒体释放致凋亡因子的主要调节因子, 其中Bcl-2具有抗凋亡作用, 而Bax具有促凋亡作用。Don和Gal可以通过降低OGD/R后神经元内cleaved-caspase 3的水平并提高抗凋亡蛋白Bcl-2的表达而发挥抗神经元凋亡作用。
由于星形胶质细胞对神经元存活、生长和分化发挥关键的营养和支持作用[8], 星形胶质细胞可分泌多种神经营养因子(NTFs), 包括BDNF、NGF和NT-3等, 这些神经营养因子通过与神经元表面特异性受体结合, 如Trk受体和p75受体等, 进一步激活神经元内PI3K/Akt和MAPK通路等, 从而影响神经元的凋亡[9]。本研究结果表明, 在神经元-星形胶质细胞共培养体系中, 与OGD/R组相比, Don和Gal均可以明显增加BDNF和NGF的合成和分泌量, 但这一过程主要发生在星形胶质细胞中。而在单独培养的神经元或星形胶质细胞中, Don和Gal促进BDNF和NGF合成、分泌的作用均较弱。提示OGD/R损伤后, 神经元与星形胶质细胞的相互作用对Don和Gal的促BDNF和NGF的合成、分泌发挥重要的作用。此外, 还发现Don和Gal可以明显升高OGD/R后共培养体系中神经元表面活化的Trk受体表达水平, 这进一步证实了Don和Gal对OGD/R后神经营养因子的分泌具有重要影响。
已有研究表明, CREB是一种重要的细胞核内调控因子, 其Ser133位点的磷酸化是实现调节转录的重要途径, 胞外信号通过影响CREB的磷酸化来激活多种靶基因的转录, 其中包括对神经营养因子BDNF和NGF基因转录的影响[10, 11]。因此, 首先采用Western blot法考察了Don和Gal对OGD/R后共培养体系中星形胶质细胞内磷酸化CREB (p-CREB)表达影响。与OGD/R组相比, Don和Gal均可以明显上调共培养体系中星形胶质细胞内p-CREB的表达水平。这说明Don和Gal促进OGD/R后共培养体系中星形胶质细胞内p-CREB的表达水平, 可能与合成和分泌BDNF和NGF有关。
已知CREB的磷酸化可受多条信号通路调控, PI3K/Akt通路是其中重要的一条通路。PI3K是一种胞内磷脂酰肌醇激酶, 由调节亚基p85和催化亚基p110构成, 其被磷酸化后, 可产生具有第二信使作用的分子。第二信使分子与细胞内的信号分子Akt结合并磷酸化其Ser473位点, 使其激活, 而磷酸化的Akt可进一步激活CREB[12]。另外, ERK是MAPK家族中的一员, 胞外刺激可由G蛋白受体、生长因子受体和酪氨酸蛋白激酶受体, 经Raf-MEK-ERK级联信号激活ERK, 调节转录因子(如CREB、STAT和c-Myc等)及一些激酶活性, 促进细胞增殖和蛋白合成等。本研究也考察了Don和Gal对OGD/R后共培养体系中星形胶质细胞内PI3K/Akt和ERK通路的影响。结果表明, 与OGD/R组相比, Don和Gal均可以明显上调共培养体系中星形胶质细胞内PI3K (p85)、p-Akt和p-ERK的表达水平。
以上结果表明, Don和Gal可以明显促进OGD/R后神经元-星形胶质细胞共培养体系中神经营养因子BDNF和NGF的分泌和合成, 其具体机制可能是通过激活星形胶质细胞内PI3K/Akt通路和ERK通路, 上调磷酸化CREB的表达水平, 从而促进星形胶质细胞合成和分泌BDNF和NGF。
另外, 本课题组对转染Kv2.1通道的HEK293细胞的前期研究[13]表明Don对OGD导致的凋亡同样具有保护作用, 并对Kv2.1电流具有明显抑制作用, 这说明在排除了胆碱能系统的影响下, Don可能通过抑制Kv2.1通道发挥脑缺血损伤保护作用。并且, 还有研究[14-19]表明胆碱酯酶抑制剂如他克林、Don、Gal和卡巴拉汀都对神经元钾离子通道具有阻断作用。因此, 提示Don和Gal可能通过钾离子通道发挥脑缺血损伤保护作用, 两者在OGD/R后的作用可能与星形胶质细胞上的Kv通道有关, 但相关研究有待进一步开展。
综上所述, Don和Gal对OGD/R导致的神经元损伤具有明显的保护作用, 其胆碱酯酶外的机制可能主要与激活星形胶质细胞内的PI3K/Akt通路和ERK通路, 促进核转录因子CREB的磷酸化, 进而促进BDNF和NGF合成和分泌有关。
| [1] | Lorrio S, Sobrado M, Arias E, et al. Galantamine postischemia provides neuroprotection and memory recovery against tran sient global cerebral ischemia in gerbils[J]. J Pharmacol Exp Ther, 2007, 322: 591–599. DOI:10.1124/jpet.107.122747 |
| [2] | Zhou J, Fu Y, Tang XC. Nuperzine A and donepezil protect rat pheochromocytoma cells against oxygen-glucose depriva tion[J]. Neurosci Lett, 2001, 306: 53–56. DOI:10.1016/S0304-3940(01)01855-9 |
| [3] | Akasofu S, Kosasa T, Kimura M. Protective effect of donepezil in a primary culture of rat cortical neurons exposed to oxygen-glucose deprivation[J]. Eur J Pharmacol, 2003, 472: 57–63. DOI:10.1016/S0014-2999(03)01865-X |
| [4] | Jana M, Jana A, Pal U, et al. A simplified method for isolating highly purified neurons, oligodendrocytes, astrocytes, and microglia from the same human fetal brain tissue[J]. Neurochem Res, 2007, 32: 2015–2022. DOI:10.1007/s11064-007-9340-y |
| [5] | Kaech S, Banker G. Culturing hippocampal neurons[J]. Nat Protoc, 2006, 1: 2406–2415. DOI:10.1038/nprot.2006.356 |
| [6] | Falcao AS, Silva RF, Vaz AR, et al. Cross-talk between neurons and astrocytes in response to bilirubin: adverse secondary impacts[J]. Neurochem Res, 2013, 38: 644–659. DOI:10.1007/s11064-012-0963-2 |
| [7] | Madrigal JL, Leza JC, Polak P, et al. Astrocyte-derived MCO-1 mediates neuroprotective effects of noradrenaline[J]. J Neurosci, 2009, 29: 263–267. DOI:10.1523/JNEUROSCI.4926-08.2009 |
| [8] | Tonchev AB. Brain ischemia, neurogenesis, and neurotrophic receptor expression in primates[J]. Arch Ital Biol, 2011, 149: 225–231. |
| [9] | Yamaguchi H, Wang HG. The protein kinase PKB/Akt regu lates cell survival and apoptosis by inhibiting Bax conforma tional change[J]. Oncogene, 2001, 20: 7779–7786. DOI:10.1038/sj.onc.1204984 |
| [10] | Nair A, Vadodaria KC, Banerjee SB, et al. Stressor-specific regulation of distinct brain-derived neurotrophic factor tran scripts and cyclic AMP response element-binding protein expression in the postnatal and adult rat hippocampus[J]. Nuropsychopharmacology, 2007, 32: 1504–1519. DOI:10.1038/sj.npp.1301276 |
| [11] | Numakawa T, Suzuki S, Kumamaru E, et al. BDNF function and intracellular signaling in neurons[J]. Histol Histopathol, 2010, 25: 237–258. |
| [12] | Garat CV, Crossno JT Jr, Sullivan TM, et al. Inhibition of phosphatidylinositol 3-kinase/Akt signaling attenuates hypoxia-induced pulmonary artery remodeling and suppresses CREB depletion in arterial smooth muscle cells[J]. J Cardiovasc Pharmacol, 2013, 62: 539–548. DOI:10.1097/FJC.0000000000000014 |
| [13] | Yuan H, Wang WP, Feng N, et al. Donepezil attenuated oxygen-glucose deprivation insulty by blocking Kv2.1 potas sium channels[J]. Eur J Pharmacol, 2011, 657: 76–83. DOI:10.1016/j.ejphar.2011.01.054 |
| [14] | Pan Y, Xu X, Wang X. Rivastigmine blocks voltage-activated K+ currents in dissociated rat hippocampal neurons[J]. Br J Pharmacol, 2003, 140: 907–912. DOI:10.1038/sj.bjp.0705503 |
| [15] | Solntseva EI, Bukanova JV, Skrebitsky VG. Donepezil in low micromolar concentrations modulates voltage-gated potas sium currents in pyramidal neurons of rat hippocampus[J]. Biochem Biophys Res Commun, 2013, 430: 1066–1071. DOI:10.1016/j.bbrc.2012.12.037 |
| [16] | Yu B, Hu GY. Donepezil blocks voltage-gated ion channels in rat dissociated hippocampal neurons[J]. Eur J Pharmacol, 2005, 508: 15–21. DOI:10.1016/j.ejphar.2004.12.004 |
| [17] | Zhang HX, Zhang W, Jin HW, et al. Galantamine blocks cloned Kv2.1, but not Kv1.5 potassium channels[J]. Brain Res Mol Brain Res, 2004, 131: 136–140. DOI:10.1016/j.molbrainres.2004.08.010 |
| [18] | Pan YP, Xu XH, Wang XL. Galantamine blocks delayed rectifier, but not transient outward potassium current in rat dissociated hippocampal pyramidal neurons[J]. Neurosci Lett, 2003, 336: 37–40. DOI:10.1016/S0304-3940(02)01235-1 |
| [19] | Kraliz D, Singh S. Selective blockade of the delayed rectifier potassium current by tacrine in Drosophila[J]. J Neurobiol, 1997, 32: 1–10. DOI:10.1002/(ISSN)1097-4695 |
 2017, Vol. 52
2017, Vol. 52


