在正常的人类生命活动中, 基因的选择性剪切会表达不同功能的蛋白分子来参与人体正常的生理代谢过程。当基因的剪切出现紊乱时, 会产生异常的表达产物, 它们可能会影响正常的生理过程, 甚至导致疾病的发生[1, 2]。目前全世界每年有大约700~ 1 000万人死于癌症, 因此癌症是一个巨大的医学挑战[3, 4]。而它的产生和发展与许多癌症相关基因BCL-X、MDM2和FGFR1等过表达密切关联[5, 6]。在癌症治疗中, 许多化疗药物和几乎全部生物大分子药物由于难以透过细胞膜限制了抗肿瘤作用的发挥。因此, 发展促使这些药物被细胞摄取的策略变得尤为重要[7]。
细胞穿膜肽 (CPPs) 作为一种由5~30氨基酸组成的短肽, 是非常有潜力的药物递送载体之一[8]。它能够递送各种大分子药物穿透细胞膜进入细胞内且不影响它们的生物活性[9-11]。因此, 作者希望以CPPs作为模板设计出高效的非病毒载体。Penetratin来源于果蝇触角蛋白同源结构域, 是一条两亲性的穿膜肽; 因为它具有较好的穿膜效应被作为一个潜在药物载体用于各种目的[12-14]。Penetratin序列中的阳离子氨基酸精氨酸 (Arg) 和赖氨酸 (Lys) 是发挥穿膜活性的不可替代的位点, 如果对它们进行替换或改造会降低穿膜效应[15]。而序列中的色氨酸 (Trp)、苯丙氨酸 (Phe) 和异亮氨酸 (Ile) 为疏水性氨基酸, 可以促进肽与细胞膜脂质的相互作用[16-18]。因此, penetratin具有穿膜特性和两亲性, 使它可作为设计新型非病毒载体的潜在模板。
在本研究中, 以penetratin作为设计的母肽, 将它的2位和9位的氨基酸替换为半胱氨酸-喜树碱 (Cys-camptothecin, Cys-CPT) 以增加penetratin的两亲性, 旨在提高其穿膜效率的同时也使它具有一定的抗肿瘤效应, 最后得到了肽[Cys-CPT2, 9] penetratin (图 1), 作为新型载体用于肿瘤基因治疗。
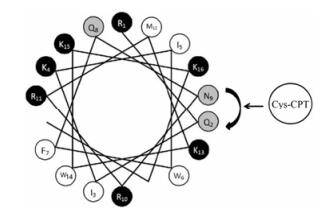
|
Figure 1 Spiral wheel structure of penetratin. Black: Basic amino acids; Gray: Hydrophilic amino acids, uncharged; White: Nonpolar amino acids; Cys: Cysteine; CPT: Camptothecin |
实验材料与仪器 RPMI-1640培养基和胎牛血清 (fetal bovine serum, FBS) 购自Gibco公司; 新生牛血清 (newborn bovine serums, NBS) 购自杭州四季青生物工程材料有限公司; 噻唑蓝[3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide, MTT]、头孢哌酮 (cefoperazone, CPZ)、异丙基阿米洛利[5-(N-ethyl-N-isopropyl) amiloride, EIPA]、甲基-β-环糊精 (methyl-beta-cyclodextrin, MβCD) 和CPT均购自Sigma-Aldrich公司; 异硫氰酸荧光素 (fluorescein isothiocyanate, FITC) 购自苏州亚科化学试剂有限公司。全自动酶标仪 (Bio-Rad公司); 激光共聚焦显微镜 (Zessie公司); 流式细胞仪 (Becton Dickinson公司)。
Penetratin和[Cys-CPT2, 9] penetratin肽的合成 选择的方法为采用经典的多肽固相合成法合成。采用MBHA树脂 (取代值为0.54 mmol·g-1) 合成, 表 1中所述肽序列。其中荧光素FITC通过连接子六氨基己酸 (6-aminocaproic acid, AHX) 连接在肽链的氮末端, 而[Cys-CPT2, 9] penetratin的合成是在主链[Cys2, 9] penetratin的合成后, 通过二硫键连接反应将CPT偶联到[Cys2, 9] penetratin的第2、9位半胱氨酸的侧链巯基基团上。最后经RP-HPLC纯化和ESI-MS质谱鉴定后的目标肽[19], 用于后续实验。
| Table 1 Amino acid sequence of peptides. aFluorescein moiety (FITC) was attached to the N-terminus of peptide via an amino hexanoic acid (AHX) spacer |
细胞培养 HeLa细胞 (人宫颈癌细胞, 上海中国科学院细胞库) 用灭活小牛血清NBS与RPMI-1640培养基配成10%小牛血清培养基培养细胞, 培养基中含硫酸链霉素 (100 mg·mL-1) 和青霉素G钠盐 (100 u·mL-1) 以避免细胞污染。细胞株培养在37 ℃、5% CO2无菌细胞培养箱中。
FITC摄取实验 HeLa细胞以每皿4×104个接种于玻璃底的培养小皿内, 37 ℃、5% CO2培养箱中孵育24 h。然后在皿中加入无血清RPMI-1640培养液配制的FITC-penetratin、FITC-[Cys2, 9] penetratin和FITC-[Cys-CPT2, 9] penetratin, 浓度为2 μmol·L-1, 培养箱中孵育30 min。再用pH 7.4磷酸盐缓冲液 (phosphate buffer solution, PBS) 洗涤细胞3次, 最后在激光共聚焦显微镜下观察细胞内FITC的荧光强度, 激发波长为488 nm。
CPT内化实验 HeLa细胞以每皿4×104个接种于玻璃底的培养皿内, 在培养箱内培养24 h, 然后在皿中加入2 μmol·L-1 CPT、[Cys-CPT2, 9] penetratin, 放置于培养箱内孵育30 min, 用PBS清洗细胞3次, 最后通过激光共聚焦在405 nm波长下观察细胞内的蓝色荧光强度 (CPT荧光)。
流式细胞仪检测实验 HeLa细胞以每孔2×105个接种于12孔板中, 培养24 h后, 用PBS洗涤细胞3次, 然后将无血清RPMI-1640培养液配制的不同浓度 (1、2和5 μmol·L-1) 的FITC-penetratin、FITC-[Cys-CPT2, 9] penetratin溶液加入到培养板孔内, 与细胞共孵育30 min, 再用胰酶消化并收集细胞, 用预冷的PBS清洗样品3次, 最后加入PBS 500 μL重悬细胞, 流式细胞仪检测荧光强度, 激发波长488 nm。
为了进一步证实FITC-[Cys-CPT2, 9] penetratin的穿膜效率, 选择被广泛研究证实穿膜活性强的穿膜肽Transportan 10 (TP10) 作为阳性对照, 对FITC-penetratin、FITC-[Cys2, 9] penetratin、FITC-[Cys-CPT2, 9]-penetratin和FITC-TP10的穿膜效率进行分析和比较, 浓度设为2 μmol·L-1。
细胞摄取的机制研究 为了研究penetratin与[Cys-CPT2, 9] penetratin的细胞摄取机制, 采用不同内吞抑制剂探究它们对肽穿膜效率的影响作用。HeLa细胞以每孔2×105个接种于12孔板, 培养箱中培养24 h备用。先用PBS洗涤细胞3次后, 在小孔内加入无血清RPMI-1640培养液配制的不同抑制剂溶液 (10 μg·mL-1网格蛋白介导型内吞抑制剂CPZ、50 μmol·L-1巨胞饮型内吞抑制剂EIPA和5 mmol·L-1小窝蛋白介导型内吞抑制剂MβCD), 预处理30 min, 然后在样品孔内分别加入10 μmol·L-1 FITC-penetratin和2 μmol·L-1 FITC-[Cys-CPT2, 9] penetratin继续共孵育30 min。最后, 将收集到的细胞在流式细胞仪中测定荧光强度。实验中只加FITC-penetratin和FITC-[Cys-CPT2, 9] penetratin的样品作为空白对照。
肽对肿瘤细胞增殖的影响 HeLa细胞以每孔5×103个接种于96孔微板中培养24 h。将无血清RPMI-1640培养液配制的CPT、penetratin、[Cys2, 9] penetratin、[Cys-CPT2, 9] penetratin溶液 (0.3125、0.625、1.25、2.5和5 μmol·L-1) 分别加入到培养孔内, 孵育30 min后用PBS清洗细胞, 然后加入含5% NBS的新培养液180 μL, 继续培养72 h后, 每孔加入MTT溶液 (5.0 g·L-1) 20 μL, 继续孵育4 h, 最后吸取上清, 每孔加入DMSO溶液150 μL, 微板器上震动5 min后, 用酶标仪在570 nm处测定吸光度值 (OD)。细胞存活率 (%) = OD药物组 / ODcontrol×100;另外采用同样处理方法考察以每孔1×104个接种于96孔板的HeLa细胞在CPT、penetratin、[Cys2, 9] penetratin和[Cys-CPT2, 9] penetratin (1、2、5、10和20 μmol·L-1) 作用1 h后的存活率。
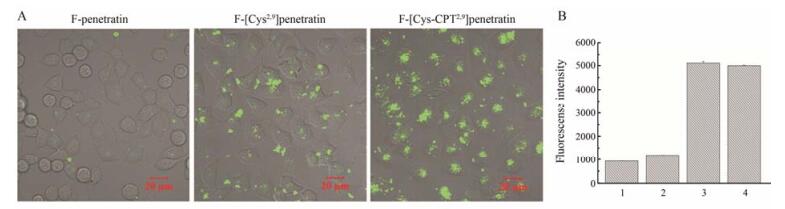
结果 1 细胞摄取当FITC标记的penetratin系列肽与HeLa细胞共孵育30 min后, 在激光共聚焦下能检测到它们在细胞内的绿色荧光。但在同一浓度下, 发现[Cys-CPT2, 9] penetratin组的细胞内荧光强度明显高于penetratin和[Cys2, 9] penetratin组, 结果显示较多的[Cys-CPT2, 9] penetratin被摄入细胞内 (图 2A)。说明改造后的[Cys-CPT2, 9] penetratin的穿膜能力明显高于penetratin。
|
Figure 2 Cellular uptake of peptides in HeLa cells. Cells were incubated with 2 μmol·L-1 FITC-labeled peptides for 30 min in serum-free medium. A: Laser confocal images of cellular uptake of peptides; B: Flow cytometry analysis of peptides internalized into cells. 1, 2, 3 and 4 were FITC-penetratin (F-penetratin), FITC-[Cys2, 9] penetratin (F-[Cys2, 9] penetratin), FITC-[Cys-CPT2, 9] penetratin (F-[Cys-CPT2, 9] penetratin) and FITC-TP10 (F-TP10, positive control). TP10: Transportan 10 |
流式细胞术实验对FITC-penetratin、FITC-[Cys2, 9] penetratin、FITC-[Cys-CPT2, 9] penetratin和FITC-TP10的细胞摄取水平进行了直观的比较。从图 2B可见, FITC-[Cys-CPT2, 9] penetratin的荧光强度高于FITC-penetratin、FITC-[Cys2, 9] penetratin约5倍, 此结果与激光共聚焦的结果一致, 显示[Cys-CPT2, 9] penetratin具有更高的穿膜能力。[Cys-CPT2, 9] penetratin的穿膜能力与阳性对照药TP10相近。通过细胞摄取实验证实, 将Cys-CPT与penetratin第2, 9位氨基酸替换后得到的[Cys-CPT2, 9] penetratin具有明显优于母体的穿膜能力。
2 [Cys-CPT2, 9] penetratin细胞摄取的量效关系对penetratin和[Cys-CPT2, 9] penetratin细胞摄取进行更深入的量效关系研究。如图 3所示, 当HeLa细胞与不同浓度的FITC-penetratin和FITC-[Cys-CPT2, 9] penetratin共孵育30 min后, 流式细胞仪检测发现两个肽作用后胞内荧光强度均随浓度的增加而增加, 而各个浓度下FITC-penetratin的荧光强度均低于相同浓度FITC-[Cys-CPT2, 9] penetratin的荧光强度, 且FITC-penetratin的浓度增加到5 μmol·L-1时, 它的细胞内的荧光强度且略低于1 μmol·L-1时FITC-[Cys-CPT2, 9] penetratin所对应的荧光强度。
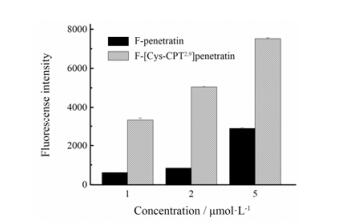
|
Figure 3 Response value of FITC-penetratin (F-penetratin) and FITC-[Cys-CPT2, 9] penetratin (F-[Cys-CPT2, 9] penetratin) under different concentrations on HeLa cells. It was investigated quantitatively by flow cytometry after 30 min treatment |
不同内吞抑制剂 (网格蛋白介导型内吞抑制剂CPZ、小窝蛋白介导型内吞抑制剂MβCD、巨胞饮内吞抑制剂EIPA) 对[Cys-CPT2, 9] penetratin细胞摄取的影响[20]。如图 4A所示, 在母肽penetratin处理组中, 发现3种内吞抑制剂CPZ、MβCD和EIPA均可明显降低它的细胞摄取, 其中各个抑制剂作用后对应的细胞摄取水平是penetratin对照组的73%、66%和56%;在图 4B中, HeLa细胞经CPZ和EIPA预处理后, [Cys-CPT2, 9] penetratin的细胞摄取率明显降低至43.1%和82%, 但MβCD处理组的细胞摄取率与对照组一致, 没有表现出细胞摄取抑制作用。结果表明, [Cys-CPT2, 9] penetratin的细胞摄取机制主要是经由网格蛋白、巨胞饮内吞通路内化进细胞的, 不经过细胞膜穴样内陷过程, 与penetratin进入细胞途径略有不同。
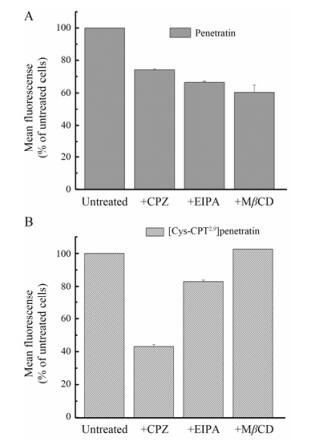
|
Figure 4 The internalization of penetratin (A) and [Cys-CPT2, 9] penetratin (B) evaluated by flow cytometry in the presence of specific endocytosis inhibitors. CPZ: Cefoperazone; EIPA: 5-(N-Ethyl-N-isopropyl) amiloride; MβCD: Methyl-beta-cyclodextrin |
为了考察[Cys-CPT2, 9] penetratin大量进入细胞时, 是否将CPT一起带入细胞内, 从而发挥抗肿瘤活性, 利用激光共聚焦对CPT内化情况进行直观分析。如图 5所示, 在CPT的激发波长下CPT和[Cys-CPT2, 9] penetratin组细胞内均能检测到蓝色荧光, 显示[Cys-CPT2, 9] penetratin导入细胞的同时自身所携带的CPT随之进入细胞内, 具有一定的抗肿瘤效应。

|
Figure 5 CPT uptake in HeLa cells. Cells were incubated with serum-free medium containing 2 μmol·L-1 CPT (A) and [Cys-CPT2, 9] penetratin (B) for 30 min and finally investigated by confocal laser scanning microscopy. DIC: Differential interference contrast microscopy; DAPI: Cells which took up CPT appear blue under fluorescent light |
为了进一步证明[Cys-CPT2, 9] penetratin抗肿瘤活性, 采用MTT法探讨[Cys-CPT2, 9] penetratin对HeLa作用不同时间后细胞的存活率状态。在[Cys-CPT2, 9] penetratin作用下, 细胞存活率表现出浓度依赖性, 对HeLa细胞的增殖具有抑制作用, 且抑制活性高于CPT组 (图 6A), 而penetratin和[Cys2, 9] penetratin对HeLa细胞的增殖未产生任何影响。在图 6B中, [Cys-CPT2, 9] penetratin在短时间内也能抑制肿瘤细胞增殖, CPT对HeLa细胞未产生明显的杀伤作用, 进一步印证了[Cys-CPT2, 9] penetratin具有高穿膜活性的同时也具有抗肿瘤活性。

|
Figure 6 Inhibitory activity of [Cys-CPT2, 9] penetratin on tumor cell proliferation. A: Survival rate of HeLa cells in drug treatment for 30 min and then cultured for about 72 h; B: Survival rate of HeLa cells in drug treatment for 1 h and determined using the MTT method. n = 3, x± s. MTT: 3-(4, 5-Dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide |
在CPPs的二级结构图中, 序列中的极性基团集中分布于结构一侧, 而非极性基团集中分布于另一侧, 从而形成双亲性的肽结构。肽的两亲性在它的穿膜活性中发挥着非常重要的作用, 因此, 对CPPs进行两亲性设计改造成为开发新型高效穿膜肽的策略之一[21-23]。本研究选择penetratin作为母肽, 在不改变序列中碱性氨基酸及芳香性、疏水性氨基酸等关键基团的前提下, 将2位Gln和9位Asn替换为疏水性基团Cys-CPT以期扩大母肽的疏水结构区域, 目的在于增加penetratin的双亲性, 进而得到更有潜力的穿膜肽[Cys-CPT2, 9] penetratin。在激光共聚焦结果中, [Cys-CPT2, 9] penetratin被摄入细胞内更多, 显示它的穿膜活性明显高于penetratin, 表明penetratin的双亲性增加后促进了穿膜肽与细胞膜之间的相互作用, 使更多的肽被细胞内化。同时流式数据也进一步证实了此结论, [Cys-CPT2, 9] penetratin具有更高的穿膜活性, 而比较penetratin与[Cys-CPT2, 9] penetratin量化结果发现, [Cys-CPT2, 9] penetratin的荧光强度比penetratin高5倍, 凸显它的穿膜优势。
基于[Cys-CPT2, 9] penetratin具有较好的穿膜活性, 作者对它的穿膜机制进行了探索。目前普遍认可CPPs的穿膜机制是细胞内化过程[24, 25], 所以使用网格蛋白介导型内吞抑制剂、小窝蛋白介导型内吞抑制剂和巨胞饮型内吞抑制剂探究[Cys-CPT2, 9] penetratin细胞摄取机制[18]。结果显示, 抑制剂CPZ、EIPA均能降低[Cys-CPT2, 9] penetratin的细胞摄取率, 这与penetratin摄取机制一致[13, 16]。但是, [Cys-CPT2, 9] penetratin的摄取过程中小窝蛋白未发挥作用, 这与penetratin摄取机制有所不同, 可能是因为引入CPT基团影响了小窝蛋白介导的内吞作用[26, 27]。由此认为[Cys-CPT2, 9] penetratin的细胞摄取机制是首先通过静电作用与细胞膜结合, 然后通过疏水性作用与膜脂质结合, 最后由网格蛋白、巨胞饮介导的内吞途径进入到细胞内。
由激光共聚焦实验可见, CPT随[Cys-CPT2, 9] penetratin被细胞摄取, 抗肿瘤活性实验也显示[Cys-CPT2, 9] penetratin具有抗肿瘤活性, 且比CPT抑制癌细胞作用更强, 表明[Cys-CPT2, 9] penetratin中引入Cys-CPT基团不仅具有更好的穿膜活性, 也有抗肿瘤活性, 此结果与作者设计理念一致。高穿膜活性和抗肿瘤活性的[Cys-CPT2, 9] penetratin在临床应用中具有更大优势:高效穿膜活性使[Cys-CPT2, 9] penetratin可开发成潜在的药物载体, 克服CPT在肿瘤治疗中难以通透细胞膜和胞内转运问题; 携带的CPT也通过凋亡通路诱使癌细胞死亡[28, 29]。两者通过协同作用来增强治疗药物的抗肿瘤活性, 同时也降低了化学药物的给药剂量, 有利于降低药物的毒副作用及肿瘤耐受现象出现的几率。总之, 新型高效穿膜肽[Cys-CPT2, 9] penetratin的发现对后续肿瘤治疗方案的研究和发展提供了前期基础。
| [1] | Faustino NA, Cooper TA. Pre-mRNA splicing and human disease[J]. Genes Dev, 2003, 17: 419–437. DOI:10.1101/gad.1048803 |
| [2] | Riffo-Campos ÁL, Castillo J, Vallet-Sánchez A, et al. In silico RNA-seq and experimental analyses reveal the differential expression and splicing of EPDR1 and ZNF518B genes in relation to KRAS mutations in colorectal cancer cells[J]. Oncol Rep, 2016, 36: 3627–3634. |
| [3] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65: 5–29. DOI:10.3322/caac.21254 |
| [4] | Ali I, Saleem K, Aboul-Enein HY, et al. Social aspects of cancer genesis[J]. Cancer Ther, 2011, 8: 6–14. |
| [5] | Srebrow A, Kornblihtt AR. The connection between splicing and cancer[J]. J Cell Sci, 2006, 119: 2635–2641. DOI:10.1242/jcs.03053 |
| [6] | Pajares MJ, Ezponda T, Catena R, et al. Alternative splicing: an emerging topic in molecular and clinical oncology[J]. Lancet Oncol, 2007, 8: 349–357. DOI:10.1016/S1470-2045(07)70104-3 |
| [7] | Zhang L, Wei G, Lu WY. Application of activatable cell-penetrating peptide in the field of tumor therapy[J]. Acta Pharm Sin (药学学报), 2014, 49: 1639–1643. |
| [8] | Fan B, Jin MJ, Huang W, et al. The development of cell-penetrating peptides in drug delivery system[J]. Acta Pharm Sin (药学学报), 2016, 51: 264–271. |
| [9] | Mäe M, Langel Ü. Cell-penetrating peptides as vectors for peptide, protein and oligonucleotide delivery[J]. Curr Opin Pharmacol, 2006, 6: 509–514. DOI:10.1016/j.coph.2006.04.004 |
| [10] | Stewart KM, Horton KL, Kelley SO. Cell-penetrating peptides as delivery vehicles for biology and medicine[J]. Org Biomol Chem, 2008, 6: 2242–2255. DOI:10.1039/b719950c |
| [11] | Vivès E, Schmidt J, Pèlegrin A. Cell-penetrating and cell-targeting peptides in drug delivery[J]. Biochim Biophys Acta, 2008, 1786: 126–138. |
| [12] | Bera S, Kar RK, Mondal S, et al. Structural elucidation of the cell-penetrating penetratin peptide in model membranes at the atomic level: probing hydrophobic interactions in the blood-brain barrier[J]. Biochemistry, 2016, 55: 4982–4996. DOI:10.1021/acs.biochem.6b00518 |
| [13] | Derossi D, Joliot AH, Chassaing G, et al. The third helix of the antennapedia homeodomain translocates through biological membranes[J]. J Biol Chem, 1994, 269: 10444–10450. |
| [14] | Lundin P, Johansson H, Guterstam P, et al. Distinct uptake routes of cell-penetrating peptide conjugates[J]. Bioconjug Chem, 2008, 19: 2535–2542. DOI:10.1021/bc800212j |
| [15] | Binder H, Lindblom G. A molecular view on the interaction of the trojan peptide penetratin with the polar interface of lipid bilayers[J]. Biophys J, 2004, 87: 332–343. DOI:10.1529/biophysj.103.034025 |
| [16] | Drin G, Mazel M, Clair P, et al. Physico-chemical require-ments for cellular uptake of pAntp peptide: role of lipid-binding affinity[J]. Eur J Biochem, 2001, 268: 1304–1314. DOI:10.1046/j.1432-1327.2001.01997.x |
| [17] | Letoha T, Gaál S, Somlai C, et al. Membrane translocation of penetratin and its derivatives in different cell lines[J]. J Mol Recognit, 2003, 16: 272–279. DOI:10.1002/jmr.v16:5 |
| [18] | Christiaens B, Symoens S, Vanderheyden S, et al. Tryptophan fluorescence study of the interaction of penetratin peptides with model membranes[J]. Eur J Biochem, 2002, 269: 2918–2926. DOI:10.1046/j.1432-1033.2002.02963.x |
| [19] | Zhang W, Song JJ, Zhang BZ, et al. Design of acid-activated cell penetrating peptide for delivery of active molecules into cancer cells[J]. Bioconjug Chem, 2011, 22: 1410–1415. DOI:10.1021/bc200138d |
| [20] | Doan ND, Létourneau M, Vaudry D, et al. Design and characterization of novel cell-penetrating peptides from pituitary adenylate cyclase-activating polypeptide[J]. J Control Release, 2012, 163: 256–265. DOI:10.1016/j.jconrel.2012.08.021 |
| [21] | Ho A, Schwarze SR, Mermelstein SJ, et al. Synthetic protein transduction domains: enhanced transduction potential in vitro and in vivo[J]. Cancer Res, 2001, 61: 474–477. |
| [22] | Oehlke J, Krause E, Wiesner B, et al. Nonendocytic, amphi-pathicity dependent cellular uptake of helical model peptides[J]. Prot Peptide Lett, 1996, 3: 393–398. |
| [23] | Oehlke J, Scheller A, Wiesner B, et al. Cellular uptake of an α-helical amphipathic model peptide with the potential to deliver polar compounds into the cell interior non-endocytically[J]. Biochim Biophys Acta, 1998, 1414: 127–139. DOI:10.1016/S0005-2736(98)00161-8 |
| [24] | Duchardt F, Fotin-Mleczek M, Schwarz H, et al. A compre-hensive model for the cellular uptake of cationic cell-penetrating peptides[J]. Traffic, 2007, 8: 848–866. DOI:10.1111/j.1600-0854.2007.00572.x |
| [25] | Futaki S, Nakase I, Tadokoro A, et al. Arginine-rich peptides and their internalization mechanisms[J]. Biochem Soc Trans, 2007, 35: 784–787. DOI:10.1042/BST0350784 |
| [26] | Maiolo JR, Ferrer M, Ottinger EA. Effects of cargo molecules on the cellular uptake of arginine-rich cell-penetrating peptides[J]. Biochim Biophys Acta, 2005, 1712: 161–172. DOI:10.1016/j.bbamem.2005.04.010 |
| [27] | Tünnemann G, Martin RM, Haupt S, et al. Cargo-dependent mode of uptake and bioavailability of TAT-containing proteins and peptides in living cells[J]. FASEB J, 2006, 20: 1775–1784. DOI:10.1096/fj.05-5523com |
| [28] | Sánchez-Alcázar JA, Ault JG, Khodjakov A, et al. Increased mitochondrial cytochrome C levels and mitochondrial hyper-polarization precede camptothecin-induced apoptosis in Jurkat cells[J]. Cell Death Differ, 2000, 7: 1090–1100. DOI:10.1038/sj.cdd.4400740 |
| [29] | Yuan Q, Ray RM, Johnson LR. Polyamine depletion prevents camptothecin-induced apoptosis by inhibiting the release of cytochrome C[J]. Am J Physiol Cell Physiol, 2002, 282: C1290–C1297. DOI:10.1152/ajpcell.00351.2001 |
 2017, Vol. 52
2017, Vol. 52


