2. 江西中医药大学, 中药固体制剂制造技术国家工程研究中心, 江西 南昌 330006;
3. 宜春学院, 化学与生物工程学院, 江西 宜春 336000
2. National Engineering Research Center for Manufacturing Technology of TCM Solid Preparation, Jiangxi University of Traditional Chinese Medicine, Nanchang 330006, China;
3. School of Chemical and Biological Engineering, Yichun University, Yichun 336000, China
恶性肿瘤是威胁人类健康最主要的疾病之一, 肿瘤细胞通过复杂的信号通路和多种机制逃避程序性死亡, 致使肿瘤的治疗具有一定的难度[1]。由于耐药性和肿瘤细胞的转移, 常见的治疗手段诸如化疗和手术治疗已经不能满足临床需求。因此, 迫切需要探索更安全有效的治疗手段。癌症是由与肿瘤细胞有关的不同基因紊乱引起的。基因治疗主要通过下调或取代致癌基因, 以干扰RNA的形式降低蛋白质的表达。肿瘤基因可以下调与表达多药耐药性 (multidrug resistance, MDR) 效应有关的蛋白质和细胞毒性免疫细胞因子, 上调与细胞凋亡有关蛋白质和肿瘤坏死因子[2-4]。这一理论为基因与化疗药物联合治疗癌症提供了理论基础。
纳米递药系统 (nanoscaled drug delivery system, NDDS) 以其独有的优势成为药剂学领域抗肿瘤治疗研究的热点。NDDS具有提高药物的靶向性、增加药物的溶解性、改变药物在体内的组织分布, 以及缓释或控释等特性, 从而降低不良反应, 提高治疗效果[5, 6]。NDDS用于共载基因与药物在抗肿瘤治疗中, 展现出重要的应用价值。
智能化纳米递释系统显示出良好的治疗效果, 其在药剂学领域得到快速发展, 受到众多研究者的高度重视。本文主要介绍近年来具有环境响应性 (包括内环境和外环境) 递释系统在共载基因与药物方面的研究进展, 分析与归纳其在抗肿瘤方面的特点和治疗效果。作者还将基因与药物共载递释系统存在技术上需要考虑的问题进行探讨, 以期为该领域进一步的发展提供参考。
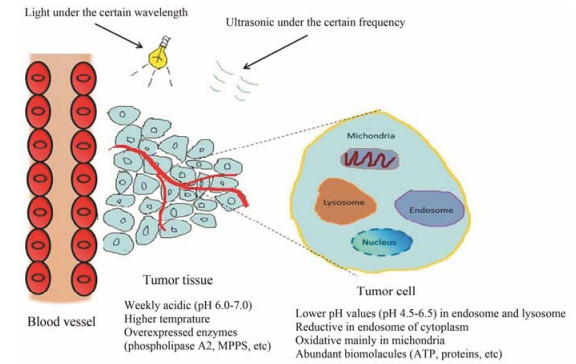
1 环境响应性共载递释系统高分子材料和纳米技术的快速发展, 促生了大量具有新型功能和良好治疗效果的递释系统。具有环境响应性递释系统可以使基因和药物在肿瘤组织 (肿瘤细胞) 选择性释放, 提高基因和药物的递释效率[7]。环境响应性载体接受来自内环境或外环境的刺激, 将基因和药物有目的地在肿瘤组织 (肿瘤细胞) 释放, 避免其在正常组织提前释放。肿瘤内环境响应性因素主要包括化学 (pH和还原剂)、物理 (热)、生物 (酶和ATP) 因素; 外环境响应性因素有光和超声波等 (图 1), 在不同的敏感环境中, 基因和药物释放的特性不尽相同。
|
Figure 1 Illustration of environment-responsive factors in the inner and outer tumors |
肿瘤内环境主要包括肿瘤组织和内体及溶酶体低pH、内体还原性 (如谷胱甘肽, GSH)、肿瘤组织较高的温度、肿瘤细胞中的生物分子如ATP和各种酶及线粒体中的超氧环境等。具有内环境相应特性的共载递释系统在不同因素的刺激下选择性释放基因和药物, 发挥协同抗肿瘤作用。
1.1.1 化学响应性递释系统 1.1.1.1 pH响应递释系统肿瘤细胞通过高效的糖酵解作用使得肿瘤组织处于弱酸环境 (pH 6.0~7.0)。另外, 肿瘤的亚细胞结构如内体和溶酶体具有更低的弱酸环境 (pH 4.5~6.5)[8-10]。基于肿瘤细胞内外环境和细胞内亚结构的pH梯度差, 可以将基因与药物共载递释系统设计成为具有pH敏感释放特性。常见的化学键如酰胺键[11]、酯键[12]和腙键[13]等在酸性条件不稳定, 在递释系统中引入这些化学基团, 制得pH敏感递药系统。
此共载递释系统研究多集中在共聚物纳米载体, 包括纳米粒、中空多孔硅纳米粒、胶束和超分支共聚物等。He等[14]利用分层的氧化石墨烯 (GO) 与电荷可逆的壳聚糖-顺式乌头酸酐 (CS-Aco)、具有生物相容性聚乙二醇 (PEG) 和低分子量聚乙烯亚胺 (PEI) 通过一定的方法制备纳米粒, 并包载多柔比星 (DOX) 和短发夹RNA (shRNA) 形成GO-PEI-PEG/DOX/CS-Aco/PEI/shRNA复合物。该复合物中具有电荷可逆的CS-Aco。在酸性环境中, 带负电荷的CS-Aco层经水解后转变为带正电荷的壳聚糖, 使纳米粒的屏蔽层变得松散, 利于DOX和shRNA的释放。解体的GO-PEI-PEG/DOX和壳聚糖能够有效地被内体摄取, 明显促进DOX和PEI/shRNA在胞浆中的释放。Wu等[15]利用盐辅助酸蚀法构建了一种中空多孔硅或有机硅纳米载体 (R/HMSVs或R/HMOVs), 并用其共载DOX和shRNA。该纳米载体因其中空结构和苯基桥键具有高效的传递效率和pH敏感释放特性, 因此可以增加细胞外药物的浓度及逆转MDR效应。另外, Jia等[16]用苯基硼酸修饰超分支己二醇二丙烯酸酯形成纳米载体 (OEI-PBA)。实验结果显示, 利用OEI-PBA共载DNA和DOX在较低的pH条件下, 硼酸链断裂使DNA和DOX触发释放, 从而增加DNA的转染率和DOX在溶酶体的浓度, 增强抗肿瘤活性。
利用载体材料在肿瘤细胞内/外电荷逆转的特性不同, 将其通过一定的方法构建具有双重pH敏感特性的共载递释系统, 可以进一步提高药物在肿瘤组织的释放和基因的转染率。Wang等[8]利用阳离子DOX-PEI (DP) 与阴离子的pDNA形成DOX和基因共载DP/pDNA (DPD) 核。然后, 阴离子的O-羧甲基壳聚糖 (CMCS)-PEG-天冬酰胺-甘氨酸-精氨酸 (NGR) 共聚物 (CMCS-PEG-NGR, CPN) 吸附在正电荷的DPD上形成双pH敏感CPN/DPD (CDPD)。实验结果显示, CDPD在pH 7.4和pH 6.0中的转染率分别为 (11.43 ± 0.59) %和 (20.20 ± 1.21) %。另外, 模拟内体条件DOX和pDNA的程序释放实验显示, DP构建的DPD核使DOX快速释放, 而在酸性的内体条件中保护pDNA被降解。Yu等[17]用聚 (甲基丙烯酸二甲胺基乙酯) 与聚[2-(二异丙基氨基) 甲基丙烯酸乙酯]形成二元共聚物 (PDMA-b-PDPA, PDPA), 并用其共载siRNA和紫杉醇 (PTX)。PDPA链段在pH 6.3中能自组装形成疏水性的核包载PTX, 而PDPA链段形成正电荷的壳与siRNA成为胶束复合物。在细胞内摄取中, siRNA在早期内体 (pH 5.9~6.2) 被激活/裂解, PDPA链段中二异丙基取代叔胺通过质子化作用释放包载的PTX。
1.1.1.2 还原响应递释系统肿瘤细胞组织中存在的主要还原性物质为GSH, 此外, 还包括硫氧还蛋白还原酶、二价铁离子 (Fe2+)、溶酶体硫醇还原酶和半胱氨酸等。研究证明, 肿瘤细胞内和细胞外具有不同的还原特性。其中, 胞浆中GSH的浓度 (2~10 mmol·L-1) 远远大于细胞外的浓度 (2~20 μmol·L-1), 由于血浆中存在酶的降解作用, 因此, 其GSH浓度最低 (1~2 μmol·L-1)[18-20]。在还原性敏感材料中通常引入二硫键[21-23]、二硒键[24, 25]和琥珀酰亚胺-硫醚键[26]等, 其中二硫键的研究最为广泛。
递释系统中的二硫键在体内GSH等还原剂的作用下断裂形成两个硫醇基, 从而提高药物在肿瘤组织的释放量和基因的转染率[27]。还原敏感性的基因与药物共载递释系统研究主要集中在阳离子纳米粒和聚合物胶束。Davoodi等[28]通过二硫键将低分子量的PEI和聚 (ε-己内酯) (PCL) 连接, 合成了具有还原敏感性的阳离子聚合物纳米粒载体。细胞质中的GSH使二硫键断裂产生触发释放效应。用该纳米粒共载DOX和p53-pDNA后的共聚物对HepG2细胞和HeLa细胞表现出比载DOX纳米粒更高的细胞毒性作用。Ko等[29]利用二硫键连接聚丙交酯和甲基丙烯酸酯, 构建了具有还原敏感性的阳离子基因与药物共载递释系统。体外释放结果显示, 在无GSH的释放介质中DOX从载药胶束中无明显的释放, 而在10 mmol·L-1 GSH中的释放量明显增加, 10 h释放总量超过了80%。体外基因转染率结果显示, ssDNA在HeLa细胞中的转染率随着阳离子胶束量的增加而增加, 并在N/P = 4时趋于平衡。Hu等[30]基于二硫键采用核交联L-精氨酸、L-组氨酸和硫辛酸构建阳离子多肽胶束 (THRss) 作为DOX和坏死因子相关凋亡诱导配体 (pTRAIL) 共载体 (THRss/DOX/TRAIL)。THRss/DOX/TRAIL表现出还原敏感特性, 通过增强溶酶体的逃逸能力从而增加DOX的细胞毒性作用和基因的转染率。LHRss/ DOX/TRAIL能够增加DOX的积聚和TRAIL的表达, 进而使MCF-7/ADR细胞的凋亡增加到83.7%。Chang等[31]利用柱[5]芳烃与二茂铁盐形成聚阳离子转运载体, 由于二茂铁盐阳离子和二茂铁基团之间均衡的还原性, 该转运载体表现出显著的还原敏感特性, 用其构建GSH响应性的DOX和siRNA共转运体, 该转运体在肿瘤细胞中可以快速地释放药物及表现出良好的基因转染率。
多孔硅纳米粒 (MSNPs) 在还原敏感性的基因与药物共载递释系统中具有重要的应用。MSNPs具有显著的特性如合适的粒径、独特的多孔结构、内部多空结构可修正载药、高的表面电位和易于表面修饰等。Ma等[32]利用二硫键连接金刚烷和乙二胺修饰的β-环糊精构成多孔硅纳米粒并包载siRNA和DOX构建共载体系。生理环境中高浓度的GSH可以使二硫键断裂从而触发药物和siRNA释放。实验结果显示, 该纳米粒共载siRNA和DOX的IC50为17.5 μg·mL-1, 载DOX纳米粒IC50则为37.2 μg·mL-1, 显示前者具有更高的细胞毒性作用。Zhao等[33]用β-环糊精与乙醇胺修饰的聚 (甲基丙烯酸缩水甘油酯) 构建CD-PGEA复合物, 并利用二硫键将其连接至星型中空硅纳米粒 (SHNPs) 的表面形成具有还原敏感性的SHNP-PGEAs纳米粒。体外释放结果显示, 10-羟基喜树碱在30 min后从具有还原敏感性的载体 (CPT-SHNP100-S-S-Ad) 中释放大约30%, 而在无还原敏感性的载体 (CPT-SHNP100-PGEA1) 中无明显的释放。SHNP-PGEAs通过还原敏感的门控作用控制药物的释放, 提高基因的转染率从而发挥协同抗肿瘤作用。
1.1.2 物理响应性递释系统肿瘤组织中的温度通常在40~45 ℃, 略高于正常组织 (37 ℃)。在较高温度下, 血液循环的速度增大, 同时可以提高传递系统在脉管系统的渗透性, 从而增加纳米粒在肿瘤部位的聚集[34]。Peng等[35]构建了一种新型的热敏感磁性阳离子脂质体递释系统 (TSM-CLDOX-shSATB1), 并用该脂质体共载DOX和特异AT序列结合蛋白-1 (SATB1 shRNA)。体外热敏释放结果显示, TSCL-DOX-shSATB1 (非磁性脂质体共载递释系统) 和TSMCL-DOX-shSATB1中DOX在37 ℃释放率分别为12%和15%, 而在42 ℃时释放率分别为35%和43%。另外, 共载递释系统表现出良好的靶向传递效应和基因沉默。
在聚合物胶束中引入普朗尼克F127 (PF127) 构建具有热敏感特性的共传递载体, 显示出良好的应用前景。Seo等[36]利用PEI连接PF127和叶酸合成了具有热敏感释放特性的聚合物胶束 (PF127-PEI-FA)。载尼罗红 (NR) 的PF127-PEI-FA胶束体外释放结果显示, 在25 ℃、37 ℃和40 ℃下NR的释放量分别为49%、69%和77%, 可以看出, 随着温度的升高, NR的释放量逐渐增大。PF127-PEI-FA胶束共载基因和药物递释系统在肿瘤靶点显示良好的药物控释特性。类似地, Lee等[37]利用PF127与分支状的PEI通过壳核交联构建热敏感胶束 (FPEI) 作为药物与基因共载体。实验结果显示, 随着温度的升高, NR从胶束中的释放增加。体内外进一步生理功能实验结果显示, FPEI系统显示出良好的温度触发释放NR并进入HeLa细胞, 而且质粒绿色荧光蛋白的转染率升高。
嵌段共聚物在热敏感共传递载体具有重要的应用。Zhang等[38]合成了一种温度敏感的嵌段共聚物, 并用其共载DNA和PTX。利用聚 (乙二醇) 二丙烯酸酯形成一个障碍凝胶释放载体以持续不断地转染培养细胞。障碍凝胶的孔隙率通过添加和移除PF127调整。该温度敏感共聚物包载DNA经皮下和瘤内注射通过形成一个热凝胶释放库延长基因表达。
1.1.3 生物响应性递释系统 1.1.3.1 酶响应递释系统研究证明, 肿瘤组织中存在高度表达的酶[磷脂酶如磷脂酶A2或金属蛋白酶 (MMPs)], 其中MMP-2和MMP-9与人体肿瘤生长有着密切关系。具有酶敏感的载体材料在肿瘤中相关酶的作用下降解, 显示出酶触发的控释特性[39]。Zhu等[40]利用中空多孔硅 (HMS) 和酶降解聚 (L-赖氨酸) (PLL) 构建了HMS/PLL纳米粒, 利用荧光素和胞嘧啶磷酸二酯鸟嘌呤 (CpG ODN) 分别作为模型药物和基因构建共载体MFHMS/(CpG/PLL)3粒子。体外释放结果显示, MFHMS/(CpG/PLL)3粒子中的荧光素和CpG ODN在α-胰凝乳蛋白酶溶液中显示出酶触发的控释特性, 而且可以通过改变酶的浓度控制两者的释放率。Qin等[41]将聚乙烯亚胺-聚乙二醇 (PEI-PEG) 通过MMP-2可裂解的PLGLAG肽链与氧化石墨烯 (GO) 接枝, 然后将DOX与上述聚合物通过化学键相连。在肿瘤组织MMP2酶过度表达的刺激下, 肽链裂解发挥肿瘤治疗作用并在原位肿瘤细胞产生DOX荧光成像。而且基于PEI的纳米复合物可以有效地介导DNA转染, 从而显示药物/基因联合治疗的强大潜力。Hao等[42]将坎地沙坦与PEI通过酰胺键接枝形成聚合物-药物 (CD-PEI), 作为药物和siRNA共载体治疗肺癌。因此, CD和siRNA通过酰胺酶相应机制从纳米载体中分离, 进而在体外通过不同的途径下调血管内皮生长因子mRNA和蛋白质的表达, 发挥协同抗血管增生作用。
1.1.3.2 ATP响应递释系统三磷酸腺苷 (ATP) 存在于活体组织中, 在重要的生理和病理过程中, 浓度会发生变化。ATP在细胞内的浓度 (1~10 mmol·L-1) 高于细胞外的浓度 (低于0.4 mmol·L-1)。这一特性易于构建ATP响应性材料用于区分肿瘤组织和正常组织的差异, 获得更好的靶向治疗效果[43]。Wang等[44]构建PEI和ATP响应双适体 (ARAD) 共聚物, 由双适体共载DOX和质粒DNA (p53) 并与PEI以静电相互作用相结合形成稳定的PEI/ARAD/DOX/p53复合物, 其可以保护适体和p53免受核糖核酸酶的降解。双适体夹层中的DOX在ATP浓度较高的环境中通过改变结构释放。经PEI/ARAD/DOX/p53复合物处理的细胞凋亡率增加到40.8%, 而PEI/ARAD/DOX复合物和PEI/ARAD/p53复合物则分别为24.7%和11.5%。因此, 共载DOX和p53可以发挥协同治疗效果并有效促进肿瘤细胞凋亡。
1.2 肿瘤外环境响应性递释系统在肿瘤组织外部施加不同的物理条件 (光、超声波等), 并在基因与药物共载递释系统中引入敏感基团 (光敏感或超声敏感), 使基因和药物在相应敏感因素下控制释放, 亦是一种较为理想的治疗手段。
1.2.1 光响应递释系统光触发释放要求传递载体中具有光反应物质, 在适宜波长光照后触发内容物释放。Yin等[45]合成了基于金纳米棒 (AuNRs) 的纳米载体, 并用其共载DOX和siRNA。该纳米复合物具有光介导治疗作用。在665 nm光源处照射AuNRs纳米复合物, 可提高siRNA和DOX的释放, 增强抗肿瘤活性。抗肿瘤实验结果显示, 用665 nm光源治疗的AuNRs纳米复合物体内肿瘤抑制率达到90%。抗肿瘤的机制为K-Ras基因的失活导致Panc-1细胞前合成相受阻。AuNRs纳米复合物对Panc-1细胞的合成相抑制率达到了35%, 高出未经处理的实验组细胞的17%。
1.2.2 超声响应递释系统共载化疗药物 (如PTX) 和siRNA靶向血管增生基因 (如BCL-2) 同时具有克服质子泵介导的耐药性和与血管增生有关的耐药性。但是基于这种纳米药物的肿瘤渗透药物传递极其困难, 这是由于与单载药物递释系统相比其粒径相对较大。通过超声波将脂质体和胶束组装形成新的递释系统可以有效解决这一问题。Yin等[46]通过异源组装PEG与聚 (L-赖氨酸) 形成的聚合物胶束 (mPEG-b-PLLys) 和脂质体, 构建超声敏感的纳米泡并用其共载PTX和siRNA (PTX-NBs/siRNA) 用于治疗肝癌。将低频超声波施加于肿瘤部位, 通过向HepG2移植模型的裸鼠尾静脉注射PTX-NBs/siRNA, 可以获得有效的siRNA和PTX肿瘤穿透共传递。
环境响应性共载基因与药物共载递释系统主要在pH响应性和还原响应性方面研究较多。通过肿瘤组织微环境和正常组织的差异, 一方面, 具有微环境响应性的共载系统可以响应肿瘤组织的特殊环境, 将药物和基因有目的地释放, 提高其在体内的稳定性, 增加生物利用度; 另一方面, 具有光敏感和超声敏感的递释系统在特定波长和一定频率超声波的刺激下同样可以定位释放药物和基因, 提高化疗药物的抗肿瘤效应和基因的转染率。但是, 外环境相应性递释系统的研究相对较少, 尤其像具有磁敏感性基因与药物共载递释系统研究很少见。因此, 该领域的研究工作还需不断地完善和深入地开展。
2 基于pH响应和/或还原响应的多功能共载递释系统从前文的论述可以看出, 环境响应性基因与药物共载递释系统通过肿瘤内外环境选择性释放效应发挥明显的治疗作用。特别是, 如果将环境响应特性 (pH响应和/或还原响应)、肿瘤靶向性和其他特性整合于一个共载系统中, 从多角度提高抗肿瘤活性, 将会获得更加明显的抗肿瘤效应。
2.1 双重响应递释系统在共载递释系统中, 同时引进具有pH响应和还原响应双重特性的化学基团, 可以进一步提高药物和基因的触发释放效应。Chen等[47]利用具有pH敏感性的聚[2-(异丙基氨基)-甲基丙烯酸乙酯] (PDPA)、还原敏感性的聚[N-(2, 2'-二巯基 (乙胺))-天冬酰胺]、[PAsp (AED)]和聚乙二醇 (PEG) 构建三元共聚物PEG-PAsp (AED)-PDPA, 然后将DOX包载至pH敏感核、靶向siRNA抗凋亡肽BCL-2基因 (BCL-2 siRNA) 包载于还原敏感夹层。在酸性溶酶体富含GSH的环境中, 双刺激响应性胶束载体可以使DOX和BCL-2 siRNA产生特异性微环境快速释放。Wang等[48]构建了由分支状PEI和生物可降解性的聚 (2-二异丙基氨基/2-巯基乙胺) 天冬氨酸乙酯[PAsp (DIP/MEA)]形成的二元共聚物[PEI-PAsp (DIP/MEA)], 并用其共载胞嘧啶脱氢酶 (CD) 基因和5-氟胞嘧啶 (pCMVCD/ 5-FC)。当纳米复合物处于癌细胞中溶酶体低pH (~5) 和富含还原剂 (~10 mmol·L-1 GSH) 时, 叔胺产生质子化作用并且二硫键断裂释放药物。体外释放结果显示, 在pH 7.4中24 h内不到10% 5-FC从纳米载体中释放, 而在pH 5.0、10 mmol·L-1 GSH条件下释放率达到98%。另外, 共载递释系统获得了有效的CD基因转染。Yoon等[49]将四臂聚乙二醇通过还原性和可酸裂解链段与DOX和抗BCL-2寡核苷酸相连构成自组装纳米共载体。动态光散射仪和电子显微镜观察研究粒径变化情况, 在还原条件下粒子完全消失, 而且在低pH条件下寡核苷酸发生裂解。DOX和寡核苷酸在介质中通过pH和还原特性控制释放, 大部分的药物和DNA在24 h内释放。
除了pH和还原双响应基因与药物共载递送系统, 具有pH和酶双响应特性的基因与药物共载系统也备受关注。Huang等[50]构建了一种细胞穿膜肽修饰的纳米粒, 并用其共载靶向血管内皮生长因子质粒表达的干扰RNA (shVEGF) 和DOX, 构建共载dtACPPD/ shVEGF-DOX纳米粒。该纳米载体通过微环境低pH和基质金属蛋白酶-2双重相应特性有效地抑制血管增生并促进肿瘤细胞凋亡。
2.2 多功能递释系统多功能基因与药物共载递释系统具有环境响应 (主要为双重敏感)、肿瘤靶向修饰和细胞膜运转等多重特性, 在基因与药物共载递释系统中具有重要的应用。Xu等[51]利用新型的三嵌段共聚物叶酸/甲氧基聚乙二醇-聚 (L-谷氨酸-酰肼)-聚 (N, N-二甲氨基丙基甲基丙烯酰胺) [FA/m-PEG-b-P (LG-Hyd)-b-PDMAPMA]作为DOX和P-gp siRNA共载体。该纳米复合物集pH敏感、还原敏感和叶酸靶向于一体。体外释放结果显示, 纳米复合物中DOX和siRNA的释放具有pH敏感和还原敏感, 与生理环境相比, 模拟肿瘤细胞内溶酶体还原酸性条件 (pH 5.0, 10 mmol·L-1GSH) 释放速度明显加快。另外, 叶酸修饰的纳米复合物比未经叶酸修饰的纳米复合物具有更高的细胞摄取率和细胞毒性。Zhang等[52]合成了聚 (丁烯磷酸盐)-聚 (ε-己内酯)-ss-聚[甲基丙烯酸2-(二甲氨基) 乙酯] (Gal-PEEP-a-PCL-ss-PDMAEMA) 三元共聚物, 并用其形成多功能生物可降解靶向共载抗癌药物和基因递释系统。该共载系统具有还原敏感、pH敏感和半乳糖酸介导的肝靶向等多重特性。DOX从载DOX胶束中的还原和pH触发释放显示, 在pH 5.0和pH 7.0 (10 mmol·L-1 GSH) 中的释放明显增加, 而且在pH 5.0中释放率更大。活体细胞成像观察结果显示, Gal-PEEP-a-PCL-ss-PDMAEMA/DNA/DOX共聚物在HepG2细胞中的摄取效率高于HeLa细胞, 这与半乳糖酸与HepG2细胞表面过度表达的去唾液酸蛋白受体之间的特异性链段-受体相互作用有关。
TAT是一种阳离子细胞穿膜肽, 能够有效地促进和加强通过静电或共价结合的基因和药物共载递释系统的细胞摄取[53]。Han等[54]利用细胞穿膜肽TAT修饰多孔硅纳米粒 (TAT-MSN) 作为阳离子包载DOX, 聚 (丙烯氯化铵)-柠康酐 (PAH-Cit) 作为阴离子内层和半乳糖修饰的三甲基壳聚糖-半胱氨酸 (GTC) 作为阳离子外层包载siRNA, 构建多层纳米复合物 (MLNs)。在GTC外层的半乳糖酸通过受体介导的细胞内吞作用使MLNs内化。内体/溶酶体酸触发的PAH-Cit的电荷逆转可以使MLNs裂解而逃离胞液。细胞质中GSH通过促使二硫键断裂进一步增加GTC层siRNA的释放, 从而产生更高的沉默率。同时, 暴露在外的载DOX借助TAT肽转运至细胞核并且显示持续释放的特性。Liu等[53]利用PEI和PEG合成共聚物, 并用TAT连接在PEG末端, 可发挥穿膜激活作用。该传递载体具有被动和主动肿瘤靶向、细胞膜运转、pH触发药物释放和共传递特性等多种功能。为获得主动或被动双靶向于肿瘤血管内皮细胞和肿瘤细胞, 具有NGR功能的病毒模拟壳在聚离子络合物胶束表面通过静电吸附形成磺胺甲基嘧啶 (SA)-PEG-NGR。结果显示, 该多功能纳米递释系统通过共载DNA和DOX可发挥基因治疗和化疗的协同作用, 有效提高基因转染和体外抗肿瘤活性。
另外, 多功能共载多肽和基因递释系统在抗肿瘤治疗中也发挥重要的作用。Chen等[55]利用叶酸修饰的细胞穿膜肽FA-CR8C和三苯基膦 (TPP) 修饰的促凋亡肽TPP-KK (KLAKLAK)2C (CKLA (TPP)) 通过核交联形成肿瘤靶向多肽[xPolyR8 (FA)-KLA (TPP), FK]。电荷可逆转的聚乙二醇-2, 3-二甲基马来酸酐 (DA)-L-赖氨酸 (PEG-PLL (DA)) 与正电荷复合物FK/p53通过静电相互作用形成FK/p53/PEG-PLL (DA) 复合物。FK/p53/PEG-PLL (DA) 复合物在肿瘤部位聚集后, 肿瘤酸触发的电荷逆转可导致PEG-PLL (DA) 从FK/p53复合物中分离, 进而通过叶酸介导的细胞摄取和静电吸附有效地进入肿瘤细胞。在胞浆中高浓度GSH刺激下, 二硫键断裂导致促凋亡肽C-KLA (TPP) 和p53基因分离。
多功能基因与药物共载递释系统正在不断地发展和完善, 在递释系统中引入具有新型功能的化学基团, 可以赋予其新的特性和治疗效应, 进一步提高基因与药物的协同治疗作用。
3 结语基因与药物共载递释系统通过协同作用可以明显提高抗肿瘤的治疗效果, 但是该系统的构建存在一些需要考虑的问题。例如, 基因与药物共载于一个递释系统具有不同的机制, 通过不同的信号通路发挥协同治疗效应。因此, 首先, 基因与药物联合应用应基于对疾病进程中的分子机制有准确的认识; 其次, 基因与药物共载于同一个递释系统需要确保基因与药物两者之间在诸如包载率和功能机制等方面不会产生相互影响。当药物和基因包载率下降时, 共载递释系统的构建会显得不够完美。作为共传递中的协同治疗, 基因与药物的释放地点、时间与数量也很重要。通常情况下, 先通过基因改变癌细胞的信号通路, 进而增加对药物的敏感性, 才能更好地发挥协同治疗作用。另外, 环境响应性的基因与药物共载递释系统研究还在不断地探索之中, 其理论体系还需要进一步地改进和完善。由于基因与药物联合治疗的复杂性, 基因与药物共载递释系统在未来用于临床治疗需要更加深入的研究。
肿瘤内环境和外环境响应性递释系统可以使基因与药物在肿瘤组织或胞浆内选择性释放, 提高药物的抗肿瘤效果和基因的转染率。基于环境响应性的多功能基因与药物共载递释系统集触发释放、靶向传递和细胞膜运转等作用于一体, 也成为该领域中备受关注的研究热点。因此, 环境响应性递释系统在基因与药物共传递中具有广阔的研究前景。
| [1] | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144: 646–674. DOI:10.1016/j.cell.2011.02.013 |
| [2] | Xiao Y, Jaskula-Sztul R, Javadi A, et al. Co-delivery of doxorubicin and siRNA using octreotide-conjugated gold nanorods for targeted neuroendocrine cancer therapy[J]. Nanoscale, 2012, 4: 7185–7193. DOI:10.1039/c2nr31853a |
| [3] | Koganti S, Jagani HV, Palanimuthu VR, et al. In vitro and in vivo evaluation of the efficacy of nanoformulation of siRNA as an adjuvant to improve the anticancer potential of cisplatin[J]. Exp Mol Pathol, 2013, 94: 137–147. DOI:10.1016/j.yexmp.2012.10.007 |
| [4] | Sher YP, Chang CM, Juo CG, et al. Targeted endostatin-cytosine deaminase fusion gene therapy plus 5-fluorocytosine suppresses ovarian tumor growth[J]. Oncogene, 2013, 32: 1082–1090. DOI:10.1038/onc.2012.134 |
| [5] | Sakai-Kato K, Nishiyama N, Kozaki M, et al. General considerations regarding the in vitro and in vivo properties of block copolymer micelle products and their evaluation[J]. J Control Release, 2015, 210: 76–83. DOI:10.1016/j.jconrel.2015.05.259 |
| [6] | Paliwal SR, Paliwal R, Agrawal GP, et al. Hyaluronic acid modified pH-sensitive liposomes for targeted intracellular delivery of doxorubicin[J]. J Liposome Res, 2016, 26: 276–287. DOI:10.3109/08982104.2015.1117489 |
| [7] | Shen Y, Wang J, Li Y, et al. Co-delivery of siRNA and paclitaxel into cancer cells by hyaluronic acid modified redox-sensitive disulfide-crosslinked PLGA-PEI nanoparticles[J]. RSC Adv, 2015, 5: 46464–46479. DOI:10.1039/C5RA03085D |
| [8] | Wang M, Liu T, Han L, et al. Functionalized O-carboxy-methyl-chitosan/polyethylenimine based novel dual pH-responsive nanocarriers for controlled co-delivery of DOX and genes[J]. Polym Chem, 2015, 6: 3324–3335. DOI:10.1039/C5PY00013K |
| [9] | Li JZ, Yuan ZQ, Yan M, et al. pH-sensitive micelles loaded paclitaxel using carboxymethyl chitosan-palmitic acid medi-ated by cRGD[J]. Acta Pharm Sin (药学学报), 2016, 51: 642–649. |
| [10] | Zhang L, Wang Y, Gao HL, et al. The construction of cell-penetrating peptide R8 and pH sensitive cleavable polyethyl-ene glycols co-modified liposomes[J]. Acta Pharm Sin (药学学报), 2015, 50: 760–766. |
| [11] | Li H, Du J, Du X, et al. Stimuli-responsive clustered nanoparticles for improved tumor penetration and therapeutic efficacy[J]. Proc Natl Acad Sci USA, 2016, 113: 4164–4169. DOI:10.1073/pnas.1522080113 |
| [12] | Bian J, Hao Y, He JL, et al. Synthesis and characterization of a biodegradable ABC triblock terpolymer as co-delivery carrier of doxorubicin and DNA[J]. J Polym Sci Polym Chem, 2014, 52: 3005–3016. DOI:10.1002/pola.v52.21 |
| [13] | Dong DW, Xiang B, Gao W, et al. pH-responsive complexes using prefunctionalized polymers for synchronous delivery of doxorubicin and siRNA to cancer cells[J]. Biomaterials, 2013, 34: 4849–4859. DOI:10.1016/j.biomaterials.2013.03.018 |
| [14] | He Y, Zhang L, Chen Z, et al. Enhanced chemotherapy efficacy by co-delivery of shABCG2 and doxorubicin with a pH-responsive charge-reversible layered graphene oxide nano-complex[J]. J Mater Chem B, 2015, 3: 6462–6472. DOI:10.1039/C5TB00923E |
| [15] | Wu M, Chen Y, Zhang L, et al. A salt-assisted acid etching strategy for hollow mesoporous silica/organosilica for pH-responsive drug and gene co-delivery[J]. J Mater Chem B, 2015, 3: 766–775. DOI:10.1039/C4TB01581A |
| [16] | Jia HZ, Zhang W, Wang XL, et al. Polymeric assembly of hyperbranched building blocks to establish tunable nanoplat-forms for lysosome acidity-responsive gene/drug co-delivery[J]. Biomater Sci, 2015, 3: 1066–1077. DOI:10.1039/C4BM00382A |
| [17] | Yu H, Xu Z, Chen X, et al. Reversal of lung cancer multidrug resistance by pH-responsive micelleplexes mediating co-delivery of siRNA and paclitaxel[J]. Macromol Biosci, 2014, 14: 100–109. DOI:10.1002/mabi.201300282 |
| [18] | Fleige E, Quadir MA, Haag R. Stimuli-responsive polymeric nanocarriers for the controlled transport of active compounds: concepts and applications[J]. Adv Drug Deliv Rev, 2012, 64: 866–884. DOI:10.1016/j.addr.2012.01.020 |
| [19] | Li J, Huo M, Wang J, et al. Redox-sensitive micelles self-assembled from amphiphilic hyaluronic acid-deoxycholic acid conjugates for targeted intracellular delivery of paclitaxel[J]. Biomaterials, 2012, 33: 2310–2320. DOI:10.1016/j.biomaterials.2011.11.022 |
| [20] | Zhou Y, Yu J, Feng X, et al. Reduction-responsive core-crosslinked micelles based on a glycol chitosan-lipoic acid conjugate for triggered release of doxorubicin[J]. RSC Adv, 2016, 6: 31391–31400. DOI:10.1039/C6RA05501J |
| [21] | Wang Y, Hong CY, Pan CY. Galactose-based amphiphilic block copolymers: synthesis, micellization, and bioapplication[J]. Biomacromolecules, 2013, 14: 1444–1451. DOI:10.1021/bm4003078 |
| [22] | Wang K, Hu Q, Zhu W, et al. Structure-invertible nanoparticles for triggered co-delivery of nucleic acids and hydrophobic drugs for combination cancer therapy[J]. Adv Funct Mater, 2015, 25: 3380–3392. DOI:10.1002/adfm.v25.22 |
| [23] | Gaspar VM, Baril P, Costa EC, et al. Bioreducible poly (2-ethyl-2-oxazoline)-PLA-PEI-SS triblock copolymer micelles for co-delivery of DNA minicircles and doxorubicin[J]. J Control Release, 2015, 213: 175–191. DOI:10.1016/j.jconrel.2015.07.011 |
| [24] | Zeng XL, Zhou XY, Li MY, et al. Redox poly (ethylene glycol)-b-poly (L-lactide) micelles containing diselenide bonds for effective drug delivery[J]. J Mater Sci Mater Med, 2015, 26: 234. |
| [25] | Ma N, Li Y, Xu HP, et al. Dual redox responsive assemblies formed from diselenide block copolymers[J]. J Am Chem Soc, 2010, 132: 442–443. DOI:10.1021/ja908124g |
| [26] | Baldwin AD, Kiick KL. Reversible maleimide-thiol adducts yield glutathione-sensitive poly (ethylene glycol)-heparin hydrogels[J]. Polym Chem, 2013, 4: 133–143. DOI:10.1039/C2PY20576A |
| [27] | Zhao J, Mi Y, Feng SS. Targeted co-delivery of docetaxel and siPlk1 by herceptin-conjugated vitamin E TPGS based immunomicelles[J]. Biomaterials, 2013, 34: 3411–3421. DOI:10.1016/j.biomaterials.2013.01.009 |
| [28] | Davoodi P, Srinivasan MP, Wang CH. Synthesis of intracel-lular reduction-sensitive amphiphilic polyethyleneimine and poly (ε-caprolactone) graft copolymer for on-demand release of doxorubicin and p53 plasmid DNA[J]. Acta Biomater, 2016, 39: 79–93. DOI:10.1016/j.actbio.2016.05.003 |
| [29] | Ko NR, Cheong J, Noronha A, et al. Reductively-sheddable cationic nanocarriers for dual chemotherapy and gene therapy with enhanced release[J]. Colloids Surface B, 2015, 126: 178–187. DOI:10.1016/j.colsurfb.2014.12.010 |
| [30] | Hu C, Gu F, Tai Z, et al. Synergistic effect of reduced polypeptide micelle for co-delivery of doxorubicin and TRAIL against drug-resistance in breast cancer[J]. Oncotarget, 2016, 7: 61832–61844. |
| [31] | Chang Y, Yang K, Wei P, et al. Cationic vesicles based on amphiphilic pillar 5 arene capped with ferrocenium: a redox-responsive system for drug/siRNA co-delivery[J]. Angew Chem Int Ed Engl, 2014, 53: 13126–13130. DOI:10.1002/anie.201407272 |
| [32] | Ma X, Teh C, Zhang Q, et al. Redox-responsive mesoporous silica nanoparticles: a physiologically sensitive codelivery vehicle for siRNA and doxorubicin[J]. Antioxid Redox Sign, 2014, 21: 707–722. DOI:10.1089/ars.2012.5076 |
| [33] | Zhao N, Lin X, Zhang Q, et al. Redox-triggered gatekeeper-enveloped starlike hollow silica nanoparticles for intelligent delivery systems[J]. Small, 2015, 11: 6467–6479. DOI:10.1002/smll.201502760 |
| [34] | Jhaveri A, Deshpande P, Torchilin V. Stimuli-sensitive nano-preparations for combination cancer therapy[J]. J Control Release, 2014, 190: 352–370. DOI:10.1016/j.jconrel.2014.05.002 |
| [35] | Peng Z, Wang C, Fang E, et al. Co-delivery of doxorubicin and SATB1 shRNA by thermosensitive magnetic cationic liposomes for gastric cancer therapy[J]. PLoS One, 2014, 9: e92924. DOI:10.1371/journal.pone.0092924 |
| [36] | Seo SJ, Lee SY, Choi SJ, et al. Tumor-targeting co-delivery of drug and gene from temperature-triggered micelles[J]. Macromol Biosci, 2015, 15: 1198–1204. DOI:10.1002/mabi.201500137 |
| [37] | Lee SY, Choi SJ, Seo SJ, et al. Shell cross-linked poly-ethylenimine-modified micelles for temperature-triggered drug release and gene delivery[J]. RSC Adv, 2014, 4: 57702–57708. DOI:10.1039/C4RA10596F |
| [38] | Zhang B, Jia F, Fleming MQ, et al. Injectable self-assembled block copolymers for sustained gene and drug co-delivery: an in vitro study[J]. Int J Pharm, 2012, 427: 88–96. DOI:10.1016/j.ijpharm.2011.10.018 |
| [39] | He HN, Sun L, Ye JX, et al. Enzyme-triggered, cell penetrating peptide-mediated delivery of anti-tumor agents[J]. J Control Release, 2016, 240: 67–76. DOI:10.1016/j.jconrel.2015.10.040 |
| [40] | Zhu Y, Meng W, Gao H, et al. Hollow mesoporous silica/poly (L-lysine) particles for codelivery of drug and gene with enzyme-triggered release property[J]. J Phys Chem C, 2011, 115: 13630–13636. DOI:10.1021/jp203454g |
| [41] | Qin SY, Feng J, Rong L, et al. Theranostic GO-based nano-hybrid for tumor induced imaging and potential combinational tumor therapy[J]. Small, 2014, 10: 599–608. DOI:10.1002/smll.v10.3 |
| [42] | Hao S, Yan Y, Ren X, et al. Candesartan-graft-polyethyle-neimine cationic micelles for effective co-delivery of drug and gene in anti-angiogenic lung cancer therapy[J]. Biotechnol Bioproc Eng, 2015, 20: 550–560. DOI:10.1007/s12257-014-0858-y |
| [43] | Ru Q, Tian X, Wu YX, et al. Voltage-gated and ATP-sensitive K plus channels are associated with cell proliferation and tumorigenesis of human glioma[J]. Oncol Rep, 2014, 31: 842–848. |
| [44] | Wang GH, Huang GL, Zhao Y, et al. ATP triggered drug release and DNA co-delivery systems based on ATP responsive aptamers and polyethylenimine complexes[J]. J Mater Chem B, 2016, 4: 3832–3841. DOI:10.1039/C5TB02764K |
| [45] | Yin F, Yang C, Wang Q, et al. A light-driven therapy of pancreatic adenocarcinoma using gold nanorods-based nanocarriers for co-delivery of doxorubicin and siRNA[J]. Theranostics, 2015, 5: 818–833. DOI:10.7150/thno.11335 |
| [46] | Yin T, Wang P, Li J, et al. Tumor-penetrating codelivery of siRNA and paclitaxel with ultrasound-responsive nanobubbles hetero-assembled from polymeric micelles and liposomes[J]. Biomaterials, 2014, 35: 5932–5943. DOI:10.1016/j.biomaterials.2014.03.072 |
| [47] | Chen W, Yuan Y, Cheng D, et al. Co-delivery of doxorubicin and siRNA with reduction and pH dually sensitive nanocarrier for synergistic cancer therapy[J]. Small, 2014, 10: 2678–2687. DOI:10.1002/smll.v10.13 |
| [48] | Wang L, Yuan Y, Lin S, et al. Co-delivery of 5-fluorocytosine and cytosine deaminase into glioma cells mediated by an intracellular environment-responsive nanovesicle[J]. Polym Chem, 2014, 5: 4542–4552. DOI:10.1039/C4PY00291A |
| [49] | Yoon S, Kim WJ, Yoo HS. Dual-responsive breakdown of nanostructures with high doxorubicin payload for apoptotic anticancer therapy[J]. Small, 2013, 9: 284–293. DOI:10.1002/smll.201200997 |
| [50] | Huang S, Shao K, Liu Y, et al. Tumor-targeting and microen-vironment-responsive smart nanoparticles for combination therapy of antiangiogenesis and apoptosis[J]. ACS Nano, 2013, 7: 2860–2871. DOI:10.1021/nn400548g |
| [51] | Xu M, Qian J, Suo A, et al. Co-delivery of doxorubicin and P-glycoprotein siRNA by multifunctional triblock copolymers for enhanced anticancer efficacy in breast cancer cells[J]. J Mater Chem B, 2015, 3: 2215–2228. DOI:10.1039/C5TB00031A |
| [52] | Zhang Y, He J, Cao D, et al. Galactosylated reduction and pH dual-responsive triblock terpolymer Gal-PEEP-a-PCL-ss-PDMAEMA: a multifunctional carrier for the targeted and simultaneous delivery of doxorubicin and DNA[J]. Polym Chem, 2014, 5: 5124–5138. DOI:10.1039/C4PY00538D |
| [53] | Liu C, Liu F, Feng L, et al. The targeted co-delivery of DNA and doxorubicin to tumor cells via multifunctional PEI-PEG based nanoparticles[J]. Biomaterials, 2013, 34: 2547–2564. DOI:10.1016/j.biomaterials.2012.12.038 |
| [54] | Han L, Tang C, Yin C. Dual-targeting and pH/redox-responsive multi-layered nanocomplexes for smart co-delivery of doxoru-bicin and siRNA[J]. Biomaterials, 2015, 60: 42–52. DOI:10.1016/j.biomaterials.2015.05.001 |
| [55] | Chen S, Rong L, Lei Q, et al. A surface charge-switchable and folate modified system for co-delivery of proapoptosis peptide and p53 plasmid in cancer therapy[J]. Biomaterials, 2016, 77: 149–163. DOI:10.1016/j.biomaterials.2015.11.013 |
 2017, Vol. 52
2017, Vol. 52


