编者按
·新药发现与研究实例简析·
新药创制是复杂的智力活动, 涉及科学研究、技术创造、产品开发和医疗效果等多维科技活动。每个药物都有自身的研发轨迹, 而构建化学结构是最重要的环节, 因为它涵盖了药效、药代、安全性和生物药剂学等性质。本栏目以药物化学视角, 对有代表性的药物的成功构建, 加以剖析和解读。
作用于多靶标的药物对防治复杂性疾病比单一靶标的药物更为有效, 而当前却可遇不可求, 因为理性设计水平还达不到精确的要求。尼达尼布同时抑制与肿瘤血管形成相关的3个激酶, 是对大多数激酶无活性的高选择性药物, 其发现也有幸运因素在内。然而研发者优化先导物对三靶标的活性和成药性, 对结构的各个部位做到精雕细刻的设计与分析, 分子模拟虽然给出了启示, 但更多的是药物化学家的灵感、判断和娴熟知识的运用, 才得以成功。
肿瘤发生和生长需要形成新生血管以提供氧和营养物, 抑制血管生成可使肿瘤萎缩, 因而是药物治疗实体瘤的重要环节。血管内皮生长因子 (VEGF) 引起其受体VEGFR的信号转导, 在血管形成过程中起关键作用, 因而最先成为肿瘤药物治疗的靶标, 已经上市的小分子药物索拉菲尼 (1, sorafinib) 和舒尼替尼 (2, sunitinib) 就是VEGFR酪氨酸激酶抑制剂。另一个与血管生成相关的靶标是血小板来源的生长因子 (PDGF) 及其相应受体 (PDGFR), 通过调控血管周细胞的增殖促进血管形成和稳定化。
|
第三个与血管形成相关的重要环节是成纤维细胞生长因子 (FGF) 及其相应受体FGFR。当肿瘤细胞的VEGFR通路受到抑制, 会采取逃逸机制, 将VEGFR通路转轨到FGFR通路, 以继续存活。所以单打一的策略对肿瘤的抑制有局限性, 而同时抑制VEGFR、PDGFR和FGFR的多靶标化合物, 会是更强效且不易产生耐药的抗肿瘤药物。勃林格殷格翰公司研究的初期只是以VEGFR为靶标, 后来拓展成基于3个受体激酶的多靶标抑制剂。
2 评价活性的模型用于通量筛选和初筛的体外模型, 是用VEGFR-2胞浆内激酶的结构域797~1335片段克隆到与谷胱甘肽-S转移酶 (GST) 融合的pFastBac蛋白上, 表达于SF-9昆虫细胞中, 经提取构建成筛选模型, 测定化合物对酶提取液的抑制活性 (IC50值)。对细胞的抑制活性是用VEGF刺激人脐静脉内皮细胞 (HUVEC) 测定半数抑制浓度 (IC50值)。实验表明, 化合物抑制HUVEC细胞增殖的活性与抑制VEGFR的活性具有相关性, 提示对HUVEC细胞的抑制是由于抑制VEGFR-2激酶而引起的。
3 先导化合物通过高通量筛选公司的化合物库, 并对曾是为了研发依赖于细胞周期蛋白4 (CDK4) 激酶抑制剂而合成的、但未呈现CDK4抑制活性的化合物进行筛选, 发现母核为吲哚啉酮的化合物3对VEGFR2有较高的抑制活性, IC50 = 763 nmol·L-1, 抑制HUVEC细胞的活性IC50 = 342 nmol·L-1。化合物3对CDK4没有抑制作用, 对其他激酶的活性也非常弱, IC50 > 10 μmol·L-1。因为对VEGFR-2激酶较强的特异性抑制作用, 被确定为先导化合物。
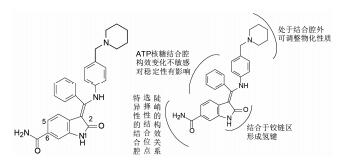
3.1 先导物的结构特征分析粗略地看化合物3与2相当类似:共有的吲哚啉酮母核, 经反式双键连接的芳香环, 后者引出碱性端基。但仔细分析3的结构与2有异同。相同处是吲哚啉酮的内酰胺经两个氢键结合于铰链区; 不同处是6位的氨酰基可能处于一个特异性腔内, 履行选择性结合的职能; 未取代的苯环可能结合于ATP核糖所处的腔内; 哌啶环未必在结合腔内。这些估计, 后经分子模拟和合成-测定-构效分析得到了验证, 深化认识了各个部位结构的作用。图 1是这些分析和验证的示意图。
|
图 1 化合物3预计的结合方式和后来验证的构效关系 |
去除6-氨酰基的化合物活性降低2倍。将氨基更换为取代的苯胺, 活性都显著降低。若将氨酰基由6位移至5位, 失去活性, 这些提示6-氨酰基吲哚啉酮似乎是不可改动的。
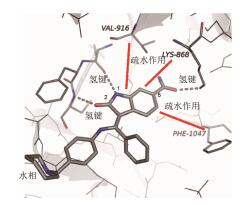
3.3 分子模拟:化合物3的结合特征为了揭示化合物3与激酶的结合方式和其中6-氨酰基的结合特征, 采用了分子模拟和计算化学方法。由于当时尚未解析VEGFR-2结构, 用同源模建方法由已知VEGFR-1的结构构建了VEGFR-2三维结构, 并根据多数激酶的杂环占据活性中心ATP的嘌呤环所处的位置, 定位了3的吲哚啉酮的位置和取向。分子模拟的结果如下: ① 吲哚啉酮环与疏水性氨基酸Lys868、Val919和Phe1047构成的疏水腔发生疏水-疏水相互作用; ② 1, 2位内酰胺与激酶铰链区的氨基酸发生两个氢键结合: C=O与Cys919的NH以及NH与Glu917的氧原子形成氢键; ③ 6-氨酰基进入ATP所处的疏水腔内, 该特异性疏水腔由Val916和Lys868把守门户, Lys8686与酰基形成氢键结合; ④ 末端的哌啶环未与激酶接触, 处于水相介质中。图 2是化合物3与VEGFR2激酶分子模拟的示意图。以上提示1, 2和6位形成多个氢键以及亲脂性母核有利于提高活性和选择性; 末端的碱性基团可以变换以调整物化性质。
|
图 2 化合物3与VEGFR2对接示意图 |
前述的6位氨酰基对活性影响很大, 分析H2NCO-片段具有亲水性 (π =-1.49), 却处于疏水腔内, 应是不适宜的, 为了增加亲脂性, 氨基上连接烷基以探究对活性的影响, 合成了化合物4~7, 结果活性显著减弱, 可能是由于体积增大, 该特异的疏水腔容纳不下, 产生位阻的缘故。将6-氨酰基“调转方向”成乙酰氨基 (π =-0.97), 化合物8完全失去活性。变换成乙酰基 (9, π =-0.55) 活性仍然很低, 再增加脂溶性, 如6-羧甲酯 (10, π =-0.01) 和6-羧乙酯 (11, π = 0.51), 活性提高, 超过了化合物3, 推测是亲脂性提高而体积并未加大, 还保留了氢键接受体C=O基团。此外, 氯或比较简单的基团如氨基或氰基化合物 (12~14) 的活性都强于3, 6-硝基化合物 (15) 活性最强。表 1列出了变换6位取代基化合物的结构和活性。
| 表 1 化合物3~15的结构和活性 |
综合分析表 1这些有代表性的化合物的构效关系, 提示6位取代基对活性的影响含有多种因素:基团尺寸、疏水性、氢键形成能力等对结合力有多重复杂影响, 构成“陡峭”的构效关系。但6位的电性效应对活性的影响较小, 推论6位的推拉电子效应对1和2位的氢键形成没有显著变化。
其中两个活性最强的是化合物15和10, 对VEGFR2的IC50分别是7和36 nmol·L-1, 抑制HUVEC细胞的活性IC50分别是60和103 nmol·L-1。然而15和10都有缺点, 硝基在体内可发生多种代谢产物, 有潜在的不良反应; 羧酸酯可能发生水解作用, 都涉及药代的成药性问题。氯取代的化合物12抑制细胞活性较强, 但对其他激酶有脱靶作用 (off-targeting), 故不可取。
10优于所有合成的化合物在于对于PDGFR和FGFR激酶也有强效抑制活性, IC50分别是54和71 nmol·L-1, 但对其他23种激酶没有抑制作用, 提示6位酯基取代选择性较强。虽然化合物10存在发生水解的羧酸酯基, 但灌胃小鼠的药代实验结果尚可 (灌胃50 mg·kg-1, Cmax 952 ng·mL-1, t1/2 3.5 h, AUC 5 246 ng·3 h·mL-1), 因此确定化合物10作为新一轮优化的先导物。
4.2 新一轮的优化继续进行结构优化的目标是对3个靶标VEGFR、PDGFR和FGFR激酶都要有较高抑制活性, 而对其他激酶 (off-target) 没有或低活性, 还需有良好的物理化学性质和药代动力学性质。优化的策略是以化合物10为起始物, 变换连接于苯胺对位的碱性片段 (哌啶环) 和连接基 (亚甲基), 与双键连接的苯基保持不变。
分子模拟显示哌啶环处于活性部位以外的水相中, 由于没有与激酶结合, 可以对该片段做较大的变换, 合成了长度不同的碱性链16~20。这些化合物对3种酶和对细胞的抑制活性都比较高。化合物21没有碱性氮原子仍然有高活性, 提示侧链上带有碱性基团并不是呈现活性的必要前提 (但对成盐性和调整物化性质很重要)。化合物23和24的侧链尺寸较小, 活性显著降低或失去活性。侧链上有含氮杂环的化合物25~27都呈现活性, 活性强弱的结构差异在下节讨论。表 2列出了变换碱性侧链的化合物及其活性。
| 表 2 不同碱性侧链的化合物及其活性 |
综合分析表 1和表 2所列的有代表性化合物的构效关系, 可以归纳出的规律性结论较少, 即或经分子模拟的微观分析, 也难以对多数化合物的活性强弱 (或有无) 做出理性的解释, 何况同时对3个靶标的作用。一方面说明影响这些靶标的结构因素的复杂性, 也说明现阶段的计算生物学存在局限性, 回顾性解释多于前瞻性的预测。
上述高活性化合物群中存在一个现象就是化合物20、21和22之间以及25和26之间的的构效关系。当与苯胺环相连的4位为叔氮原子, 活性显著高于相应的仲氮相连的化合物, 如20和21强于22; 25强于26。叔氮原子引出的侧链与苯胺的环平面呈垂直取向, 仲氮原子连接的侧链与苯胺的共面性几率较大, 推论侧链在空间的取向对活性是有影响的, 侧链与环系呈垂直取向的活性强于侧链与环的共面性。
这样, 候选化合物的选择更集中在20和25, 不仅是由于对VEGFR、PDGFR和FGFR激酶以及HUVEC细胞的高抑制活性, 而且对常见的23种激酶的活性很弱, 预示有较少的脱靶作用。20和25可抑制多种移植人肿瘤的裸鼠肿瘤生长, 小鼠灌胃也有良好的药代动力学性质。
化合物25还对Src家族的激酶有抑制作用, 对Flt-3激酶的IC50 = 26 nmol·L-1, 预示可能对急性髓细胞白血病有治疗效果。全面综合考虑, 确定25为候选药物, 公司代码为BIBF1120, 通用名为尼达尼布 (nintedanib)。
尼达尼布大鼠和猕猴的口服生物利用度 (F) 分别为12%和24%, 半衰期t1/2分别为4和7.1 h。口服生物利用度低的原因主要是首过效应酯水解缘故 (Roth GJ, Heckel A, Colbatzky F, et al. Design, synthesis, and evaluation of indolinones as triple angiokinase inhibitors and the discovery of a highly specific 6-methoxycarbonyl-substituted indolinone (BIBF 1120). J Med Chem, 2009, 52: 4466-4480)。
该项目自1998年启动, 2001年即确定尼达尼布为候选化合物, 经临床前和临床研究, 长时间大规模的一波三折的临床研究, 说明了创新药物的艰辛与风险, 直到2015年FDA批准上市, 目前的适应症是治疗非小细胞肺癌和特质性肺纤维化病 (IPF), 后者是FDA首次同年批准的两个治疗IPF小分子药物之一 (另一个药物是吡非尼酮) (Roth GJ, Binder R, Colbatzky F, et al. Nintedanib: from discovery to the clinic. J Med Chem, 2015, 58: 1053-1063)。
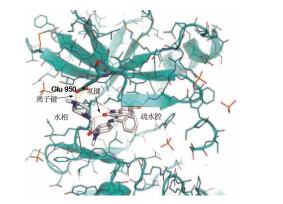
5 尼达尼布与VEGFR的结合特征和持续的抑制作用X-射线研究与VEGFR2复合物单晶结构表明, 尼达尼布结合于ATP结合位点, 定位于激酶的N末端和C末端结构域之间的裂隙处 (图 3), 连接有甲酯基的吲哚啉酮环处于疏水性氨基酸构成的疏水腔内, 内酰胺的-CO-NH-分别与铰链上的氨基酸Cys919和Glu917残基形成氢键, 这与前面叙述的分子模拟的结果相一致。甲基哌嗪环的位置与前述的哌啶环相同, 进入到水相中, 只是4位氮原子与Glu850的羧基的两个氧原子形成二齿性离子键, 距离分别为3.2和3.3 ,增加了结合强度, 这一点在分子模拟中因化合物3是哌啶环, 不可能预测到这种结合。
|
图 3 尼达尼布与VEGFR晶体衍射结构 |
尼达尼布与激酶结合的另一个特征是持续性抑制作用。用VEGFR2转染的细胞脉冲追踪 (pulse-chase) 实验证明, 细胞暴露于尼达尼布1 h后彻底洗除药物, 继续温孵细胞8、24和32 h, 之后用VEGF刺激细胞, Western印迹分析表明, VEGFR2受体的磷
酸化一直处于被抑制状态 (32 h以上)。推测是尼达尼布在细胞内酯基被水解, 游离酸难以穿越细胞膜逃逸, 被封闭在胞内。由于游离酸活性也很高 (IC50 = 62 nmol·L-1), 这或许是其持续性抑制的原因之一 (Hilberg F, Roth GJ, Krssak M, et al. BIBF1120: triple angiokinase inhibitor with sustained receptor blockade and good antitumor efficacy. Cancer Res, 2008, 68:4774-4782)。笔者认为也可能有其他因素。一是尼达尼布与酶的强力结合 (IC50 = 5 nmol·L-1), 几乎成为不可逆状态, 类似于共价键结合导致的持续抑制状态。也可能由于生成的酶-尼达尼布复合物具有慢离解速率常数, 即或介质中已不存在药物, 因药物有较长的驻留时间 (residence time) 使酶分子持续处于与抑制剂结合状态。这需要结合动力学实验证明。
 2017, Vol. 52
2017, Vol. 52



