2. 山西大学化学化工学院, 山西 太原 030006;
3. 山西大学化学生物学与分子工程教育部重点实验室, 山西 太原 030006;
4. 中国医学科学院、北京协和医学院药物研究所, 北京 100050;
5. 美国路易斯维尔大学, 美国 路易斯维尔 40292
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Shanxi University, Taiyuan 030006, China;
4. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China;
5. University of Louisville, Louisville 40292, USA
氨基酸是生物功能大分子——蛋白质的基本组成单位, 是动物体合成蛋白质的原料来源, 在医药行业及工业生产的各个领域具有重要地位。因此, 氨基酸分析技术对蛋白质化学、生物化学和整个生命科学研究以及产品开发、质量控制和生产管理等具有重要意义[1, 2]。目前, 氨基酸分离与测定的方法正在不断发展与完善之中, 包括化学法、气质色谱法、毛细管电泳法、液相色谱法等。
化学法主要是测定样品中总氨基酸的含量, 不能定性分析[1]。液相色谱法中应用最广泛的是茚三酮柱后衍生法[3]。此法可在低压条件下进行, 具有氨基酸水解物稳定的优点, 但是操作复杂、影响因素多。毛细管电泳法虽具有进样量少、灵敏度高等优点, 但分辨率及检测器的选择性仍需要提高[4]。氨基酸自动分析仪具有操作步骤简单、仪器稳定的优点, 但仪器价格昂贵、运行费用高及分辨率较低[5-8]。近年来, GC-MS法因选择性好、灵敏度高, 分析速度快等优点[7], 已成为目前定量分析氨基酸类物质最好的方法之一, 已在生化、医药、食品等方面得到了广泛的应用[9]。
气相色谱中常见的氨基酸衍生化试剂主要有硅烷化试剂、烷基氯甲酸酯类试剂等[10]。常见的用于衍生化氨基酸的硅烷化试剂主要有N-甲基-N-三甲硅基三氟乙酰胺 (MSTFA)、N-O-双 (三甲硅基) 三氟乙酰胺 (BSTFA) 等[11]。此类衍生化产物具有易于制备、衍生化后可直接进行气相色谱分析的特点, 这样节省了样品制备时间。但是硅烷化衍生试剂易于水解, 所以要求被处理样品必须完全干燥无水, 而且衍生化反应必须在加热条件下长时间进行[12]。常见的烷基氯甲酸酯类试剂主要有氯甲酸甲酯 (MCF)、氯甲酸乙酯 (ECF) 等。此类衍生化试剂与酚、胺的衍生化反应可以直接在水相中进行, 衍生化产物是碳酸酯和氨基甲酸酯[10]。氯甲酸酯作为胺的酰基化试剂, 衍生化反应迅速、产物单一且结构稳定。能同时衍生有机酸、游离脂肪酸、酚类、氨基酸类和胺类物质, 因此是本研究的主要候选对象。
由于氨基酸R基不同, 因此各种氨基酸的化学性质也有较大差异。比如按等电点pH将氨基酸分为酸性、碱性及中性氨基酸, 因此要定量制备出适于GC分析的所有氨基酸的衍生物有一定困难[6]。本文采用的基于ECF衍生化测定氨基酸的方法是对文献报道氨基酸衍生化方法的改进[13, 14]。本研究通过在操作过程中分两次加入衍生化试剂, 而且在第2次衍生化前调节pH, 最终可以同时检测20种不同属性氨基酸。本研究还使用正己烷代替氯仿, 减小对人体的伤害。实验结果表明该方法简便易操作, 氨基酸测定种类全面, 适用于植物、动物等多种生物样本的测定。
材料与方法仪器与材料 气相色谱质谱联用仪 (GC-MS) (Trace GC-PolarisQ Mass, Thermo Finnigan)。ECF、MSTFA含1%的TMS (成都化夏化学试剂有限公司); 蒸馏水, 无水乙醇、氢氧化钠、氯仿、无水硫酸钠、正己烷、吡啶 (分析纯, 北京化工试剂公司); 20种氨基酸对照品 (批号为140624-201506) 购于中国食品药品检定研究院; 黄芪花植物样本、健康小鼠尿液及血液样本取自山西大学中医药现代研究中心。
色谱条件与质谱条件 DB-5毛细管柱 (30 m × 0.5 mm × 0.25 μm); 载气:高纯氦, 流速1.0 mL·min-1; 分流比10:1;进样口温度220 ℃; 程序升温:起始温度80 ℃, 保持2 min, 10 ℃·min-1升至140 ℃, 保持1 min, 4 ℃·min-1升至240 ℃, 保持1 min, 5 ℃·min-1升至280 ℃, 保持5 min; Xcalibur 2.0.7工作站; 电子轰击 (EI) 离子源:离子源温度220 ℃, 传输线温度250 ℃; 扫描模式Full Scan; 质量扫描范围m/z 45~550。
氨基酸对照品溶液制备 分别取20种氨基酸对照品适量, 精密称定, 加蒸馏水配成浓度均为1 mg·mL-1的溶液。其中酪氨酸溶液中加入0.1 mol·L-1 NaOH溶液200 μL, 使溶液澄清透明。
氨基酸对照品溶液衍生化 精密量取20种氨基酸对照品溶液各1.00 mL, 分别加入无水乙醇400 μL、吡啶100 μL和ECF 50 μL, 20 ℃、40 kHz超声1 min, 然后加入正己烷500 μL, 涡旋1 min, 静置5 min, 3 000 r·min-1离心5 min, 然后加入7 mol·L-1 NaOH约100 μL调pH 9~10, 再加入ECF 50 μL进行二次衍生化, 超声1 min, 加入正己烷500 μL, 涡旋30 s, 3 000 r·min-1离心5 min, 取上清液, 合并两次上清液。氮气吹干。用适量正己烷复溶, 混合所有对照品的衍生化产物。氮气吹干, 正己烷100 μL复溶, 加入少量无水硫酸钠, 0.22 μm微孔滤膜滤过, 0.2 μL进样分析。
黄芪花氨基酸溶液的制备 黄芪花药材粉碎后, 过百目筛, 称取黄芪花粉末10 g, 加入蒸馏水300 mL, 加热回流提取3 h。旋转蒸发浓缩后用蒸馏水定容于100 mL量瓶, 备用。取黄芪花氨基酸溶液1 mL, 按如上方法进行衍生化反应。
小鼠尿液供试品溶液制备 取小鼠尿液1 mL, 在4 ℃、14 000 r·min-1条件下离心10 min, 取上清液, 备用。
小鼠血清供试品溶液制备 取血样100 μL, 加入去离子水100 μL, 甲醇400 μL, 涡旋混匀后冰浴10 min, 再超声混匀5 min, 继续冰浴10 min后在4 ℃、12 000 r·min-1条件下离心10 min。取上清液, 备用。
方法学考察
系统适应性 取同一份混合有20种氨基酸对照品溶液, 按上述方法操作, 制备对照品衍生化产物, 连续重复进样6次, 记录各色谱峰保留时间及分离度, 计算各色谱峰保留时间的相对标准偏差。
线性关系和定量限 将混合有20种氨基酸对照品溶液的母液稀释至不同浓度, 每个浓度平行进样3次, 以各氨基酸对照品溶液的进样浓度为横坐标, 以各组分色谱峰面积为纵坐标, 分别绘制各待测组分的标准曲线, 进行线性回归, 得回归方程和相关系数。以信噪比为10时相应进样分析的量为定量限。
稳定性 将混合有20种氨基酸对照品的溶液, 按上述方法操作, 制备对照品衍生化产物, 按上述方法分别在0、2、4、8、12和24 h检测, 记录各对照品的峰面积, 计算RSD。
精密度 将混合有20种氨基酸对照品的溶液, 按上述方法操作, 制备对照品衍生化产物, 平行6份, 按上述方法测定, 记录各对照品的峰面积, 计算RSD。
加样回收率 根据标准曲线以及黄芪花氨基酸溶液样本中目标峰的峰面积结合标准曲线方程计算样本中目标物质的含量, 取3份10 mL黄芪花氨基酸溶液分别加入相当于目标物质的含量50%、100%、150%的标准物质, 按上述方法操作, 制备供试品溶液, 按上述方法测定, 记录各目标化合物的峰面积, 每个浓度平行3份, 计算回收率。
结果 1 方法专属性参照文献[14, 15]方法同时结合本实验室具体情况。取上述氨基酸对照品溶液分别采用MSTFA及ECF对氨基酸进行处理, 比较不同衍生化试剂对氨基酸分离系统的影响。两种氨基酸衍生化化学反应式如反应路线1所示。
|
Scheme1 Reaction equation of ethyl chloroformate (ECF, A) and N-methyl-N-(trimethylsilyl) trifluoroacetamide (MSTFA, B) |
实验结果表明, 硅烷化衍生化方法检测到的峰较少而且杂质峰较多、基线不平, 改进后的ECF衍生化新方法共检测到20种氨基酸, 基线平整且杂质峰少、峰的分离度较好。
2 方法学考察结果表明, 对于大部分氨基酸, 在2~20 μg·mL-1内其浓度与响应值具有良好的线性关系, 相关系数r2均大于0.99。在线性考察实验中, 黄芪花氨基酸溶液中17种氨基酸的含量均在如表 1所示含量范围内。系统适应性实验结果显示20种氨基酸对照品的RSD<10%, 分离度R > 1.5, 表明方法的系统适应性良好。精密度实验结果RSD<10%, 表明方法的精密度良好。稳定性实验结果表明, 各目标色谱峰相对保留时间及色谱峰面积比值均无明显变化, 氨基酸对照品的RSD均在10%以内, 供试品溶液在24 h内稳定。具体实验结果见表 1。
| Table 1 Regression data, equation precision, limit of quantification (LOQ), system adaptability and stability. Y: Peak area; x: Concentration of compound (μg·mL-1); ND: Not detected |
加样回收率实验结果表明, 黄芪花氨基酸溶液中的17种氨基酸成分的平均回收率分布在78.3%~109.9%之间。其RSD在0.69%~6.66%之间, 说明该方法的准确度良好。
通过对分析方法的线性、精密度、重复性、回收率及稳定性的考察, 结果表明优化后的新方法在线性关系、灵敏度、重复性以及衍生化后产物稳定性和回收率等方面都具有优势, 满足实验定性定量分析的要求。
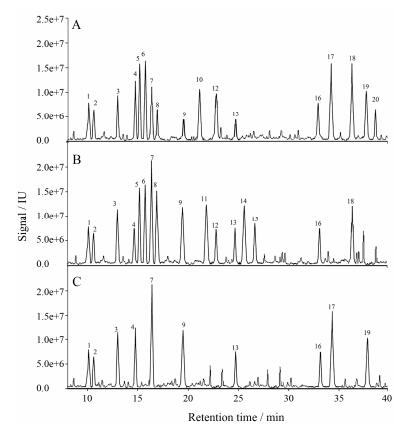
3 实际生物样本测定按照上述方法处理黄芪花、小鼠尿液及小鼠血清生物样本, 采用改进的ECF衍生化方法及色谱分析条件进样分析。结果如图 1所示, 图中各峰分离度较好, 杂质峰较少, 表明改进后的衍生化方法对植物样本以及小鼠尿样和血样都有较好的检测效果。各样本中氨基酸的含量见表 2。通过与对照品保留时间比对, 在黄芪花中共测得17种氨基酸、在小鼠尿液中测得16种氨基酸、在小鼠血清中测得10种氨基酸。

|
Figure 1 The GC-MS chromatogram of three samples deriva tized with ECF. A: The amino acids of Astragalus flower; B: The amino acids of the mouse urine; C: The amino acids of the mouse serum. The codes of peaks 1-20 were the same as in Table 1 |
| Table 2 Determination of amino acids in biological samples. ND: Not detected |
本文通过比较MSTFA和ECF两种试剂对氨基酸衍生化反应测定的影响, 总结改进后的ECF衍生化反应具有如下优点: ① ECF衍生化反应不需要将待测物去除水分, 大大降低了前处理的时间和难度[11]; ②衍生化试剂价格相对较便宜, 易于推广; ③衍生化反应迅速, 在48 min内20种氨基酸得到很好的分离, 且产物稳定; ④氨基酸测定种类增加至20种, 且重复性、精密度、稳定性及回收率等方面都有很好的效果。
本实验比较了ECF衍生化氨基酸不调节pH和调节pH对氨基酸出峰数目及分离系统的影响。结果表明在操作过程中分两次加入衍生化试剂而且通过在第2次衍生化前调节pH, 可以同时测定20种氨基酸。其反应的基本原理是在化学反应过程中当氨基酸的羧基变成酯或者钠盐后, 氨基的化学反应性能得到加强, 易和酰氯反应。将pH调为弱碱性, 氨基酸的氨基与酰氯更易发生反应, 因此衍生产物种类及浓度均增加。本实验还比较了氯仿和正己烷两种萃取剂, 考察不同萃取剂对氨基酸分离测定的影响。结果表明以毒性较小的正己烷代替氯仿作为萃取溶剂, 萃取效率较好。
| [1] | Zhang L, Liu SY. The research progress of amino acid determination method[J]. Hebei Chem Ind (河北化工), 2009, 32: 27–29. |
| [2] | Pan L, Li FF, Cui C, et al. Amino acid indirect fluores-cence assay for high throughput screening of proteases[J]. Sci Technol Food Ind (食品工业科技), 2009, 30: 338–340. |
| [3] | Li Q, Li G, Zhang HN. Determination of amino acid contents in Lilium davidii var. unicolor by post-column derivatization[J]. Food Nutr China (中国食物与营养), 2013, 19: 68–71. |
| [4] | Qu Q, Tang X, Wang C, et al. Characterization and applica-tion of a new ultraviolet derivatization reagent for amino acids analysis in capillary electrophoresis[J]. Anal Chim Acta, 2006, 572: 212–218. DOI:10.1016/j.aca.2006.05.026 |
| [5] | Zhou F, Liu S, Deng MR, et al. Determination of amino acids in Eucommia ulmoides Oliv leaves by gas chromatography-mass spectrometry/selected ion monitor[J]. Central South Pharm (中南药学), 2012, 10: 257–260. |
| [6] | Ni J, Xu HR. Research progress of tea amino acid detection[J]. Tea (茶), 2007, 33: 63–66. |
| [7] | Liu RS, Yang HQ, Huang YW, et al. Extraction, puri-fication and analysis of free amino acids in plants[J]. J Henan Univ Sci Technol:Nat Sci (河南科技大学学报:自然科学版), 2007, 28: 76–79. |
| [8] | Zhong YT, He C, Chen CX. Determination of amino acids in foods by high performance liquid chromatography[J]. China Tropical Med (中国热带医学), 2008, 8: 132–134. |
| [9] | Zhang J, Wang CP, Ruan JY, et al. GC/MS an GC determination method of the main free amino acid in tea research[J]. J Tea Sci (茶叶科学), 2010, 30: 445–452. |
| [10] | Yang XX. The research progress of derivative reagent gas chromatography[J]. J Inf Sci Technol China (中国科技信息), 2005, 7: 25. |
| [11] | Xie GX, Qiu YP, Gao XF, et al. Analysis of dencichine in Panax notoginseng by gas chromatography-mass spectrometry with ethyl chloroformate derivatization[J]. J Pharm Biomed Anal, 2007, 43: 920–925. DOI:10.1016/j.jpba.2006.09.009 |
| [12] | Chu XP. Research on the Anti-asthmatic Ingredients and Mechanisms of Herba Ephedrae and Pheretima Drug Partnership (药对麻黄-地龙抗哮喘药效物质基础与作用机制研究)[D]. Shanghai:Shanghai Jiao Tong University, 2008. |
| [13] | Namera A, Yashiki M, Nishida M, et al. Direct extract for determination of amino acids in human urine by gas chromatography and mass spectrometry[J]. J Chromatogr B, 2002, 776: 49–55. DOI:10.1016/S1570-0232(02)00075-2 |
| [14] | Qiu Y, Su M, Liu Y, et al. Application of ethyl chloroformate derivatization for gas chromatography-mass spectrometry based metabonomic profiling[J]. Anal Chim Acta, 2007, 583: 277–283. DOI:10.1016/j.aca.2006.10.025 |
| [15] | Lin JC. Metabonomic Study on Chemical Liver Injury and Liver Cancer (化学性肝损伤及肝癌的代谢组学研究)[D]. Shanghai:Shanghai Jiao Tong University, 2008. |
 2017, Vol. 52
2017, Vol. 52


