2. 南京海源中药饮片有限公司, 江苏 南京 210061;
3. 南京海昌中药集团有限公司, 江苏 南京 210061
2. Nanjing Haiyuan Prepared Slices of Chinese Crude Drugs Co. Ltd, Nanjing 210061, China;
3. Nanjing Haichang Chinese Medicine Corporation, Nanjing 210061, China
牛蒡子为菊科植物牛蒡 (Arctium lappa L.) 的干燥成熟果实, 味辛、苦, 性寒, 归肺、胃二经, 具有疏散风热、解毒透疹、利咽消肿等功效[1], 临床主要用于治疗咽喉肿痛、发热咳嗽、热毒疮肿等, 现代药理学研究证明, 牛蒡子具有抗肿瘤、抗糖尿病、抗炎、抗病毒、抗菌等作用[2], 2015年版《中国药典》收载其饮片品种有:牛蒡子和炒牛蒡子。牛蒡子生品长于疏散风热、解毒利咽, 经过炒制后, 可缓和其寒滑之性、免伤脾胃、气香浓郁可使宣散作用更强, 且有利于有效成分的煎出而增效, 从而长于解毒透疹、利咽散结、化痰止咳。
牛蒡子炮制前后临床疗效发生变化, 这些变化的物质基础是牛蒡子炮制前后化学成分发生了变化。课题组前期研究表明牛蒡子生品和炒品中绿原酸、异绿原酸A、牛蒡苷和牛蒡苷元等4个主要成分含量有显著变化[3], 但这4个成分的含量变化尚不能完全代表牛蒡子炒制前后药效变化的物质基础。因此, 有必要对牛蒡子炒制前后化学成分进行进一步研究, 揭示牛蒡子中的主要成分以及这些成分炮制前后的变化。
超高效液相色谱与质谱联用技术 (UHPLC-Q-TOF-MS/MS) 集高效分离能力的色谱, 高分辨、高灵敏、强定性能力的质谱于一体, 已成为中药成分研究的最有效的分析工具之一[4, 5]。牛蒡子主要化学成分包括木脂素类、酚酸类、萜类、脂肪油类等[6], 本研究以牛蒡子生品和炒品为研究对象, 采用UHPLC-Q-TOF-MS/MS技术定性和HPLC-UV定量多指标相结合的综合分析方法, 探讨牛蒡子炒制前后化学成分变化, 试图从化学成分角度阐述炒制对牛蒡子药效物质基础的影响, 为临床用药提供科学依据。
材料与方法仪器 日本Shimadzu超高效液相色谱仪 (配有LC-30AD二元液相泵、SIL-30SD自动进样器、DGU-20A5R在线脱气机、CTO-30A柱温箱); 美国AB SCIEX TripleTOF 5600+系统 (配有电喷雾离子源ESI); 数据采集软件: Analyst TF1.6 software (ABSCEIX, USA); 数据处理软件系统: Peakview 1.2 software (ABSCEIX, USA) 和Markerview 1.2.1 software (ABSCEIX, USA); 30A超高效液相色谱分析系统 (日本岛津公司); SPE固相萃取小柱; Shimadzu LC-20AB高效液相色谱系统 (日本岛津公司, 包括在线脱气机、Prominence SIL-20A自动进样器、SPD-M20A二极管阵列检测器、CTO-20A柱温箱)。KQ5200DB型数控超声波清洗器 (昆山市超声仪器有限公司); BP121S电子分析天平 (梅特勒−托雷多公司)。
试剂 色谱纯甲酸、质谱纯甲醇、质谱纯乙腈 (德国E. Merck); 水为Milliporeill-Q超纯水; 绿原酸 (批号110753-201314) 购自中国食品药品检定研究院; 牛蒡苷 (批号150901) 购自天津市科曼思特医药科技发展有限公司; 异绿原酸A (批号151028)、异绿原酸B (批号150726)、异绿原酸C (批号150624) 均购自南京森贝伽生物科技有限公司。牛蒡苷元由本实验室自制, 通过HPLC法确定纯度大于98%。实验中不同产地牛蒡子样品购自中药饮片企业, 共9个产地 (山东、东北、吉林、湖南、河北、安徽、江苏、四川、陕西), 经南京海源中药饮片有限公司丁斐中药师鉴定, 为菊科植物牛蒡 (Arctium lappa L.) 的干燥成熟果实。
UHPLC-Q-TOF-MS/MS定性分析 色谱条件采用Agilent C18反向色谱柱 (2.1 mm × 100 mm, 1.8 μm), 前置Aglient C18预柱; 流动相A (0.1%甲酸水溶液)−B (乙腈), 梯度洗脱, 程序为0~5 min, 5% B; 5~9 min, 5%~27% B; 9~28 min, 27%~45% B; 28~30 min, 45%~5% B; 流速0.3 mL·min−1; 柱温35 ℃, 进样体积2 μL。质谱条件UHPLC-Q-TOF-MS/ MS系统使用ESI离子源, 分别在正、负离子模式下采集数据。ISVF为4 500/−4 500 V, TEM为550 ℃, DP为60/−60 V, CE为35/−35 eV, 雾化气体为氮气, Gas1为55 psi (1 psi ≈ 6.9 kPa), Gas2为55 psi, Curtain Gas为35 psi。一级质谱母离子扫描范围为m/z 100~2 000, 二级质谱子离子扫描范围为m/z 50~1 000, 开启动态背景扣除 (DBS)。
HPLC-UV定量分析 色谱柱采用YMC-Pack-ODS-A C18 (250 mm × 4.6 mm, 5 µm); 流动相A (0.1%甲酸水溶液)−B (乙腈), 梯度洗脱, 程序为0~20 min, 5%~15% B; 20~75 min, 15%~35% B; 75~90 min, 35%~50% B; 流速: 1.0 mL·min−1; 柱温: 35 ℃; 检测波长: 286 nm; 进样量: 10 µL。
炒牛蒡子饮片的制备 按照课题组前期优化的牛蒡子最佳炒制工艺进行炮制:锅温310 ℃, 投入适量净牛蒡子, 不断翻炒, 待药温达到119 ℃, 开始计时, 翻炒2 min左右, 停止加热。继续翻炒, 直至有香味溢出, 取出, 放凉, 即得。
供试品溶液的制备 取牛蒡子及炒牛蒡子粉 (60目) 各1.0 g, 精密称定, 置100 mL锥形瓶中, 精密加入70%乙醇溶液60 mL, 超声提取30 min, 取出称定重量, 用70%乙醇补足减失重量, 静置后滤过, 取续滤液即得。
对照品溶液的制备 分别精密称取一定量的绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、牛蒡苷、牛蒡苷元对照品, 分置于不同的量瓶中, 加入甲醇分别制备得1.004、1.018、1.122、1.052、14.28和1.026 mg·mL−1单一对照品储备液, 混合对照品溶液储备液均由各标品储备液混合并稀释得到, 置于4 ℃保存。
结果 1 数据分析 1.1 数据库的建立借助于CNKI、PubMed和SciFinder等数据库检索牛蒡子相关文献, 尽可能全面地建立包含中药牛蒡子中所含化合物的分子式、分子质量和化学名称等信息数据库, 并借助于ChemSpider、ChemicalBook等下载各个化合物的mol文件, 计算其在正离子模式下常见离子[M+H]+、[M+NH4]+和负离子模式下常见离子[M+COOH]−、[M−H]−等多种离子形态的精确质荷比数值。
1.2 软件应用将牛蒡子生品和炒品的原始质谱数据导入PeakView软件中, 通过分析比较各个化合物由总离子流图提取到的二级碎片与其mol文件所对应的碎片之间的匹配以及相关文献数据对比进行化学成分确认, 最终误差<5 ppm的成分被鉴定出来; 并借助于Markerview软件对多批牛蒡子生品和炒品原始质谱数据进行主成分分析和组间t检验分析, 得出其PCA得分图和载荷图。
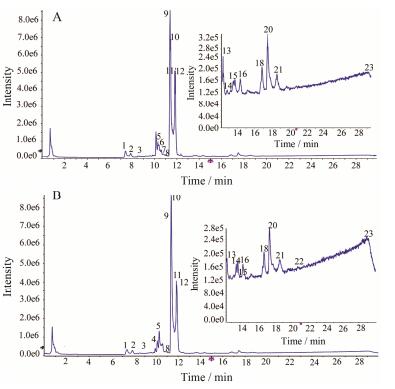
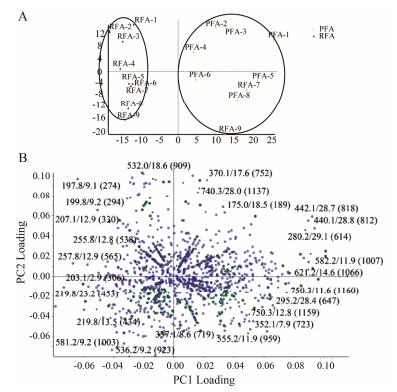
1.3 成分鉴别和分析牛蒡子生品和炒品在负离子模式下的总离子流图见图 1, 正负离子两种模式下共鉴别出23种化合物 (表 1), 以牛蒡苷为例来说明鉴别过程, 峰10的[M+COOH]−为579.208 0, 对应分子式为C27H34O11, 质量数为534.210 1, 主要二级碎片为m/z 371.150 4, 发现质量数正好与牛蒡苷元相当, 推测该化合物为牛蒡苷, 将牛蒡苷的mol文件所预测的碎片与二级碎片进行匹配, 最终确认该化合物为牛蒡苷。其他化合物采用类似鉴定方法, 鉴定出来的23种成分主要是木脂素类和酚酸类成分, 可以看出牛蒡子炒制前后质变成分较少。运用Markerview软件进行PCA分析和t检验, 在负离子模式下牛蒡子样品的得分图、载荷图见图 2, 根据主成分分析得分图可以看出, 18批牛蒡子生品和炒品分别聚成两类, 表明牛蒡子生品和炒品在第一主成分得分上有明显的差异, 即分别聚向横轴的相反方向, 说明牛蒡子炒制前后二者的UHPLC-Q-TOF-MS/MS数据存在明显的差异; 载荷图中对类别差异产生影响的离子的贡献大小在载荷图中以其原点距离表示, 图中每个点代表对分类贡献的成分, 即对其分类影响越大的离子在载荷图中距离原点的距离越远。在差异性成分分析中, P < 0.05的成分被鉴定出来, 其中t-value > 0表示牛蒡子炒制后峰强度减小; t-value < 0, 表明牛蒡子炒制后峰强度增大。在鉴定出的23种成分中共得出10种差异性成分, 发现牛蒡子炒后, 绿原酸、牛蒡苷、异绿原酸A含量下降, 异绿原酸B、异绿原酸C、牛蒡苷元、牛蒡酚C/异牛蒡酚C/牛蒡酚E/牛蒡素A、牛蒡酚H、牛蒡酚A、牛蒡酚F含量升高。
| Table 1 Components identified from raw Fructus Arctii (RFA) and processed Fructus Arctii (PFA). *P < 0.05, **P < 0.01 vs RFA |
|
Figure 1 The typical total ion chromatograms (TIC) of RFA (A) and PFA (B) in negative ion mode. The peak numbers represent the same meanings as in Table 1 |
|
Figure 2 The final PCA score plot (A), loading plot (B) of RFA and PFA in negative ion mode |
将混合对照品储备液进行倍比稀释, 配制成不同浓度的对照品溶液, 依次注入液相色谱仪, 按上述色谱条件测定峰面积, 以峰面积 (Y) 对分析物浓度 (X) 作线性回归, 求回归方程及线性相关系数r, 结果见表 2。
| Table 2 Linear results of 6 components in Fructus Arctii |
取同一混合对照品溶液, 按上述色谱条件连续进样6次, 分别记录6种分析物的峰面积, 计算峰面积的RSD, 分别为0.65%、0.58%、0.54%、0.59%、0.61%、0.87%, 结果表明仪器精密度良好。
2.3 稳定性取同一供试品溶液, 分别在0、2、4、8、12、24 h进样, 记录6种分析物的峰面积, 计算峰面积的RSD分别为0.091%、2.54%、0.57%、2.73%、0.12%、1.80%, 结果表明供试品溶液24 h内稳定。
2.4 重复性精密称取牛蒡子生品6份, 按“供试品溶液的制备”项下方法平行制备6份供试液, 按上述色谱条件进样, 依法测定峰面积, 计算6种分析物的含量, 其含量RSD分别为1.11%、0.88%、0.68%、2.15%、0.66%、1.83%, 表明该方法重复性良好。
2.5 回收率精密称定牛蒡子生品0.5 g, 共6份, 精密加入对照品适量 (与0.5 g牛蒡子中各成分量相当), 按“供试品溶液的制备”项下方法操作, 在上述色谱条件下进样分析, 计算回收率。这6种分析物的平均回收率分别为100.8%、99.4%、100.6%、94.3%、96.8%、98.6%; RSD分别为1.14%、1.92%、2.57%、2.18%、1.34%、0.76%, 符合药典规定。
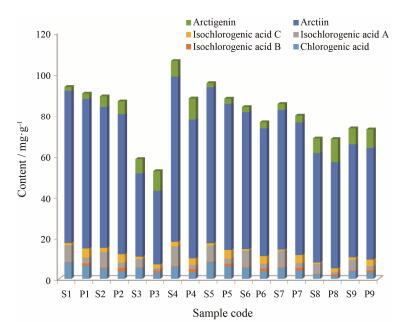
2.6 样品含量测定分别制备9个产地牛蒡子生品及炮制品的供试品溶液, 吸取供试品溶液各10 µL, 依法进样测定, 9个产地牛蒡子炮制前后主要活性成分含量变化如图 3所示。
|
Figure 3 Content change of main active components in RFA and PFA from different locations |
牛蒡子炒制后绿原酸、牛蒡苷、异绿原酸A含量降低, 异绿原酸B、异绿原酸C、牛蒡苷元含量增加, 推测高温使牛蒡苷苷键断裂, 分解为牛蒡苷元, 这与UHPLC-Q-TOF-MS/MS定性分析中牛蒡苷的裂解规律吻合; 异绿原酸A、异绿原酸B、异绿原酸C是互为同分异构体的二咖啡酰奎宁酸, 绿原酸为单咖啡酰奎尼酸, 二者生物合成途径相似, 常常共存于植物体内, 两者均对多种致病菌和病毒有较强的抑制和杀灭作用, 推测牛蒡子在炒制过程中, 绿原酸受热分解为咖啡酸和奎宁酸, 异绿原酸3种同分异构体之间可能相互转化, 但这些变化是如何产生的, 这些成分在炮制过程中的变化及规律都有待进一步研究。
本文利用HPLC-UV液相色谱与UHPLC-Q-TOF-MS/MS质谱联用技术, 明确了牛蒡子炒制前后的10种主要差异成分及其变化趋势, 并以其中6种成分为指标, 对不同产地炒制前后的牛蒡子分别进行了含量测定, 各成分的变化趋势同定性结果一致, 进一步验证了10种差异性成分选取的代表性和可靠性。本研究从炒制前后成分的含量变化入手, 探究了炮制对牛蒡子物质基础的影响, 为牛蒡子的质量控制研究提供了新的思路, 为其药效物质基础研究提供了科学依据。
牛蒡苷元具有抗炎、抗病毒活性[7], 抗肿瘤活性强于牛蒡苷, 牛蒡苷元对直肠癌、胰腺癌细胞PANC-1、皮肤癌、肝癌HepG2等均有一定的抑制活性[8], 作为活性成分的牛蒡苷元含量炒后增加, 提示可能是炒牛蒡子增效的重要原因之一, 已有研究报道, 牛蒡子中木脂素类和酚酸类成分具有明显的抗肿瘤活性, 如牛蒡酚F对前列腺癌PC-3细胞[8], 牛蒡酚B、牛蒡酚A、异牛蒡酚A对人慢性粒细胞白血病K562细胞[9], 也有多篇文献报道绿原酸的抗癌活性[10, 11], 这些成分共同发挥牛蒡子抗肿瘤活性, 牛蒡子炒制之后药效增加与这些成分的关系有待下一步的实验来验证。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015ed. Vol 1. Beijing: China Medical Science Press, 2015. |
| [2] | Qin KM, Wang B, Li WD, et al. Quality assessment of raw and processed Arctium lappa L. through multicomponent quantification chromatographic fingerprint and related chemometric analysis[J]. J Sep Sci, 2015, 38: 1491–1498. DOI:10.1002/jssc.v38.9 |
| [3] | Qin KM, Shu YC, Yang GM, et al. Study on change rule of major components of Arctii Fructus during processing[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2015, 30: 1503–1507. |
| [4] | Wang ZF, Zhao Y, Fan ZQ, et al. Qualitative analysis of chemical constituents in Si-Wu Decoction based on TCM component database[J]. Acta Pharm Sin (药学学报), 2015, 50: 1309–1317. |
| [5] | Xue Ying, Li XW, Li ZY, et al. UPLC/Q-TOF MS and NMR plant metabolomics approach in studying the effect of growth year on the quality of Polygala tenuifolia[J]. Acta Pharm Sin (药学学报), 2015, 50: 340–347. |
| [6] | Qin KM, Liu QD, Cai H, et al. Chemical analysis of raw and processed Fructus arctiiby high-performance liquid chromatography/diode array detection-electrospray ioniza-tion-mass spectrometry[J]. Pharmacogn Mag, 2014, 10: 541–546. DOI:10.4103/0973-1296.141806 |
| [7] | Min KC, Jang YP, Kim YC, et al. Arctigenin, a phenylpro-panoid dibenzylbutyrolactonelignan, inhibits MAP kinases and AP-1 activation via potent MKK inhibition:the role in TNF-α inhibition[J]. Int Immunopharmacol, 2004, 4: 1419–1429. DOI:10.1016/j.intimp.2004.06.011 |
| [8] | Zhang XD, Zhang CQ, Liu QD, et al. Research progress on anti-cancer active components and action mechanism of Arctii Fructus[J]. Mod Chin Med (中国现代中药), 2012, 14: 12–17. |
| [9] | Liu KL. Studies on the Constituents and Anti-tumor Ac-tivity in vitro of Arctium lappa L. (牛蒡子的化学成分研究与抗肿瘤作用初步研究)[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2008. |
| [10] | Wu XL, Wang J, Ren J, et al. Nuclear magnetic resonance spectroscopy-based metabonomics study on metabolic markers of chlorogenic acid against mouse breast cancer[J]. Chin J Antibiot (中国抗生素杂志), 2013, 38: 444–449. |
| [11] | Xiao HR, Li uY, Sun QY, et al. Study on the inhibitory effects of chlorogenic acid on CT26 colon cancer[J]. West China J Pharm Sci (华西药学杂志), 2012, 27: 269–271. |
 2017, Vol. 52
2017, Vol. 52


