天龙通心方 (TLTX) 是在参考大量中医药治疗冠心病心绞痛文献的基础上, 结合临床实践及现代药理研究成果研制的新型现代中药产品。该方由红景天、丹参、川芎等6味中药组成, 具有益气活血、通络止痛之功效, 临床用于治疗气虚血瘀所致的胸痹, 症见胸痛胸闷、心悸气短和倦怠乏力。药理研究表明, 该药可明显减轻心肌梗塞程度, 使得梗塞面积减小, 梗塞区重量减轻, 对心肌缺血所致心肌梗塞有明确的保护作用。对天龙通心方中各药味的化学研究及药理研究表明, 多酚类成分是主要的心血管活性成分。红景天苷是红景天的主要成分, 具有多种心血管药理活性[1-5]。酚酸类成分则是丹参中的主要成分, 具有强抗氧化及抗血小板聚集和血管舒张作用[6-8]。川芎的最主要酚酸成分为阿魏酸, 药理研究也发现其具有抗血小板聚集、抗血栓及降血脂等多种心血管系统活性[9, 10]。
本课题组前期应用LTQ-Orbitrap在天龙通心提取物中明确了33种主要成分, 结合文献和标准品应用API 4000Q TRAP定量了其中18种成分, 包括8个皂苷类成分, 6个丹参类成分、3个红景天类成分和1个川芎类成分。为尽可能全面反映整个复方的体内特征, 本研究对这18种成分进行了大鼠给药后的血浆含量测定预试, 结果在阳离子条件下皂苷类成分能够检测很少, 阴离子条件下可以完整描绘药代曲线的共有7个成分, 分别为丹酚酸A (salvianolic acid A, SAA)、丹酚酸B (salvianolic acid B, SAB)、紫草酸 (linthospermic acid, LA)、丹参素 (danshensu, DSS)、红景天苷 (salidroside, Sal)、阿魏酸 (ferulic acid, FA) 和迷迭香酸 (rosmarimic acid, RA)。为探讨TLTX药效物质基础, 并为临床给药方案提供依据, 本实验开展了这7种入血成分的定量分析方法研究, 并对TLTX大鼠给药后的血药浓度和药代特征进行了分析。
材料与方法药品和试剂 对乙酰氨基酚对照品 (含量测定用, 批号100018-200408), SAB对照品 (纯度95.4%, 批号111562-201212), DSS对照品 (纯度98.1%, 批号110855-201311), Sal对照品 (含量99.8%, 批号110818-201206) 和FA对照品 (纯度90.6%, 批号110773-201313), 均购自中国食品药品检定研究院; SAA对照品 (纯度大于95%, 批号20131026), RA对照品 (纯度大于95%, 批号20131204) 和LA对照品 (纯度大于95%, 批号20131117), 由南京泽朗医药科技有限公司提供。抗坏血酸 (分析纯, 批号20080107), 由国药集团化学试剂有限公司提供; 天龙通心提取物, 由河北涿州东乐制药有限公司提供, 批号TL20140612, 其中SAB、SAA、LA、RA、DSS、Sal和FA在提取物中的含量分别为1.90%、0.14%、0.12%、0.10%、0.19%、0.53%和0.02%。流动相用色乙腈、甲醇均为色谱纯, 购自美国Fisher公司。流动相用甲酸, 为美国J.T. Baker公司色谱纯产品。
仪器 液相质谱联用仪 (API 4000QTRAP), 配有Turbo VTM离子源仓、离子喷雾和大气压电离离子源, 以及Analysis 1.4.2数据处理系统, 美国Applied Biosystem公司; 高效液相系统为Agilent 1200系统配置包括G1322A脱气机、G1311A四元梯度泵、G1329A自动进样器G1316A柱温箱、G1330B进样盘温控器和G1314B检测器, 美国Agilent公司; 台式高速冷冻离心机 (MIKRO 22R), 德国Hettich公司。氮吹仪 (Model 18780), 美国Pierce公司。
色谱条件 色谱柱为kinetex C18柱, 预柱采用0.2 μm过滤筛板, 柱温10 ℃, 进样量为10 μL, 自动进样器10 ℃, 运行时间15.0 min。水相为含0.05%甲酸的水溶液 (含10%有机相), 有机相为甲醇/乙腈等比混合液 (含0.05%甲酸), 流速0.23 mL·min-1, 洗脱比例如下: 0→0.5 min为5%有机相, 1.5→4.5 min为65%有机相, 5.5→15 min为5%有机相。
质谱条件 离子源为ESI源, 气帘气体20 psi (1 psi ≈ 6.9 kPa), 源内温度600 ℃, 源内气体GS1为55 psi, 离子喷射电压 (IS)-4 500 V, 碰撞气 (CAD) Medium, 检测方式负离子检测, 扫描方式选择反应监测 (MRM) 方式, 扫描时间为80 ms, 用于定量分析的离子对如下所示: m/z 717.2→519.1 (SAB)、m/z 493.2→295.1 (SAA)、m/z 537.2→493.2 (LA)、m/z 359.2→161.0 (RA)、m/z 197.0→179.0 (DSS)、m/z 345.1→118.9 (Sal)、m/z 193.0→133.9 (FA) 和m/z 149.9→106.9 (IS)。
对照品及内标储备液的制备 取7种对照品各约5 mg, 精密称定, 分别置于5 mL量瓶中, 甲醇溶解并稀释至刻度, 制得对照品储备液。精密吸取各对照品储备液适量, 加入甲醇分别稀释成100 μg·mL-1的工作液, 待用; 取对乙酰氨基酚对照品约10.0 mg, 精密称定, 置于10 mL量瓶中, 甲醇溶解并稀释至刻度, 制得内标储备液。精密量取内标储备液适量, 加乙腈制备内标工作液。
血浆样品处理 精密吸取血浆50 μL, 转移至Ostro 96孔固相萃取板, 加入甲酸溶液10 μL、抗坏血酸溶液20 μL和含有内标的乙腈洗脱液200 μL, 混匀, Waters 96孔正压装置加压5 min (40 psi), 转移全部滤过液, 35 ℃水浴氮气吹干, 加入初始比例流动相液100 μL, 振荡混匀, 12 000 r·min-1离心5 min, 取上清液进行LC-MS/MS分析。
大鼠体内药代动力学研究 健康雄性SD大鼠6只 (合格证编号11401500008468), 由斯贝福 (北京) 实验动物科技有限公司提供, 体重220 ± 20 g。实验前12 h禁食不禁水, 实验期间自由饮水, 实验12 h后进食。按4.5 g·kg-1剂量灌胃给药, 分别于给药后0.083、0.167、0.333、0.667、1、1.5、2、4、6、8和10 h经大鼠眼眶静脉丛采血约0.2 mL, 置肝素化离心管中, 3 000 r·min-1离心5 min, 吸取血浆待测。采用DAS2.0生物统计学软件对大鼠灌胃给药后的时间-血药浓度数据进行非房室模型 (统计距法) 计算, 并应用SIMCA-P+进行分析。
结果 1 方法学验证 1.1 选择性取6个不同来源的大鼠空白血浆样品、相应空白血浆配制的样品以及天龙通心给药后的血浆样品进行分析, 见图 1。测定结果显示, 待测成分SAB、SAA、LA、RA、DSS、Sal、FA和内标的保留时间分别为5.74、5.85、5.66、5.70、1.84、2.82、5.56和2.22 min, 空白血浆在相应时间处没有出峰, 表明该血浆处理方法及测定条件具有专属性, 血浆中的内源性物质不干扰测定。
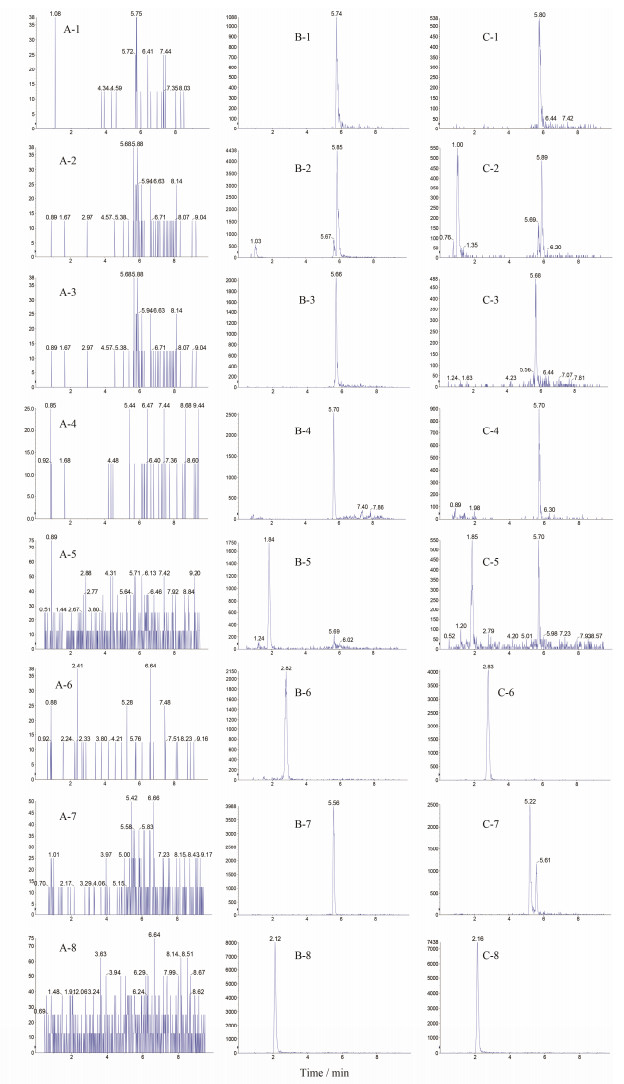
|
Figure 1 Typical MRM chromatograms of seven compounds and IS in rat plasma. A: Blank plasma; B: Blank plasma spiked with 20 ng·mL-1; C: Plasma sample at 10 min obtained from a rat after an oral administration of Tianlongtongxin extract. 1: Salvianolic acid B; 2: Salvianolic acid A; 3: Linthospermic acid; 4: Rosmarimic acid; 5: Danshensu; 6: Salidroside; 7: Ferulic acid; 8: IS |
实验当日精密吸取各标准品溶液适量, 用空白血浆配制成不同浓度的混标母液。在此基础上加入空白血浆进行逐级稀释, 得到系列标准血浆样品。以每个待测物浓度为横坐标, 待测物与内标物的面积比值为纵坐标, 用加权最小二乘法进行回归运算, 求得的直线回归方程即为标准曲线。各成分在血浆中的典型标准曲线为: RA, y = 0.024x + 0.003 47 (r = 0.996 1, 线性范围1.25~80 μg·L-1); SAB, y = 0.007x + 0.004 05 (r = 0.995 2, 线性范围2.5~160 μg·L-1); LA, y = 0.009x + 0.005 74 (r = 0.997 8, 线性范围1.25~80 μg·L-1); FA, y = 0.018x + 0.001 78 (r = 0.998 3, 线性范围2.5~160 μg·L-1); SAA, y = 0.013x + 0.002 17 (r = 0.996 3, 线性范围5~320 μg·L-1); DSS, y = 0.006x + 0.001 24 (r = 0.997 6, 线性范围5~320 μg·L-1); Sal, y = 0.002x + 0.014 (r = 0.998 7, 线性范围25~1 600 μg·L-1)。
1.3 定量下限实验配制成浓度为LLOQ的血浆样品6份, 按“血浆样品处理”项下依法操作, 进样10 μL, 进行LC-MS/MS分析。测定结果显示, RA的定量下限为1.25 μg·L-1, 精密度为12.18%; SAB、LA和FA的定量下限均为2.5 μg·L-1, 精密度分别为5.01%、9.21%和9.26%; SAA和DSS的定量下限均为5 μg·L-1, 精密度分别为10.37%和9.67%; Sal的定量下限为25 μg·L-1, 精密度为6.62%。
1.4 精密度和准确度取大鼠空白血浆, 配制RA (4、100、500 μg·L-1)、SAB/LA/FA (5、20、80 μg·L-1)、SAA/DSS (10、40、160 μg·L-1) 和Sal (50、200、800 μg·L-1) 低、中、高3个浓度的质量控制 (QC) 样品, 按“血浆样品处理”项下操作, 平行操作5样本, 测定3天, 根据当日标准曲线, 分别计算QC样品的测得浓度, 计算测定方法的批内和批间精密度。与配制浓度对照, 求得测定方法的准确度。结果显示, 各成分的日内精密度均小于10%, 日内精密度均小于15%, 准确度均在85.1%~114.6%内。
1.5 基质效应取来源不同的空白血浆, 按照“血浆样品处理”项下处理空白血浆, 以此为基质溶液配制低、中、高3个浓度血浆基质样品, 同时以初始比例流动相配制3个浓度混标溶液作为无基质样品, 以血浆基质样品的各成分峰面积与无基质溶液中该成分之比作为基质效应因子, 考察不同个体基质对各成分的影响, 结果显示, SAA的基质效应在128%~141%, 说明血浆基质对其有一定基质增强作用; DSS和Sal的基质效应分别为72%~75%和78%~85%, 存在一定基质抑制作用; 其他成分的基质效应均在92%~114%, 不存在基质效应。尽管血浆对化合物各成分的基质影响各不相关, 但是各成分的RSD在12.3%以内, 说明基质影响的个体间差异不大, 表明个体内及个体间的基质效应在校正曲线校正后, 不影响生物样品的准确定量分析。
1.6 回收率以空白血浆配制成3个浓度的质控样品, 每个浓度5份样品, 按“血浆样品处理”方法提取样品。同时取空白血浆, 按“血浆样品处理”项下操作, 取上清液配制相同浓度的对照样品 (control)。测定得到质控样品与相应浓度的对照样品的峰面积 (A), 计算其绝对回收率 (RE) = AQC / Acontrol。Sal和DSS的回收率最低, 3个浓度在54%~59%之间; SAA的回收率最高, 在90%~110%之间, 其余5个成分的回收率均在60%~73%之间。
1.7 稳定性在标准曲线范围内选择低、中、高3个浓度, 以大鼠血浆配制成相应标准样品溶液, 同时配置标准曲线, 分别进行0 h点 (配制后立即按照“血浆样品处理”项下方法处理) 分析, 在冰浴中血浆放置2 h后再按照“血浆样品处理”项下方法处理后分析, 将处理后样品在进样器放置12 h后分析, 每个浓度5份样品。以随行标准曲线计算的样品浓度与标识浓度的偏差 (RE%) 考察样品放置稳定性。结果显示, 各成分在室温放置后所有样品测量值的均值与标识比较的相对偏差均小于12.55%, 表明上述放置及处理条件下样品稳定, 可以满足测定要求。
2 大鼠血浆样品分析用本文建立的方法对大鼠给药后不同时间点血浆样品进行测定, 结果显示, TLTX给药后5 min即有成分吸收入血, 除FA外其他成分均可在给药10 h后被检出, 但各成分浓度差异很大, 其中含量最高的为Sal, 其次为DSS、LA和SAB, 含量最低的为SAA、FA和RA, 各成分在给药剂量下的时间-浓度曲线见图 2。
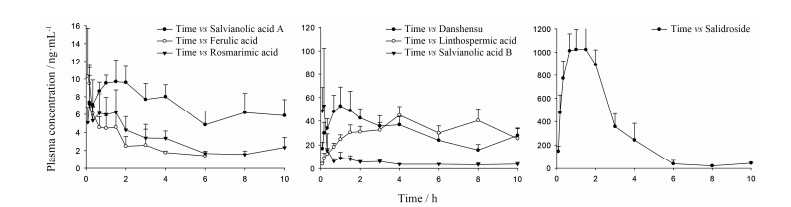
|
Figure 2 Mean plasma concentration-time curve of 7 compounds in rat after a single oral administration of Tianlongtongxin extract (TLTX) at a 4.5 g·kg-1dose. n = 6, x± s |
依据LC-MS/MS分析获得这7种入血成分血药浓度数据, 应用非房室模型方法计算药代动力学参数, 评价TLTX主要成分在大鼠体内的药代动力学参数, 分析结果见表 1。总体来看, 除了Sal, 大鼠血浆中其他待测成分含量均不高, 最大血药浓度不过几十纳克, 有的甚至为几个纳克; 从达峰时间来看, FA和SAB在大鼠体内达峰最快, 其次为RA、Sal、DSS和SAA, LA为达峰最晚的成分。从体内暴露量来看, Sal在大鼠血浆中的AUC最大, 远高于其他成分 (10倍以上), 但其在提取物中的含量不及SAB的1/3, 表明前者具有更好的生物利用度。
| Table 1 Pharmacokinetic parameters of 7 compounds in plasma after oral administration of TLTX in rats. n = 6, x± s |
将每只实验动物的药代参数进行min-max标准化后, 使用SIMCA-P+ 12.0软件对不同成分进行数据分析, 所得PCA二维得分图见图 3A, 结果显示, 待分析样本数据的空间分布明显不同, 可以清晰地分为Sal组 (蓝色) 和其他组 (红色), 这说明Sal药代参数与其他6个成分药代参数有明显差异。对其他6个成分药代参数的进一步分析发现 (图 3B), 这6组样品的空间分布比较相近, 且个体差异较大。
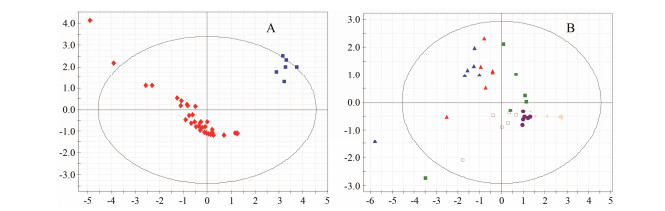
|
Figure 3 PCA score plots of different components of TLTX. A: Seven components, salidroside-blue, other six components-red, R2 = 0.814, Q2 = 0.412; B: The other six components without salidroside, salvianolic acid B group-green, danshensu group-red, linthospermic acid group-blue, salvianolic acid A group-brown, rosmarimic acid group-purple, ferulic acid group-yellow, R2 = 0.727, Q2 = 0.073 2 |
中药复方中所含化学成分种类多、含量低, 进入体内后血浆的情况更为复杂, 因此尽可能检测描述中药复方体内动力学过程, 将有助于阐释复方的物质基础和作用机制。然而实验对象大鼠血量有限, 连续动态多点取血方式下每个时间点取血不宜过量, 否则会使大鼠短时间失血过多而影响实验结果。但通常中药复方中所含成分不仅含量低, 而且化学属性差异大, 为保证检测灵敏度需要对每类化合物进行针对性的条件优化, 或至少针对正负离子两种检测模式进行优化, 这就需要更多的血浆样本进行检测。鉴于此, 作者尝试对血浆样品进行“一次处理、多次测定”的方法, 即在血容量有限的前提下, 优化血浆样品处理方法使其尽可能在一次处理后能够满足不同检测的需要, 该方法不仅能在保证待测分析化合物数量的同时还能减少所需血浆体积, 同时也节约了大量样品处理时间和成本。本研究根据预实验拟定每个时间点大鼠取全血0.2 mL, 分两次从正、负离子两种模式下进行检测。通过对比有机溶媒沉淀、液液萃取和固相萃取3种血浆样品处理方法下的离子抑制和回收率, 选择了Ostro96孔固相萃取板。尽管本次实验由于入血的正离子皂苷类成分含量太低而无法检测, 没有进行正离子的方法学研究, 但该方法后续在其他中药复方多成分的定量分析检测中体现出优势 (结果另文发表)。需要注意的是本方法对待测化合物的稳定性、尤其是后续待测化合物的稳定性有较高的要求。
在TLTX的体外研究中共定性定量了18个主要成分, 但其中8个皂苷类成分的总含量仅为0.02%, 再加上该类成分本身吸收差, 因此导致给药后在大鼠体内无法检测出皂苷类成分。在对其余10个负离子的研究中, 大鼠体内能够描述完整药时曲线的共有7个成分, 本研究在前期工作和文献基础上[11-13]针对这7个成分进行了定量分析方法学和体内药代动力学研究。在对这7个成分体内药代参数的PCA分析中, 可明显地将Sal与其他6个成分组区分开。从体内行为来看, Sal达峰快、达峰血药浓度高和半衰期短。由于该成分AUC远高于其他成分, 且在体内吸收快, 文献[1-5]报道也有多种心血管药理活性, 由此表明其可能是复方中的主要起效成分, 这也从体内血药浓度角度说明了红景天为君药的科学性。其他6个成分的进一步分析虽然没有显著差别, 但仍可以看出DSS和LA的空间分布比较接近, 而DSA、FA和RA的体内药代行为相近, 但这3个成分入血浓度较低, 对复方药效的支撑作用有待进一步研究。
在应用SIMCA进行组间差异分析时, 采用了统计矩处理方法得到的药代参数作为变量, 但缺少稳态分布容积 (Vss) 和清除率 (CL) 两个机体对药物处置过程描述的重要参数。这是因为大多数的中药复方均是口服给药, 无法进行静脉给药, 缺少相应的生物利用度信息而无法提供相关数据。如果在后期的研究中能够将传统中药复方提高至组分配伍的中药复方, 探讨有效成分体内行为的分类将更有意义。
| [1] | Zhang XK, Shama A, Feng J, et al. Inhibition of hypoxia-induced vascular leakage by salidroside[J]. Med J Natl Defend Forces Northwest China (西北国防医学杂志), 2016, 37: 605–607. |
| [2] | Wang XJ, Luo X, Zhou JM, et al. Chemical constituents from rhizomes of Rhodiola wallichiana var. cholaensis and their protective effects on myocardium[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 2822–2826. |
| [3] | Li J, Li JF, Wei TT, et al. Salidroside inhibits myocardial cell apoptosis in acute myocardial ischemia rats[J]. J Clin Pathol Res (临床与病理杂志), 2016, 36: 893–897. |
| [4] | Zhang MF, Shen YQ. Progress on pharmacological research of cardioprotection by salidroside[J]. Drug Eval Res (药物评价研究), 2017, 40: 125–132. |
| [5] | Ping Z, Zhang LF, Cui YJ, et al. The protective effects of salidroside from exhaustive exercise-induced heart injury by enhancing the PGC-1α-NRF1/NRF2 pathway and mitochondrial respiratory function in rats[J]. Oxid Med Cell Longev, 2015, 2015: 876825. |
| [6] | Fei AH, Cao Q, Chen SY, et al. Salvianolate inhibits reactive oxygen species production in H2O2-treated mouse cardiomyocytes in vitro via the TGFβ pathway[J]. Acta Pharmacol Sin, 2013, 34: 496–500. DOI:10.1038/aps.2012.209 |
| [7] | Tang MK, Ren DC, Zhang JT, et al. Effect of salvianolic acids from radix salviae miltiorrhizae on regional cerebral blood flow and platelet aggregation in rats[J]. Phytomedi-cine, 2002, 9: 405–409. DOI:10.1078/09447110260571634 |
| [8] | Jiang X, Jiang Y, Sun D, et al. Protective effect of magne-sium lithospermate B against dextran sodiumsulfate induced ulcerative colitis in mice[J]. Nviron Toxicol Pharmacol, 2013, 36: 97–102. DOI:10.1016/j.etap.2013.03.010 |
| [9] | Wang B, Ouyang J, Liu Y, et al. Sodium ferulate inhibits atherosclerogenesis in hyperlipidemia rabbits[J]. J Cardiovasc Pharmacol, 2004, 43: 549–554. DOI:10.1097/00005344-200404000-00010 |
| [10] | Ardiansyah, Ohsaki Y, Shirakawa H, et al. Novel effects of a single administration of ferulic acid on the regulation of blood pressure and the hepatic lipid metabolic profile in stroke-prone spontaneously hypertensive rats[J]. J Agric Food Chem, 2008, 56: 2825–2830. DOI:10.1021/jf072896y |
| [11] | Zhang Y, Li LQ, Lin L, et al. Pharmacokinetics, tissue distribution, and excretion of salidroside in rats[J]. Planta Med, 2013, 79: 1429–1433. DOI:10.1055/s-00000058 |
| [12] | Lin L, Liu JX, Zhang Y, et al. Prescription compatibility effect on the major components absorption in Danshen extract and their identification[J]. Acta Pharm Sin (药学学报), 2010, 45: 1290–1295. |
| [13] | Wang SP, Liu L, Wang LL, et al. Simultaneous determination of six hydrophilic components in rat plasma after oral administration of Jitai tablet by liquid chromatography-electrospray ionization-tandem mass spectrometry:application to a pharmacokinetic study[J]. J Chromatogr B, 2013, 912: 75–84. DOI:10.1016/j.jchromb.2012.11.019 |
 2017, Vol. 52
2017, Vol. 52


