2. 河南科技大学第一附属医院, 河南 南阳 473000
2. The First Affiliated Hospital of Henan University of Science and Technology, Nanyang 473000, China
食管癌 (EC) 的发病率在消化系统恶性肿瘤中位列第三, 且死亡率高[1]。其较高的复发率和转移率是导致5年生存率较低的主要原因[2]。食管鳞状细胞癌 (ESCC) 占所有食管癌发病率的90%以上, 与食管腺癌相比, 二者有显著不同的病因和病理特征[3]。寻找ESCC的预后预测指标和关键的分子机制不仅可以帮助临床预防和监测预后, 也可以为研究者提供新的治疗思路和治疗方案。
FoxM1是学术界公认的癌基因, 其在食管鳞癌中表达明显上调[4], 对其具有抑制作用的天然药物及化学合成单体药物的研究是目前药学界研究的热点。白花丹素 (5-羟基-2-甲基-1, 4-萘醌) 是双子叶植物药白花丹科植物白花丹根的活性提取物。《生草药性备要》: “味苦, 性寒, 无毒。”《广西药植图志》: “味辛, 气烈, 性热, 有大毒。”《四川中药志》: “性温, 味淡, 无毒。”《岭南草药志》: “性微温; 根茎:味微涩微苦; 叶:辣, 有毒。”入肺、脾、肝三经。目前已经被证明具有抗炎[5]、抗动脉粥样硬化[6]和抗肿瘤的作用[7]。有研究表明, 白花丹素具有抑制多种肿瘤细胞增殖的作用包括卵巢癌[8]、前列腺癌[9]、乳腺癌[10]和白血病[11]。但目前没有研究报道白花丹素在食管鳞癌中的研究情况, 关于其抗肿瘤分子机制的研究也很少, 因此本文围绕白花丹素对食管鳞癌的抗肿瘤活性进行研究。
材料与方法细胞与实验动物 KYSE-30、KYSE-70、KYSE-140和293T细胞, 由郑州大学中英分子肿瘤学研究中心提供。BALB/c裸鼠, 10只, 4~5周龄, 雄性, SPF级, 体质量18~22 g, 由常州卡文斯实验动物有限公司提供, 合格证号: SYXK (苏) 2011-0003。适应性饲养1周后用于实验。
药品、试剂与仪器 白花丹素 (Sigma公司, 美国), FoxM1启动子克隆质粒 (pEZX-LvGA04-FoxM1 promoter)、FoxM1启动子克隆对照质粒 (pEZX-LvGA01)、Secrete-PairTM双荧光素酶基因检测试剂盒 (GeneCopoeia公司, 美国)。
细胞培养 KYSE-30、KYSE-70、KYSE-140和293T细胞培养于37 ℃、5% CO2、湿度饱和的培养箱中, KYSE-30、KYSE-70和KYSE-140用含有10% FBS和1%青链霉素的1640培养基培养, 293T细胞用含有10% FBS和1%青链霉素的DMEM培养基进行培养。细胞在对数生长期进行后续实验。
CCK-8检测白花丹素对肿瘤细胞增殖的影响 将对数生长期的KYSE-140、KYSE-70和KYSE-30细胞分别接种于96孔板中, 每孔约0.5×103~1×103个细胞, 细胞贴壁后按0.625、1.25、2.5、5.0、10和20 μmol·L-1浓度加入白花丹素, 以含0.1% DMSO完全培养基为对照组。每组浓度设5个复孔, 24、48和72 h后换新鲜培养基, 并加入CCK-8试剂, 4 h后在450 nm处检测吸光度 (OD) 值。以白花丹素浓度为横坐标, 抑制率为纵坐标绘制抑制曲线, 并得出半数抑制浓度 (IC50)。
白花丹素对肿瘤细胞凋亡的影响 将对数生长期的KYSE-140细胞接种在腔室培养瓶中, 每瓶约1×104个细胞, 24 h后按0和5 μmol·L-1的浓度加入白花丹素, 再培养24 h, 取下细胞爬片, PBS漂洗2遍, 加入配好的凋亡染液, 室温避光孵育15 min, 荧光显微镜下观察。Annexin V-FITC荧光信号呈绿色, propidium iodide (PI) 荧光信号呈红色。
白花丹素对FoxM1 mRNA表达的影响 将处于对数生长期的KYSE-140细胞接种在6孔板中, 贴壁后以5和10 μmol·L-1浓度加入白花丹素, 对照组加入PBS, 24 h后消化收集细胞, TRIzol法提取总RNA。将1 μg RNA逆转录成cDNA: 2×RT mix 10 μL、mix 2 μL、oligo dT23VN 1 μL、random hexamers 12 μL, 总体系20 μL。反应条件: 25 ℃, 5 min; 50 ℃, 15 min; 85 ℃, 5 min。Real-time PCR的方法检测目的基因和内参的表达。引物序列如下: GAPDH: F 5'-GCTCTC TGCTCCTCCTGTTC-3', R 5'-ACGACCAAATCCGT TGACTC-3'; FoxM1: F 5'-TTAAGCAGCAGAAACG ACCG-3', R 5'-TCACCGGGAACTGGATAGGT-3'。以2-ΔΔCt表示基因的相对表达水平。所有样本均设3个复孔。
白花丹素对FoxM1蛋白表达量的影响 将处于对数生长期的KYSE-140细胞接种在6孔板中, 24 h后以5和10 μmol·L-1浓度加入白花丹素, 对照组加入PBS, 24 h后消化收集细胞提取总蛋白并进行定量。然后电泳分离, 转膜, 封闭, 兔抗人FoxM1一抗 (abcam, 美国) 孵育, 洗膜, 抗兔二抗孵育, ECL显影, GAPDH为内参。
构建稳定表达GLuc-SEAP双报告基因的FoxM1启动子克隆及FoxM1启动子对照克隆的KYSE-140细胞系 将对数生长期的293T细胞接种于10 cm培养皿中, 密度达到50%~60%时, 进行病毒包装, 收集细胞上清10 mL, 离心、过滤。分别各取1 mL加入密度达到50%~60%的KYSE-140细胞中, 24 h后更换培养基。72 h后加入嘌呤霉素 (1.0 μg·mL-1) 进行筛选, 48 h后除去抗生素, 药物浓度减半维持培养[12]。
白花丹素对FoxM1的转录调控 将处于对数生长期的稳定表达GLuc-SEAP双报告基因的KYSE-140细胞接种在6孔板中, 贴壁后以5和10 μmol·L-1浓度加入白花丹素, 对照组加入PBS, 培养24 h后收集0.2 mL培养基, 然后进行双荧光素酶基因报告实验:每孔10 μL细胞培养物 (3个复孔) 加入96孔白板, 每孔加入GLuc工作液100 μL, 室温孵育1 min, 多功能酶标仪检测GLuc的荧光强度。从GLuc检测流程中吸取50 μL含有GLuc工作液的细胞培养物, 65 ℃加热10~15 min。每孔10 μL (3个复孔) 加入96孔白板, SEAP工作液100 μL, 孵育10 min, 多功能酶标仪检测SEAP的荧光强度。
体内实验观察白花丹素对异体种植KYSE-140细胞生长的影响 BALB/c小鼠共10只, 随机分为对照组 (PBS)、白花丹素组 (通过腹腔注射2 mg·kg-1·day-1, 每周进行5次)。KYSE-140细胞 (1×106个细胞) 悬浮在1 mL PBS中, 皮下种植裸鼠的右侧腋下。当肿瘤达到100 mm3, 开始药物治疗。每天测量肿瘤大小, 肿瘤体积根据以下公式计算: V (mm3) = a×b2/2, a是肿瘤最长轴, b是肿瘤最短的轴。所有的小鼠都在治疗24天后处死。收集肿瘤组织, 测量固定后进行组织学研究。
免疫组化 肿瘤组织在4%多聚甲醛中固定, 常规处理后浸蜡包埋。取各组蜡块常规1 μm切片, 常规脱蜡、水化、修复后进行免疫和显色反应, 封片后显微镜观察各组FoxM1的表达水平。
统计学分析 应用SPSS 17.0软件包进行统计学处理, 实验结果以x± s表示, 多样本均数间比较采用单因素方差分析, 当P < 0.05时认为差别有统计学意义。
结果 1 白花丹素明显抑制KYSE-30、KYSE-70和KYSE-140细胞增殖白花丹素处理24、48、72 h后, 用CCK-8方法检测KYSE-30、KYSE-70和KYSE-140细胞的增殖, 发现白花丹素能够明显抑制3种细胞的增殖, 其抑制率在各个食管癌细胞系中均呈浓度依赖性 (图 1)。
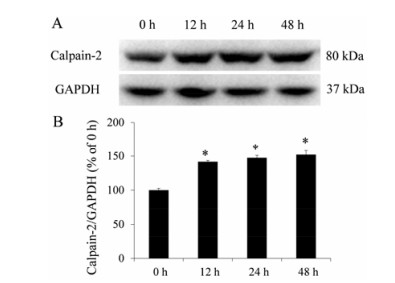
|
Figure 1 Plumbagin inhibited KYSE-30, KYSE-70 and KYSE-140 cells proliferation. A: 24 h; B: 48 h; C: 72 h; D: At different times, IC50 of plumbagin in KYSE-30, KYSE-70 and KYSE-140 cells |
5.0 μmol·L-1白花丹素处理KYSE-140细胞24 h后, Annexin V-FITC和PI染色, 10×倍镜下取3个不同视野进行计数, 发现白花丹素能够同时增加早期和晚期凋亡的敏感性 (图 2)。
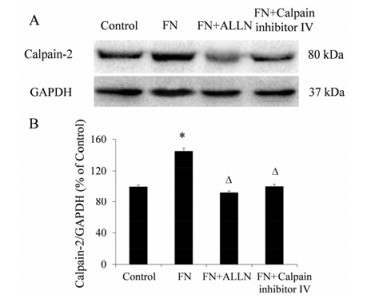
|
Figure 2 Plumbagin induced apoptosis of KYSE-140 cells (image overlapping, green fluorescence represents early apoptosis, red fluorescence represents late apoptosis). A: Negative control; B: KYSE-140 cells treated with 5.0 μmol·L-1 plumbagin for 24 h; C: Quantitative analysis of column chart for apoptosis. n = 3, x± s. *P < 0.05 vs control |
5.0和10 μmol·L-1白花丹素分别作用24 h后, Western blot结果表明, KYSE-140细胞中FoxM1蛋白表达明显下降 (图 3A、B)。qPCR结果显示, 白花丹素能够明显下调KYSE-140细胞FoxM1 mRNA的表达 (图 3C)。为进一步分析白花丹素对FoxM1基因调控的机制, 采用5.0和10 μmol·L-1白花丹素处理含GLuc-SEAP双报告基因的FoxM1启动子的KYSE-140/ FoxM1及相应对照克隆的KYSE-140/FoxM1-Con细胞, 结果显示, 在5.0和10 μmol·L-1两个浓度下, 白花丹素能够明显下调FoxM1基因的启动子活性 (图 3D)。
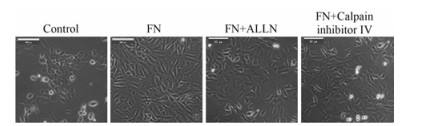
|
Figure 3 Plumbagin can inhibit FoxM1 expression, and regulate the activity of FoxM1 gene promoter. A: Western blot showed that plumbagin inhibited FoxM1 protein expression; B: The quantitative histogram of FoxM1 protein expression; C: Plumbagin inhibited FoxM1 mRNA expression; D: Plumbagin can inhibit the promoter activity of FoxM1 significantly. n = 3, x± s. *P < 0.05, **P < 0.01 vs control |
本研究检测了白花丹素体内抑制食管癌细胞生长的能力。结果显示, 与对照组相比, 给药2 mg·kg-1·day-1的裸鼠, 肿瘤生长的抑制作用明显, 肿瘤大小减少约47.52%。对照组平均肿瘤体积是2 123.77 mm3, 实验组为1 114.55 mm3 (图 4A、C)。两组裸鼠体重变化无显著差异 (图 4D)。与对照组相比, 实验组的肿瘤重量减少了39.26% (图 4E)。这些结果表明, 白花丹素抑制体内食管癌细胞的生长。
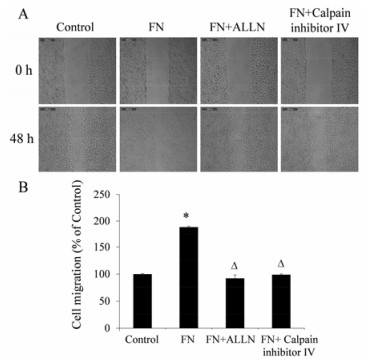
|
Figure 4 Plumbagin can inhibit proliferation of esophageal cancer cell in vivo, and inhibit the expression of FoxM1. A: Plumbagin inhibited tumor cell proliferation; B: FoxM1 protein expression; C: Tumor volume changes in two groups; D: The change of nude mice weight; E: Tumor weight difference in two groups. n = 5, x± s. *P < 0.05 vs control |
之前的体外研究表明, 白花丹素通过抑制FoxM1抑制食管癌细胞的生长。为了进一步确定白花丹素在体内产生同样的效果, 通过裸鼠皮下成瘤实验验证白花丹素对成瘤的抑制作用, 并通过肿瘤组织切片染色来评估FoxM1的表达水平。结果显示, 与对照组的肿瘤组织相比, 实验组的FoxM1表达水平下降 (图 4B)。与本课题组前期研究的数据结合起来表明, 白花丹素通过下调FoxM1的表达发挥其抗肿瘤活性。
讨论食管癌严重危害人类生命和健康, 是世界上最常见的恶性肿瘤之一, 我国是世界上食管癌发病率最高的国家, 发病率及死亡率始终处于较高水平[1]。食管鳞癌早期缺乏特异症状, 患者就诊时大部分 (约80%) 处于中晚期 (ⅢB~Ⅳ期), 预后极差[2]。尽管近年来食管癌治疗技术有了很大提高, 食管癌也采取了手术治疗、放疗和化疗等多学科综合治疗措施, 但其治愈率并没有明显改善, 总的5年生存率不到20%, 治疗后复发与转移是导致食管癌治疗失败的最终原因[2]。
FoxM1是Fox转录因子家族成员之一, 可通过调节细胞增殖相关基因转录, 进而调节胚胎发育和组织再生等过程[13, 14]。FoxM1是一种致癌的转录因子, 在多种人类恶性肿瘤中, 与肿瘤细胞增殖和凋亡密切相关[15]。近年来, 多项研究证明, FoxM1异常表达可影响基因组稳定性及细胞有丝分裂等, 从而促进肿瘤发生发展及转移。高水平表达FoxM1的恶性肿瘤往往预示着具有低分化、高度恶性、远处转移和临床预后差等特性[16]。其通过调控下游相关基因表达成为多种恶性肿瘤如胰腺癌[17]、宫颈癌[18]、结肠癌[19]和胃癌[20]等的致癌基因。除了本研究, 许多其他研究已经发现, 下调FoxM1能够抑制食管癌细胞的生长[4]。因此, FoxM1被认为是一个有吸引力的预防和/或治疗癌症的目标。以FoxM1为靶点对于食管癌的治疗可能有显著意义, 小分子FoxM1抑制剂是目前药理学研究的热点。最近的研究表明, 许多天然药物提取物的抗肿瘤作用与下调FoxM1的表达有关[21]。
许多研究已经证明, 白花丹素具有治疗肿瘤的潜在价值。在乳腺癌、肺癌和前列腺癌中, 白花丹素能显著抑制肿瘤发生和肿瘤细胞的生长。在本研究中亦发现, 白花丹素具有抑制食管癌细胞增殖和促进其凋亡的作用, 进一步的机制研究表明, 其在体内和体外抑制肿瘤生长的作用可能与抑制癌基因FoxM1的表达有关。双荧光素酶基因报告实验表明, 白花丹素具有抑制FoxM1基因启动子的作用, 说明其对FoxM1基因具有直接的调控作用, 正是这种调控作用使其在体内体外实验中发挥了抗肿瘤作用。
以上结果表明, 下调FoxM1介导了白花丹素对食管癌细胞生长的抑制作用。此外, 白花丹素极有可能作为潜在FoxM1抑制剂治疗包括食管癌在内的许多肿瘤疾病。但是, 还需进一步的体内研究来确定白花丹素的抗肿瘤活性与FoxM1的失活有关, 以及进行白花丹素在体内的代谢机制研究, 为以FoxM1为靶点的抗肿瘤治疗提供依据。
| [1] | Henry MA, Lerco MM, Ribeiro PW, et al. Epidemiological features of esophageal cancer. Squamous cell carcinoma versus adenocarcinoma[J]. Acta Cir Bras, 2014, 29: 389–393. DOI:10.1590/S0102-86502014000600007 |
| [2] | Godoy MC, Bruzzi JF, Viswanathan C, et al. Multimodality imaging evaluation of esophageal cancer:staging, therapy assessment, and complications[J]. Abdom Imaging, 2013, 38: 974–993. DOI:10.1007/s00261-013-9986-7 |
| [3] | Thompson WM. Esophageal carcinoma[J]. Abdom Imaging, 1997, 22: 138–142. DOI:10.1007/s002619900158 |
| [4] | Takata A, Takiguchi S, Okada K, et al. Clinicopathological and prognostic significance of FOXM1 expression in eso-phageal squamous cell carcinoma[J]. Anticancer Res, 2014, 34: 2427–2432. |
| [5] | Kaewbumrung S, Panichayupakaranant P. Antibacterial activity of plumbagin derivative-rich Plumbago indica root extracts and chemical stability[J]. Nat Prod Res, 2014, 28: 835–837. DOI:10.1080/14786419.2013.879585 |
| [6] | Sharma I, Gusain D, Dixit VP. Hypolipidaemic and anti-atherosclerotic effects of plumbagin in rabbits[J]. Indian J Physiol Pharmacol, 1991, 35: 10–14. |
| [7] | Yan W, Wang TY, Fan QM, et al. Plumbagin attenuates cancer cell growth and osteoclast formation in the bone microenvironment of mice[J]. Acta Pharmacol Sin, 2014, 35: 124–134. DOI:10.1038/aps.2013.152 |
| [8] | Sinha S, Pal K, Elkhanany A, et al. Plumbagin inhibits tumorigenesis and angiogenesis of ovarian cancer cells in vivo[J]. Int J Cancer, 2013, 132: 1201–1212. DOI:10.1002/ijc.v132.5 |
| [9] | Hafeez BB, Zhong W, Fischer JW, et al. Plumbagin, a medicinal plant (Plumbago zeylanica)-derived 1, 4-naphtho-quinone, inhibits growth and metastasis of human prostate cancer PC-3M-luciferase cells in an orthotopic xenograft mouse model[J]. Mol Oncol, 2013, 7: 428–439. DOI:10.1016/j.molonc.2012.12.001 |
| [10] | Kuo PL, Hsu YL, Cho CY. Plumbagin induces G2-M arrest and autophagy by inhibiting the AKT/mammalian target of rapamycin pathway in breast cancer cells[J]. Mol Cancer Ther, 2006, 5: 3209–3221. DOI:10.1158/1535-7163.MCT-06-0478 |
| [11] | Xu KH, Lu DP. Plumbagin induces ROS-mediated apoptosis in human promyelocytic leukemia cells in vivo[J]. Leuk Res, 2010, 34: 658–665. DOI:10.1016/j.leukres.2009.08.017 |
| [12] | Chen YW, Fan DM, Liu G, et al. Establishment of human ovarian cancer Skov3 cell line stably expressing miR-183 by lentiviral system[J]. J Henan Univ Sci Tech (Med Sci), 2015, 33: 248–251. |
| [13] | Laoukili J, Stahl M, Medema RH. FoxM1:at the crossroads of ageing and cancer[J]. Biochim Biophys Acta, 2007, 1775: 92–102. |
| [14] | Kalin TV, Ustiyan V, Kalinichenko VV. Multiple faces of FoxM1 transcription factor:lessons from transgenic mouse models[J]. Cell Cycle, 2011, 10: 396–405. DOI:10.4161/cc.10.3.14709 |
| [15] | Liu M, Dai B, Kang SH, et al. FoxM1B is overexpressed in human glioblastomas and critically regulates the tumori-genicity of glioma cells[J]. Cancer Res, 2006, 66: 3593–3602. DOI:10.1158/0008-5472.CAN-05-2912 |
| [16] | Gartel AL. The oncogenic transcription factor FOXM1 and anticancer therapy[J]. Cell Cycle, 2012, 11: 3341–3342. DOI:10.4161/cc.21841 |
| [17] | Huang C, Du J, Xie K. FOXM1 and its oncogenic signaling in pancreatic cancer pathogenesis[J]. Biochim Biophys Acta, 2014, 1845: 104–116. |
| [18] | Yung MM, Chan DW, Liu VW, et al. Activation of AMPK inhibits cervical cancer cell growth through AKT/FOXO3a/FOXM1 signaling cascade[J]. BMC Cancer, 2013, 13: 327. DOI:10.1186/1471-2407-13-327 |
| [19] | Song IS, Jeong YJ, Han J. Mitochondrial metabolism in cancer stem cells:a therapeutic target for colon cancer[J]. BMB Rep, 2015, 48: 539–540. DOI:10.5483/BMBRep.2015.48.10.179 |
| [20] | Okada K, Fujiwara Y, Takaha T, et al. Overexpression of forkhead box M1 transcription factor (FOXM1) is a potential prognostic marker and enhances chemoresistance for docetaxel in gastric cancer[J]. Ann Surg Oncol, 2013, 20: 1035–1043. DOI:10.1245/s10434-012-2680-0 |
| [21] | Ahmad A, Sakr WA, Rahman KM. Novel targets for detec-tion of cancer and their modulation by chemopreventive natural compounds[J]. Front Biosci, 2012, 4: 410–425. |
 2017, Vol. 52
2017, Vol. 52


