2. 清华大学化学系, 北京 100084
2. Department of Chemistry, Tsinghua University, Beijing 100084, China
血必净注射液由红花、赤芍、川芎、丹参和当归等5味中药提取精制而成, 具有活血化瘀、疏经通络和溃散毒邪的作用, 治疗因感染、创伤和烧伤等引起的多器官功能障碍综合征效果确切[1], 是防治脓毒症及多器官功能障碍综合征 (multiple organ dysfunction syndrome, MODS) 的一线临床用药。姚咏明课题组[2]对血必净注射液药理作用进行了大量系统研究, 血必净通过调节T细胞凋亡, 影响单核细胞组织因子及凝血功能[3], 干预活化蛋白C和肿瘤坏死因子α (TNF-α)[4, 5]等改善脓毒症大鼠的症状, 其作用涉及调节性T细胞 (Treg)、高迁移率族蛋白Bl (HMGB1)、单核细胞蛋白酶激活受体-1 (PAR-1)、组织因子 (TF)、白细胞介素-6 (IL-6) 和TNF-α等炎症和免疫相关靶点, 一定程度上解释了血必净注射液治疗脓毒症的相关机制。然而, 由于脓毒症本身的病因、病机复杂, 经典药理学实验研究往往只针对疾病某一病理特征或环节构建动物或细胞模型, 通过药物对某一个或某些特定病理生化指标的改变来评价药物疗效, 对药物作用机制的阐明也多停留在某一特定的通路, 结果多具有片面性, 难以整体反映中药复方对机体多方面的影响, 违背了中医药的“整体观”。
Luo等[6]提出中医药研究从根本上不同于西医药模式, 是一种“系统-系统”的作用模式, 即多组分药物群 (药物系统) 与生物系统 (系统生物学) 的相互作用, 并在此基础上提出了中医药整体系统生物学, 即开展中药化学物质组学与系统生物学相结合研究, 采用化学物质组学表征中药复杂系统, 基因组学、蛋白质组学、代谢组学及药理学等表征生命系统, 建立研究两个复杂系统相互作用和网络调控机制的方法体系。
网络药理学是基于系统生物学和多向药理学提出的一种药物设计新方法[7], 通过生物学网络中节点的连接和关系来分析药物对疾病网络的干预构建“分子 (药物)-靶点-通路-疾病”的多层次网络, 从整体效应角度预测药物靶点, 认识药物作用机制, 为提高药物发现效率提供理论依据和技术支撑。网络药理学“多成分-多靶点-多通路”的研究策略将药物-靶点网络与生物系统网络相结合, 是研究中药复杂系统和人体生物系统两个系统之间的相互作用, 阐明中药复方作用机制的重要手段之一。目前, 网络药理学研究在中药研究中主要应用于中药药效物质基础研究、中药药效作用机制研究、中药药效评价研究和中药方剂配伍理论研究等[8]。
反向分子对接技术基于Fisher的“锁-钥匙模型学说”[9], 以天然产物、先导化合物及化学合成物这些小分子化合物为探针, 在已知结构的靶点数据库内搜寻可能与之结合的生物大分子, 通过空间和能量匹配相互识别形成分子复合物, 进而预测药物潜在的作用靶点, 为寻找药物作用靶点提供了新的方法。继INVDOCK软件之后, TarFisDock、PharmMapper等免费在线服务器为人们所熟知并逐渐得到认可[10]。PharmMapper是基于配体特征的反向药效团匹配开发的以活性小分子为探针, 搜寻潜在药物靶点, 从而预测小分子生物活性的反向分子对接方法之一[11]。该程序通过对TargetBank、DrugBank、Binding DB和PDTD四大数据库检索, 可快速获取药物靶点信息, 由于其具有运算速度快、靶点信息全面等优点, 在中药靶点研究中得到广泛应用[12]。
本研究基于“系统-系统”的中药复方整体系统生物学研究模式, 基于血必净注射液的化学物质组学研究结果, 运用网络药理学方法通过构建“成分-靶点-通路”网络模型, 全面系统预测血必净注射液主要化学成分干预脓毒症的潜在作用靶点和通路, 为深入探讨血必净注射液治疗脓毒症的作用机制和基于血必净注射液的组分中药发现提供科学依据。
材料与方法化合物信息 前期建立了血必净注射液整体化学物质组多波长指纹图谱, 全息表征其化学物质基础。采用超高效液相-四级杆-飞行时间质谱 (UPLC-QTOF/MS) 液质联用技术对血必净注射液中的化学成分进行定性分析, 通过一级和二级质谱信息分析并结合文献报告, 共鉴定出41种化学成分[13], 本研究选取其中21个主要活性成分 (血必净注射液指纹图谱特征峰, 含量稳定, 已有确切的生物活性报道, 配伍药材中指标性成分), 包括:苯甲酰芍药苷 (C30H32O12, CAS号: 38642-49-8)、没食子酰芍药苷 (C30H32O15, CAS号: 122965-41-7)、芍药苷 (C23H28O11, CAS号: 23180-57-6)、芍药内酯苷 (C23H28O11, CAS号: 39011-90-0)、氧化芍药苷 (C23H28O12, CAS号: 39011-91-1)、鸟苷 (C10H13N5O5, CAS号: 118-00-3)、尿苷 (C9H12N2O6, CAS号: 58-96-8)、红花黄色素A (C27H30O15, CAS号: 85532-77-0)、羟基红花黄色素A (C27H32O16, CAS号: 78281-02-4)、脱水红花黄色素B (C48H52O26, CAS号: 184840-84-4)、咖啡酸 (C9H8O4, CAS号: 331-39-5)、阿魏酸 (C10H10O4, CAS号: 1135-24-6)、丹参素 (C9H10O5, CAS号: 76822-21-4)、原儿茶醛 (C7H6O5, CAS号: 139-85-5)、丹酚酸B (C36H30O16, CAS号: 121521-90-23)、没食子酸 (C7H6O5, CAS号: 149-91-7)、洋川芎内酯H (C12H16O4, CAS号: 94596-27-7)、洋川芎内酯Ⅰ (C12H16O4, CAS号: 94596-28-8)、4', 5-二羟基黄酮-6, 7-O-吡喃葡萄糖苷 (C27H30O16)、6-羟基山柰酚-3, 6-O-β-D-葡萄糖苷 (C27H32O17)、6-羟基山柰酚-3, 6, 7-O-β-D-葡萄糖苷 (C33H42O22), 以上化学信息来源于美国化学文摘数据库 (Chemical Abstract Service, CAS)。
*.mol2格式文件建立 从CAS数据库中确定21种活性成分的化学结构。应用Chembiodraw Ultra 12.0软件画出其各自的结构图, 并以MDL Molfile (*.mol) 格式存储; 将建立的MDL Molfile (*.mol) 格式文件导入Chem Bio 3D Ultra12.0软件, 将该成分的二维结构式转换为三维立体结构式, 通过“另存为”将MDL Molfile (*.mol) 格式转换为*.mol2格式文件。
潜在作用靶点反向预测 登录PharmMapper服务器 (http://59.78.96.61/pharmmapper), 上传血必净注射液主要活性成分的*.mol2格式文件, 采用“反向药效团匹配方法”得到虚拟筛选结果。由于检索到的药物靶点存在命名不规范等问题, 本研究使用美国国立生物技术信息中心 (National Center for Biotechnology Information, NCBI) 数据库的Gene基因搜索功能 (http://www.ncbi.nlm.nih.gov/gene), 将筛选出的分子-靶点匹配度 (Fit Score) 大于4.5的药物靶点 (若无Fit > 4.5, 选取Fit值最高的10个靶点) 名称输入到NCBI数据库中并限定物种为人类, 将输入的所有药物靶点名称校正为该靶点的官方简写 (Official Gene Symbol), 由此获取与活性成分相关的靶点信息。
靶点通路注释分析 利用DAVID数据库中功能注释工具 (Functional Annotion Tool), 上传搜索到的潜在药物靶点的官方简写, 之后选择KEGG-Pathway, 选取具有显著差异性 (P < 0.05) 的所有通路, 即可输出所有靶点作用的体内通路, 药物靶点富集的通路被认为是药物调控的主要通路。
“活性成分-靶点-通路”网络模型构建 根据血必净注射液主要活性成分靶点预测结果, 采用Cytoscape软件的Merge功能构建血必净注射液“成分-靶点-通路”网络模型。节点 (node) 表示活性成分、潜在作用靶点及作用通路。边 (edge) 用来连接某一个化合物及其潜在作用靶点, 同时用来连接活性成分作用靶点及其注释的相关通路, 由此构建网络探讨血必净注射液多成分、多靶点和多通路的作用机制。
结果 1 血必净注射液药材-成分-靶点分析血必净注射液的21个代表性成分, 包含以苯甲酰芍药苷为代表的芍药苷类成分5个、4', 5-二羟基黄酮-6, 7-O-吡喃葡萄糖等糖苷类成分5个、红花黄色素A等红花黄色素类成分3个、丹参素等有机酸类成分6个和洋川芎内酯H等内酯类成分2个。从药材归属来看, 其中有6个成分来自赤芍, 3个成分来自川芎, 3个成分来自丹参, 6个成分来自当归, 7个成分来自红花, 其中川芎和当归有3个共有成分, 红花和当归有1个共有成分。经上述数据库检索和转化操作后, 共得到靶点550个。其中, 赤芍潜在作用靶点287个, 川芎潜在作用靶点30个, 丹参潜在作用靶点72个, 当归潜在作用靶点65个, 红花潜在作用靶点96个。
2 血必净注射液靶点-通路分析在线人类孟德尔遗传数据库 (Online Mendelian Inheritance in Man, OMIM) 具有及时性、准确性、全面性、实用性和便捷的检索功能等特点[14, 15]。利用OMIM数据库检索与脓毒症相关的基因, 共有96个, 其中与血必净注射液的共同靶点有8个 (HARS、BTK、LCN2、ELANE、FROCR、CASP1、IL6、S100A9)。将OMIM得到的靶点与血必净注射液的靶点分别进行通路分析, 得到共同通路33条, 见表 1。其中涉及免疫应激及炎症的通路有10条, 见表 2。
| Table 1 Information of common pathways |
| Table 2 Information of inflammatory and immune related pathways-ingredients |
根据KEGG网站上的通路信息及相关文献, 对表 2中10条通路的生物学意义简单描述如下。
MAPK信号通路:脂多糖 (lipopolysaccharides, LPS) 炎症刺激可导致MAPK的活化。MAPK的激活可促进多种促炎因子如TNF-α、IL-1β、IL-6和IL-8等的表达和释放, 被认为是调控炎症反应的中心环节[16]。
ErbB信号通路: ErbBs受体包括ErbB1、ErbB2、ErbB3和ErbB4亚型。神经调节蛋白 (neuregulin, NRG) 通过激活ErbB酪氨酸激酶受体进行一系列的信号转导。Xu等[17]通过体内外实验研究证明NRG在中枢神经系统属于抗炎物质。
VEGF信号通路:组织器官在生理或病理状态下, 受到促血管生成因子的刺激, 引发血管新生。现有大量证据表明, VEGFR-2主要介导VEGF驱动的内皮细胞反应, 它被认为是生理和病理血管生成的关键信号转导。VEGF结合VEGFR-2引发一系列不同的信号通路, 导致上调的基因参与介导的内皮细胞增殖和迁移, 促进它们的生存和血管通透性。
Fc epsilon RI信号通路: Fc的εRI信号通路与炎症有关, 影响炎症介质如白三烯 (LTC4、LTD4和LTE4) 和前列腺素 (尤其PDG2) 的释放和细胞因子 (TNF-α、IL-4和IL-5) 分泌。
T细胞受体信号通路:与机体免疫调节直接相关, T细胞是淋巴细胞的主要组分, 它具有多种生物学功能, 如直接杀伤靶细胞, 辅助或抑制B细胞产生抗体, 对特异性抗原和促有丝分裂原的应答反应以及产生细胞因子等。
自然杀伤细胞介导的细胞毒性:自然杀伤 (natural killer, NK) 细胞是先天性免疫系统的淋巴细胞, 涉及对非自身细胞以及受到各种形式刺激 (如感染病毒、细菌、寄生虫或恶性转化) 的自身细胞的早期防御。NK细胞杀伤的机制与在适应性免疫应答中产生细胞毒性T细胞的机制相同; 细胞毒颗粒释放到结合的靶细胞表面, 并且它们所包含的效应蛋白穿透细胞膜并诱导细胞程序性死亡。
B细胞受体信号通路: B细胞是适应性免疫的重要组成部分, 其生产和分泌数以百万计的不同的抗体分子, 分别识别不同的抗原。磷脂酰肌醇3-激酶和磷脂酶C-γ2是B细胞受体信号重要的下游效应器。这一信号最终导致即早基因的表达, 进一步激活参与B细胞增殖、分化和免疫球蛋白生产等过程的其他基因表达。
Toll样受体 (Toll-like receptor, TLR) 信号通路:识别病原体, 引起先天免疫快速活化, 诱导促炎因子的产生和共刺激分子的上调, TLR信号通路共分为两组:一组是快速活化核因子κB (nuclear factor-κB, NF-κB) 和MAPK导致促炎因子产生的MyD88依赖通路; 另一组是与INF-β和INF可诱导基因的诱导、并与NF-κB和MAPK缓慢活化、树突细胞成熟有关的MyD88非依赖通路。
JAK-STAT信号通路: JAK-STAT途径是体内普遍存在的信号通路之一, 参与机体细胞的增殖、分化、存活和凋亡, 介导机体免疫失调和肿瘤生成等过程。目前发现, STAT家族存在7个成员, 其中, STAT1可抑制NF-κB的活化; STAT2被IFN-α/β和IFN-λs活化; STAT3能够被多种细胞因子 (IL-6、IL-10、IFN-α/β) 激活; IL-12、IL-23和IFN-α激活STAT4[18, 19]。
补体和凝血级联通路:与机体的免疫功能密切相关。一方面, 补体系统是血浆蛋白水解级联和先天免疫的中介, 介导对病原体的非特异性防御机制; 另一方面, 凝血级联反应是其他酶原转换为丝氨酸蛋白酶的过程, 最终形成凝血酶。由凝血酶激活的某些蛋白酶活化受体是先天免疫介质的成员。激肽释放酶-激肽系统是一种内源性的代谢级联, 引发导致血管活性激肽 (缓激肽相关肽) 的释放。激肽牵连许多生理和病理过程, 包括血压调节和钠平衡、炎症过程, 以及心脏的保护作用。
3 血必净注射液“成分-靶点-通路”网络模型构建采用Cytoscape软件构建血必净注射液“活性成分-靶点-通路”网络模型, 见图 1。血必净注射液21个活性成分的作用靶点分布于不同的代谢通路, 相互协调, 从多种途径体现药物治疗脓毒症的作用机制。
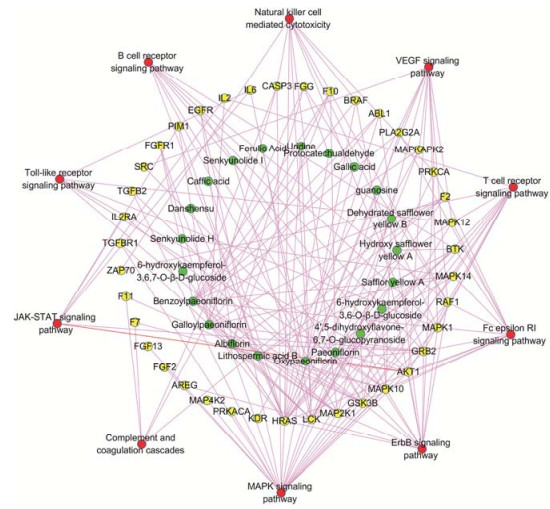
|
Figure 1 Ingredients-targets-pathways network of active ingredients of Xuebijing injection (   |
脓毒症发病机制涉及感染、炎症、免疫、凝血、组织损害及基因多态性等一系列基本问题, 并与机体多系统、多器官病理生理改变密切相关[20]。本研究综合血必净注射液的作用靶点和OMIM数据库中与脓毒症相关的疾病基因分析, 结果表明, 血必净注射液主要作用于丝裂原活化蛋白激酶信号通路、ErbB信号通路、血管内皮生长因子信号通路、Fc epsilon受体Ⅰ信号通路、T细胞受体信号通路、自然杀伤细胞介导的细胞毒性、B细胞受体信号通路、Toll样受体信号通路、JAK-STAT信号通路、补体和凝血级联等通路, 通过调节T细胞、B细胞和多种细胞因子 (TNF-α、IL-6、血管内皮生长因子等) 发挥抗炎、免疫的作用, 与文献[1-5]报道的血必净治疗脓毒症的药理研究结果一致。
脱水红花黄色素B、苯甲酰芍药苷、芍药苷和氧化芍药苷等作用于与NF-κB活化有关的Toll样受体信号通路。NF-κB普遍存在于生物体内各种类型的细胞中, 涉及炎症反应、免疫应答及细胞增生、转化和凋亡等生物过程。Jiang等[21]建立了生物活性集成超高效液相色谱/四极时间飞行质谱 (UPLC-Q/TOF) 系统, 筛选出血必净注射液中脱水红花黄色素B、苯甲酰芍药苷、芍药苷和氧化芍药苷等成分具有一定的NF-κB抑制活性, 证实血必净注射液中这4种有效成分通过抑制NF-κB活性发挥抗炎作用。
赤芍中的芍药苷既作用于MAPK、Fc epsilon受体Ⅰ和ErbB等炎症相关的通路, 也作用于B细胞受体和T细胞受体等免疫相关的通路。芍药苷可抑制促炎性介质如TNF-α、IL-1 β、iNOS、环氧合酶-2和5-脂氧酶的上调, 发挥抗炎作用[22]。另外, Lü等[23]研究发现赤芍水提取物五没食子酰葡萄糖通过与脂质A直接结合, 使内毒素失活以及降低血清内毒素和TNF-α的释放, 达到治疗脓血症的目的。
丹参中的丹酚酸B同时作用于MAPK、Fc epsilon受体Ⅰ和Toll样受体等炎症相关通路以及免疫相关通路。Wang等[24]研究发现, 丹酚酸B可降低由LPS诱导的心肌细胞炎症损伤大鼠的LDH和TNF-α浓度, 以及降低TLR4和NF-κB的表达, 说明丹酚酸B可能是通过抑制TLR-4-NF-κB-TNF-α通路实现对心肌细胞的保护作用。另外, 丹酚酸B还有保护内皮细胞, 抑制VEGF诱导的血管通透性增加, 抑制血小板活化、聚集与释放等作用[25-27]。
红花中的羟基红花黄色素A主要作用于与免疫相关的T细胞、B细胞受体信号通路。Lu等[28]研究了含75%羟基红花黄色素A的红花总黄素对免疫功能的影响, 提示红花总黄素可能是治疗多种免疫性疾病的主要有效成分。
当归和川芎中的洋川芎内酯Ⅰ、红花中的脱水红花黄色素B作用于肾素-血管紧张素系统和造血细胞系, 对心脑血管和血压的调节有着重要的影响。丹参中的丹酚酸B和赤芍的主要成分芍药苷、苯甲酰芍药苷等除发挥抗炎、免疫的作用外, 还作用于补体和凝血级联通路, 调控血压、钠平衡及心脏的保护作用。血必净注射液各药材活性成分共同发挥抗炎、免疫调节、控制血压和心脑血管保护等作用。
血必净注射液中来源于5个配伍药材21个主要活性成分通过调控不同的基因, 作用于不同的通路, 协同配伍产生抗炎、免疫调节、控制血压和心脑血管保护等作用, 充分显示了不同成分之间的多靶点多通路协同作用, 体现了中药方剂的整体观念。本文运用网络药理学技术手段, 基于“系统-系统”的模式, 探索血必净治疗脓毒症“多成分-多靶点-多通路”的作用机制, 其研究结果与现有的血必净治疗脓毒症的药理机制研究相互验证, 更好地解释了血必净临床治疗脓毒症的作用机制, 为中药方剂治疗疾病的作用机制研究提供了新思路, 为血必净干预脓毒症作用机制的深入研究提供一定参考和方向。
| [1] | Zhao ZG, Tang ZZ, Liu J, et al. Influence of Xuebijing injection on inflammatory factors and function of vascular endothelial cells in patients with severe sepsis[J]. Mil Med J S Chin (华南国防医学杂志), 2015, 29: 101–103. |
| [2] | Dai XG. The Effect of AICD of Regulatory T Cell in Septic Rats on Immunological Function of Effector T Lymphocytes Induced by Xuebijing Injection (脓毒症大鼠调节性T细胞凋亡对效应T细胞免疫功能的影响及血必净注射液的干预作用)[D]. Changsha: Central South University, 2008. http://www.cqvip.com/Main/Detail.aspx?id=29812929 |
| [3] | Gui YG. Effects of Xuebijing Injection on Tissue Factor of Monocyte and Coagulation Parameters in Septic Rats (血必净对脓毒症大鼠单核细胞组织因子及凝血功能的影响)[D]. Tianjin: Tianjin Medical University, 2009. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y1553030 |
| [4] | Li YP, Qiao YJ, Wu ZX, et al. Effects of Xuebijing injection on tissue tumor necrosis factor-α and blood coagulation parameters in septic rats[J]. Chin J Integr Tradit West Med Intensive Crit Care (中国中西医结合急救杂志), 2007, 14: 104–107. |
| [5] | Li YP, Zheng GJ, Wu ZX, et al. Effects of Xuebijing injection on activated protein C and coagulation parameters in septic rats[J]. Chin J Integr Tradit West Med Intensive Crit Care (中国中西医结合急救杂志), 2008, 15: 361–364. |
| [6] | Luo GA, Xie YY, Liang QL, et al. Integrated medicine for traditional Chinese medicine:the third discussion on the proposal of holistic system medicine[J]. World Sci Technol Mod Tradit Chin Med Mater Med (世界科学技术-中医药现代化), 2015, 17: 7–15. |
| [7] | Hopkins AL. Network pharmacology[J]. Nat Biotechnol, 2007, 25: 1110. DOI:10.1038/nbt1007-1110 |
| [8] | Liu J, Huang YM, Wang H. Advances in network pharma-cology[J]. West China J Pharm Sci (华西药学杂志), 2014, 29: 723–725. |
| [9] | Fischer E. Influence of configuration on the action of enzymes[J]. Ber Dtsch Chem Ges, 1894, 27: 2985–2993. DOI:10.1002/(ISSN)1099-0682 |
| [10] | Fan SJ, Li XJ. The new way to observe and validate the reverse docking-drug target[J]. Prog Physiol Sci (生理科学进展), 2012, 43: 367–370. |
| [11] | Liu XF, Ouyang SS, Yu B, et al. PharmMapper server:a web server for potential drug target identification using pharmacophore mapping approach[J]. Nucleic Acids Res, 2010, 38: W609–W614. DOI:10.1093/nar/gkq300 |
| [12] | Gao Y, Gao L, Gao XA, et al. An exploration in the action targets for antidepressant bioactive components of Xiaoyaosan based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2015, 50: 1589–1595. |
| [13] | Huang H, Ji L, Song S, et al. Identification of the major constituents in Xuebijing injection by HPLC-ESI-MS[J]. Phytochem Anal, 2011, 22: 330–338. DOI:10.1002/pca.v22.4 |
| [14] | Zhen YS, Xie P, Shi HB, et al. Online mendelian in-heritance in man[J]. Mol Cardiol China (中国分子心脏病学杂志), 2001, 1: 46–48. |
| [15] | Ding LS, Zhang YW. The use of OMIM and library information consultation service[J]. J Med Intell (医学情报工作), 2004, 25: 181–183. |
| [16] | Peng S, Hang N, Liu W, et al. Andrographolide sulfonate ameliorates lipopolysaccharide-induced acute lung injury in mice by down-regulating MAPK and NF-κB pathways[J]. Acta Pharm Sin B, 2016, 6: 205–211. DOI:10.1016/j.apsb.2016.02.002 |
| [17] | Xu Z, Ford GD, Croslan DR, et al. Neuroprotection by neuregulin-1 following focal stroke is associated with the attenuation of ischemia-induced pro-inflammatory and stress gene expression[J]. Neurobiol Dis, 2005, 19: 461–470. DOI:10.1016/j.nbd.2005.01.027 |
| [18] | Song Z, Zhang LY, Dong HB, et al. Advances in JAK-STAT signaling pathway[J]. China Anim Husb Veter Med (中国畜牧兽医), 2012, 39: 128–132. |
| [19] | Liu H, Yao YM. Advances in cross-talk of cellular signaling pathways associated with inflammatory response[J]. Chin J Pathophysiol (中国病理生理杂志), 2005, 8: 1607–1613. |
| [20] | Yao YM, Lin HY. Development of pathogenesis and man-agement of sepsis[J]. Continu Med Edu (继续医学教育), 2006, 24: 35–40. |
| [21] | Jiang M, Zhou M, Han Y, et al. Identification of NF-κB inhibitors in Xuebijing injection for sepsis treatment based on bioactivity-integrated UPLC-Q/TOF[J]. J Ethnopharmacol, 2013, 147: 426–433. DOI:10.1016/j.jep.2013.03.032 |
| [22] | Guo RB, Wang GF, Zhao AP, et al. Paeoniflorin protects against ischemia-induced brain damages in rats via inhibit-ing MAPKs/NF-кB-mediated inflammatory responses[J]. PLoS One, 2012, 7: e49701. DOI:10.1371/journal.pone.0049701 |
| [23] | Lü GF, Zheng J, Zhou H, et al. The screening and isolation of an effective anti-endotoxin monomer from Radix Paeoniae Rubra using affinity biosensor technology[J]. Int Immunopharmacol, 2005, 5: 1007–1017. DOI:10.1016/j.intimp.2005.01.013 |
| [24] | Wang J, Zhang Y, Guo LL, et al. Salvianolic acid B inhibits the TLR-4-NF-κB-TNF-α pathway and attenuates neonatal rat cardiomyocyte injury induced by lipopolysaccharide[J]. Chin J Integr Med, 2011, 17: 775–779. DOI:10.1007/s11655-011-0877-x |
| [25] | Zhan YE. Research progress on pharmacologic actions of salvianolic acid B[J]. Milit Med J South China (华南国防医学杂志), 2007, 21: 37–39, 54. |
| [26] | Yang FG, Zhang AY, Chen ZY, et al. Effect of salvianolic acid B on cardiovascular endothelial cells and platelet activetion in a rabbit model of ischemia-reperfusion[J]. J Chin Integr Med (中西医结合学报), 2008, 6: 1250–1254. DOI:10.3736/jcim |
| [27] | Li W, Zhang JP, Xu SX, et al. Effect of salvianolic acid B on the Platelet aggregation and sP-sel and sCD40L release[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2013, 01: 48–50. |
| [28] | Lu ZW, Liu F, Hu J, et al. Suppressive effects of safflower yellow on immune functions[J]. Acta Pharmacol Sin, 1991, 12: 537–542. |
 2017, Vol. 52
2017, Vol. 52


