红景天 (Rhodiola rosea) 系蔷薇目景天科 (Crassulaceae) 红景天属多年生草本或亚灌木植物, 是珍稀药用植物之一。其主要活性成分红景天苷 (salidroside, SAL), 具有保护神经及心血管系统、调节机体代谢、增强免疫系统功能以及干预衰老等多种药理作用[1]。红景天苷具有良好的体内外延缓衰老的效果, 其对D-半乳糖衰老小鼠展现出良好的整体抗衰老效应, 能够显著逆转H2O2诱导的细胞衰老样表型, 以及改善UVB诱导的成纤维细胞的衰老样改变[2-4]。
衰老过程的调控涉及多个系统, 如氧化应激系统、端粒长度改变、p53-p21和p16-Rb信号通路等。microRNAs (miRNAs) 主要通过与靶基因mRNA 3'非编码区 (untranslated regions, UTR) 的完全或不完全配对引起mRNA降解或翻译抑制, 从而在转录后水平调控基因的表达, 进而参与调控个体发育、细胞凋亡、增殖及分化等生物过程[5, 6], 并且miRNA作为新的衰老调控系统越来越受到重视。本研究利用miRNA芯片研究红景天苷对人胚肺二倍体成纤维2BS细胞的复制性衰老的miRNA表达谱的影响, 拟从miRNA水平初步探讨红景天苷干预细胞复制性衰老的作用机制。
材料与方法药品与试剂 红景天苷购自中国食品药品检定研究院, 采用DMSO-乙醇 (1:1, v/v) 配置成5 mmol·L-1母液, 保存于-20 ℃备用; DMEM-高糖培养基 (美国Gibco公司); 胎牛血清 (美国Hyclone公司); Trizol (Invitrogen公司); miScript Reverse Transcription Kit、miScript SYBR Green PCR kit 200试剂盒 (德国Qiagen公司); 其他生化试剂均为国产分析纯。
细胞株 人胚肺二倍体成纤维细胞2BS由北京天坛生物制品有限公司建株, 30代 (PD) 以下为年轻细胞, 55 PD以上为完全衰老细胞。2BS细胞使用含有10%胎牛血清的DMEM-高糖培养基, 在饱和湿度、37 ℃、5% CO2通用培养条件下常规培养。当细胞生长至约80%~90%汇合时, 将细胞进行1:2传代。
红景天苷处理2BS细胞 2BS细胞分为3组, 每组3例:取28 PD 2BS细胞作为年轻组 (young), 50 PD 2BS细胞分为溶媒对照组 (old) 和红景天苷干预组 (old+SAL), 其中年轻组细胞只加溶剂1‰ DMSO:乙醇 (1:1, v/v) 处理24 h, 50 PD细胞对照组加入1‰ DMSO-乙醇 (1:1, v/v)、50 PD细胞干预组加入5 μmol·L-1红景天苷, 处理24 h后收集细胞, 提取RNA用于miRNA芯片分析。
microRNA芯片检测分析 BS细胞给予处理后, 立即收集细胞, Trizol试剂提取各组细胞总RNA, 采用Agilent Bioanalyzer鉴定RNA的纯度和质量。对RNA 3'端加poly (A), 并进行荧光标记, 进行杂交反应。本实验采用LC Sciences microRNA微阵列 (单色, miRbase 19.0版本), 用激光共聚焦扫描仪对杂交结束后的芯片进行扫描, 对杂交信号值进行背景扣除, 归一化。
荧光定量PCR验证芯片结果 选取芯片结果中显著差异表达的miRNA进行验证。miR-let-7c、miR-let-7e、miR-466、miR-181d以及内参U6的定量PCR引物购自德国Qiagen公司。按照miScript Reverse Transcription Kit试剂盒说明书, 将各例RNA样本逆转录为cDNA, 反应程序为: 37 ℃ 60 min, 95 ℃ 5 min, 冰上保存。按照miScript SYBR Green PCR Kit的说明, 进行定量PCR, 反应程序为: 95 ℃ 5 min预变性, 95 ℃ 15 s, 55 ℃ 30 s, 70 ℃ 34 s (采集信号) 重复40个循环进行扩增; 溶解曲线采用ABI 7000默认程序。反应结束后仪器自动计算出Ct值 (threshold cycles)。每个样本设置3个重复管, 同时设无模板阴性对照。2-ΔΔCt法计算各组之间miRNA的表达差异。
靶基因预测与功能显著性分析 采用生物信息学软件 (Mirtarbase http://mirtarbase.mbc.nctu.edu.tw) 对芯片检测的差异表达miRNA (P < 0.05) 进行靶基因预测, 选择预测结果中有实验验证过的靶基因进行功能分析。基于GO (gene ontology) 数据库和KEGG (kyoto encyclopedia of genes and genomes) 信号通路数据库, 利用David软件 (the database for annotation, visualization and integrated discovery, https://david.ncifcrf.gov/) 对靶基因进行GO显著性分析和信号通路显著性分析。
统计学处理 SPSS 10.0软件进行数据分析, 采用t检验, P < 0.05为差异具有统计学意义。
结果 1 miRNA表达谱差异及聚类分析本课题的前期研究表明红景天苷具有良好的体内外延缓衰老的效果[2, 3]。为了进一步探讨红景天苷干预细胞复制性衰老的分子机制, 采用miRBase 19.0版microRNA Microarray芯片对年轻细胞 (28 PD, young)、近复制衰老 (50 PD, old) 和红景天苷处理的50 PD细胞 (old+SAL) 进行miRNA表达谱分析。芯片结果显示, 在年轻细胞组和衰老细胞组之间, 有43个miRNA表达差异显著 (P < 0.05), 其中有11个miRNA的P值小于0.01 (图 1), 推测其可能与细胞复制性衰老显著相关。衰老细胞组和红景天苷处理的衰老细胞组间的比较结果则显示有58个miRNA在红景天苷干预后表达发生了改变 (P < 0.05), 其中17个miRNA差异非常显著 (P < 0.01, 图 1), 这些miRNA的表达可能受到红景天苷的调控。
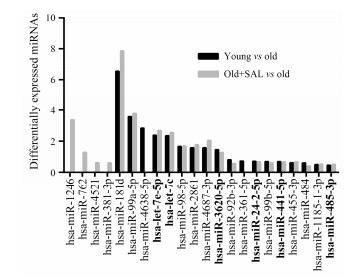
|
Figure 1 Differentially expressed miRNAs. Bold fonts: miRNAs differentially expressed in both young/old and old+SAL/old groups. SAL: Salidroside |
进一步分析发现, 31个miRNA (P < 0.05, 图 2) 在以上两组比较间均表现出明显的差异, 说明这些miRNA分子很有可能是在衰老的细胞受到红景天苷干预后参与细胞衰老调控的关键miRNA分子, 其中有6个miRNA分子 (P < 0.01, 图 1) 包括hsa-let-7c、hsa-let-7e和hsa-mir-3620表达量在衰老细胞组中降低, 而在红景天苷干预后表达增加, hsa-mir-411、hsa-mir-24-2-5p和hsa-mir-485-3p则表现出相反的趋势。
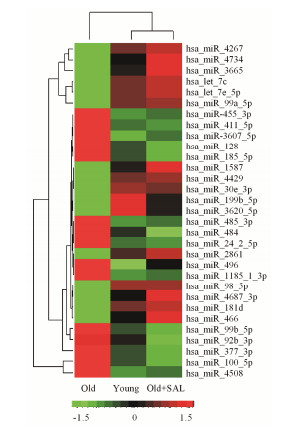
|
Figure 2 Hierarchical clustering analysis of the 31 miRNAs differentially expressed in both young/old (P < 0.05) and old+ SAL/old (P < 0.05) groups. The colors display miRNA expres sion variance: red indicates a higher gene expression, green lower expression, and black the median value |
为了验证miRNA芯片结果, 选择了差异表达较为明显的hsa-mir-466、hsa-let-7c、hsa-let-7e和hsa-mir-181d进行验证, 利用荧光定量PCR方法检测年轻细胞 (28 PD, young)、近复制衰老 (50 PD, old) 和红景天苷处理的50 PD细胞 (old+SAL) 3组之间4种miRNA差异表达情况。结果表明, 这4个miRNA表达趋势与芯片结果相符 (图 3)。
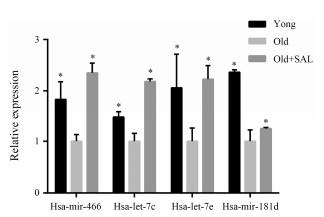
|
Figure 3 Validation of miRNA microarray data via RT-PCR. The relative expression value of hsa-mir-466, hsa-let-7c, hsa-let-7e and hsa-mir-181d were normalized to U6 RNA level. *P < 0.05 vs old group |
使用Mirtarbase数据库对31个miRNA的靶基因进行检索, 整理出已经实验验证过的196个靶基因并对其进行功能分析, 结果显示红景天苷调控的miRNA分子的靶基因功能明显富集于31个GO (图 4A), 包括转录因子活性调节、细胞泛素化调节和蛋白激酶等。Pathway显著性分析显示靶基因明显富集于11条信号通路 (图 4B), 包括p53信号通路、转录因子CREB信号通路和AKT/mTOR信号通路等。

|
Figure 4 GO and Pathway analysis on differentially expressed miRNAs. A: 31 GO terms enriched in SAL anti-senescence; B: 11 pathways enriched in SAL anti-senescence. The–lgP is the negative logarithm of the P-value. |
2BS人胚肺二倍体成纤维细胞系是国内外广受认可的一种细胞衰老模型。细胞衰老包括复制性和早熟性衰老。复制性衰老是细胞衰老的最常见类型, 已报道p53在复制性衰老中起到重要作用[7]。p21在转录水平由p53活化, 介导端粒依赖和DNA损伤等引起的衰老。p21能结合并抑制多种cyclin-CDK复合物活性, 在调控G1期和G2/M期阻滞中有着重要作用[8]。
红景天苷具有良好的体内外延缓衰老的效果, 本课题采用microRNA Microarray芯片对红景天苷干预人胚肺二倍体成纤维细胞衰老的机制进行分析。找到了43个miRNA与细胞复制性衰老显著相关, 58个miRNA在红景天苷干预后表达发生了改变。6个miRNA分子包括hsa-let-7c、hsa-let-7e和hsa-mir-3620在衰老细胞组中表达降低而在红景天苷干预后表达增加, hsa-mir-411、hsa-mir-24-2-5p和hsa-mir-485-3p则表现出相反的趋势。
let-7最初是在控制线虫干细胞发育分化中被发现的, 也是在人体发现的第一个miRNA分子。在高等生物中, let-7的表达随着胚胎发育而增加, let-7的失调将导致细胞分化程度异常和疾病的发生, 包括肿瘤等。本研究的芯片结果显示hsa-let-7c和hsa-let-7e随着细胞复制性衰老而表达降低, 且该结果与先前的报道相符[9]。荧光定量PCR结果进一步验证了这一结果, 并且在红景天苷干预后hsa-let-7c和hsa-let-7e的表达随着细胞衰老的减缓而有所增加。有研究报道let-7c通过下调其靶基因Bcl-xl抑制肿瘤细胞凋亡[10, 11]。Xu等[12]发现let-7a可以通过与衔接蛋白p66Shc mRNA上的种子序列结合, 抑制p66Shc的翻译表达, 从而延缓人二倍体成纤维细胞的复制性衰老的过程。miR-24可以通过调控一系列细胞周期相关的基因MYC、AURKB、CCNA2、CDC2、CDK4和FEN1, 并直接抑制靶基因E2F2, 使细胞周期阻滞于G1期从而抑制细胞增殖[13]。DNA损伤的积累是细胞衰老的重要标志。DNA双链断裂 (double-strand break, DSB) 损伤时, 组蛋白2A变异体 (histone family 2A variant, H2AX) 可以发生不同的翻译后修饰标记损伤的DNA双链, 促进局部DNA修复因子和染色体重塑因子的募集, 维持基因组的稳定性。miR-24-2可以通过靶向抑制H2AX和BCL-2, 同时下调p53-p21信号相关基因MDM-2和p21, 阻碍DNA损伤修复, 促进细胞的凋亡[14, 15]。
miRNA芯片结果结合Mirtarbase数据库进行生物信息学分析, 对已经报道过的靶基因进行功能聚类和信号通路分析, 发现红景天苷调控的miRNA分子的靶基因功能明显富集于31个GO, 11条信号通路。其中cAMP/CREB信号通路在调控葡萄糖稳态、细胞生存以及维持学习和记忆功能中发挥重要作用[16]。CREB是一种组成型核转录因子, 在cAMP及各种激酶作用下, 其第133位Ser磷酸化而活化, 与DNA反应元件CRE“TGACGTCA”序列结合, 并与p300和CBP形成复合物, 促进下游靶基因BDNF等的转录。CREB的活性和表达随着年龄增长而降低[17]。CREB及其靶基因BDNF在老龄大脑中表达降低, 与学习认知能力下降有关。在阿尔茨海默病中, Rosa等[18]发现Aβ蛋白通过抑制CREB转录, 抑制CREB下游基因BDNF表达。mTOR通过磷酸化其底物核糖体蛋白S6激酶1和eIF4E结合蛋白1调节mRNA的翻译起始和过程, 从而控制蛋白的合成速率。当营养充分时, mTOR被激活并促进生长和合成代谢。相反, 当养分缺失时, mTOR活性受到抑制从而转向生长抑制和分解代谢[19]。mTOR信号在热量限制延长机体寿命中起到重要作用[20]。在果蝇中, 热量限制同时抑制mTOR, 激活eIF4E结合蛋白1, 导致线粒体电子传递链增加, 使线粒体呼吸作用增强, 减少ROS的产生, 降低ROS导致的衰老并延长了寿命[21]。另外, mTOR还可通过减少溶酶体对细胞内容物的降解而抑制自噬, 进而影响细胞衰老[7]。Wu等[22]通过研究mTOR缺失小鼠发现, 虽然mTOR缺失小鼠表现出比野生型小鼠较小的体型, 但在食量、代谢等方面没有差异, 并表现出更长的寿命。Marcais等[23]报道, 在T细胞中let-7c直接作用于mTOR的UTR区域, 抑制其翻译。let-7家族成员在发育、肿瘤的发生发展中起到了重要的作用, 红景天苷调控let-7是否通过抑制mTOR信号延缓衰老还需要进一步验证。
综上所述, 本研究利用miRNA表达谱芯片, 筛选出红景天苷干预细胞复制性衰老的相关miRNA, 并对其调控的靶基因和信号通路进行了分析, 从miRNA角度初步探讨了红景天苷抗细胞衰老的分子机制, 为进一步深入研究其抗衰老作用机制提供了基础。
| [1] | Shen JJ, Mao GX, Chen JJ, et al. Research progress of pharmacological actions and mechanisms of active components of Rhodiola L[J]. Int J Geriatrics (国际老年医学杂志), 2012, 33: 206–210. |
| [2] | Mao GX, Deng HB, Yuan LG, et al. Protective role of salidroside against aging in a mouse model induced by D-galactose[J]. Biomed Environ Sci, 2010, 23: 161–166. DOI:10.1016/S0895-3988(10)60047-5 |
| [3] | Mao GX, Wang Y, Qiu Q, et al. Salidroside protects human fibroblast cells from premature senescence induced by H2O2 partly through modulating oxidative status[J]. Mech Ageing Dev, 2010, 131: 723–731. DOI:10.1016/j.mad.2010.10.003 |
| [4] | Mao GX, Xing WM, Wen XL, et al. Salidroside protects against premature senescence induced by ultraviolet B irradiation in human dermal fibroblasts[J]. Int J Cosmet Sci, 2015, 37: 321–328. DOI:10.1111/ics.2015.37.issue-3 |
| [5] | Zahnow CA, Baylin SB. Epigenetic networks and miRNAs in stem cells and cancer[J]. Mol Cell, 2010, 39: 661–663. DOI:10.1016/j.molcel.2010.08.036 |
| [6] | Fabbri M, Calore F, Paone A, et al. Epigenetic regulation of miRNAs in cancer[J]. Adv Exp Med Biol, 2013, 754: 137–148. DOI:10.1007/978-1-4419-9967-2 |
| [7] | Rufini A, Tucci P, Celardo I, et al. Senescence and aging:the critical roles of p53[J]. Oncogene, 2013, 32: 5129–5143. DOI:10.1038/onc.2012.640 |
| [8] | Agarwal ML, Agarwal A, Taylor WR, et al. p53 controls both the G2/M and the G1 cell cycle checkpoints and mediates reversible growth arrest in human fibroblasts[J]. Proc Natl Acad Sci U S A, 1995, 92: 8493–8497. DOI:10.1073/pnas.92.18.8493 |
| [9] | Marasa BS, Srikantan S, Martindale JL, et al. MicroRNA profiling in human diploid fibroblasts uncovers miR-519 role in replicative senescence[J]. Aging (Albany NY), 2010, 2: 333–343. |
| [10] | Zhan M, Qu Q, Wang G, et al. let-7c sensitizes acquired cisplatin-resistant A549 cells by targeting ABCC2 and Bcl-XL[J]. Pharmazie, 2013, 68: 955–961. |
| [11] | Qin B, Xiao B, Liang D, et al. MicroRNA let-7c inhibits Bcl-xl expression and regulates ox-LDL-induced endothelial apoptosis[J]. BMB Rep, 2012, 45: 464–469. DOI:10.5483/BMBRep.2012.45.8.033 |
| [12] | Xu F, Pang L, Cai X, et al. let-7-repressesed Shc translation delays replicative senescence[J]. Aging Cell, 2014, 13: 185–192. DOI:10.1111/acel.2014.13.issue-1 |
| [13] | Lal A, Navarro F, Maher CA, et al. miR-24 Inhibits cell proliferation by targeting E2F2, MYC, and other cell-cycle genes via binding to "seedless" 3'UTR microRNA recognition elements[J]. Mol Cell, 2009, 35: 610–625. DOI:10.1016/j.molcel.2009.08.020 |
| [14] | Celeste A, Petersen S, Romanienko PJ, et al. Genomic instability in mice lacking histone H2AX[J]. Science, 2002, 296: 922–927. DOI:10.1126/science.1069398 |
| [15] | Srivastava N, Manvati S, Srivastava A, et al. miR-24-2 controls H2AFX expression regardless of gene copy number alteration and induces apoptosis by targeting antiapoptotic gene BCL-2:a potential for therapeutic intervention[J]. Breast Cancer Res, 2011, 13: R39. DOI:10.1186/bcr2861 |
| [16] | Mayr B, Montminy M. Transcriptional regulation by the phosphorylation-dependent factor CREB[J]. Nat Rev Mol Cell Biol, 2001, 2: 599–609. |
| [17] | Hansen RT 3rd, Zhang HT. Senescent-induced dysregulation of cAMP/CREB signaling and correlations with cognitive decline[J]. Brain Res, 2013, 1516: 93–109. DOI:10.1016/j.brainres.2013.04.033 |
| [18] | Rosa E, Fahnestock M. CREB expression mediates amyloid beta-induced basal BDNF downregulation[J]. Neurobiol Aging, 2015, 36: 2406–2413. DOI:10.1016/j.neurobiolaging.2015.04.014 |
| [19] | Laplante M, Sabatini DM. mTOR Signaling[J]. Cold Spring Harb Perspect Biol, 2012, 4: a011593. |
| [20] | Grandison RC, Piper MD, Partridge L. Amino-acid imbal-ance explains extension of lifespan by dietary restriction in Drosophila[J]. Nature, 2009, 462: 1061–1064. DOI:10.1038/nature08619 |
| [21] | Zid BM, Rogers AN, Katewa SD, et al. 4E-BP extends lifespan upon dietary restriction by enhancing mitochondrial activity in Drosophila[J]. Cell, 2009, 139: 149–160. DOI:10.1016/j.cell.2009.07.034 |
| [22] | Wu JJ, Liu J, Chen EB, et al. Increased mammalian lifespan and a segmental and tissue-specific slowing of aging after genetic reduction of mTOR expression[J]. Cell Rep, 2013, 4: 913–920. DOI:10.1016/j.celrep.2013.07.030 |
| [23] | Marcais A, Blevins R, Graumann J, et al. mi-croRNA-mediated regulation of mTOR complex components facilitates discrimination between activation and anergy in CD4 T cells[J]. J Exp Med, 2014, 211: 2281–2295. DOI:10.1084/jem.20132059 |
 2017, Vol. 52
2017, Vol. 52


