L-谷氨酸是食物蛋白质的重要组成, 约占膳食蛋白的10%~20%, 在营养代谢、能量需求、免疫响应、氧化应激、信号通路调节及突触传递中具有多种作用[1]。在中枢神经系统中, 谷氨酸作为一种兴奋性神经递质, 在学习、记忆等生理过程和中枢疼痛感觉传导等方面起关键作用[2-4]。L-谷氨酸及其一钠盐 (图 1) 是主要的鲜味来源, L-谷氨酸一钠是味精的主要成分, 其进入消化道后在胃酸的作用下会转化为L-谷氨酸。越来越多研究表明, 谷氨酸在胃肠道保护中发挥着重要作用, 涉及胃肠道的能量供应、氧化应激、消化、吸收及屏障功能等环节。

|
Figure 1 Chemical structures of L-glutamate (a) and L-monosodium glutamate (b) |
谷氨酸是肠道的主要氧化供能物质, 食物中约96%谷氨酸被肠道代谢[1], 谷氨酸进入胃肠道细胞首先产生α-酮戊二酸, 然后进入三羧酸循环合成大量ATP, 谷氨酸代谢产生的ATP对肠道完整性与功能维持非常重要[5]。此外, 它还是肠道内其他氨基酸 (L-丙氨酸、L-天冬氨酸、L-鸟氨酸、L-脯氨酸) 及谷胱甘肽 (GSH) 的前体物质, 而GSH是肠道细胞最主要的抗氧化物质[6], 因此谷氨酸在胃肠道抗氧化应激中也发挥着重要作用[7, 8]。
谷氨酸进入肠道细胞是谷氨酸代谢通路的第一步, 谷氨酸较难透过生物膜, 其由肠道内向上皮细胞转运主要基于Na+依赖性谷氨酸转运体 (或称高亲和力谷氨酸转运体, EAATs)[9], 该转运体每转运1个谷氨酸分子, 伴有3个Na+和1个H+同向转运到细胞内, 1个K+逆向转运到细胞外[10]。由于谷氨酸几乎在肠道代谢, 体内谷氨酸需要自身合成, 主要是由α-酮戊二酸或谷氨酰胺、脯氨酸、精氨酸等其他氨基酸合成[1], 谷氨酸运出细胞是通过谷氨酸/胱氨酸转运体 (Xc-) 控制的, Xc-将一分子谷氨酸转运到细胞外, 同时将一分子胱氨酸转运进细胞内 (图 2)。Xc-对细胞外谷氨酸水平的维持是非常重要的, 研究发现阿司匹林通过抑制谷氨酸/胱氨酸转运体, 抑制谷氨酸释放, 是其引起胃黏膜损伤的原因之一[11]。胃肠道内适当浓度的谷氨酸对胃肠道功能的维持是必需的。
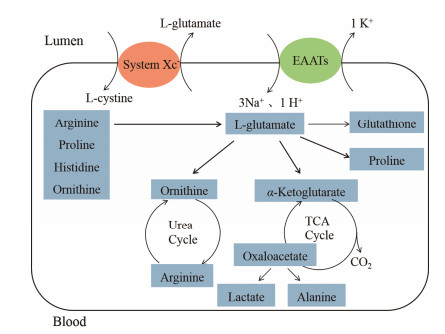
|
Figure 2 Schematic of L-glutamate metabolism and transport. EAATs: Excitatory amino acid transporters; Xc-: Glutamate/ cystine antiporter |
近期研究发现, 除中枢神经系统外, 谷氨酸受体在舌及胃肠道等外周组织也有表达[12], 包括钙敏感受体 (CaSRs)、代谢型谷氨酸受体 (mGluRs)[13]、鲜味受体T1R1/T1R3受体异质二聚体[14]等。谷氨酸通过谷氨酸受体, 刺激一氧化氮 (NO) 的合成, NO可刺激五羟色胺 (5-HT) 释放, 并激活迷走神经, 将胃肠道内的信息传递至中枢神经系统[15], 中枢神经系统接受信息整合后调控胃肠道的胃酸、胃蛋白酶原、黏液、HCO3-等分泌及血流与肠道运动等[16], 肠道神经系统与中枢神经系统连接的双向通路称为肠脑轴[17]。
肠脑轴在鲜味感知[18]、食物消化调节[15, 19, 20]及胃肠道屏障功能[21-23]中发挥重要作用。谷氨酸是膳食中蛋白质摄入的信号[15], 如谷氨酸与氨基酸丰富的食物合用, 会增强犬胃酸、胃蛋白酶原及黏液的分泌, 而与碳水化合物丰富的食物合用, 则不会影响犬胃分泌作用[24]; 谷氨酸钠与脂质食物合用, 会增加人的胃排空速度[25], 这表明谷氨酸在蛋白质类食物消化中发挥重要作用。胃肠道内给予不同剂量的谷氨酸 (0.1~10 mmol ·L-1), 可剂量依赖性增加大鼠十二指肠上皮细胞内的pH及黏液凝胶层的厚度, 抑制酸及细菌等的影响[21, 22]; 也可抑制肠外营养引起的小鼠胃萎缩及黏膜屏障破坏[23]。
3 谷氨酸对胃肠道损伤的保护作用 3.1 谷氨酸对非甾体抗炎药致胃肠道损伤的预防及治疗非甾体抗炎药广泛用于炎症、疼痛及脑血管疾病的治疗, 但长期给予非甾体抗炎药会引起黏膜损伤、出血、胃溃疡及肠内炎症等胃肠道不良反应[26]。其损伤机制目前较为明确[27]。首先, 许多非甾体抗炎药为有机酸, 在胃内酸性环境中以非解离形式被吸收, 在胃上皮细胞解离产生大量的H+, 引起线粒体氧化磷酸化解偶联, 导致ATP合成减少, 破坏细胞间紧密连接, 使肠道菌、蛋白水解酶等进入上皮细胞, 引起胃黏膜细胞的坏死与凋亡[28]。其次, 非甾体抗炎药抑制环氧合酶-1 (COX-1), 从而抑制具有保护作用的前列腺素的表达, 使胃黏膜局部血流减少, 黏液和黏膜屏障功能减弱, 从而增加微生物入侵[29], 微生物产生的毒素上调诱导型一氧化氮合酶 (iNOS) 的表达, 进一步破坏肠道上皮屏障[30]。再次, 由于COX被抑制, 可激活脂肪氧合酶通路, 增加白细胞三烯的合成, 引起炎症及组织缺血, 导致胃黏膜损伤[27]。此外, 非甾体抗炎药还能通过抑制促溃疡修复生长因子的表达来抑制溃疡的修复过程[31]。如吲哚美辛可通过下调血管内皮生长因子 (VEGF) 的表达并抑制血管生成, 而抑制溃疡修复[32]。
3.1.1 增强胃肠道黏膜的屏障功能谷氨酸对胃肠道屏障功能的增强作用主要包括以下几个方面: ①增加HCO3-的分泌, 抑制酸性非甾体抗炎药引起的直接损伤。黏液-碳酸氢盐屏障是胃黏膜发挥屏障功能的重要防线。研究发现谷氨酸灌注SD大鼠十二指肠, 可增加十二指肠HCO3-的分泌, 提高十二指肠上皮细胞的pH, 用L-谷氨酸预处理, 可减少pH为1.8的酸性溶液引起的大鼠十二指肠上皮细胞的损伤[33, 34]。②增加黏液层的厚度与黏蛋白的表达。肠道黏液层是抵御外界病原体的第一道防线, 可抑制病原微生物等与上皮细胞直接作用, 而黏蛋白是肠道黏液层的主要组成成分[35]。MUC2黏蛋白对胃肠道内黏液凝胶层的形成是非常重要的, 具有拮抗致病菌对肠道的黏附和侵袭的作用[36], 研究表明非甾体抗炎药可减少大鼠小肠上皮细胞MUC2表达, 这种作用可被L-谷氨酸拮抗, 如在给予非甾体抗炎药氯索洛芬前, 给予5天L-谷氨酸钠, 能显著逆转氯索洛芬引起的大鼠小肠MUC2 mRNA表达的下降, 增强肠道屏障功能, 减少肠道菌的入侵, 从而抑制氯索洛芬引起的肠道损伤[37]。③增强胃肠道上皮细胞间的紧密连接, 降低其通透性。肠道上皮细胞作为一个选择性屏障, 允许必需的营养物质、电解质等运至循环系统, 抑制有害物质进入内环境, 细胞间的紧密连接在维持上皮细胞层完整性中发挥关键作用[38, 39]。谷氨酸能增加闭合蛋白、封闭蛋白-1、封闭蛋白-2、紧密连接蛋白 (ZO)-1、ZO-2及ZO-3的表达, 增加猪小肠上皮细胞 (IPEC-1) 的跨膜电阻[40], 可将高渗透性肠道模型 (Caco2细胞) 的渗透性减少30%[41]。④增强免疫调节作用。肠道免疫功能是肠道黏膜屏障功能不可缺少的一部分。肠道相关淋巴组织对细胞、毒素、食物抗原及潜在的有害生物构成重要屏障。T-细胞、B-细胞、树枝状细胞及巨噬细胞均表达谷氨酸受体[42, 43], 谷氨酸在免疫细胞功能方面具有重要作用。如谷氨酸可使体外培养的B-细胞及外周单核细胞产生更多的IgG与IgE[43]。Pacheco等[44]研究发现在抗原接触T-细胞时, 树枝状细胞释放谷氨酸, 而释放的谷氨酸会影响T-细胞的增殖与细胞因子的产生, 提示谷氨酸可通过调控肠道T-细胞, 增强胃肠道的屏障作用[45]。
3.1.2 提高胃肠道上皮细胞的增殖能力并抑制氧化应激谷氨酸可在细胞水平上提高猪小肠上皮细胞 (IPEC-1) 的增殖能力[40]。如外源性谷氨酸预处理大鼠胃内皮细胞, 可明显抵抗阿司匹林引起的细胞凋亡[11]。在体内, 谷氨酸与谷氨酰胺预处理大鼠, 能够显著逆转吲哚美辛引起的大鼠小肠上皮细胞凋亡[46]。氧化应激是细胞损伤的另一个主要原因, 其产生的过量活性氧会损伤胃肠道黏膜屏障功能[47]。谷氨酸作为GSH的前体物质具有抗氧化作用, 可降低肠道氧化应激导致的损伤。如谷氨酸可减弱霉菌毒素及敌草快引起的氧化应激反应[7, 8], 可降低氯索洛芬引起的大鼠肠道iNOS高表达而发挥肠道保护作用, 可逆转吲哚美辛引起的大鼠胃肠道内过氧化物酶的过表达从而减弱吲哚美辛对肠道的损伤[46]。
3.1.3 增强神经系统对胃肠道的调节并促进损伤修复肠脑轴的调节对胃肠道的黏膜防御具有重要作用[33, 34]。完全肠外营养, 会导致小肠黏膜萎缩及上皮屏障功能下降, 而谷氨酸可通过恢复肠内传感, 抑制肠道萎缩[23]。口服给予谷氨酸能够在mRNA及蛋白水平增加小猪胃及空肠内谷氨酸受体及转运体的表达, 从而加强谷氨酸的信号传导及胃肠道的屏障功能[48, 49]。除预防保护外, 谷氨酸还可促进非甾体抗炎药引起的胃溃疡修复。如5%谷氨酸钠可显著增加VEGF的表达及血管生成, 加快氯索乐芬引起的大鼠小肠溃疡修复进程[50] (图 3)。

|
Figure 3 Schematic of the mechanism of the protective effect of L-glutamate on gastrointestinal lesion. iNOS: Inducible nitric oxide synthase; Muc 1: Mucin 1; NO: Nitric oxide; VEGF: Vascular endothelial growth factor; ZO-1, 2, 3: Zonula occludens-1, 2, 3 |
幽门螺杆菌是一种微量需氧、呈螺旋状的革兰阴性细菌, 它是胃炎、十二指肠溃疡及胃溃疡的主要致病因子。幽门螺杆菌在胃内的定植是致病的基础, 其鞭毛及黏附因子, 使其能够通过胃内黏液层并表达尿素酶, 尿素酶水解胃中尿素产生的NH3能中和胃酸并利于其在胃内定植, 幽门螺杆菌引起胃损伤的程度与胃液中NH3的浓度[51]或尿素酶活性相关[52]。幽门螺杆菌刺激胃黏膜, 引起巨噬细胞和淋巴细胞增多, 这些细胞分泌iNOS等活性物质, 使黏膜组织中的自由基增多, 引起胃上皮细胞凋亡[53], 造成胃黏膜进一步损伤。幽门螺杆菌表达多种毒力因子, 其中CagA的研究最广泛, CagA与细胞间的紧密连接蛋白作用, 破坏胃上皮细胞的屏障作用[54]。如空泡毒素VacA可引起细胞空泡化, 并可进入线粒体膜, 引起线粒体功能紊乱, 从而导致细胞凋亡[55]。
3.2.1 抑制幽门螺杆菌的定植谷氨酸可通过多种途径增强胃肠道的屏障功能, 这对幽门螺杆菌的定植起到抑制作用。①谷氨酸增加黏液层及黏蛋白的分泌, 阻止幽门螺杆菌的定植。研究表明, 胃上皮细胞表达的MUC1黏蛋白可阻止幽门螺杆菌等微生物的黏附及入侵[56], 可抑制肿瘤坏死因子 (TNF-α) 与IL-8炎症因子的表达, 从而抑制幽门螺杆菌引起的炎症反应。谷氨酰胺及γ-氨基丁酸均可增加离体猪空肠MUC1的表达, 谷氨酰胺首先生成谷氨酸, 再转化为γ-氨基丁酸, 因此推测谷氨酸作为两者中间物质, 也可增加肠道上皮细胞表面黏蛋白MUC1的表达[57], 但其具体作用需要进一步研究。②谷氨酸可增加胃上皮细胞间的紧密连接, 从而抑制幽门螺杆菌的入侵[39]。
3.2.2 抑制NH3引起的细胞凋亡NH3能显著损伤胃黏膜的平衡, 导致胃黏膜层厚度降低, 上皮细胞的损伤与凋亡[58], 并减慢已损伤胃黏膜的恢复[59]。研究发现, NH4Cl能剂量依赖性引起RGM1细胞 (胃表面上皮细胞) 的空泡化及凋亡, 而谷氨酸可剂量依赖性对抗NH4Cl引起的胃上皮细胞损伤, 有研究[60]指出谷氨酸抑制NH3引起的脑神经细胞损伤机制是在谷氨酰胺合成酶的作用下与NH3生成谷氨酰胺, 但在该研究中抑制谷氨酰胺合成酶的活性并不影响谷氨酸对胃上皮细胞的保护作用, 提示谷氨酸的胃肠道氨解毒作用不是通过与NH3结合生成谷氨酰胺而实现的, 其作用机制尚需进一步研究[61]。
4 谷氨酸相关药物制剂的研究前景相关研究表明, 大剂量的谷氨酸钠易引发麻木、头痛、心悸及肾损伤等症状, 但小剂量时其安全性较好。谷氨酸引发的头痛症状的回顾性分析[62]和相关研究[63, 64]显示, 谷氨酸钠给予量小于每天2.5 g时与头痛和成年人肥胖无关。动物及临床试验表明[65-67], 日常摄入剂量下, 谷氨酸与哮喘和肾损伤也无相关性。提示谷氨酸在较低摄入剂量下安全性较高, 将其配伍使用是胃肠道黏膜保护与抗溃疡药物开发中具有重要临床意义及开发价值的新药研究思路。
4.1 谷氨酸配伍非甾体抗炎药非甾体抗炎药使用广泛, 但易引发胃肠道不良反应。大量研究在非甾体抗炎药引起的胃肠道损伤的保护方面做出了努力[27], 如非甾体抗炎药与质子泵抑制剂、前列腺素类似物等胃肠道保护剂合用, 可在一定程度上减轻黏膜损伤, 但这些药物的长期使用也会带来其他风险。20世纪90年代以来, 寻找COX-2选择性抑制剂已成为非甾体抗炎药研究的热点, 但该类药物因会引起心肌梗死及血栓形成等心血管风险, 2004年默克公司将选择性COX-2抑制剂罗非昔布在全球市场撤回。目前为止, 仍然没有疗效理想的非甾体抗炎药致胃肠道损伤的治疗方法。另一方面, 使用非甾体抗炎药的患者普遍对胃肠道的保护意识极弱, Zhu等[68]的调查结果发现使用小剂量阿司匹林的患者仅有3.46%同时使用胃肠保护剂, 为提高患者用药的顺应性, 可将非甾体抗炎药与胃肠道保护剂做成复方制剂。谷氨酸的药效明确、长期使用安全性高, 因此可考虑开发谷氨酸与非甾体抗炎药的复方制剂, 在胃肠道保护同时, 提高患者用药的顺应性。其风险在于谷氨酸可能提高阿司匹林的溶解性[69], 进而影响其吸收特性, 复方制剂处方的合理设计与工艺安排, 如采用分别包衣、不同胃肠道段释放药物等技术, 是规避这种理化作用导致的临床安全性的有效方法。
4.2 谷氨酸作为胃保护剂的幽门螺杆菌根除方案幽门螺杆菌的感染率高, 且易引起胃和十二指肠溃疡以及胃癌等疾病, 因此幽门螺杆菌的根除对于上述疾病的治疗和预防尤为重要。目前根除幽门螺杆菌的标准疗法为质子泵抑制剂联用两种抗生素如阿莫西林和克拉霉素的三联疗法, 但其根除率随幽门螺杆菌的耐药性上升而下降。目前含铋的四联药物治疗合并幽门螺杆菌感染的消化性溃疡、慢性胃炎、胃癌等消化道疾病应用较多[70], 但也存在铋不良反应较多, 且幽门螺杆菌耐药性日趋严重的问题。基于谷氨酸具有增强胃黏膜屏障功能、抑制幽门螺杆菌定植和保护幽门螺杆菌致胃损伤的作用, 且具有安全性高、价格低的特点, 将其作为胃肠道保护剂, 联合其他药物而探索新的幽门螺杆菌根治方案, 具有广泛的应用前景。目前, 虽已证明谷氨酸在体外及动物中均能够抑制幽门螺杆菌定植、抑制其引起的胃损伤, 但由于幽门螺杆菌的宿主具有特殊性, 其对人类幽门螺杆菌感染的协助治疗作用仍需进一步研究证实。
5 总结与展望L-谷氨酸不仅在中枢神经系统中发挥重要作用, 其在胃肠道、肾和肺等外周器官中也具有重要的调节作用。L-谷氨酸可通过多种机制保护非甾体抗炎药及幽门螺杆菌引起的胃肠道损伤。L-谷氨酸在一定剂量范围内安全性高, 与非甾体抗炎药配伍使用或在幽门螺杆菌根除治疗中具有较大的应用前景。同时L-谷氨酸给药剂量需要进一步明确, 其临床试验中胃肠道黏膜保护作用需进一步研究。
| [1] | Brosnan JT, Brosnan ME. Glutamate:a truly functional amino acid[J]. Amino Acids, 2013, 45: 413–418. DOI:10.1007/s00726-012-1280-4 |
| [2] | Ménard C, Quirion R. Group 1 metabotropic glutamate receptor function and its regulation of learning and memory in the aging brain[J]. Front Pharmacol, 2012, 3: 182. |
| [3] | Chen XL, Wang KW. The fate of medications evaluated for ischemic stroke pharmacotherapy over the period 1995-2015[J]. Acta Pharm Sin B, 2016, 6: 522–530. DOI:10.1016/j.apsb.2016.06.013 |
| [4] | Sun K, Fan JY, Han JY. Ameliorating effects of traditional Chinese medicine preparation, Chinese materia medica and active compounds on ischemia/reperfusioninduced cerebral microcirculatory disturbances and neuron damage[J]. Acta Pharm Sin B, 2015, 5: 8–24. DOI:10.1016/j.apsb.2014.11.002 |
| [5] | Burrin DG, Stoll B. Metabolic fate and function of dietary glutamate in the gut[J]. Am J Clin Nutr, 2009, 90: 850S–856S. DOI:10.3945/ajcn.2009.27462Y |
| [6] | Burrin DG, Janeczko MJ, Stoll B. Emerging aspects of dietary glutamate metabolism in the developing gut[J]. Asia Pac J Clin Nutr, 2008, 17(Suppl 1): 368–371. |
| [7] | Yin J, Liu MF, Ren WK, et al. Effects of dietary supplementation with glutamate and aspartate on diquat-induced oxidative stress in piglets[J]. PLoS One, 2015, 10: e0122893. DOI:10.1371/journal.pone.0122893 |
| [8] | Duan JL, Yin J, Wu MM, et al. Dietary glutamate supple-mentation ameliorates mycotoxin-induced abnormalities in the intestinal structure and expression of amino acid transporters in young pigs[J]. PLoS One, 2014, 9: e112357. DOI:10.1371/journal.pone.0112357 |
| [9] | Toshihiko I, Marie G, Masahiko W. Cellular distribution of glutamate transporters in the gastrointestinal tract of mice:an immunohistochemical and in situ hybridization approach[J]. Biomed Res, 2005, 26: 271–278. DOI:10.2220/biomedres.26.271 |
| [10] | Vandenberg RJ, Ryan RM. Mechanisms of glutamate transport[J]. Physiol Rev, 2013, 93: 1621–1657. DOI:10.1152/physrev.00007.2013 |
| [11] | Du J, Li XH, Zhang W, et al. Involvement of glutamate-cystine/glutamate transporter system in aspirin-induced acute gastric mucosa injury[J]. Biochem Biophys Res Commun, 2014, 450: 135–141. DOI:10.1016/j.bbrc.2014.05.069 |
| [12] | Du J, Li XH, Li YJ. Glutamate in peripheral organs:biology and pharmacology[J]. Eur J Pharmacol, 2016, 784: 42–48. DOI:10.1016/j.ejphar.2016.05.009 |
| [13] | Bezençon C, le Coutre J, Damak S. Taste-signaling proteins are coexpressed in solitary intestinal epithelial cells[J]. Chem Senses, 2007, 32: 41–49. DOI:10.1093/chemse/bjl034 |
| [14] | Nakamura E, Hasumura M, San GA, et al. New frontiers in gut nutrient sensor research:luminal glutamate-sensing cells in rat gastric mucosa[J]. J Pharmacol Sci, 2010, 112: 13–18. DOI:10.1254/jphs.09R16FM |
| [15] | Torii K, Uneyama H, Nakamura E. Physiological roles of dietary glutamate signaling via gut-brain axis due to efficient digestion and absorption[J]. J Gastroenterol, 2013, 48: 442–451. DOI:10.1007/s00535-013-0778-1 |
| [16] | Kitamura A, Tsurugizawa T, Uematsu A, et al. New therapeutic strategy for amino acid medicine:effects of dietary glutamate on gut and brain function[J]. J Pharmacol Sci, 2012, 118: 138–144. DOI:10.1254/jphs.11R06FM |
| [17] | Uneyama H. Nutritional and physiological significance of luminal glutamate-sensing in the gastrointesinal funcions[J]. J Pharm Soc Jpn, 2011, 131: 1699–1709. |
| [18] | Ghirri A, Bignetti E. Occurrence and role of umami molecules in foods[J]. Int J Food Sci Nutr, 2012, 63: 871–881. DOI:10.3109/09637486.2012.676028 |
| [19] | Kitamura A, Tsurugizawa T, Torii K. Biological significance of glutamate signaling during digestion of food through the gut-brain axis[J]. Digestion, 2011, 83: 37–43. DOI:10.1159/000323407 |
| [20] | Nakamura E, Uneyama H, Torii K. Gastrointestinal nutrient chemosensing and the gut-brain axis:significance of glutamate signaling for normal digestion[J]. J Gastroenterol Hepatol, 2013, 28(Suppl 4): 2–8. |
| [21] | Uneyama H, Niijima A, San GA, et al. Luminal amino acid sensing in the rat gastric mucosa[J]. Am J Physiol Gastrointest Liver Physiol, 2006, 291: G1163–G1170. DOI:10.1152/ajpgi.00587.2005 |
| [22] | Akiba Y, Kaunitz JD. Luminal chemosensing and upper gastrointestinal mucosal defenses[J]. Am J Clin Nutr, 2009, 90: 826S–831S. DOI:10.3945/ajcn.2009.27462U |
| [23] | Xiao W, Feng Y, Holst JJ, et al. Glutamate prevents intestinal atrophy via luminal nutrient sensing in a mouse model of total parenteral nutrition[J]. FASEB J, 2014, 28: 2073–2087. DOI:10.1096/fj.13-238311 |
| [24] | Khropycheva R, Andreeva J, Uneyama H, et al. Dietary glutamate signal evokes gastric juice excretion in dogs[J]. Digestion, 2011, 83(Suppl 1): 7–12. |
| [25] | Teramoto H, Shimizu T, Yogo H, et al. Gastric emptying and duodenal motility upon intake of a liquid meal with monosodium glutamate in healthy subjects[J]. Physiol Rep, 2014, 2: e00187. |
| [26] | Wallace JL. Mechanisms, prevention and clinical implica-tions of nonsteroidal anti-inflammatory drug-enteropathy[J]. World J Gastroenterol, 2013, 19: 1861–1876. DOI:10.3748/wjg.v19.i12.1861 |
| [27] | Sinha M, Gautam L, Shukla PK, et al. Current perspectives in NSAID-induced gastropathy[J]. Mediators Inflamm, 2013, 2013: 258209. |
| [28] | Tomisato W, Tanakaa K, Katsu T, et al. Membrane permeabilization by non-steroidal anti-inflammatory drugs[J]. Biochem Biophys Res Commun, 2004, 323: 1032–1039. DOI:10.1016/j.bbrc.2004.08.205 |
| [29] | Tanaka A, Hase S, Miyazawa T, et al. Up-regulation of cyclooxygenase-2 by inhibition of cyclooxygenase-1:a key to nonsteroidal anti-inflammatory drug-induced intestinal damage[J]. J Pharmacol Exp Ther, 2002, 300: 754–761. DOI:10.1124/jpet.300.3.754 |
| [30] | Takeuchi K, Yokota A, Tanaka A, et al. Factors involved in upregulation of inducible nitric oxide synthase in rat small intestine following administration of nonsteroidal anti-inflammatory drugs[J]. Dig Dis Sci, 2006, 51: 1250–1259. DOI:10.1007/s10620-006-8045-4 |
| [31] | Szabo S, Vincze A. Growth factors in ulcer healing:lessons from recent studies[J]. J Physiol Paris, 2000, 92: 77–81. |
| [32] | Takeuchi K, Tanigami M, Amagase K, et al. Endogenous prostaglandin E2 accelerates healing of indometha-cin-induced small intestinal lesions through upregulation of vascular endothelial growth factor expression by activation of EP4 receptors[J]. J Gastroenterol Hepatol, 2010, 25(Suppl 1): S67–S74. |
| [33] | Akiba Y, Watanabe C, Mizumori M, et al. Luminal L-glutamate enhances duodenal mucosal defense mechanisms via multiple glutamate receptors in rats[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 297: G781–G791. DOI:10.1152/ajpgi.90605.2008 |
| [34] | Akiba Y, Kaunitz JD. Duodenal chemosensing and mucosal defenses[J]. Digestion, 2011, 83(Suppl 1): 25–31. |
| [35] | Merga Y, Campbell BJ, Rhodes JM. Mucosal Barrier, bacteria and inflammatory bowel disease:possibilities for therapy[J]. Dig Dis, 2014, 32: 475–483. DOI:10.1159/000358156 |
| [36] | Johansson MEV, Phillipson M, Petersson J, et al. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria[J]. Proc Natl Acad Sci U S A, 2008, 105: 15064–15069. DOI:10.1073/pnas.0803124105 |
| [37] | Amagase K, Kimura1 Y, Wada A, et al. Prophylactic effect of monosodium glutamate on NSAID-induced enteropathy in rats[J]. Curr Pharm Des, 2014, 20: 2783–2790. DOI:10.2174/13816128113199990579 |
| [38] | Camilleri M, Madsen K, Spiller R, et al. Intestinal barrier function in health and gastrointestinal disease[J]. Neurogastroenterol Motil, 2012, 24: 503–512. DOI:10.1111/nmo.2012.24.issue-6 |
| [39] | Turner JR. Intestinal mucosal barrier function in health and disease[J]. Nat Rev Immunol, 2009, 9: 799–809. DOI:10.1038/nri2653 |
| [40] | Jiao N, Wu ZL, Ji Y, et al. L-Glutamate enhances barrier and antioxidative functions in intestinal porcine epithelial cells[J]. J Nutr, 2015, 145: 2258–2264. DOI:10.3945/jn.115.217661 |
| [41] | Vermeulen MA, de Jong J, Vaessen MJ, et al. Glutamate reduces experimental intestinal hyperpermeability and facilitates glutamine support of gut integrity[J]. World J Gastroenterol, 2011, 17: 1569–1573. DOI:10.3748/wjg.v17.i12.1569 |
| [42] | Rezzani R, Corsetti G, Rodella L, et al. Cyclosporine-A treatment inhibits the expression of metabotropic glutamate receptors in rat thymus[J]. Acta Histochem, 2003, 105: 81–87. DOI:10.1078/0065-1281-00688 |
| [43] | Sturgill JL, Mathews J, Scherle P, et al. Glutamate signaling through the kainate receptor enhances human immunoglobulin production[J]. J Neuroimmunol, 2011, 233: 80–89. DOI:10.1016/j.jneuroim.2010.11.014 |
| [44] | Pacheco R, Oliva H, Martinez-Navıo JM. Glutamate released by dendritic cells as a novel modulator of T cell activation[J]. J Immunol, 2006, 177: 6695–6704. DOI:10.4049/jimmunol.177.10.6695 |
| [45] | Ruth MR, Field CJ. The immune modifying effects of amino acids on gut-associated lymphoid tissue[J]. J Anim Sci Biotechnol, 2013, 4: 27. DOI:10.1186/2049-1891-4-27 |
| [46] | Basivireddy J, Jacob M, Balasubramanian KA. Oral gluta-mine attenuates indomethacin-induced small intestinal dam-age[J]. Clin Sci (Lond), 2004, 107: 281–289. DOI:10.1042/CS20030390 |
| [47] | Fang YZ, Yang S, Wu GY. Free radicals, antioxidants, and nutrition[J]. Nutrition, 2002, 18: 872–879. DOI:10.1016/S0899-9007(02)00916-4 |
| [48] | Lin M, Zhang B, Yu CN, et al. L-Glutamate supplementation improves small intestinal architecture and enhances the expressions of jejunal mucosa amino acid receptors and transporters in weaning piglets[J]. PLoS One, 2014, 9: e111950. DOI:10.1371/journal.pone.0111950 |
| [49] | Zhang J, Yin YL, Shu XG, et al. Oral administration of MSG increases expression of glutamate receptors and transporters in the gastrointestinal tract of young piglets[J]. Amino Acids, 2013, 45: 1169–1177. DOI:10.1007/s00726-013-1573-2 |
| [50] | Amagase K, Nakamura E, Kato S, et al. Glutamate as a potential protective drug in the gastrointestinal mucosa[J]. J Pharm Soc Jpn, 2015, 135: 779–782. |
| [51] | Triebling AT, Korsten MA, Dlugosz JW, et al. Severity of helicobacter-induced gastric injury correlates with gastric juice ammonia[J]. Dig Dis Sci, 1991, 36: 1089–1096. DOI:10.1007/BF01297452 |
| [52] | Kohda K, Tanaka K, Aiba Y, et al. Role of apoptosis induced by Helicobacter pylori infection in the development of duodenal ulcer[J]. Gut, 1999, 44: 456–462. DOI:10.1136/gut.44.4.456 |
| [53] | Ding SZ, Minohara Y, Fan XJ, et al. Helicobacter pylori infection induces oxidative stress and programmed cell death in human gastric epithelial cells[J]. Infect Immun, 2007, 75: 4030–4039. DOI:10.1128/IAI.00172-07 |
| [54] | Kim SS, Ruiz VE, Carroll JD, et al. Helicobacter pylori in the pathogenesis of gastric cancer and gastric lymphoma[J]. Cancer Lett, 2011, 305: 228–238. DOI:10.1016/j.canlet.2010.07.014 |
| [55] | Palframan SL, Kwok T, Gabriel K. Vacuolating cytotoxin A (VacA), a key toxin for Helicobacter pylori pathogenesis[J]. Front Cell Infect Microbiol, 2012, 2: 1–9. |
| [56] | Mcguckin MA, Every AL, Skene CD, et al. Muc1 mucin limits both Helicobacter pylori colonization of the murine gastric mucosa and associated gastritis[J]. Gastroenterology, 2007, 133: 1210–1218. DOI:10.1053/j.gastro.2007.07.003 |
| [57] | Braun HS, Sponder G, Pieper G, et al. GABA selectively increases mucin-1 expression in isolated pig jejunum[J]. Genes Nutr, 2015, 10: 47. DOI:10.1007/s12263-015-0497-8 |
| [58] | Kawano S, Tsuji M, Fusamoto H, et al. Chronic effect of intragastric ammonia on gastric mucosal structures in rats[J]. Dig Dis Sci, 1991, 36: 33–38. DOI:10.1007/BF01300084 |
| [59] | Suzuki H, Yanaka Y, Muto H. Luminal ammonia retards restitution of guinea pig injured gastric mucosa in vitro[J]. Am J Physiol Gastrointest Liver Physiol, 2000, 279: G107–G117. |
| [60] | Daikhin Y, Yudkoff M. Compartmentation of brain glutamate metabolism in neurons and glia[J]. J Nutr, 2000, 130: 1026S–1031S. |
| [61] | Nakamura E, Hagen SJ. Role of glutamine and arginase in protection against ammonia-induced cell death in gastric epithelial cells[J]. J Physiol Gastrointest Liver Physiol, 2002, 283: G1264–G1275. DOI:10.1152/ajpgi.00235.2002 |
| [62] | Obayashi Y, Nagamura Y. Does monosodium glutamate really cause headache?:a systematic review of human studies[J]. J Headache Pain, 2016, 17: 54. DOI:10.1186/s10194-016-0639-4 |
| [63] | Brosnan JT, Drewnowski A, Friedman MI. Is there a relationship between dietary MSG obesity in animals or humans?[J]. Amino Acids, 2014, 46: 2075–2087. DOI:10.1007/s00726-014-1771-6 |
| [64] | Hien VT, Lam NT, Khan NC, et al. Monosodium glutamate is not associated with overweight in Vietnamese adults[J]. Public Health Nutr, 2013, 16: 922–927. DOI:10.1017/S1368980012003552 |
| [65] | Yoneda J, Chin K, Torii K, et al. Effects of oral monosodium glutamate in mouse models of asthma[J]. Food Chem Toxicol, 2011, 49: 299–304. DOI:10.1016/j.fct.2010.10.032 |
| [66] | Zhou Y, Yang M, Dong BR. Monosodium glutamate avoidance for chronic asthma in adults and children[J]. Cochrane Database Syst Rev, 2012, 6: CD004357. |
| [67] | Mahieu S, Klug M, Millen N, et al. Monosodium glutamate intake affect the function of the kidney through NMDA receptor[J]. Life Sci, 2016, 149: 114–119. DOI:10.1016/j.lfs.2016.02.023 |
| [68] | Zhu LL, Xu LC, Chen Y, et al. Poor awareness of preventing aspirin-induced gastrointestinal injury with combined protecttive medications[J]. World J Gastroenterol, 2012, 18: 3167–3172. DOI:10.3748/wjg.v18.i24.3167 |
| [69] | Murtaza G, Karim S, Najam-ul-Haq M, et al. Interaction analysis of aspirin with selective amimno acids[J]. Acta Pol Pharm, 2014, 71: 139–143. |
| [70] | Papastergiou V, Georgopoulos SD, Karatapanis S. Treatment of Helicobacter pylori infection:past, present and future[J]. World J Gastrointest Pathophysiol, 2011, 5: 392–399. |
 2017, Vol. 52
2017, Vol. 52


