血脑屏障 (blood brain barrier, BBB) 是维系脑部稳态的一把“双刃剑”, 能有效保护脑免受病原生物、毒性分子甚至机体自身免疫系统等侵扰, 但也能阻碍约98%以上治疗药物入脑, 极大地限制了药物从血液向脑内转运[1, 2]。如何高效跨越BBB成为脑部疾病治疗面临的重要挑战。为此, 药剂学研究者们提出了基于BBB特定受体介导递药系统入脑的策略, 其主要实现形式之一即是在适宜大小的递药系统表面修饰目标受体的相应配体, 通过配体-受体的识别触发胞吞转运, 上述所用配体常被称为导向分子, 主要包括多肽、抗体和适配体等。但天然构成的导向分子, 例如部分线性多肽, 可能面临体内稳定性问题, 过早被酶降解进而显著影响递药系统的入脑效率及其脑内分布。开发稳定型导向分子及其相关递药策略开始受到关注[3-5]。
分子印迹 (molecular imprinting) 是一种针对特定分子 (模板分子)“量身定制”能特异性识别该分子的高分子聚合物 (molecularly imprinted polymer, MIP) 的经典技术。其主要流程为:将模板分子与功能单体预先孵育形成预聚合物, 然后加入交联剂, 使得功能单体在模板分子周围交联形成聚合物, 再通过适宜溶剂将模板分子从聚合物中洗脱, 在聚合物上留下与原模板分子空间结构、尺寸大小等相匹配的“空穴”结构 (结合位点), 从而可以选择性地“捕获”模板分子。分子印迹具有广泛的应用前景, 上述模板分子既可以是小分子化合物, 也可以是生物大分子[6, 7]。如果以细胞膜上特定受体蛋白为识别对象, 分子印迹聚合物具有构建靶向递药系统的潜力。然而, 此类膜蛋白 (可溶性胞外区) 往往不易制备且成本高, 难以满足分子印迹对模板分子较大用量的需求。作者前期提出了一种构象表位印迹策略并取得较好效果, 即:设计与膜蛋白胞外区构象表位结构相似、核心序列一致的多肽, 以该多肽替代整体蛋白作为模板开展分子印迹, 印迹形成的“空穴”能够特异性识别膜蛋白及其所在细胞/组织[8]。鉴于该方法所得的印迹聚合物纳米粒 (molecularly imprinted polymeric nanoparticles, MIPNPs) 粒径大小适宜 (50 nm左右), 而聚合物表面的“空穴”结构稳定, 可视作一种稳定型“导向分子”, 设想通过分子印迹技术有可能制备得到新型脑靶向载体系统。
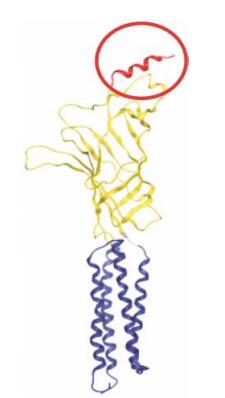
烟碱型乙酰胆碱受体 (nAChR) 是化学 (配体) 门控的离子通道蛋白, 由亚单位构成, 包括α1~7、α9~10、β1~4、γ、δ、ε等。通过亚单位的组合能形成具有不同药理学特征的受体亚型。nAChR可分为中枢型和外周型, α7是中枢神经系统中分布最多的受体亚型之一, 在血脑屏障的脑毛细血管内皮细胞上高度表达。大量研究发现, 给予尼古丁和其他烟碱受体激动剂后, nAChR可发挥一定的神经保护作用。近年来, 从自然界已有的nAChR α7结合蛋白 (如狂犬病毒蛋白、蛇毒蛋白等) 中筛选、设计多肽配体并介导药物入脑的研究已取得明显效果, 体现出nAChR α7作为脑靶向递药重要靶点的潜力[9-11]。有趣的是, nAChR α7胞外区暴露在外的N末端呈现明显的α螺旋 (图 1)[12], 这提示, 此段螺旋区域可作为识别整体受体的构象表位。基于此, 本研究旨在探索构建一种新型脑靶向递药系统, 通过印迹nAChR α7 N端特定表位来实现对该受体及其所在细胞特异性结合, 并对所得印迹聚合物纳米载体的体内外靶向性进行初步评价。
|
Figure 1 A homology model of the bovine α7 nAChR based in a refined model of the Torpedo nAChR[12]. The N-terminal α-helix at the top is shown in red |
药品与试剂 丙烯酰胺 (AAM)、N, N '-亚甲基双丙烯酰胺 (BIS)、N-(3-氨基丙基) 甲基丙烯酰胺盐酸盐[N-(3-aminopropyl) methacrylamide monohydro chloride, APMA]、过硫酸铵 (APS)、N, N, N, N '-四甲基乙二胺 (TEMED)、异硫氰酸荧光素 (FITC)、罗丹明B (rodamine B, RhB) 均购自阿拉丁试剂有限公司; IR783 (2-[2-[2-chloro-3-[2-[1, 3-dihydro-3, 3-dimethyl-1-(4-sul fobutyl)-2H-indol-2-ylidene]-ethylidene]-1-cyclohexen-1-yl]-ethenyl]-3) 购自北京泛博生物化学有限公司; 胎牛血清购自美国Gibco公司, 其他试剂均为分析纯。bEND.3细胞和A549细胞均购自南京凯基生物科技发展有限公司。细胞用含10%胎牛血清的DMEM高糖培养基, 于37 ℃、5% CO2条件下连续培养。Balb/c裸鼠[体重 (20±1.0) g, 雌性]由成都达硕实验动物有限公司提供。
仪器 MOS-500圆二色谱 (Bio-Logic, 法国); 激光粒度及zeta电位分析仪 (Nano ZS, 英国马尔文公司); FEI Tecnai G20高分辨透射电镜 (FEI, 美国); 荧光倒置显微镜 (IX-73, 日本奥林巴斯公司); BLO-RAD MODEL 680酶标仪 (北京成志科为生物科技有限公司); NovoCyte流式细胞仪 (艾森生物有限公司); 小动物活体成像系统 (FX PRO, 美国Bruker公司)。
多肽的表征 多肽经固相合成及纯化制得。其氨基酸序列为: EFQRKLYKELVK (EFQ多肽)。配制EFQ多肽浓度为50 µmol·L-1溶液, 置于半径0.1 cm的测量皿中测定圆二色性。波长扫描范围为190~250 nm, 扫描速度和分辨率分别为10 nm·min-1和1 nm。
纳米粒的制备与表征 称取AAM 35 mg、BIS 11 mg和APMA 1 mg超声溶于3.0 mL纯水中, EFQ多肽0.8 mg超声溶解到2.0 mL三氟乙醇中, 两者混合后于室温下磁力搅拌0.5 h使其形成预聚合物。然后, 在N2条件下依次加入6% (w/v) APS溶液100 μL和TEMED 10 μL引发聚合, 在室温下持续搅拌反应24 h。反应结束后, 加入适量无水乙醇使纳米粒聚集沉淀, 并用无水乙醇反复洗涤、离心 (8 000 r·min-1, 20 min) 4次, 除去模板分子和未反应的单体。经洗涤后纳米粒用纯水分散并通过Sephadex G-50凝胶柱洗脱后, 冻干即得到印迹聚合物纳米粒 (MIPNPs)。非印迹纳米粒 (NIPNPs) 制备方法相同, 只是前者以多肽作为模板分子, 而后者制备时不加任何模板分子。以同样的方法制备包载荧光探针的纳米粒 (RhB或IR783) 用于后续实验。用激光散射粒度仪测定纳米粒的粒径及其分散情况, 并用透射电镜 (TEM) 观察纳米粒的外观形态。
纳米粒与多肽相互作用的检测 利用荧光偏振法 (fluorescence polarization, FP) 测定纳米粒与多肽分子的相互作用, 其FP值 (P) 计算公式: P=(IⅡ-IⅠ) / (IⅡ + IⅠ), 其中IⅡ为水平荧光强度, IⅠ为垂直荧光强度。滤光片激发和发射波长分别为: λex=485 nm, λem=535 nm。
将纳米粒溶于纯水中, 分别与适量FITC标记的EFQ多肽溶液 (含三氟乙醇) 混合均匀后孵育, 于不同时间点分别取样, 通过酶标仪测定P, 确定平衡时间。配置一系列不同浓度的纳米粒溶液, 将FITC标记的多肽溶液分别与之混合均匀, 在室温下吸附达平衡后, 通过酶标仪测定P, 并通过GraphPad Prism 5软件计算Kd。
细胞对纳米粒的摄取 将细胞数以每孔5×104个铺于24孔培养板中培养过夜。将包载RhB的纳米粒 (16 g·L-1, 50 μL) 加入到培养板中, 加入相同体积的磷酸盐缓冲溶液 (PBS) 设为对照组, 每组设8孔。避光孵育2 h后, 吸出培养基, PBS清洗3次。同一组实验中, 选4孔于37 ℃加4%多聚甲醛固定30 min, PBS清洗3次, 加入DAPI染色5 min, PBS清洗3次, 于荧光倒置显微镜下观察; 其余4孔用胰酶消化后, PBS清洗3次, 重新分散在培养基中, 通过流式细胞仪测定Nil的荧光强度。选用激发波长为488 nm, 发射波长为530 nm。
体内靶向性考察 将包载IR783近红外荧光探针的纳米粒经尾静脉注射 (100 μL, 10 mg·kg-1) 后[13], 分别在2、4、6、8和12 h进行活体荧光成像检测 (激发波长为720 nm, 发射波长为790 nm)。在注射12 h后, 解剖小鼠, 收集脑、心、肝、脾、肺、肾和脊髓, 检测离体器官的荧光分布情况。
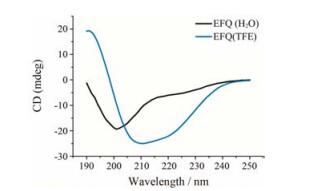
结果与讨论 1 印迹条件的选择及纳米粒的制备尽管EFQ多肽在nAChRα7中呈α螺旋结构, 但当单独合成此段线性多肽后, 其在水溶液中变得无序 (图 2), 这说明脱离了整体蛋白的环境, 该多肽仅靠自身难以维持特定构象, 无法发挥构象表位的功能。在前期研究中, 将目标多肽中的核心氨基酸“嫁接”到一条支架多肽 (scaffold) 上, 该支架多肽本身具有经多对二硫键固定的、与目标序列天然构象类似的特定结构, 这使得“嫁接”后的产物能较好地替代原始序列作为分子印迹的模板[8]。但实现这一过程并非易事, 涉及支架多肽的选择、“嫁接”位点的确定等。是否存在更为简易的方法来维持目标多肽的高级结构?实际上, 线性多肽的结构容易受到外界环境的影响, 如有机溶剂、酸碱度和金属离子等都有可能调控线性多肽的结构[14-16]。三氟乙醇是一种常见的α螺旋诱导剂, 通过促进多肽分子内氢键形成来诱导形成有序的二级结构[17]。如图 2所示, 当三氟乙醇含量达到40%时, EFQ多肽的圆二色谱在208和220 nm处出现双峰, 并且双峰为负值, 呈右旋α螺旋结构, 表明在该条件下EFQ多肽被诱导成与天然状态相似的构象表位。
|
Figure 2 Circular dichroism (CD) spectrum of EFQRKLYKELVK (EFQ) peptide in 40% tetrafluoroethylene (TFE) or water at 25 ℃ |
理论上, 三氟乙醇的含量越高, 多肽经诱导形成的α螺旋结构的比例越高。但有机溶剂的过多引入会对丙烯酰胺类单体的交联反应造成不利影响。本实验采用40%三氟乙醇的条件较好地兼顾了多肽诱导效果和交联反应速度两方面。
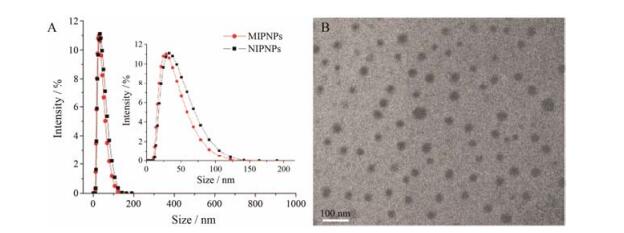
2 纳米粒的表征经粒度仪测定, MIPNPs和NIPNPs的平均粒径分别为42.1±4.3 nm和43.5±5.1 nm, 多分散指数 (PDI) 分别为0.195±0.018和0.203±0.024 (图 3A)。表明本印迹方法制得的纳米粒粒径大小适宜、分散性好, 且模板分子的加入未对纳米粒的粒径及其分布产生影响。经透射电镜观察 (图 3B) 发现所得印迹纳米粒形态圆整、分布均匀, 与激光粒度仪检测结果一致。
|
Figure 3 The characterization of nanoparticles (NPs). A: The particle size and distribution of NPs determined using dynamic light scattering (DLS). B: Transmission electron microscopy image of molecularly imprinted polymeric nanoparticles (MIPNPs). NIPNPs: Non-imprinted nanoparticles |
荧光偏振技术是一种测定分子-分子间相互作用的常用方法, 其基本原理是:荧光标记的物质在环境中旋转时, 偏振荧光的强度与分子的旋转程度呈负相关。大分子物质旋转慢, 发出的偏振荧光强; 小分子物质旋转快, 其偏振荧光弱。聚合物纳米粒可视为“超大”分子体系, 当荧光标记的多肽与其结合时, 偏振荧光值会发生显著变化, 因此, 荧光偏振十分适合表征多肽与纳米粒之间的相互作用。
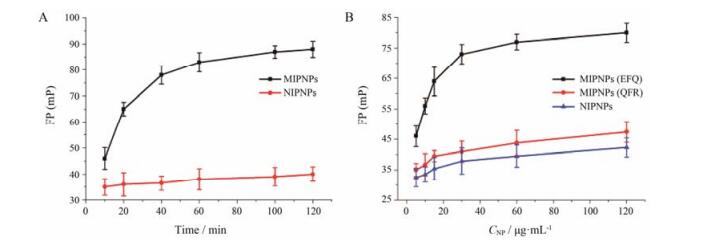
本实验中, 首先确定表位多肽与纳米粒结合的饱和孵育时间。如图 4A显示, 随着时间增加, MIPNPs对多肽的结合量逐渐增加 (荧光偏振值逐渐升高), 在2 h后达到平衡, 结合曲线趋于平稳, 而NIPNPs与FIFC标记EFQ多肽结合后的荧光偏振值变化较小。进一步设置不同浓度的纳米粒与相同浓度的多肽进行孵育至平衡, 测定荧光偏振值。结果 (图 4B) 表明, MIPNPs对EFQ多肽有明显的特异性“捕获”能力, 显著强于NIPNPs, 而印迹乱序肽 (QFREKYLEKVLK) 的纳米粒则对EFQ多肽几无结合。基于文献[18]报道聚丙烯酰胺类纳米粒的密度范围大致为0.08 < ρ < 0.27, 可近似拟合MIPNPs表观结合常数Kd值为14.8~50.0 nmol·L-1。
|
Figure 4 Fluorescence-polarization (FP) analysis of direct binding between NPs and FITC-labeled peptide. A: Determination of the equilibrium time required for the association of NPs with EFQ. B: Direct binding between NPs and peptides. EFQ: EFQRKLYKELVK peptide; QFR: QFREKYLEKVLK peptide |
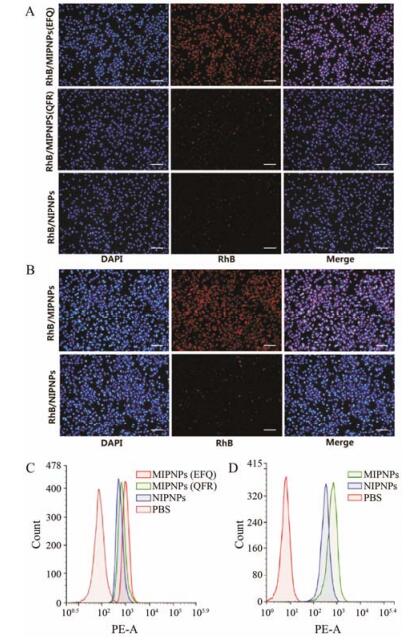
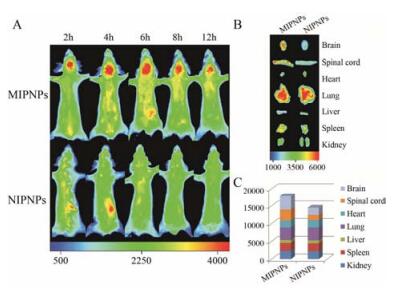
bEnd.3脑微血管内皮细胞株是常用的血脑屏障靶细胞模型, 其表达nAchR α7受体[10]。分别经流式细胞术定量和荧光倒置显微镜定性检测, 结果显示, bEnd.3细胞 (图 5A) 对MIPNPs的摄取显著高于NIPNPs (前者摄取量为后者的2.01倍), 而印迹乱序肽的纳米粒摄取效果不明显, 这表明经构象表位印迹制备得到的MIPNPs能有效介导靶细胞摄取纳米粒并具有特异选择性。同样的趋势也反映在高表达nAchR α7受体的A549细胞摄取实验上[9]。图 5D显示, A549细胞对MIPNPs的摄取量达到NIPNPs的2.56倍。进一步体内活体成像实验 (图 6) 表明, MIPNPs在观察期的各个时间点内, 其脑部的蓄积程度均明显高于NIPNPs, 初步体现出MIPNPs具有较好的主动靶向性。
|
Figure 5 Evaluation of in vitrotargeting ability. A: Fluores cence images of NPs uptake by bEnd.3 cells (bar=100 μm). B: Fluorescence images and of NPs uptake by A549 cells (bar=100 μm). Flow cytometric analysis of NPs uptake by bEnd.3 cells (C) and A549 cells (D). RhB/MIPNPs: RhB loaded MIPNPs |
|
Figure 6 Evaluation of in vivotargeting ability. A: In vivo NP distribution in nude mice at the indicated time points. B: Fluo rescence images of major organs ex vivoat 12 h post-injection. C: Semi-quantitative results obtained using ex vivo fluorescence images |
本文应用分子印迹技术设计并初步制备了一种具有脑靶向性的印迹聚合物载体系统, 其对靶受体构象表位多肽具有较强的亲和力, 能有效识别靶细胞及体内靶组织, 具有进一步深入研究和应用的潜力。
| [1] | Chen Y, Liu L. Modern methods for delivery of drugs across the blood-brain barrier[J]. Adv Drug Deliv Rev, 2012, 64: 640–665. DOI:10.1016/j.addr.2011.11.010 |
| [2] | Patabendige A, Skinner RA, Abbott NJ. Establishment of a simplified in vitro porcine blood-brain barrier model with high transendothelial electrical resistance[J]. Brain Res, 2013, 1521: 1–15. DOI:10.1016/j.brainres.2012.06.057 |
| [3] | Wei X, Zhan C, Shen Q, et al. A D-peptide ligand of nico-tine acetylcholine receptors for brain-targeted drug delivery[J]. Angew Chem Int Ed Engl, 2015, 54: 3023–3027. DOI:10.1002/anie.201411226 |
| [4] | Taylor EM, Otero DA, Banks WA, et al. Retro-inverso prosaptide peptides retain bioactivity, are stable in vivo, and are blood-brain barrier permeable[J]. J Pharmacol Exp Ther, 2000, 295: 190–194. |
| [5] | Prades R, Oller-Salvia B, Schwarzmaier SM, et al. Applying the retro-enantio approach to obtain a peptide capable of overcoming the blood-brain barrier[J]. Angew Chem, 2015, 127: 4039–4044. DOI:10.1002/ange.201411408 |
| [6] | Vlatakis G, Andersson LI, Müller R, et al. Drug assay using antibody mimics made by molecular imprinting[J]. Nature, 1993, 361: 645–647. DOI:10.1038/361645a0 |
| [7] | Hawkins DM, Trache A, Ellis EA, et al. Quantification and confocal imaging of protein specific molecularly imprinted polymers[J]. Biomacromolecules, 2006, 7: 2560–2564. DOI:10.1021/bm060494d |
| [8] | Zhang Y, Deng C, Liu S, et al. Active targeting of tumors through conformational epitope imprinting[J]. Angew Chem Int Ed Engl, 2015, 54: 5157–5160. DOI:10.1002/anie.v54.17 |
| [9] | Mei D, Lin ZQ, Fu JJ, et al. The use of α-conotoxin ImI to actualize the targeted delivery of paclitaxel micelles to α7 nAChR-overexpressing breast cancer[J]. Biomaterials, 2015, 42: 52–65. DOI:10.1016/j.biomaterials.2014.11.044 |
| [10] | Zhan C, Li B, Hu L, et al. Micelle-based brain-targeted drug delivery enabled by a nicotine acetylcholine receptor ligand[J]. Angew Chem Int Ed Engl, 2011, 50: 5482–5485. DOI:10.1002/anie.201100875 |
| [11] | Kumar P, Wu H, McBride JL, et al. Transvascular delivery of small interfering RNA to the central nervous system[J]. Nature, 2007, 448: 39–43. DOI:10.1038/nature05901 |
| [12] | Castillo M, Mulet J, Aldea M, et al. Role of the N-terminal α-helix in biogenesis of α7 nicotinic receptors[J]. J Neurochem, 2009, 108: 1399–1409. DOI:10.1111/jnc.2009.108.issue-6 |
| [13] | Deng CY, Long YY, Liu S, et al. Construction of biotin-modified polymeric micelles for pancreatic cancer targeted photodynamic therapy[J]. Acta Pharm Sin (药学学报), 2015, 50: 1038–1044. |
| [14] | Li X, Suzuki K, Kashiwada A, et al. Soft metal ions, Cd (II) and Hg (II), induce triple-stranded α-helical assemblyand folding of a de novo designed peptide in their trigonal geometries[J]. Protein Sci, 2000, 9: 1327–1333. DOI:10.1110/(ISSN)1469-896X |
| [15] | Loo JA, Loo RR, Udseth HR, et al. Solvent-induced conformational changes of polypeptides probed by electrospray-ionization mass spectrometry[J]. Rapid Commun Mass Spectrom, 1991, 5: 101–105. DOI:10.1002/(ISSN)1097-0231 |
| [16] | Mutter M, Gassmann R, Buttkus U, et al. Switch peptides:pH-induced α-helix to β-sheet transitions of bis-amphiphilic oligopeptides[J]. Angew Chem Int Ed Engl, 1991, 30: 1514–1516. DOI:10.1002/(ISSN)1521-3773 |
| [17] | Roccatano D, Colombo G, Fioroni M, et al. Mechanism by which 2, 2, 2-trifluoroethanol/water mixtures stabilize secon-dary-structure formation in peptides:a molecular dynamics study[J]. Proc Natl Acad Sci U S A, 2002, 99: 12179–12184. DOI:10.1073/pnas.182199699 |
| [18] | Hoshino Y, Kodama T, Okahata Y, et al. Peptide imprinted polymer nanoparticles:a plastic antibody[J]. J Am Chem Soc, 2008, 130: 15242–15243. DOI:10.1021/ja8062875 |
 2017, Vol. 52
2017, Vol. 52


