肿瘤的早期诊断便于人们及早地发现肿瘤, 对肿瘤的治疗具有极其重要的意义。在众多的肿瘤诊断方法中, 磁共振成像 (magnetic resonance imaging, MRI) 不仅具有较高的空间分辨率, 还能够提供高质量的软组织任意断面3D成像信息[1, 2], 现已成为一种临床常见的肿瘤诊断成像技术。根据作用机制的不同, 常见的磁共振成像造影剂可以分为两大类:顺磁性造影剂和超顺磁性造影剂。目前, 基于钆 (Gd) 的螯合物是临床上常用的顺磁性造影剂[3], 但该类造影剂在使用时具有明显不足之处, 主要体现为体内滞留时间短、分布无特异性、毒性较大且难以进入病变细胞等[4, 5]。作为一种新型的造影剂, 超顺磁性氧化铁很大程度上弥补了上述不足, 其进入体内后, 主要集中在网状内皮细胞丰富的肝、脾和骨髓等组织和器官[6], 从而提高该部位与周围组织的MRI成像对比度。
在众多的氧化铁纳米材料中, Fe3O4纳米粒由于其易于制备、价格低廉且尺寸可控等特点, 已引起了研究者的极大兴趣。其独特的理化性质, 使其在细胞分离[7, 8]、靶向药物传递[9, 10]、肿瘤热疗[11]和磁共振成像[12, 13]等生物应用中发挥出巨大潜能。作为磁共振成像造影剂, Fe3O4纳米粒能够有效缩短氢质子的横向弛豫时间 (T2), 削弱T2信号强度, 使靶组织或器官图像变暗, 从而在磁共振成像中提供高质量的成像对比图。此外, Fe3O4纳米粒不仅在生物环境中显示出长期的稳定性, 还在细胞毒性和溶血实验中展现出较低的毒性和良好的生物相容性[14-17]。这些优点使得Fe3O4纳米粒成为磁共振成像中最具有发展前景的造影剂之一。
光热成像 (photothermal imaging) 是一种非破坏性的成像技术, 因其信号响应主要由局部温度变化引起, 使得光热成像具有较高的灵敏度和较低的背景噪声[18]。光热成像中光热剂的使用, 可以改变靶部位与周围环境的温度差, 从而提高成像对比度。最新研究发现, Fe3O4纳米粒可以作为一种新型的、靶向性的和低毒的光热剂, 它在近红外光照射下, 能将吸收的光能转换为热能, 从而实现对肿瘤部位的光热成像[19, 20]。本文制备了亲水性Fe3O4纳米粒, 对其形貌及磁性进行了表征, 考察了Fe3O4纳米粒的细胞毒性、细胞摄取及体内分布, 并通过体内外实验研究了其在磁共振及光热双模式成像中的应用。
材料与方法试剂 六水合三氯化铁[iron (III) chloride hexa hydrate, FeCl3·6H2O]、乙二醇 (ethylene glycol, EG)、三水合醋酸钠 (sodium acetate trihydrate, NaAc·3H2O)、柠檬酸三钠、无水乙醇 (国药化学试剂有限公司); 盐酸多柔比星 (doxorubicin hydrochloride, DOX, 北京华奉联博科技有限公司); 吲哚菁绿 (indocyanine green, ICG, 百灵威科技有限公司); 四甲基偶氮唑蓝 (methyl thiazoyl terazolium, MTT)、Hoechst 33342染料 (Sigma-Aldrich公司); LysoGreen染料 (江苏凯基生物技术股份有限公司); 人乳腺癌MCF-7细胞、鼠肉瘤S180细胞 (中国科学院上海生化与细胞研究所); Dulbecco’s modified eagle medium (DMEM) 细胞培养基 (赛默飞世尔生物化学制品有限公司); 胚胎牛血清 (杭州四季青生物科技有限公司); 其他试剂均为分析纯, 所有实验用水均为去离子超纯水。
仪器 紫外可见分光光度计 (TU-1800PC, 北京普析通用仪器有限公司); 透射电子显微镜 (Tecnai 12, 荷兰Philips公司); 振动样品磁强计 (VSM-7410, 美国LakeShore公司); 可调808 nm半导体激光器 (LDD 808-2000G3, 西安赫胥尔镭得激光科技有限公司); 红外热成像仪[testo 875-1i, 德图仪器国际贸易 (上海) 有限公司]; 磁共振成像仪 (Skyra 3.0 T, 德国Simens公司); 二氧化碳培养箱 (MCO-18AC, 松下健康医疗器械株式会社); 酶标仪 (Spectra max 190, 美国MD公司); 激光共聚焦显微镜 (TCS SP5 II, 德国Leica公司); 小动物活体成像仪 (Maesto, 美国Cri公司)。
实验动物 清洁级ICR雄性小鼠 (4~5周, 20±2 g) 购于江苏大学实验动物中心, 合格证号: SCXK (苏) 2013-0011。其使用符合“实验动物的护理和使用指南”所规定的条例。
水分散性Fe3O4纳米粒的制备 采用水热法制备水分散性Fe3O4纳米粒[21]。制备方法如下:精密称取FeCl3·6H2O 0.473 g、柠檬酸三钠0.40 g溶于70 mL EG, 在搅拌下加入NaAc·3H2O 3.854 g, 强烈搅拌30 min, 待完全溶解后移入100 mL聚四氟乙烯高压反应釜中, 密封反应釜于200 ℃反应12 h。自然冷却至室温, 所得黑色产物用无水乙醇和去离子水洗涤若干次 (磁性分离), 最后将样品分散于去离子水中保存备用。
荧光标记的Fe3O4纳米粒的制备 分别采用DOX及ICG标记Fe3O4纳米粒。Fe3O4-DOX制备方法如下:将DOX (1 mg·mL-1) 1 mL加入到2 mL Fe3O4 (2 mg·mL-1) 水溶液中搅拌过夜。离心除去过量的DOX, 用pH 7.4的磷酸盐缓冲液 (phosphate buffer saline, PBS) 洗涤至上清液无色。合并上清并定容, 采用紫外分光光度计测其在480 nm波长处的吸光度, 计算其载药量。样品再分散于4 ℃ PBS溶液中备用。Fe3O4-ICG的制备方法与Fe3O4-DOX相似, 即将等体积的ICG (100 μg·mL-1) 与Fe3O4 (1 mg·mL-1) 水溶液混合搅拌过夜。离心洗涤除去未吸附的ICG, 并测定其上清液在780 nm波长处的吸光度以计算载药量, 最后保存在4 ℃ PBS溶液中备用。
Fe3O4纳米粒的表征 采用TEM观察Fe3O4纳米粒的形貌。取已制备适宜浓度的样品, 超声5 min后, 用滴管吸取少量溶液滴加到TEM专用的镀碳支持膜上, 干燥后置于TEM仪器下观察。采用NanoMeasurer 1.2软件随机在TEM图上选取150个粒子统计后得纳米粒的粒径分布。采用VSM测定样品干燥粉末在-10~10 kOe的磁滞回线。此外, 在样品溶液的侧壁放置一块强磁铁, 观察磁铁对样品的吸附特性。
体外磁共振成像 将Fe3O4纳米粒配制成浓度为0~0.8 mmol·L-1的水溶液, 整齐排列在试管架上。采用磁共振成像仪获得T2加权的磁共振图像, 并记录T2值。参数设置:重复时间 (TR)=2 000 ms, 视野 (FOV)=200 mm, 回波时间 (TE)=40 ms。以Fe离子浓度为横坐标, 1/T2值为纵坐标, 绘制线性图。
体外光热效果 将Fe3O4纳米粒配置成质量浓度为60 μg·mL-1的水溶液, 取0.5 mL于离心管中, 用808 nm近红外激光 (2 W·cm-2) 照射8 min, 每隔2 min用红外热像仪获取样品溶液的光热成像图片。此外, 为了研究光热效果与Fe3O4纳米粒浓度的关系, 配制了一系列不同质量浓度 (30、60、125及250 μg·mL-1) 的Fe3O4水溶液, 在同样的实验条件下, 采用电热偶每隔1 min测定并记录温度, 绘制升温曲线。
细胞摄取 取对数生长期的MCF-7细胞, 用胰蛋白酶消化后制成细胞悬浮液, 按照每孔5×104个细胞接种于内含盖玻片的6孔板中, 然后置于37 ℃、含5% CO2的细胞培养箱中培养。待24 h细胞贴壁后, 分别用1 mL含DOX或Fe3O4-DOX的新鲜培养液替换原培养液, 质量浓度为10 μg·mL-1 (以DOX计, Fe3O4对DOX的平均载药量为5.54%)。继续培养0.5或1 h后吸出培养液, 并用PBS洗涤3遍。先后用LysoGreen (1 μmol·L-1, 30 min) 和Hoechst 33342 (10 μg·mL-1, 15 min) 染色。PBS洗涤3遍后, 加入4%多聚甲醛固定30 min, PBS洗涤后取出盖玻片用树脂封片, 最后置于激光共聚焦显微镜下观察。
细胞毒性评价 采用MTT法考察Fe3O4纳米粒的细胞毒性。取对数生长期的MCF-7细胞, 按照每孔5×103个细胞接种于96孔板中, 然后置于37 ℃、含5% CO2的细胞培养箱中培养。24 h后, 用100 μL含不同质量浓度 (10、20、50、100、200、500和1 000 μg·mL-1) Fe3O4纳米粒的新鲜培养液替换原培养液, 继续培养24 h。再次吸出培养液, 并用PBS洗涤3遍, 之后每孔各加入MTT (1 mg·mL-1) 100 μL培养4 h后移去。每孔加入二甲基亚砜150 μL, 震荡10 min后, 采用酶标仪测定每孔在570 nm处吸光度值。每个浓度设置6个复孔, 实验重复3次。
荷瘤小鼠体内组织分布研究 将对数生长期的S180细胞用胰蛋白酶消化后制成细胞悬浮液 (每毫升2.5×106个), 取0.5 mL腹腔注射入小鼠体内, 等待数天后腹水形成。吸出腹水, 无菌PBS稀释3倍后, 取100 μL皮下注射入小鼠的腋窝, 饲养1周后S180荷瘤小鼠模型建成。将荷瘤小鼠随机分成2组, 分别尾静脉注射游离ICG或Fe3O4-ICG, 给药剂量为2 mg·kg-1 (浓度以ICG计, Fe3O4对ICG的平均载药量为6.81%)。分别在注射6、12和24 h处死小鼠, 取出心、肝、脾、肺、肾和肿瘤等组织, PBS洗涤后用小动物活体成像系统拍照并测定其荧光强度。
体内磁共振成像及光热成像 荷瘤小鼠随机分成2组, 分别尾静脉注射200 μL生理盐水或Fe3O4溶液 (5 mg·mL-1)。将适宜大小的纽扣磁铁固定在肿瘤部位, 体内成像研究在给药24 h后进行。将小鼠麻醉后, 采用配备有小动物成像线圈的3.0 T医用磁共振扫描仪对小鼠进行磁共振成像, 并记录肿瘤部位T2信号值。对于近红外光热成像, 则将小鼠麻醉后, 采用808 nm激光 (2 W·cm-2) 照射3 min, 在此过程中用红外热像仪对小鼠进行成像。
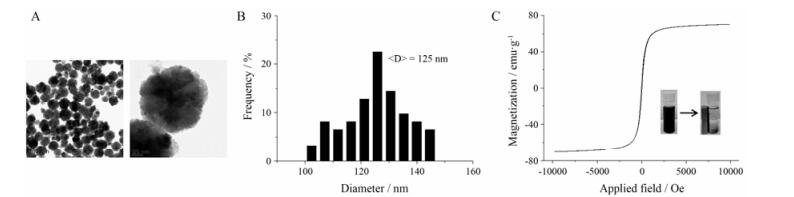
结果与讨论 1 Fe3O4纳米粒的表征利用TEM对所制备的Fe3O4纳米粒的结构和形貌特征进行表征。由图 1A可以看出, 水溶性Fe3O4纳米粒外观呈球形, 具有良好的均一性和分散性。NanoMeasurer1.2软件统计得到的粒径分布结果如图 1B所示, 其平均粒径约为125 nm。Fe3O4纳米粒在-10~10 kOe磁场强度内的磁化曲线如图 1C所示, 从图中可以看出, 该Fe3O4纳米粒具有较高的饱和磁化强度, 为70.30 emu·g-1。其剩磁和矫顽力都极低, 曲线几乎过原点, 说明该磁性纳米粒在室温下表现出超顺磁性, 这是因为本实验水热法合成的磁性纳米粒是由许多5~10 nm的初级磁纳米晶体组成的[21]。此外, Fe3O4纳米粒在无外加磁场时, 能够稳定地分散于水中, 当在溶液瓶旁侧立一块强磁铁后, 可以观察到粒子能够快速地被强磁铁吸附在瓶壁有磁场一侧, 如图 1C插图所示, 说明该Fe3O4纳米粒具有良好的磁性。
|
Figure 1 Characterization of the as-synthesized Fe3O4 nanoparticles. TEM images (A) and size distribution (B) of Fe3O4 nanoparti cles, the average size was obtained by measuring about 150 particles randomly selected from the TEM images. (C) Normalized field-dependent magnetization curves at room temperature for the Fe3O4 nanoparticles. Inset: photographs of the nanoparticles suspendsion without or with a magnet |
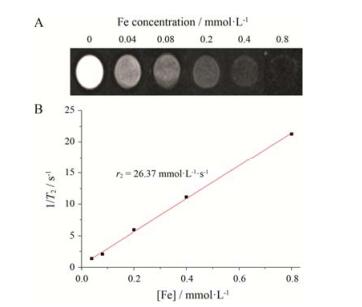
通过体外磁共振成像来研究所合成的Fe3O4纳米粒作为T2类磁共振成像造影剂的可能性, 结果如图 2所示。从图 2A可以看出, 随着Fe3O4纳米粒浓度的增大, 磁共振信号强度显著降低, 反映在图像上为磁共振成像目标区域越来越黑。此外, 将1/T2值与Fe离子浓度进行线性拟合, 结果如图 2B所示, 1/T2与Fe离子浓度具有良好的线性关系。直线的斜率即为横向弛豫率 (r2), 为26.37 mmol·L-1s-1, 说明该Fe3O4纳米粒具有良好的体外磁共振成像性能, 可以作为体外T2加权的MRI造影剂。
|
Figure 2 In vitro magnetic resonance response of Fe3O4 nanoparticles. (A) T2-weighted MR images of Fe3O4 nanoparti cles in aqueous solution with various concentrations. (B) T2 relaxation rate (1/T2, s-1) of Fe3O4 nanoparticles as a function of Fe concentration (mmol·L-1), the slope indicated the specific relaxivity (r2) |
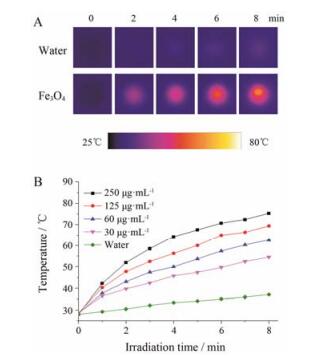
采用808 nm激光器 (2 W·cm-2, 8 min) 照射Fe3O4纳米粒的水溶液, 研究Fe3O4纳米粒的体外光热转换性能。图 3A表示水与Fe3O4水溶液 (60 μg·mL-1) 的光热成像图, 随着照射时间的延长, Fe3O4水溶液的光热成像图越来越亮, 即温度越来越高。作为对照, 水的光热成像图则明显比Fe3O4暗, 说明Fe3O4纳米粒具有良好的光热性能。此外, 还研究了Fe3O4纳米粒的光热转换性能与Fe3O4浓度的关系, 如图 3B所示。照射8 min后, 当Fe3O4纳米粒的质量浓度从30 μg·mL-1增加到250 μg·mL-1, 其溶液的温度从55 ℃增大到75 ℃, 说明Fe3O4纳米粒的光热转换性能与其浓度成正相关。而对照组水在同样条件下, 温度仅上升了9 ℃。以上结果说明, Fe3O4具有良好的近红外吸收性质, 能将光能转换为热能, 可以作为新型光热材料进行深入研究。
|
Figure 3 Photothermal effect of Fe3O4 nanoparticles induced by continuous NIR laser irradiation (808 nm, 2 W·cm-2). (A) In vitro photothermal images of water and Fe3O4 suspension (60 μg·mL-1) as a function of irradiation time. (B) Photothermal heating curves of water and Fe3O4 suspensions at various concentrations as a function of irradiation time |
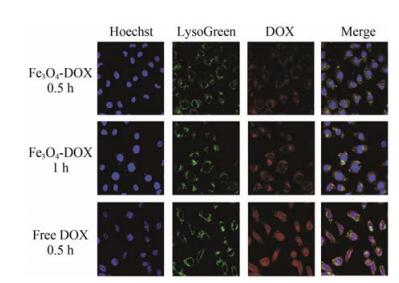
DOX是一种常用的肿瘤治疗药物, 其本身带有荧光。本文采用DOX标记了Fe3O4纳米粒, 并通过观察DOX的荧光来研究MCF-7细胞在不同时间点对Fe3O4-DOX的摄取情况。如图 4所示, 红色荧光是DOX发出的特征荧光, 蓝色荧光是细胞核染料Hoechst 33342产生的特征荧光, 绿色荧光是溶酶体染料LysoGreen产生的特征荧光。从图中可以看出, 孵育0.5 h后, Fe3O4-DOX处理组的细胞中出现红色荧光, 表明Fe3O4-DOX已经进入细胞。随着孵育时间延长至1 h, 细胞中红色荧光更强, 说明更多的Fe3O4-DOX被细胞摄取, MCF-7细胞对Fe3O4-DOX的摄取存在时间依赖性。关于细胞内定位, 游离DOX在孵育0.5 h后已经大量进入细胞核, 而Fe3O4-DOX则在孵育1 h后也仅能存在于细胞质中。以上结果表明, 本实验合成的Fe3O4纳米粒可以被肿瘤细胞摄取。
|
Figure 4 Cellular uptake of Fe3O4-DOX and free DOX in MCF-7 cells. Red: DOX fluorescence; Blue: Hoechst 33342 staining of nuclei; Green: LysoGreen staining of lysosome. DOX: Doxorubicin hydrochloride |
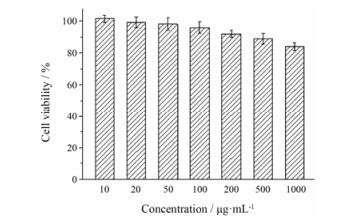
采用MTT法研究了Fe3O4纳米粒对MCF-7细胞的毒性作用, 结果见图 5。从图中可见, 经过24 h孵育后, MCF-7细胞的存活率随着Fe3O4纳米粒浓度的增加而有所下降。但是, 各浓度下MCF-7细胞的存活率都未见显著降低, 当Fe3O4的浓度小于200 μg·mL-1时, 其存活率均在90%以上, 而当浓度提高至5倍, 依然表现出近85%的细胞存活率, 说明该Fe3O4纳米粒具有良好的生物相容性, 能够用于后续的体内研究。
|
Figure 5 Cell viability of MCF-7 cells incubated with different concentrations of Fe3O4 nanoparticles for 24 h |
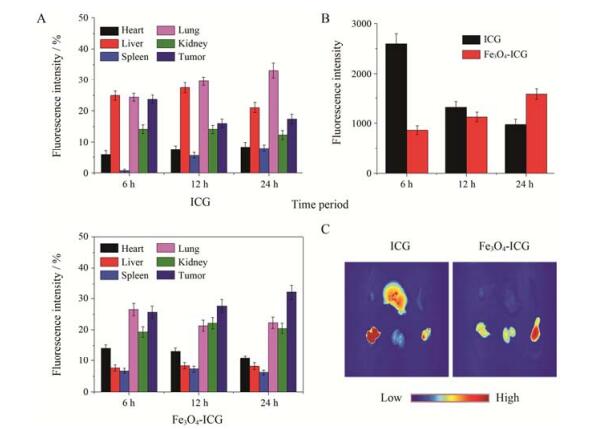
进行体内肿瘤成像的前提是造影剂能够在肿瘤内富集, 因此有必要对Fe3O4纳米粒在体内的组织分布情况进行研究。ICG是美国食品药品监督管理局 (FDA) 批准临床使用的一种近红外荧光染料, 具有较高的体内应用安全性[22]。本文采用ICG标记Fe3O4纳米粒, 并通过检测ICG的信号强度来研究Fe3O4纳米粒在荷瘤小鼠体内的组织分布情况。各小鼠以每个组织荧光强度占所有组织总荧光强度的比值作图。如图 6A所示, 尾静脉注射后6~24 h之间, Fe3O4-ICG主要分布于肺、肾脏及肿瘤等部位, 而对照组ICG主要分布于肝脏、肺及肿瘤等部位。图 6B表示不同时间点肿瘤部位的荧光强度, 游离ICG在注射6 h后即可在肿瘤部位达到其最大值, 但是随着时间的延长逐渐从瘤内被清除。而Fe3O4-ICG则随着时间的延长逐渐在肿瘤部位富集。图 6C为注射24 h后的离体组织分布图, 荧光越强, 图像越亮。从图中可以直观地看出, 注射24 h后, ICG仅少量存在于肿瘤部位, 而Fe3O4-ICG则在肿瘤部位具有相对较高的浓度。体内组织分布结果表明, Fe3O4纳米粒具有肿瘤靶向性, 开展肿瘤部位成像时, 应在注射后24 h左右进行。
|
Figure 6 Biodistribution of Fe3O4-ICG and free ICG in S180 tumor-bearing mice. (A) Tissue distribution determined by the ICG fluorescence at different time points, the ratio of the fluorescence intensity of each tissue to the total fluorescence intensity was plotted. (B) Quantitative analysis of fluorescence intensity of tumors at 6 h, 12 h and 24 h post-injection. (C) Ex vivo fluorescence images of major organs and tumor at 24 h post-injection. n=3, x±s |
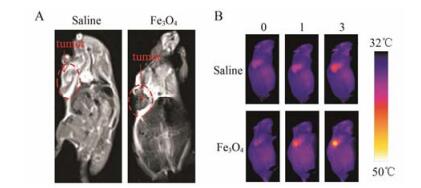
体外磁共振成像及光热成像结果表明, Fe3O4纳米粒可以实现体外磁共振/光热双模式成像。进一步研究其体内双模式成像, 以探讨其成为双模式成像造影剂的可能性, 结果如图 7所示。从图 7A可见, 在磁共振图像上, 尾静脉注射Fe3O4纳米粒的小鼠的肿瘤部位明显比生理盐水组的肿瘤部位更暗, 肿瘤组织与周围正常组织的对比也更明显。此外, 以信号强度计, Fe3O4纳米粒组肿瘤部位的T2信号强度比生理盐水组降低了48.7%, 说明该Fe3O4纳米粒具有良好的体内磁共振成像效果。图 7B显示了体内热成像效果, Fe3O4纳米粒具有良好的体内光热性质, 随着近红外光照时间的延长, 光热成像效果越来越明显。以上结果表明Fe3O4纳米粒具有良好的成像性能, 能够作为磁共振/光热双模式成像造影剂。
|
Figure 7 Dual-modal imaging of S180 tumor-bearing mice observed 24 h after intravenous injection of saline or Fe3O4 nanoparticles. T2-weighted MR images (A) and photothermal images versusirradiation time (B) |
本文采用水热法制备了水分散性的磁性Fe3O4纳米粒, 外观为均一稳定的球形结构, 粒径约为125 nm, 在室温下表现出磁性及超顺磁性。此外, 该纳米粒还具有良好的体外磁共振响应及光热转换性能。细胞实验表明, 该Fe3O4纳米粒能被肿瘤细胞摄取, 摄取后分布于细胞质中并且对细胞具有较低的毒性。体内分布研究发现, 该纳米粒能够在肿瘤部位富集, 具较好的肿瘤靶向性。将其尾静脉注射到荷瘤小鼠体内后, 磁共振成像T2信号下降了48.7%, 近红外光照后, 肿瘤部位升温明显, 可以实现对肿瘤部位的磁共振/光热双模式成像。由于其在肿瘤部位成像方面的应用潜能, 该Fe3O4纳米粒对促进肿瘤临床诊断技术的发展具有重大意义。
| [1] | Shalviri A, Foltz WD, Cai P, et al. Multifunctional terpoly-meric MRI contrast agent with superior signal enhancement in blood and tumor[J]. J Control Release, 2013, 167: 11–20. DOI:10.1016/j.jconrel.2013.01.014 |
| [2] | Ge XQ, Song ZM, Sun LN, et al. Lanthanide (Gd3+ and Yb3+) functionalized gold nanoparticles for in vivo imaging and therapy[J]. Biomaterials, 2016, 108: 35–43. DOI:10.1016/j.biomaterials.2016.08.051 |
| [3] | Sherry AD, Woods M. Chemical exchange saturation transfer contrast agents for magnetic resonance imaging[J]. Annu Rev Biomed Eng, 2008, 10: 391–411. DOI:10.1146/annurev.bioeng.9.060906.151929 |
| [4] | Shen AJ, Dong HQ, Wen HY, et al. Gadolinium-based contrast agents for tumor targeting imaging[J]. Prog Chem (化学进展), 2011, 23: 772–780. |
| [5] | Liu TH, Chang G, Cao RJ, et al. Applications of superparamagnetic Fe3O4 nanoparticles in magnetic resonance imaging[J]. Prog Chem (化学进展), 2015, 27: 601–613. |
| [6] | Kaim AH, Wischer T, O'Reilly T, et al. MR imaging with ultrasmall superparamagnetic iron oxide particles in experi-mental soft-tissue infections in rats[J]. Radiology, 2002, 225: 808–814. DOI:10.1148/radiol.2253011485 |
| [7] | Xu H, Aguilar ZP, Yang L, et al. Antibody conjugated magnetic iron oxide nanoparticles for cancer cell separation in fresh whole blood[J]. Biomaterials, 2011, 32: 9758–9765. DOI:10.1016/j.biomaterials.2011.08.076 |
| [8] | Lu W, Ling M, Jia M, et al. Facile synthesis and characterization of polyethylenimine-coated Fe3O4 superparamagnetic nanoparticles for cancer cell separation[J]. Mol Med Rep, 2014, 9: 1080–1084. |
| [9] | Tong Q, Shu XG, Lu XM, et al. Effects of magnetic gemcitabine stealth nano-liposomes on the characteristics of breast cancer cell line MCF-7[J]. Acta Pharm Sin (药学学报), 2009, 44: 181–187. |
| [10] | Shen BB, Ma Y, Yu SY, et al. Smart multifunctional magnetic nanoparticle-based drug delivery system for cancer thermo-chemotherapy and intracellular imaging[J]. ACS Appl Mater Interfaces, 2016, 8: 24502–24508. DOI:10.1021/acsami.6b09772 |
| [11] | Shen S, Wang S, Zheng R, et al. Magnetic nanoparticle clusters for photothermal therapy with near-infrared irradiation[J]. Biomaterials, 2015, 39: 67–74. DOI:10.1016/j.biomaterials.2014.10.064 |
| [12] | Gao WH, Liu ST, Fan CX, et al. Pharmacokinetics, tissue distribution and magnetic resonance's response characterstics of folic acid-O-carboxymethyl chitosan ultrasmall superparamagnetic iron oxide nanoparticles in mice and rats[J]. Acta Pharm Sin (药学学报), 2011, 46: 845–851. |
| [13] | Deng XL, Ge XD, Wu XF, et al. Pharmacokinetics and MR imaging of SPIO-shRNA dual functional molecular probe in vivo[J]. Acta Pharm Sin (药学学报), 2015, 50: 1285–1289. |
| [14] | Cheng FY, Su CH, Yang YS, et al. Characterization of aqueous dispersions of Fe3O4 nanoparticles and their biomedical applications[J]. Biomaterials, 2005, 26: 729–738. DOI:10.1016/j.biomaterials.2004.03.016 |
| [15] | Shen LH, Bao JF, Wang D, et al. One-step synthesis of monodisperse, water-soluble ultra-small Fe3O4 nanoparticles for potential bio-application[J]. Nanoscale, 2013, 5: 2133–2141. DOI:10.1039/c2nr33840h |
| [16] | Shen S, Wu L, Wang CR, et al. Preparation and in vitro evaluation of doxorubicin-loaded magnetic iron oxide nanoparticles[J]. Acta Pharm Sin (药学学报), 2013, 48: 1844–1849. |
| [17] | Rajan B, Sathish S, Balakumar S, et al. Synthesis and dose interval dependent hepatotoxicity evaluation of intravenously administered polyethylene glycol-8000 coated ultra-small superparamagnetic iron oxide nanoparticle on Wistar rats[J]. Environ Toxicol Pharmacol, 2015, 39: 727–735. DOI:10.1016/j.etap.2015.01.018 |
| [18] | Cui JB, Xu SY, Guo C, et al. Highly efficient photothermal semiconductor nanocomposites for photothermal imaging of latent fingerprints[J]. Anal Chem, 2015, 87: 11592–11598. DOI:10.1021/acs.analchem.5b03652 |
| [19] | Guo XM, Wu Z, Li W, et al. Appropriate size of magnetic nanoparticles for various bioapplications in cancer diagnostics and therapy[J]. ACS Appl Mater Interfaces, 2016, 8: 3092–3106. DOI:10.1021/acsami.5b10352 |
| [20] | Chen L, Wu L, Liu F, et al. Azo-functionalized Fe3O4 nanoparticles:a near-infrared light triggered drug delivery system for combined therapy of cancer with low toxicity[J]. J Mate Chem B, 2016, 4: 3660–3669. DOI:10.1039/C5TB02704G |
| [21] | Liu J, Sun ZK, Deng YH, et al. Highly water-dispersible biocompatible magnetite particles with low cytotoxicity stabilized by citrate groups[J]. Angew Chem Int Ed, 2009, 48: 5875–5879. DOI:10.1002/anie.v48:32 |
| [22] | Sheng ZH, Hu DH, Xue MM, et al. Indocyanine green nanoparticles for theranostic applications[J]. Nano-Micro Lett, 2013, 5: 145–150. DOI:10.1007/BF03353743 |
 2017, Vol. 52
2017, Vol. 52


