2. 浙江农林大学 工程学院, 浙江 临安 311300;
3. 塔里木大学生命科学学院, 新疆 阿拉尔 843300
2. School of Engineering, Zhejiang Agricultural & Forestry University, Lin'an 311300, China;
3. School of Life Science, Tarim University, Alaer 843300, China
目前, 组学是药学、生物学等领域的研究重点, 而相互作用是组学研究热点。蛋白质组间的相互作用是研究药物与蛋白质组相互作用的前提。药物与单一蛋白质分子的相互作用研究已有诸多报道[1, 2], 但是, 药物的体液(血液) 输运过程不只涉及一种蛋白分子, 故药物与单一蛋白质分子的相互作用仅是最简单的模型。人体血液中的高丰度血清蛋白质种类达15 000种以上, 从全蛋白质组与药物相互作用来探究药理作用需要考虑太多因素, 难以获得合理数据, 因此研究蛋白质组之间的相互作用及蛋白质组与药物分子之间的相互作用是研究全蛋白质组与药物相互作用的必由之路。
考察蛋白质组与药物相互作用能获得真实的药理机制, 药物输运过程涉及混合蛋白质组, 混合蛋白体系的浓度、分布和空间构象无疑对载运药物分子起着关键作用[3]。因此, 研究药物与蛋白质分子结合作用机制首先要研究混合蛋白体系的浓度、分布和药物分子空间构象等情况。当前, 药物与蛋白质组相互作用的研究鲜有文献报道, 土大黄苷(rhaponticin, RT) 分子式为C21H24O9 (化学名为3-羟基-5-[(1''E)-2''-(3'-羟基-4'-甲氧基苯基) 乙烯基]苯基-β-D-葡萄糖苷), 为二苯乙烯衍生物。RT是广泛存在于蓼科植物叶中的中药活性成分, 分子结构清楚且表征谱特征明显, 具有相应的前期研究基础[4]。牛血清白蛋白(bovine serum albumin, BSA) 或牛乳铁蛋白(bovine lacto ferrin, BLF) 与药物的相互作用已有文献[5, 6]报道, 蛋白质分子间的相互作用研究已有大量成果[7, 8], 故开展RT与BSA-BLF混合蛋白质组的相互作用研究具有理论依据。本工作分析了BSA-BLF混合蛋白质组之间的相互作用影响RT与BSA-BLF混合蛋白质组的相互作用, 对研究药物分子与混合蛋白质组体系的相互作用及建立相应的理论模型具有重要意义[9]。
材料与方法材料 土大黄苷(rhaponticin, RT, ≥99%, 南京泽郎医药科技有限公司); 牛乳铁蛋白(bovine lacto ferrin, BLF, ≥98%, 上海华美生物工程公司); 牛血清白蛋白(bovine serum albumin, BSA, ≥98%, 上海华美生物工程公司); 三羟甲基氨基甲烷(Tris, GR, 上海华美生物工程公司); 其他试剂为分析纯试剂, 实验用水为亚沸蒸馏去离子水。配制为0.1 mol·L−1 Tris-HCl缓冲溶液(pH 7.4), 用此缓冲液配制10 μmol·L−1 BSA/BLF及1.0 mmol·L−1 RT贮备液, 另外, 再用此缓冲液分别配制1、3、5、7、9和10 μmol·L−1 BSA/BLF体系作为对照, 并配制0.1、0.3、0.5、0.7、0.9和1.0 mmol·L−1的RT溶液。配制cBSA/cBLF浓度比分别为1/9、3/7、5/5、7/3和9/1, 总浓度为10 μmol·L−1的BSA-BLF混合蛋白质组溶液体系。红外光谱实验所用的BSA、BLF和BSA-BLF体系的总浓度均为0.9 mmol·L−1。
仪器 F-7000型荧光光度计(日本Hitachi公司); IR Prestige-21傅立叶变红外光谱仪(日本Shimadzu公司), 衰减全反射附件(ATR)。
RT与BSA-BLF蛋白质组的相互作用 移取BSA/BLF/BSA-BLF溶液2.5 mL于1 cm比色皿, 逐次加入1.0 mmol·L−1 RT溶液进行荧光滴定, RT的量分别为10、10、5、15、20、20和20 μL, 移取1、3、5、7、9和10μmol·L−1 BSA/BLF溶液于1 cm比色皿, 以及分别移取cBSA/cBLF浓度比分别为1/9、3/7、5/5、7/3和9/1, 总浓度为0.1 μmol·L−1的BSA-BLF混合蛋白质组溶液于1 cm比色皿, 逐次加入0.1、0.3、0.5、0.7、0.9和1.0 mmol·L−1的RT溶液进行荧光滴定, Tris-HCl缓冲溶液做荧光空白校正, 发射与激发狭缝宽度均为2.5nm, 波长扫速240 nm·min−1, 固定激发波长282nm, 室温下绘制250~500 nm发射光谱。
BSA、BLF、BSA-BLF与RT的相互作用对蛋白质二级结构的影响 分别将加入RT前后的BSA、BLF和不同浓度比BSA-BLF的混合蛋白质组溶液及缓冲液均匀地铺满ATR的ZnSe晶片, 4 cm−1分辨率下, 扫描60次, 收集加入RT前后的不同蛋白质溶液体系扣除缓冲溶液吸收后的红外光谱, 所得图谱进行二阶求导和去卷积处理后, 分析蛋白质二级结构变化。
结果与讨论 1 药物RT与蛋白质组(BSA-BLF) 的相互作用图 1为单蛋白质分子(BLF、BSA)、混合蛋白质组(BSA-BLF) 与药物(RT) 的相互作用荧光谱。
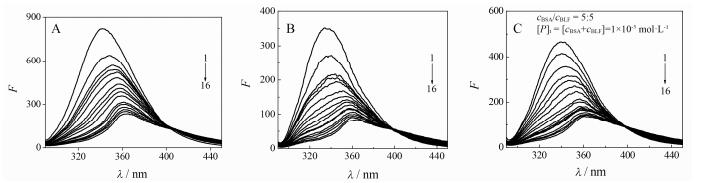
|
Figure 1 The fluorescence emission spectra of bovine serum albumin (BSA, A), bovine lactoferrin (BLF, B) and BLF-BSA system (C) in the absence and presence of rhaponticin (RT). λex=282 nm, λem=250−500 nm. cBSA=cBLF=10 μmol·L−1, cBSA-BLF=10 μmol·L−1, cRT (mmol·L−1), 1 to 16: 0, 0.40, 0.80, 1.00, 1.20, 1.60, 2.04, 2.48, 2.88, 3.32, 4.20, 4.60, 5.04, 5.48, 5.92, 6.36 |
从图 1可知, BSA、BLF及BSA-BLF蛋白质组在341、336和339 nm有很强的荧光发射峰, 随着RT浓度增加, BSA、BLF及BSA-BLF蛋白质组的荧光均被有规律地猝灭, 表现出浓度依赖型的荧光猝灭现象, 说明RT分别与BSA、BLF及BSA-BLF蛋白质组发生了相互作用。RT与BSA、BLF及BSA-BLF蛋白质组相互作用的荧光最大发射峰位置明显红移, 说明RT与BSA、BLF及BSA-BLF蛋白质组相互作用中, 均使BSA、BLF及BSA-BLF分子结构中部分微区所处的化学环境发生改变。
在RT-蛋白质组相互作用体系中, 根据荧光强度线性加和性原理, BSA-BLF-RT体系的理论F值(荧光强度) 应为相应RT与BSA、BLF蛋白质分子单独相互作用的F值之和。例如cBSA/cBLF=5/5的BSA-BLF (c=10 μmol·L−1) 与RT相互作用后的理论F值, 应为RT分别与单独的BSA (c=5 μmol·L−1)、BLF (c=5 μmol·L−1) 相互作用的F值之和。通过比较BSA-BLF-RT体系的理论F值与实际F值大小, 可以说明RT-BSA-BLF体系中, BSA与BLF相互作用对荧光效应的影响。图 1C为RT与BSA-BLF (cBSA/cBLF=5/5) 的相互作用荧光谱, 其余比例的BSA-BLF与RT相互作用的荧光谱类似, 没有一一列出。分析可知, BSA-BLF体系(c=10 μmol·L−1) 与RT相互作用后的实际F值不等于其理论F值, 说明其F值无加和性, 不遵循线性加和性原理, 说明RT与蛋白质组相互作用受BLF-BSA、BSA-BSA及BLF-BLF之间的相互作用等因素的影响。
荧光法研究药物与单一蛋白相互作用时, 根据实验数据可采用不同理论方程拟合获得合理的药物−蛋白质相互参数[11, 12]。本实验是关于药物与蛋白质组的相互作用研究, 不同于药物与单一蛋白相互作用体系, 目前尚没有成熟的药物与蛋白质组相互作用的猝灭机制方程, 将在后续研究中探索。
2 蛋白质组(BSA-BLF) 中单蛋白质分子间的相互作用分析蛋白质组的测量F值通常受体系中蛋白质分子间(环境因素) 相互作用的影响[10], 为阐明BSA-BLF与RT相互作用中单蛋白质分子间的相互作用, 进一步简化复杂相互作用体系, 直观观察蛋白质分子微环境变化对蛋白质分子F值的影响。首先考虑同种蛋白之间的相互作用, 用RT加入前蛋白分子的F0值对蛋白质浓度[P]作图, 通过BSA/BLF浓度变化探索同种蛋白质分子间的相互作用, 进一步考虑不同种蛋白质分子间的相互作用, 以混合蛋白质组为对象, 考察BSA-BLF中BSA与BLF的相互作用。同样用蛋白质组的F0值对蛋白组的浓度比cBSA/cBLF作图, 结果见图 2。
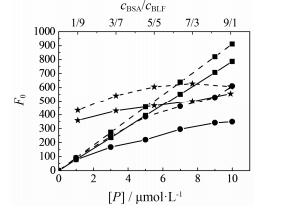
|
Figure 2 The theoretical and reality fluorescence intensity of different concentrations of BSA (■), BLF (●) and BSA-BLF (★) system in the absence of RT. The cBSAand cBLF range from 1−10 μmol·L−1, respectively; the total concentration of BSA-BLF is 10 μmol·L−1 (broken lines stand for the theoretical fluorescence intensity without overall microenvironmental influence) |
从图 2可知, 在一定浓度范围, 蛋白质分子的F值与其浓度并不呈简单的线性关系, 说明蛋白的F值随着浓度变化受其所处微环境的影响。深入分析, 可能为蛋白质分子自身相互作用。随着BSA、BLF浓度的上升, BSA/BLF分子通过氢键或者静电力等聚集在一起甚至形成团聚体导致其F值比理论F值偏低。观察发现BSA的F值随浓度变化的趋势曲线远比BLF更加接近理想状态下的理论值, 说明BLF的荧光效应更易受微环境影响, 在其浓度上升时, BLF由于更加“柔性”, BLF分子很可能聚集在一起, 其相应的F值比理想状态下的F值低很多, 造成实际F值偏离理论值较远。相对来说, BSA随着其浓度的上升, 其F值会比理论值偏低, BSA由于更加“刚性”, 但偏离较小, 在高浓度时不易聚合在一起。BSA-BLF体系实际的F值比理论加和值偏小, 原因是由于蛋白质分子自身的相互作用及BSA和BLF之间的相互作用, 导致实际的F值比理论加和值偏小。观察图 2发现, 蛋白分子F值的真实值(图中实线部分) 偏离理想状态下的理论值(图中虚线部分) 越远, 说明蛋白质受微环境影响程度越大, 即蛋白分子自身相互作用越大。为了量化阐述微环境对蛋白质浓度变化时荧光效应的影响, 本文提出一个参数--总体微环境影响因子(overall microenvironmental influence factor, IOM)。
| $ {{I}_{\text{OM}}}=\left( {{J}_{\text{T}}}-{{J}_{\text{M}}} \right)/{{J}_{\text{T}}} $ | (1) |
式1中JT是图 2蛋白荧光曲线理想状态下理论F值的积分, JM是蛋白荧光曲线实际状态下测量实际F值的积分。通过计算, BSA的IOM=0.251 7, BLF的IOM=0.448 1。BSA-BLF的IOM=0.192 7。
IOM (BSA-BLF) < IOM (BSA) < IOM (BLF) 的结果与图 2的表象分析和实验数据一致。BSA-BLF的IOM比BSA、BLF的IOM偏小, 说明BSA-BLF受微环境影响程度比BSA、BLF小。BSA-BLF体系中, 由于BSA-BLF、BSA-BSA、BLF-BLF复杂相互作用, 使其受微环境影响较BSA、BLF偏小。说明同种、不同种蛋白之间相互作用受微环境的影响是不同的, 不同种蛋白不仅受不同种蛋白之间相互作用的影响, 而且还受蛋白质分子自身相互作用的影响。
3 RT与BSA-BLF相互作用中单蛋白质分子间的相互作用分析蛋白质组溶液中, 同种、不同种蛋白质分子间的相互作用对RT与混合蛋白质组的相互作用均有影响。在一定浓度RT, 分析组成蛋白质混合物体系中单组分蛋白质分子间的相互作用及不同组分蛋白质分子间的相互作用, 测定相应蛋白浓度和其相应浓度的F值, 分析BSA/BLF/BSA-BLF与RT相互作用体系的微环境变化。图 3为RT浓度[Q]与蛋白浓度[P]的比值与荧光下降值ΔF (ΔF=F0 − F) 的关系图。
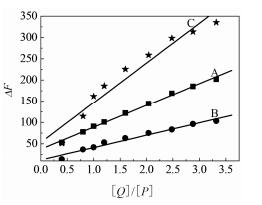
|
Figure 3 The plot of BSA/BLF/BSA-BLF protein fluorescence reduction (ΔF) vs [Q]/[P] (A: cBSA=5 μmol·L−1; B:cBLF=5 μmol·L−1; C: [P]t=cBSA + cBLF=10 μmol·L−1, cBSA/cBLF=1) |
从图 3可知, [Q]/[P]小于3.5时, RT能够成正比地猝灭BSA/BLF/BSA-BLF的荧光强度(其他浓度的BSA、BLF和其他浓度比的BSA-BLF荧光下降值ΔF与[Q]/[P]关系图没有一一列于图 3), RT浓度[Q]与BSA/BLF/BSA-BLF浓度[P]的比值与BSA/BLF/ BSA-BLF荧光下降值ΔF (ΔF=F0 − F) 呈现良好的线性关系。图 3的斜率(slope, S) 的化学意义是当RT浓度等于蛋白浓度([Q]/[P]=1, [Q]/[P]≤3.5) 时, RT分子对蛋白自身荧光的平均猝灭值。可见, S能够反映RT分子在一定浓度范围内与BSA/BLF/BSA-BLF体系的相互作用程度。BSA/BLF/BSA-BLF体系的S值分别列于表 1。
| Table 1 The average fluorescence reduction (ΔF) of per RT molecule acting on the per BSA/BLF/BSA-BLF fluorescence emitter |
进一步分析RT在一定浓度范围([Q]/[P]≤3.5) 与BSA/BLF/BSA-BLF体系的相互作用程度, 对BSA/ BLF/BSA-BLF-RT相互作用体系的S值与蛋白的浓度[P]作图, 得到图 4。
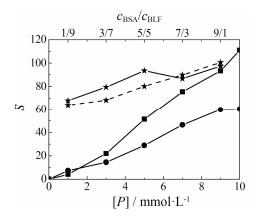
|
Figure 4 The trend curve of the slope of the RT-BSA (■)/BLF (●)/BSA-BLF (★) system's average fluorescence reduction (ΔF). The cBSA and cBLF range from 1 to 10 μmol·L−1, and the total concentration of BSA-BLF is 10 μmol·L−1 |
图 4结合表 1可见, 单一蛋白质BSA/BLF-RT作用体系, 蛋白质浓度越高, 单位浓度RT对单一蛋白质的荧光猝灭程度越大。BSA-RT随着BSA浓度增大, 单位浓度RT对单位浓度BSA的平均荧光猝灭值呈大致直线上升关系。相比而言, BLF-RT随BLF浓度增大, 单位浓度RT对单位浓度BLF的平均荧光猝灭值不像BSA那样呈比例增大, 而是随BLF浓度升高, 曲线趋于平缓。说明BLF相对于BSA而言更易受到微环境影响, BLF更加“柔性”, 在浓度上升时其更易聚集而造成实际荧光值偏离理论值较远, 同时RT在BLF高浓度时不易插入其内部, 所以单位浓度RT对单位浓度BLF的平均荧光猝灭值在BLF高浓度时没有随着BLF浓度升高而显著增大; 相对来说, BSA则更加“刚性”, 高浓度时也不易团聚在一起, 因此随着BSA浓度上升, RT依然能够比较容易作用于BSA分子。
图 4中虚线部分表示的理论BSA-BLF的S值是通过图 4中对相应的蛋白各组分S值的加和值。例如, BSA-BLF (cBSA/cBLF=1:9, ctotal=10 μmol·L−1) 体系-RT相互作用的理论S值是SBSA-RT (1 μmol·L−1) 与SBLF-RT (9 μmol·L−1) 之和。图 4结合表 1可见, 对于BSA-BLF体系(浓度比为1:9、3:7和5:5三组实验), 实际S值比理论S值高; 其余两组实际S值比理论S值低。说明RT-BSA-BLF体系中, BSA对高浓度下聚集在一起的BLF能起到“解聚”作用, BSA与BLF相互作用影响BLF与BLF的相互作用, 使BLF能够在溶液环境中更加分散, 从而有利于RT对BLF的荧光猝灭作用, 使RT对BLF分子的实际单位平均荧光下降值有所增加, 因此随着混合蛋白质组体系中BLF浓度比例增大, 实际单位平均荧光下降值S实际比理论值S理论高。相比而言, BSA在高浓度时也有轻微的聚合作用, 但是BLF对高浓度下聚集在一起的BSA分子不具有像BSA同样的“解聚”作用。因此, 随着混合蛋白体系中BSA浓度比例的增多, 其理论值S理论比实际值S实际略微大一些。
以上实验数据表明RT与蛋白质组之间存在着相互作用, 该相互作用受蛋白质组中同种蛋白质分子之间的相互作用及不同种蛋白质分子之间的相互作用的影响。混合蛋白质组中蛋白质分子结构不同, 溶液微环境影响RT-混合蛋白质组之间相互作用存在差异。
4 RT对BSA-BLF蛋白质组体系二级构象的影响为阐述RT与BSA-BLF的相互作用机制, 利用傅立叶变换红外光谱进一步分析RT作用于BSA-BLF时对蛋白质分子二级构象变化的影响[11]。分析RT与BSA、BLF和BSA-BLF相互作用的FT-IR谱(其他混合比例蛋白质组的IR谱类似, 没有一一列出), 见图 5。
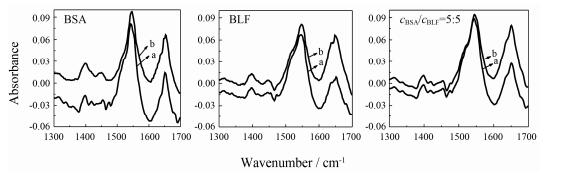
|
Figure 5 The FT-IR spectra and difference spectra of BSA/BLF/BSA-BLF in absence and presence of RT. (a) FT-IR spectra of apo protein (s); (b) FT-IR difference spectra [(protein (s) + RT solution) − (RT solution)] in buffer solution in the region of 1 300 − 1 700 cm−1. (the total concentration of protein or proteome 0.9 mmol·L−1 and the cRT=0.9 mmol·L−1) |
蛋白质分子的红外光谱能够反映“酰胺带”的峰值, 这些峰值能够反映出蛋白质分子肽链结构的变化[12], 通过傅立叶变换红外光谱可以定量确定蛋白质的二级结构含量变化。目前, 对蛋白质二级结构红外图谱归属研究比较成熟的是酰胺Ⅰ带(1 600~1 700 cm−1) 和酰胺Ⅱ带(1 500~1 600 cm−1)[13]。酰胺Ⅰ带的红外光谱的峰位(约在1 651 cm−1) 主要反应蛋白质分子内肽链上C=O与NH所组成氢键的伸缩运动。酰胺Ⅱ带红外光谱的峰位(约在1 543 cm−1) 主要反映蛋白质分子内部肽链上C-N键的伸缩和N-H键的弯曲运动[1]。本实验蛋白质体系酰胺Ⅰ带和酰胺Ⅱ带的峰位列于表 2。
| Table 2 The peak positions of protein (s) in amide I and amide Ⅱ regions |
从图 5和表 2可知, RT的加入使BSA酰胺Ⅰ带的峰位从1 651.04移动到1 652.97 cm−1, BLF从1 651.04移动到1 647.19 cm−1, 说明RT与BSA和BLF分子中的C=O基团发生相互作用。RT的加入并没有改变混合蛋白质组体系酰胺Ⅰ带的峰值, 说明在BSA-BLF体系中, 由于BSA与BLF的相互作用以及BSA-BSA与BLF-BLF的相互作用等影响, 使RT不再与其分子内部的C=O基团作用。BLF分子酰胺Ⅱ带的峰位和BSA-BLF (1:9) 的峰位相同, BSA分子酰胺Ⅱ带的峰位和其余几组BSA-BLF体系的峰位一致, 这是因为BSA能够破坏团聚在一起的BLF分子, 使BLF在溶液中更加分散, 而RT会优先对BSA酰胺Ⅱ带发生影响, 从而导致BSA酰胺Ⅱ带的峰位和其余几组BSA-BLF体系的峰位一致。除了BSA-BLF (1:9) 之外的混合蛋白质组体系在加入RT后, 酰胺Ⅱ带的峰值均发生了改变且变化程度一致, 这说明RT与蛋白质组分子内部的C-N键和N-H键均发生了作用, RT对BSA分子内部C-N键和N-H键的影响大于BLF分子。总之, RT的加入使蛋白质组体系分子内部的部分微区结构发生了改变。RT与混合蛋白质组的相互作用过程中, 蛋白质组中各蛋白质分子的微区构象均发生了变化, 分子结构不同, 分子微区构象变化程度差异明显。
通过分析全反射傅立叶变换红外光谱的酰胺Ⅰ带峰位, 能够详细了解蛋白质分子在药物分子作用前后二级构象的变化[13, 14]。酰胺Ⅰ带对蛋白质分子二级结构变化的反应比酰胺Ⅱ带更加敏感, 因而通过研究酰胺Ⅰ带得出蛋白质分子二级结构的变化实用性更大, 应用也更广泛。将得到的红外光谱用二阶导数、去卷积技术进行处理, 把原来酰胺Ⅰ带中未能分辨的峰进一步分解为多个子峰, 并指出各个子峰的峰位置, 再通过曲线拟合方法, 定量分析BSA分子中二级结构的各个组分。目前蛋白质酰胺Ⅰ带(1 600~1 700 cm−1) 谱峰归属已经比较成熟[14, 15]: 1 610~1 640 cm−1为β-折叠; 1 650~1 658 cm−1为α-螺旋; 1 658~1 695 cm−1为β-转角。图 6和表 3分别是应用二阶导数、去卷积谱方法对不同的药物−蛋白质(组) 体系进行典型曲线拟合获得的拟合图和蛋白质(组) 体系的二级结构组分表, 其中其他比例混合蛋白组的曲线拟合图与图 6类似, 没有一一列出。
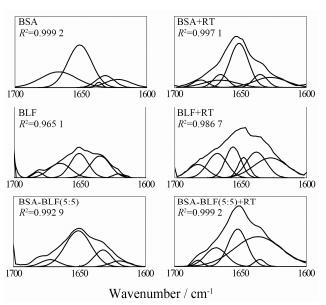
|
Figure 6 The curve-fit amide Ⅰ region with secondary structure determination of free BSA/BLF/BSA-BLF and RT-BSA/BLF/ BSA-BLF system in buffer in the region of 1 600−1 700 cm−1. The total concentration of BSA/BLF/BSA-BLF=0.9 mmol·L−1 and the concentration of RT=0.9 mmol·L−1 |
| Table 3 The effect of RT on the assignments of the secondary structure of BSA/BLF/BSA-BLF system before and after the treatment of RT |
从图 6和表 3可以获得在加入RT前后BSA/BLF蛋白体系的二级构象的信息。对于BSA分子, 加入RT后(加入的RT分子与蛋白质的浓度相等), BSA的二级结构中β-折叠含量从22.82%升高到27.88%, β-转角含量从27.54%升高到28.76%, 而α-螺旋含量从49.63%下降到43.36%。对于BLF, RT的加入使BLF二级结构中β-折叠含量上升, β-转角和α-螺旋含量均有所降低, 且BLF的α-螺旋含量从19.56下降到8.60%。对于BSA和BLF分子, RT的加入均能使其分子二级结构中α-螺旋含量降低, 说明BSA和BLF分子的刚性结构减少, 分子整体的肽链结构较加入RT之前更加松散, 并且RT对BLF的影响更为显著, 也就是说RT对BLF的“舒展”能力更强, 结论也与荧光实验结论一致。
从图 6和表 3可以获得RT作用于BSA-BLF体系前后混合蛋白体系二级结构的变化。观察发现, BSA-BLF (1:9) 体系中虽然BLF所占比例大, 但此蛋白混合的二级结构组成和BSA的二级结构相近, 与BLF的二级结构差别较大。分析认为是BSA的红外吸收信号比BLF要强且BSA在混合蛋白溶液体系中更加分散, 因此, 尽管在BSA-BLF (1:9) 体系中BSA的占比很小, 分散在溶液体系中的BSA对红外吸收光谱起主要的贡献作用。通常, 蛋白质分子的α-螺旋结构对蛋白质的整体构象起支撑作用, 一般把α-螺旋含量当作一个重要指标进行研究[15]。RT的加入均使BSA-BLF体系中α-螺旋含量降低, 说明RT能够使混合蛋白体系内部肽链更加舒展, 混合蛋白质体系整体刚性下降。在混合蛋白体系BSA-BLF (1:9) 到BSA-BLF (9:1), 加入RT后, α-螺旋含量的降低值分别为4.24%、9.56%、19.21%、16.78%和9.75%。当BSA在BSA-BLF体系比重较低(1:9、3:7) 时, BLF主要以团聚体形式存在而BSA主要在溶液中呈分布状态, 所以RT更容易作用于BSA分子。随着BSA含量的升高, BSA会对部分团聚BLF分子起到解聚作用, 使RT同时作用于BSA和BLF, 这是RT使BSA-BLF (5:5) 体系二级结构中α-螺旋含量下降最多的主要原因。然而, 随着BSA-BLF体系中BSA含量的继续增加, RT主要作用于BSA, 这就导致随着BSA与BLF分子在混合蛋白体系中浓度比的增加(7:3、9:1), α-螺旋含量下降值没有BSA-BLF (5:5) 的α-螺旋含量下降值显著。说明在RT与混合蛋白质组的相互作用过程中, 蛋白质组中单组分蛋白质分子间的相互作用影响蛋白质分子二级构象变化, 浓度比不同, 相互作用不同, 从而导致影响分子构象变化程度也不同。
结论本工作采用光谱技术探索蛋白质分子间相互作用对药物(RT)-蛋白质组相互作用的影响, 除了通过荧光光谱和全反射傅立叶红外变换光谱方法进行测量外, 还做了一定的理论探索工作, 初步建立了研究蛋白质组(BSA-BLF体系) 与药物(RT) 相互作用的新方法。为了量化阐述蛋白质分子间相互作用(即蛋白分子的微环境发生改变) 对药物−蛋白质组相互作用的影响, 通过测量荧光效应的变化规律, 提出了一个参数IOM, 以IOM综合衡量微环境变化对对药物−蛋白质组相互作用的影响, 取得了较好的结果。IOM能侧面反应蛋白在溶液环境下自身构象的刚性及柔性性质。其次建立了单蛋白质分子-RT体系与BSA-BLF混合蛋白质组-RT相互作用的荧光对比模型, 为阐释混合蛋白质组体系与RT相互作用的荧光机制打下基础。另外, 采用全反射傅立叶红外变换谱具体分析RT对BSA/BLF/BSA-BLF混合蛋白组体系二级结构的变化, 进一步证实了荧光实验的推论并深入讨论了RT与BSA-BLF体系相互作用的机制。本工作以BSA与BLF两组分简单混合蛋白质体系模拟蛋白质组, 开展混合蛋白质组与药物的相互作用, 获得的结果具有初步的探索意义, 将为真实多组分蛋白质组与药物的相互作用研究提供创新思路和实验方法, 本文有关结果可为蛋白质组与药物相互作用的深入研究提供有益参考。
| [1] | Guo M, Fan WX, Hu RH. The molecular mechanism of spectroscopy combined with molecular simulation and characterization of DNA rhaponticin and serum albumin[J]. China J Chin Mater Med (中国中药杂志), 2014, 06: 1075–1082. |
| [2] | Zhao Q. Study on Small Molecular Docking Technology Based on Protein Interaction (基于分子对接技术的小分子-蛋白质相互作用研究)[D]. Wuxi:Jiangnan University, 2009. |
| [3] | Wu SS, Yuan WB, Wang HY, et al. Synthesis, crystal structure and interaction with DNA and HSA of (N, N'-dibenzylethane-1, 2-diamine) transition metal complexes[J]. J Inorg Biochem, 2008, 102: 2026–2034. DOI:10.1016/j.jinorgbio.2008.08.005 |
| [4] | Xu Y, Guo ZJ, Tan L. Advances in the research on rhaponticin[J]. Chin J Mod Appl Pharm (中国现代应用药学杂志), 2009, 26: 549–552. |
| [5] | Guo M, Lü WJ, Li MH, et al. Study on the binding interaction between carnitine optical isomer and bovine serum albumin[J]. Eur J Med Chem, 2008, 43: 2140–2148. DOI:10.1016/j.ejmech.2007.11.006 |
| [6] | Guo M, Zhang LY, Lü WJ, et al. Analysis of the spectroscopic characteristics on the binding interaction between tosufloxacin and bovine lactoferrin[J]. J Lumin, 2011, 131: 768–775. DOI:10.1016/j.jlumin.2010.11.036 |
| [7] | Hu ZJ. Analysis strategy of protein-protein interaction networks[J]. Methods Mol Biol, 2013, 939: 141–181. DOI:10.1007/978-1-62703-107-3 |
| [8] | Guo R, Liu QZ. Recent advances in the techniques of proteinprotein interaction study[J]. J Tianjin Med Univ (天津医科大学学报), 2015, 21: 542–544. |
| [9] | Schächter V. Protein-interaction networks:from experiments to analysis[J]. Drug Discov Today, 2002, 7: S48–S54. DOI:10.1016/S1359-6446(02)02281-X |
| [10] | Van de Weert M, Stella L. Fluorescence quenching and ligand binding:a critical discussion of a popular methodology[J]. J Mol Struct, 2011, 998: 144–150. DOI:10.1016/j.molstruc.2011.05.023 |
| [11] | Guo M, Zou JW, Yi PG, et al. Binding interaction of gatifloxacin with bovine serum albumin[J]. Anal Sci, 2004, 20: 465–470. DOI:10.2116/analsci.20.465 |
| [12] | Jefferson ER, Walsh TP, Barton GJ. Biological units and their effect upon the properties and prediction of proteinprotein interactions[J]. J Mol Biol, 2006, 364: 1118–1129. DOI:10.1016/j.jmb.2006.09.042 |
| [13] | Ragusa S, Cambria MT, Pierfederici F, et al. Structure-activity relationship on fungal laccase from Rigidoporus lignosus:a Fourier-transform infrared spectroscopic study[J]. Biochim Biophys Acta, 2002, 1601: 155–162. DOI:10.1016/S1570-9639(02)00469-7 |
| [14] | Bummer PM. An FTIR study of the structure of human serum albumin adsorbed to polysulfone[J]. Int J Pharm, 1996, 132: 143–151. DOI:10.1016/0378-5173(95)04344-6 |
| [15] | Brauner JW, Flach CR, Mendeisohn R. A quantitative reconstruction of amide I contour in the IR spectra of globular protein:from structure to spectrum[J]. J Am Chem Soc, 2005, 127: 100–109. DOI:10.1021/ja0400685 |
 2017, Vol. 52
2017, Vol. 52


