胆汁酸(bile acid)[1]是胆汁的主要成分, 是由胆固醇在肝脏中合成的一大类胆烷酸的总称, 常以钠盐或钾盐的形式存在。人体中胆固醇在肝细胞内经胆固醇7α-羟化酶(cholesterol 7α-hydroxylase, CYP7A1)等催化生成初级胆汁酸(包括胆酸和鹅脱氧胆酸)并储存于胆囊中, 然后释放到小肠参与脂类物质的消化吸收, 并在肠内细菌的作用下7位脱羟基生成次级胆汁酸(包括脱氧胆酸、石胆酸和酮基石胆酸)[2]。肠道内95%以上的胆汁酸会经回肠末端黏膜上皮细胞刷状缘侧的顶端Na+依赖性胆汁酸转运体(apical sodium-dependent bile acid transporter, ASBT)以及基底膜的有机溶质转运体(organic solute transporter, OST)所介导主动转运重吸收入血, 经门静脉进入肝脏, 并再次排入肠腔, 此过程称为肝-肠循环(enterohepatic circulation, EHC)。
胆汁酸在肠道内的重吸收主要是受到ASBT的调节。人类ASBT基因属于第十溶质转运蛋白家族第二成员(SLC10A2), 位于染色体13q33上, 具有6个外显子结构; ASBT是一种由348个氨基酸构成的主动转运体蛋白, 相对分子质量为48 000, 主要分布于回肠末端刷状缘, 在胆管上皮和肾近端小管等处亦有分布, 并对结合型及游离型胆汁酸均有极高的亲和力[3]。近年来, 关于ASBT调控相关机制研究的不断深入, 以及其在肠道炎症、肠道肿瘤、糖尿病、高脂血症等疾病治疗中的重要作用也被深入挖掘, ASBT有望成为上述疾病治疗的新靶点。现就ASBT表达调控及其在疾病治疗方面的相关研究作一综述。
1 ASBT的表达调控随着相关研究的不断深入, 发现转录因子、核受体、RNA结合蛋白等对其表达均有调控作用(图 1)。
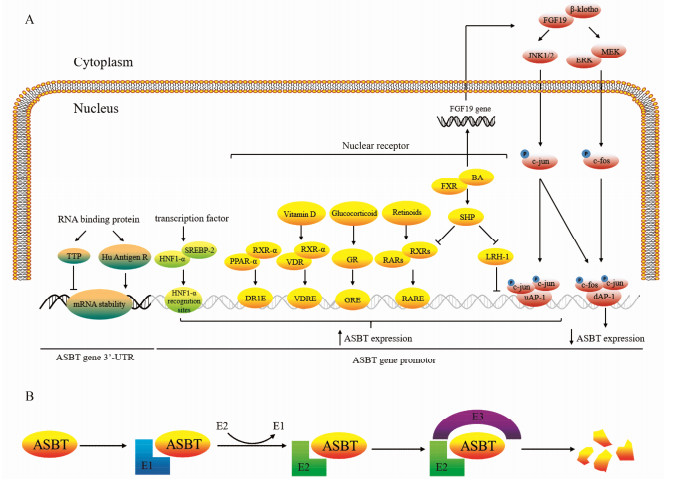
|
Figure 1 The advances in regulation mechanism of apical sodium-dependent bile acid transporter (ASBT). (A) The ASBT gene expression mediated by transcription factors, RNA-binding protein, nuclear receptor, fibroblast growth factor-19. (B) The ASBT protein expression regulated by regulation of protein ubiquitination and degradation pathway. E1: Ubiquitin-activating enzyme; E2: Ubiquitin-binding enzyme; E3: Ubiquitin-protein ligase |
肝细胞核因子1-α (hepa tocyte nuclear factor 1-α, HNF1-α)是调控许多肝功能相关基因表达的重要转录因子, 具有POU同源异型结构域, 肝脏内含量较高, 同时在小肠、肾脏、胰腺等处也均有表达[4]。研究发现, ASBT基因启动子上存在3个HNF1-α识别位点, 提示ASBT基因的表达可能与HNF1-α有关。Shih等[4]利用HNF1-α基因敲除小鼠证实在小鼠小肠、肾脏等处均未检测出ASBT, 指出ASBT的表达依赖于HNF1-α, 且HNF1-α可以增强ASBT基因启动子活性。同时, 肠道内的一些细胞因子和炎症介质也可以通过降低HNF1-α的表达, 从而降低ASBT的表达。
1.1.2 ASBT与SREBPs胆固醇调节元件结合蛋白(sterol-regulatory element binding proteins, SREBPs)是锚定于内质网中的细胞内胆固醇感受器, 具有碱性螺旋-环-螺旋-拉链结构域(basic helix-loop-helix-zip domain), 属于转录因子家族成员, 包括SREBP-1a、SREBP-1c和SREBP-2等3种亚型。SREBPs与胆固醇及脂质代谢密切相关, 现有研究证实给予25-羟基胆固醇后可抑制小肠上皮细胞ASBT的活性, 抑制ASBT启动子活性及其mRNA水平[5]。Thomas等[6]在体内外实验中证实上述固醇类物质对ASBT的调节作用与SREBPs (尤其是SREBP-2)有关, 但SREBP-2并不是直接影响ASBT基因的表达, 而是与HNF1-α结合后发挥作用。胆固醇通过对SREBPs的水解修饰影响其转录活性[7], 体内胆固醇水平降低可导致SREBPs的NH2末端无效剪切, 产生失活突变的SREBPs[8], 最终减弱SREBPs与HNF1-α的结合能力, 导致ASBT表达下降, 体内胆汁酸外排减少, 阻止胆固醇水平持续降低, 维持机体稳态。
1.2 ASBT与RNA结合蛋白Tristetraprolin (TTP)和Hu Antigen R是两种十分重要的RNA结合蛋白, 在调节RNA稳定性方面发挥着十分重要的作用。TTP和Hu Antigen R为具有双锌指结构域的蛋白质, 可以与一些3'非翻译区(3'-UTR)富含A、U碱基的mRNA结合, 调节mRNA的稳定性。目前已知, 体内许多重要物质(如IFN[9]、COX-2[10]等)的mRNA水平均受到TTP和Hu Antigen R的调节。Chen等[11]通过构建具有不同长度3'-UTR的ASBT mRNA证实:随着3'-UTR长度的增加, ASBT mRNA的半衰期逐渐降低。通过凝胶迁移实验发现上述实验中ASBT mRNA是通过结合TTP和Hu Antigen R来调节其稳定性的; 利用干扰RNA技术证实TTP可以降低ASBT mRNA的稳定性, 而Hu Antigen R则具有与其相反的作用。
1.3 ASBT与核受体 1.3.1 ASBT与RAR维甲酸受体包括维甲酸受体(retinoic acid receptor, RAR)和维甲酸X受体(retinoid X receptor, RXR)两类子受体家族, 其在代谢综合征、肿瘤、器官纤维化等多种疾病中发挥重要调节作用; RARs与RXRs通常形成异源二聚体与靶基因启动子上的维甲酸反应元件(retinoic acid responsive elements, RARE)结合调节下游基因转录, 此外RXRs还可与其他核受体超家族(如糖皮质激素受体、维生素D受体、过氧化物酶体增殖物激活受体)等形成异源二聚体发挥作用[12]。Neimark等[13]证实人类ASBT基因转录起始位点下游118 bp处存在RAR/RXR反应元件, 利用荧光素酶报告系统给予9-顺式维甲酸或11-全反式维甲酸后可上调ASBT启动子活性且这种激活作用可被小分子异源二聚体伴侣(small heterodimer partner, SHP)所拮抗。
1.3.2 ASBT与PPAR-α过氧化物酶体增殖物激活受体α (peroxisome proliferators-activated receptors α, PPAR-α)是调节体内脂质代谢、胆酸合成、参与炎症反应的重要核受体。目前, 通过基因测序技术已确认ASBT基因转录启始位点-1 565~-1 577位点上存在一段由6个核苷酸组成直接重复序列, 称为DR1元件(AGGCCAgAGGCCA); DR1元件是核受体与基因结合关键位置, 并且证实PPAR-α可以与RXR-α形成异源二聚体结合到ASBT基因上的DR1元件上, 反式激活ASBT基因表达, 促进胆汁酸的重吸收[14]。
1.3.3 ASBT与GR糖皮质激素受体(glucocorticoid receptor, GR)是核受体超家族的一员, 也是一种激素依赖的转录调节因子; 当和糖皮质激素结合后, 以同源二聚体的形式与靶基因启动子上的具有不完全回文结构的DNA共有序列即糖皮质激素反应元件(glucocorticoid response element, GRE)相互作用, 从而调节基因表达, 最终引起各种生物学效应。在大鼠实验中已证实糖皮质激素受体可以诱导ASBT的表达[15]。近年来, Jung等[16]发现在SLC10A2基因启动子上存在两个具有GRE功能的基序; 分别为位于-781~-795位点的IR3-A (AAAACAcgtTGTTCT)和位于-549~-563位点的IR3-B (AGGACAatcTGTTCT)。并在人体实验中证实应用地塞米松(dexamethasone)或布地奈德(budesonide)后, 回肠中ASBT表达增加。因此, 糖皮质激素受体可作为反式激活因子正向调节SLC10A2基因表达, 促进ASBT表达[16, 17], 从而增加胆汁酸重吸收、提高血清胆汁酸水平。
1.3.4 ASBT与VDR维生素D受体(vitamin D receptor, VDR)是一种包含427个氨基酸残基的亲核蛋白, 相对分子质量为50 000, 属于类固醇激素/甲状腺激素受体超家族成员。VDR介导维生素D生物活性形式1, 25(OH)2D3的重要生理功能, 经配体活化后, VDR与RXR形成异源二聚体, 并与靶基因启动子上的维生素D受体反应元件(vitamin D receptor response elements, VDREs)结合, 调节靶基因的转录, 参与调节体内多种细胞增殖、分化、钙的动态平衡及某些重要蛋白质的表达[18, 19]。目前发现ASBT基因启动子上游(-2 131~2 117, 5'-AGAAGTGGGAGGAGA-3')存在一段与25-羟维生素D3-24羟化酶基因VDRE[20]相似的序列。Chen等[21]利用酶切和点突变的方法处理上述序列, 将其转染入Caco-2细胞后发现ASBT基因启动子活性下降。在动物实验上, 给予1, 25(OH)2D3的SD大鼠与对照组相比, ASBT蛋白和mRNA水平以及肠道胆酸吸收速率均呈上升趋势。证实了维生素D可以反式激活ASBT基因, 提高肠道对胆汁酸的吸收, 提示VDR在调节人体胆汁酸稳态方面具有重要的生理作用。
1.3.5 ASBT与FXR法尼醇X受体(farnsoid X receptor, FXR)是核受体超家族成员之一, 与体内糖类、脂肪酸和胆固醇代谢密切相关。胆汁酸(bile acids, BA)是胆固醇代谢的终产物, 在脂肪代谢中发挥着十分重要的作用, 同时又是FXR的配体; 而FXR的相关生理功能受到胆汁酸的调节。现有研究发现在大鼠体内胆汁酸不会影响回肠中ASBT的表达[22], 而在人类和小鼠体内却存在着胆汁酸对ASBT的负反馈调节[13, 23]。研究发现, 小鼠体内胆汁酸通过与FXR结合, 上调SHP, 从而抑制对ASBT转录发挥关键调控作用的肝受体同源物-1 (liver receptor homologue-1, LRH-1)的表达, 发挥对ASBT的负性调节作用[24]。而在人体内则略有不同, 胆汁酸通过FXR/SHP途径抑制RAR/RXR诱导的ASBT基因的转录激活[13]; 胆汁酸与FXR结合后也可促进FGF-19基因的转录, 减少SHP的降解从而拮抗RXR, 抑制ASBT的表达, 促进胆汁酸的排出[25]。
1.4 ASBT与FGF-19成纤维细胞生长因子-19 (fibroblast growth factor, FGF-19)是成纤维细胞因子家族成员之一, 主要由肠细胞和胆管上皮细胞分泌; 已有研究表明FGF-19在调节胆汁酸的体内平衡和“胆汁池”大小上起重要作用, 并且还可以作为一种非胰岛素依赖的活性物质参与肝糖原和蛋白质的合成[26]。
Ghosh等[27]发现FGF-19可通过调节c-fos/c-jun异源二聚体蛋白的形成调控回肠中ASBT的表达。FGF-19与FGF-R4/β-klotho复合物结合后通过下述两种方式调控ASBT的表达(每个FGF-19家庭成员需要一个来自klotho家族跨膜蛋白的辅助因子; 因klotho蛋白能把与其作用的FGF受体有效地转变为FGF-19成员的特异性受体)。首先, 通过活化JNK1/JNK2磷酸化c-jun蛋白[28] (JNK2为c-jun的负性调节因子), 入核后可分别与上游激活子蛋白-1 (upstream activator protein-1, uAP-1)反应元件和下游激活子蛋白-1 (downstream activator protein-1, AP-1)反应元件结合激活SLC10A2启动子, 促进ASBT表达; 也可通过激活MEK/ERK信号通路磷酸化c-fos蛋白[29], 进入细胞核以c-fos/c-jun的形式与下游AP-1反应元件结合, 抑制ASBT的表达; 亦可; 两种调控方式中以c-fos蛋白调节为主。综上所述, FGF-19负性调节ASBT的表达。
1.5 ASBT与泛素化降解途径泛素(ubiquitin)是一个由76个氨基酸组成的多肽链, 真核生物中的异常或短寿蛋白质均通过泛素化途径进行降解, 近年来研究发现机体内多种膜转运蛋白也是通过该途径降解[30]。泛素化包括3个酶参与的3个反应, 即由泛素激活酶(ubiquitin-activating enzyme, E1)、泛素结合酶(ubiquitin-conjugating enzyme, E2)、泛素-蛋白连接酶(ubiquitin-protein ligase, E3)催化的级联反应。Xia等[31]通过protein turnover assay和Western blot等方法测定ASBT的降解半衰期为5.7±1.2 h, 为一种不稳定的短寿蛋白质, 同时给予MG132 (一种特异的蛋白酶体抑制剂)处理后发现ASBT蛋白水平呈时间依赖性升高, 提示ASBT可能通过泛素-蛋白酶体途径降解。
炎症细胞因子白介素-1β (interleukin 1β, IL-1β)可通过激活丝裂元活化蛋白激酶(mitogen-activated protein kinases, MAPKs)从而调节相关靶基因和转录因子的活性[32]。在肠道内, IL-1β可通过升高JNK的活性, 使ASBT的335位的丝氨酸(S335A)和339位的苏氨酸(T339A)磷酸化, 从而触发泛素化作用, 降解ASBT[31]; 由此可知, ASBT的S335A和T339A位点对其稳定性至关重要。
近年来, 有研究表明肠道胆汁酸中的某些成分与ASBT的降解有关; Miyata等[33]证实用氨苄西林预处理C57BL/6N小鼠可增加ASBT蛋白质表达水平但不影响其mRNA水平, 再给予肠杆菌相关胆汁酸(enterobacteria-associated bile acid), 如牛磺去氧胆酸(taurodeoxycholic acid, TDCA)、胆酸(cholic acid, CA)使ASBT蛋白表达水平显著下降, mRNA水平无变化。可见, 肠道内的某些胆汁酸成分是调节ASBT泛素化降解的重要因素, 且为一种转录后调节方式; 临床上也有望通过给予外源性胆酸来治疗ASBT表达增多所致的疾病, 提高用药的安全性和有效性。从目前研究成果上看, 体内胆汁酸可通过以下两种途径下调ASBT的表达:一是通过FXR/SHP途径在转录水平上调控; 二是泛素依赖的蛋白降解途径进行转录后调节。
2 ASBT与疾病的发生和治疗胆汁酸是调节机体代谢稳态的关键物质, 而ASBT作为调控胆汁酸转运的重要转运体, 其在疾病发生和治疗方面的作用越来越受到科研工作者的重视, 相关研究也越来越多。
2.1 ASBT与高脂血症胆汁酸是调节机体脂质平衡和胆固醇稳态的关键物质, ASBT则是胆汁酸肝肠循环过程中负责肠道重吸收胆汁酸的最主要的转运体。应用ASBT抑制剂(2164U90[34]、S-8921[35]、R-146224[36]、SC-435[37, 38])后可增加经肠道外排的胆汁酸含量, 从而代偿性促进肝脏大量合成胆汁酸, 致肝内胆汁酸合成限速酶CYP7A1活性提高, 使得作为胆汁酸合成原料的胆固醇在体内的水平降低, 起到降低胆固醇的作用(表 1)。这一降胆固醇作用是通过调节胆汁酸与胆固醇间的代谢平衡而实现的[39], 与传统降胆固醇药物他汀类化合物抑制3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase, HMGR)的机制有所不同。ASBT分布于回肠细胞表面, 因此药物无需经过胃肠道吸收进入循环系统发挥其抑制ASBT的作用[37], 大大降低不良反应发生的风险, 成为了降胆固醇药物研究的新策略。
| Table 1 Main potential ASBT inhibitor drugs. UDCA: Ursodeoxycholic acid |
胆汁淤积性肝病是指各种病因所致的肝脏胆汁生成、分泌和排泄障碍, 使得胆汁不能正常流入十二指肠而进入血液的病理状态, 患者表现为皮肤瘙痒、乏力、尿色加深和黄疸等。胆汁淤积本身又可进一步加重肝脏损害, 严重者可导致肝衰竭甚至死亡。胆汁淤积性肝病按发生部位可分为肝内胆汁淤积(包括肝细胞和胆管细胞)以及肝外胆汁淤积, 而目前该疾病的治疗多采用“去除病因和对症治疗”的方式, 尚缺乏有效的治疗药物, FDA仅批准熊去氧胆酸(ursodeoxycholic acid, UDCA)用于治疗原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)和原发性硬化性胆管炎(primary sclerosing cholangitis, PSC), UDCA和处在IⅡ期临床试验的奥贝胆酸同为FXR的配体, 两者通过与FXR结合, 下调ASBT的表达, 对胆汁的肝肠循环进行调解。Hruz等[40]研究发现在阻塞性胆汁淤积性患者中ASBT的mRNA水平降低, 这可能是机体的一种代偿机制, 通过减少胆汁酸的重吸收, 减轻肝内的胆汁淤积程度。上述研究提示应用ASBT抑制剂后通过阻断胆汁的肝肠循环, 使得胆汁的流失大于其合成, 对胆汁淤积性疾病产生有益的作用; 并且目前已有A4250、GSK2330672和LUM001等ASBT抑制剂完成Ⅱ期临床试验, 用于治疗多种类型的胆汁淤积性肝病(表 2)[34-38, 41, 42]。
| Table 2 Main potential ASBT inhibitor compounds |
糖尿病是一种以慢性血糖水平升高为特征的代谢性疾病, 患者体内的胰岛素水平失衡, 还会造成脂质、蛋白质和电解质等的代谢异常; 研究发现, 在糖尿病患者和多种糖尿病动物模型中均发现胆汁池“容积”增大[43], 肠道胆汁酸吸收增加[44]。多项临床研究也表明抑制糖尿病患者体内胆汁酸吸收有利于控制其血糖和血脂水平[45, 46]。Annaba等[47]研究发现胰岛素可显著抑制ASBT的表达及其启动子活性, 在链脲霉素致大鼠糖尿病模型中发现ASBT的表达和对胆汁酸的重吸收能力均明显上调。Wu等[48]应用不溶性ASBT抑制剂GSK2330672后发现SD大鼠血清葡萄糖水平显著下降、胰岛素水平明显升高。进一步研究发现抑制ASBT后导致肠道内胆汁酸含量升高, 使得结肠内多种功能肽如胰高血糖素样肽-1 (glucagon-like peptide-1, GLP-1)、YY肽(peptide YY, PYY)的分泌增加, 从而促进胰岛B细胞分泌胰岛素, 控制机体血糖水平。Chen等[49]在应用另一ASBT抑制剂264W94后发现升结肠内G-蛋白偶联受体(TGR-5)表达增加, 加之TGR-5又是GLP-1分泌的正调控因子[50], 因此推测ASBT抑制剂的降血糖作用主要是通过上调TGR-5, 从而增加GLP-1分泌实现的。由此可见, ASBT抑制剂有望成为控制糖尿病患者血糖水平的新型干预手段, 开发成为安全有效的降糖药物。
2.4 ASBT与炎症性肠病炎症性肠病(inflammatory bowel disease, IBD)是一组发生于肠道的慢性、反复发作的炎症性疾病的统称, 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn’s disease, CD); 其临床表现为腹痛、腹泻、肠梗阻等。研究发现, 克罗恩病患者会出现严重的胆汁酸吸收障碍[51]; 导致机体代偿增加胆汁分泌, 胆红素、胆盐水平升高, 加剧患色素性胆结石的风险[52]。Wojtal等[53]发现在107例炎症性肠病患者中肠道ASBT的表达显著下调, 在这种异常的肠道炎症背景下, ASBT的数量以及对胆汁酸的亲和性均显著下降[54]。由此推测, 肠道内相关炎症细胞因子如白细胞介素-1β (IL-1β)、肿瘤坏死因子-α (TNF-α)、IL-6等可抑制ASBT的表达, 其具体机制可能为上述炎症细胞因子触发ASBT的泛素化降解途径[31]; 亦或是诱导c-fos和c-jun磷酸化, 进而抑制ASBT表达[55]。目前临床上多用甲泼尼龙(methylprednisolone, MP)治疗炎症性肠病, 原因在于MP可广泛抑制多种炎症反应信号通路, 抑制肠道营养及电解质吸收不良[56]。
2.5 ASBT与便秘胆汁酸作为维持人体稳态的关键物质, 除调节机体糖脂代谢, 参与肠道营养物质吸收和电解质转运外, 其在肠道内的浓度与肠道功能也密切相关。临床上胆汁反流性胃炎或胆汁淤积性肝病患者以及长期服用胆汁酸螯合剂如考来烯胺的高脂血症患者, 由于肠道内胆汁酸水平降低, 常会出现便秘的症状。胆汁酸作为肠道内重要的信号分子, 是TGR-5的内源性配体。有研究指出, TGR-5与胆汁酸结合后, 可刺激5-羟色胺(5-HT)和降钙素基因相关肽(CGRP)的分泌, 促进结肠蠕动。利用离体小鼠全段结肠研究发现, 与野生型小鼠相比, TGR-5敲除小鼠的肠道蠕动和排便频率明显降低[57], 同时也有类似研究发现TGR-5敲除后小鼠粪便水分含量明显低于野生型小鼠, 表明TGR-5参与调控肠道内水分及电解质的外排, 促进胃肠蠕动, 起到改善便秘的作用。Wong等[58]及Simrén等[59]证实应用ASBT抑制剂后可减少肠道胆汁重吸收, 提高肠道胆汁浓度发挥胃肠促动力作用, 从而缓解慢性便秘症状。
2.6 ASBT与肠道肿瘤肠道内高浓度的胆汁酸尤其是次级胆汁酸(如脱氧胆酸、石胆酸等)与肠道黏膜的过度接触是肠道肿瘤发生的重要危险因素。胆汁酸可诱导细胞氧化应激及亚硝基化应激, 造成细胞凋亡、DNA损伤, 存活下来的细胞进行损伤修复; 未成功修复的细胞在反复接触胆汁酸后继续错配复制, 导致细胞突变积蓄, 抗凋亡及增殖能力提高, 在长期“自然选择”后最终发生癌变[60, 61]。动物实验中发现肠内灌注外源性胆汁酸可致肠道上皮异常增生, 诱发癌变[62]。Dawson等[63]发现, 与野生型小鼠相比, ASBT基因缺陷小鼠粪便胆汁酸含量显著升高达10倍以上, 提示肠道胆汁酸转运体可能通过调控胆汁酸肝-肠循环参与到肠道肿瘤的发生和发展中。Raufman等[64]比较野生型小鼠和ASBT缺陷小鼠偶氮甲烷诱导结肠癌模型中肿瘤的数量和体积, 发现后者较前者明显增加。在人结肠癌细胞系H508的研究中证实胆汁可激动毒蕈碱M3受体, 通过与表皮生长因子受体(epidermal growth factor receptors, EGFR)间的相互作用, 诱导基质金属蛋白酶-7 (matrix metalloproteinase-7, MMP7)的表达[65, 66], 促进结肠癌的发生。随着胆汁酸与肠道肿瘤发生机制研究的不断深入, 使得ASBT抑制剂的相关临床研究面临着一项重大挑战, 即长期应用ASBT抑制剂后会使得肠道和粪便中的胆汁酸增加, 此种变化是否会导致肠道肿瘤发生这一严重不良反应, 将是日后相关研究工作者需要重视的问题之一。
3 结语与展望综上所述, ASBT作为胆汁酸在肠道重吸收的关键转运体, 对于维持体内胆汁酸稳态乃至代谢平衡具有十分重要的意义。随着对ASBT调控机制探索的不断深入及其在高脂血症、糖尿病、炎症性肠病、便秘、肠道肿瘤等疾病治疗中的相关研究, 为ASBT成为疾病治疗的新靶点提供了可信、有力的理论基础和科学依据。通过clinicaltrials数据库(https://clinicaltrials.gov/)检索得知, 已有许多化合物进入到临床试验, 其中A3390、GSK2330672、LUM001等药物已经完成Ⅱ期临床试验(表 1)。同时一些候选化合物在动物实验中也取得了良好的疗效, 在治疗Ⅱ型糖尿病、高脂血症等疾病方面具有极大的潜力(表 2)。
| [1] | Alrefai WA, Gill RK. Bile acid transporters:structure, function, regulation and pathophysiological implications[J]. Pharm Res, 2007, 24: 1803–1823. DOI:10.1007/s11095-007-9289-1 |
| [2] | Chiang JY. Regulation of bile acid synthesis:pathways, nuclear receptors, and mechanisms[J]. J Hepatol, 2004, 40: 539–551. DOI:10.1016/j.jhep.2003.11.006 |
| [3] | Craddock AL, Love MW, Daniel RW, et al. Expression and transport properties of the human ileal and renal sodiumdependent bile acid transporter[J]. Am J Physiol, 1998, 274: G157–G169. |
| [4] | Shih DQ, Bussen M, Sehayek E, et al. Hepatocyte nuclear factor-1α is an essential regulator of bile acid and plasma cholesterol metabolism[J]. Nat Genet, 2001, 27: 375–382. DOI:10.1038/86871 |
| [5] | Alrefai WA, Sarwar Z, Tyagi S, et al. Cholesterol modulates human intestinal sodium-dependent bile acid transporter[J]. Am J Physiol Gastrointest Liver Physiol, 2005, 288: G978–G985. DOI:10.1152/ajpgi.00379.2004 |
| [6] | Thomas C, Landrier JF, Gaillard D, et al. Cholesterol dependent downregulation of mouse and human apical sodium dependent bile acid transporter (ASBT) gene expression:molecular mechanism and physiological consequences[J]. Gut, 2006, 55: 1321–1331. DOI:10.1136/gut.2005.085555 |
| [7] | Alrefai WA, Annaba F, Sarwar Z, et al. Modulation of human Niemann-Pick C1-like 1 gene expression by sterol:role of sterol regulatory element binding protein 2[J]. Am J Physiol Gastrointest Liver Physiol, 2007, 292: G369–G376. |
| [8] | Horton JD, Goldstein JL, Brown MS. SREBPs:activators of the complete program of cholesterol and fatty acid synthesis in the liver[J]. J Clin Invest, 2002, 109: 1125–1131. DOI:10.1172/JCI0215593 |
| [9] | Herdy B, Karonitsch T, Vladimer GI, et al. The RNA-binding protein HuR/ELAVL1 regulates IFN-β mRNA abundance and the type Ⅰ IFN response[J]. Eur J Immunol, 2015, 45: 1500–1511. DOI:10.1002/eji.201444979 |
| [10] | Giaginis C, Alexandrou P, Tsoukalas N, et al. Hu-antigen receptor (HuR) and cyclooxygenase-2(COX-2) expression in human non-small-cell lung carcinoma:associations with clinicopathological parameters, tumor proliferative capacity and patients' survival[J]. Tumour Biol, 2015, 36: 315–327. DOI:10.1007/s13277-014-2637-y |
| [11] | Chen F, Shyu AB, Shneider BL. Hu antigen R and tristetraprolin:counter-regulators of rat apical sodium-dependent bile acid transporter by way of effects on messenger RNA stability[J]. Hepatology, 2011, 54: 1371–1378. DOI:10.1002/hep.24496 |
| [12] | le Maire A, Alvarez S, Shankaranarayanan P, et al. Retinoid receptors and therapeutic applications of RAR/RXR modulators[J]. Curr Top Med Chem, 2012, 12: 505–527. DOI:10.2174/156802612799436687 |
| [13] | Neimark E, Chen F, Li X, et al. Bile acid-induced negative feedback regulation of the human ileal bile acid transporter[J]. Hepatology, 2004, 40: 149–156. |
| [14] | Jung D, Fried M, Kullak-Ublick GA. Human apical sodiumdependent bile salt transporter gene (SLC10A2) is regulated by the peroxisome proliferator-activated receptor α[J]. J Biol Chem, 2002, 277: 30559–30566. DOI:10.1074/jbc.M203511200 |
| [15] | Nowicki MJ, Shneider BL, Paul JM, et al. Glucocorticoids upregulate taurocholate transport by ileal brush-border membrane[J]. Am J Physiol, 1997, 273: G197–G203. |
| [16] | Jung D, Fantin AC, Scheurer U, et al. Human ileal bile acid transporter gene ASBT (SLC10A2) is transactivated by the glucocorticoid receptor[J]. Gut, 2004, 53: 78–84. DOI:10.1136/gut.53.1.78 |
| [17] | Out C, Dikkers A, Laskewitz A, et al. Prednisolone increases enterohepatic cycling of bile acids by induction of Asbt and promotes reverse cholesterol transport[J]. J Hepatol, 2014, 61: 351–357. DOI:10.1016/j.jhep.2014.03.025 |
| [18] | Imai Y, Youn MY, Inoue K, et al. Nuclear receptors in bone physiology and diseases[J]. Physiol Rev, 2013, 93: 481–523. DOI:10.1152/physrev.00008.2012 |
| [19] | Heikkinen S, Vaisanen S, Pehkonen P, et al. Nuclear hormone 1α, 25-dihydroxyvitamin D 3 elicits a genome-wide shift in the locations of VDR chromatin occupancy[J]. Nucleic Acids Res, 2011, 39: 9181–9193. DOI:10.1093/nar/gkr654 |
| [20] | Kerner SA, Scott RA, Pike JW. Sequence elements in the human osteocalcin gene confer basal activation and inducible response to hormonal vitamin D 3[J]. Proc Natl Acad Sci U S A, 1989, 86: 4455–4459. DOI:10.1073/pnas.86.12.4455 |
| [21] | Chen X, Chen F, Liu S, et al. Transactivation of rat apical sodium-dependent bile acid transporter and increased bile acid transport by 1α, 25-dihydroxyvitamin D 3 via the vitamin D receptor[J]. Mol Pharmacol, 2006, 69: 1913–1923. DOI:10.1124/mol.105.020792 |
| [22] | Arrese M, Trauner M, Sacchiero RJ, et al. Neither intestinal sequestration of bile acids nor common bile duct ligation modulate the expression and function of the rat ileal bile acid transporter[J]. Hepatology, 1998, 28: 1081–1087. |
| [23] | Figge A, Lammert F, Paigen B, et al. Hepatic overexpression of murine Abcb11 increases hepatobiliary lipid secretion and reduces hepatic steatosis[J]. J Biol Chem, 2004, 279: 2790–2799. DOI:10.1074/jbc.M307363200 |
| [24] | Chen F, Ma L, Dawson PA, et al. Liver receptor homologue-1 mediates species-and cell line-specific bile aciddependent negative feedback regulation of the apical sodiumdependent bile acid transporter[J]. J Biol Chem, 2003, 278: 19909–19916. DOI:10.1074/jbc.M207903200 |
| [25] | Sinha J, Chen F, Miloh T, et al. β-Klotho and FGF-15/19 inhibit the apical sodium-dependent bile acid transporter in enterocytes and cholangiocytes[J]. Am J Physiol Gastrointest Liver Physiol, 2008, 295: G996–G1003. DOI:10.1152/ajpgi.90343.2008 |
| [26] | Xu JN, Yin K, Zhang WP. The metabolic regulation function of human fibroblast growth factor 19[J]. Med Res, 2012, 41: 3. |
| [27] | Ghosh A, Chen F, Banerjee S, et al. c-Fos mediates repression of the apical sodium-dependent bile acid transporter by fibroblast growth factor-19 in mice[J]. Am J Physiol Gas-trointest Liver Physiol, 2014, 306: G163–G171. DOI:10.1152/ajpgi.00276.2013 |
| [28] | Bode AM, Dong Z. The functional contrariety of JNK[J]. Mol Carcinog, 2007, 46: 591–598. DOI:10.1002/(ISSN)1098-2744 |
| [29] | Roskoski R Jr. ERK1/2 MAP kinases:structure, function, and regulation[J]. Pharmacol Res, 2012, 66: 105–143. DOI:10.1016/j.phrs.2012.04.005 |
| [30] | Hirano K, Zuber C, Roth J, et al. The proteasome is involved in the degradation of different aquaporin-2 mutants causing nephrogenic diabetes insipidus[J]. Am J Pathol, 2003, 163: 111–120. DOI:10.1016/S0002-9440(10)63635-8 |
| [31] | Xia X, Roundtree M, Merikhi A, et al. Degradation of the apical sodium-dependent bile acid transporter by the ubiquitinproteasome pathway in cholangiocytes[J]. J Biol Chem, 2004, 279: 44931–44937. DOI:10.1074/jbc.M400969200 |
| [32] | O'Neill LA. Signal transduction pathways activated by the IL-1 receptor/toll-like receptor superfamily[J]. Curr Top Microbiol Immunol, 2002, 270: 47–61. |
| [33] | Miyata M, Yamakawa H, Hayashi K, et al. Ileal apical sodiumdependent bile acid transporter protein levels are down-regulated through ubiquitin-dependent protein degradation induced by bile acids[J]. Eur J Pharmacol, 2013, 714: 507–514. DOI:10.1016/j.ejphar.2013.06.036 |
| [34] | Hallen S, Björquist A, Ostlund-Lindqvist AM, et al. Identification of a region of the ileal-type sodium/bile acid cotransporter interacting with a competitive bile acid transport inhibitor[J]. Biochemistry, 2002, 41: 14916–14924. DOI:10.1021/bi0205404 |
| [35] | Sakamoto S, Kusuhara H, Miyata K, et al. Glucuronidation converting methyl 1-(3, 4-dimethoxyphenyl)-3-(3-ethylvaleryl)-4-hydroxy-6, 7, 8-trimethoxy-2-naphthoate (S-8921) to a potent apical sodium-dependent bile acid transporter inhibitor, resulting in a hypocholesterolemic action[J]. J Pharmacol Exp Ther, 2007, 322: 610–618. DOI:10.1124/jpet.106.116426 |
| [36] | Kitayama K, Nakai D, Kono K, et al. Novel non-systemic inhibitor of ileal apical Na+-dependent bile acid transporter reduces serum cholesterol levels in hamsters and monkeys[J]. Eur J Pharmacol, 2006, 539: 89–98. DOI:10.1016/j.ejphar.2006.04.005 |
| [37] | Bhat BG, Rapp SR, Beaudry JA, et al. Inhibition of ileal bile acid transport and reduced atherosclerosis in apoE-/- mice by SC-435[J]. J Lipid Res, 2003, 44: 1614–1621. DOI:10.1194/jlr.M200469-JLR200 |
| [38] | West KL, Zern TL, Butteiger DN, et al. SC-435, an ileal apical sodium co-dependent bile acid transporter (ASBT) inhibitor lowers plasma cholesterol and reduces atherosclerosis in guinea pigs[J]. Atherosclerosis, 2003, 171: 201–210. DOI:10.1016/j.atherosclerosis.2003.08.019 |
| [39] | Zhang EY, Phelps MA, Cheng C, et al. Modeling of active transport systems[J]. Adv Drug Deliv Rev, 2002, 54: 329–354. DOI:10.1016/S0169-409X(02)00007-8 |
| [40] | Hruz P, Zimmermann C, Gutmann H, et al. Adaptive regulation of the ileal apical sodium dependent bile acid transporter (ASBT) in patients with obstructive cholestasis[J]. Gut, 2006, 55: 395–402. DOI:10.1136/gut.2005.067389 |
| [41] | Ghosh A, Chen F, Soler DM, et al. Fibroblast growth factor (FGF) 19 inhibition of the apical sodium dependent bile acid transporter (ASBT) involves 2 distinct pathways:ERK-AP-1 and FXR-SHPLRH-1[J]. Hepatology, 2012, 56: 540A. |
| [42] | Schlattjan JH, Fehsenfeld H, Greven J. Effect of the dimeric bile acid analogue S 0960, a specific inhibitor of the apical sodium-dependent bile salt transporter in the ileum, on the renal handling of taurocholate[J]. Arzneimittelforschung, 2003, 53: 837–843. |
| [43] | Bennion LJ, Grundy SM. Effects of diabetes mellitus on cholesterol metabolism in man[J]. N Engl J Med, 1977, 296: 1365–1371. DOI:10.1056/NEJM197706162962401 |
| [44] | Caspary WF. Effect of insulin and experimental diabetes mellitus on the digestive-absorptive function of the small intestine[J]. Digestion, 1973, 9: 248–263. |
| [45] | Sonnett TE, Levien TL, Neumiller JJ, et al. Colesevelam hydrochloride for the treatment of type 2 diabetes mellitus[J]. Clin Ther, 2009, 31: 245–259. DOI:10.1016/j.clinthera.2009.02.018 |
| [46] | Zema MJ. Colesevelam hydrochloride:evidence for its use in the treatment of hypercholesterolemia and type 2 diabetes mellitus with insights into mechanism of action[J]. Core Evid, 2012, 7: 61–75. |
| [47] | Annaba F, Ma K, Kumar P, et al. Ileal apical Na+-dependent bile acid transporter ASBT is upregulated in rats with diabetes mellitus induced by low doses of streptozotocin[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 299: G898–G906. DOI:10.1152/ajpgi.00139.2010 |
| [48] | Wu Y, Aquino CJ, Cowan DJ, et al. Discovery of a highly potent, nonabsorbable apical sodium-dependent bile acid transporter inhibitor (GSK2330672) for treatment of type 2 diabetes[J]. J Med Chem, 2013, 56: 5094–5114. DOI:10.1021/jm400459m |
| [49] | Chen L, Yao X, Young A, et al. Inhibition of apical sodiumdependent bile acid transporter as a novel treatment for diabetes[J]. Am J Physiol Endocrinol Metab, 2012, 302: E68–E76. DOI:10.1152/ajpendo.00323.2011 |
| [50] | Thomas C, Gioiello A, Noriega L, et al. TGR5-mediated bile acid sensing controls glucose homeostasis[J]. Cell Metab, 2009, 10: 167–177. DOI:10.1016/j.cmet.2009.08.001 |
| [51] | Davie RJ, Hosie KB, Grobler SP, et al. Ileal bile acid malabsorption in colonic Crohn's disease[J]. Br J Surg, 1994, 81: 289–290. DOI:10.1002/(ISSN)1365-2168 |
| [52] | Brink MA, Slors JF, Keulemans YC, et al. Enterohepatic cycling of bilirubin:a putative mechanism for pigment gallstone formation in ileal Crohn's disease[J]. Gastroenterology, 1999, 116: 1420–1427. DOI:10.1016/S0016-5085(99)70507-X |
| [53] | Wojtal KA, Eloranta JJ, Hruz P, et al. Changes in mRNA expression levels of solute carrier transporters in inflammatory bowel disease patients[J]. Drug Metab Dispos, 1871: 1871–1877. |
| [54] | Sundaram U, Wisel S, Stengelin S, et al. Mechanism of inhibition of Na+-bile acid cotransport during chronic ileal inflammation in rabbits[J]. Am J Physiol, 1998, 275: G1259–G1265. |
| [55] | Neimark E, Chen F, Li X, et al. c-Fos is a critical mediator of inflammatory-mediated repression of the apical sodiumdependent bile acid transporter[J]. Gastroenterology, 2006, 131: 554–567. DOI:10.1053/j.gastro.2006.05.002 |
| [56] | Coon S, Kekuda R, Saha P, et al. Glucocorticoids differentially regulate Na-bile acid cotransport in normal and chronically inflamed rabbit ileal villus cells[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 298: G675–G682. DOI:10.1152/ajpgi.00176.2009 |
| [57] | Alemi F, Poole DP, Chiu J, et al. The receptor TGR5 mediates the prokinetic actions of intestinal bile acids and is required for normal defecation in mice[J]. Gastroenterology, 2013, 144: 145–154. DOI:10.1053/j.gastro.2012.09.055 |
| [58] | Wong BS, Camilleri M. Elobixibat for the treatment of constipation[J]. Expert Opin Investig Drugs, 2013, 22: 277–284. DOI:10.1517/13543784.2013.753056 |
| [59] | Simrén M, Bajor A, Gillberg PG, et al. Randomised clinical trial:the ileal bile acid transporter inhibitor A3309 vs. placebo in patients with chronic idiopathic constipation-a double-blind study[J]. Aliment Pharmacol Ther, 2011, 34: 41–50. DOI:10.1111/j.1365-2036.2011.04675.x |
| [60] | Bernstein C, Holubec H, Bhattacharyya AK, et al. Carcinogenicity of deoxycholate, a secondary bile acid[J]. Arch Toxicol, 2011, 85: 863–871. DOI:10.1007/s00204-011-0648-7 |
| [61] | Bernstein H, Bernstein C, Payne CM, et al. Bile acids as endogenous etiologic agents in gastrointestinal cancer[J]. World J Gastroenterol, 2009, 15: 3329–3340. DOI:10.3748/wjg.15.3329 |
| [62] | Flynn C, Montrose DC, Swank DL, et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci[J]. Mol Carcinog, 2007, 46: 60–70. DOI:10.1002/(ISSN)1098-2744 |
| [63] | Dawson PA, Haywood J, Craddock AL, et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice[J]. J Biol Chem, 2003, 278: 33920–33927. DOI:10.1074/jbc.M306370200 |
| [64] | Raufman JP, Dawson PA, Rao A, et al. Slc10a2-null mice uncover colon cancer-promoting actions of endogenous fecal bile acids[J]. Carcinogenesis, 2015, 36: 1193–1200. DOI:10.1093/carcin/bgv107 |
| [65] | Cheng K, Xie G, Raufman JP. Matrix metalloproteinase-7-catalyzed release of HB-EGF mediates deoxycholyltaur-ineinduced proliferation of a human colon cancer cell line[J]. Biochem Pharmacol, 2007, 73: 1001–1012. DOI:10.1016/j.bcp.2006.11.028 |
| [66] | Peng Z, Heath J, Drachenberg C, et al. Cholinergic muscarinic receptor activation augments murine intestinal epithelial cell proliferation and tumorigenesis[J]. BMC Cancer, 2013, 13: 204. DOI:10.1186/1471-2407-13-204 |
 2017, Vol. 52
2017, Vol. 52


