2. 天津药物研究院新药评价中心, 释药技术与药代动力学国家重点实验室, 天津 300193
2. Tianjin Center for New Drug Evaluation and Research, State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin, 300193, China
近年来,液质联用技术已广泛应用于中药及复方多成分的鉴定[1, 2]。该技术可快速获取化合物的质荷比,从而推断未知化合物的化学式,是探索中药复杂体系中各种化学成分的重要方法。其中,飞行时间质谱 (TOF/MS) 具有高灵敏度的MS/MS功能,具有高分辨率、质量范围宽的特点,能实现母离子和子离子的精确质量数测定,从而达到明确化合物结构的目的,可用于小分子化合物的精确定性,其与高效液相色谱联用,同时实现了物质的分离和鉴定,对分析中药化学组成具有优势。
元胡止痛方是常用的纯中药制剂,由延胡索 (Corydalis Rhizoma) 和白芷 (Angelicae Dahuricea Radix) 两味药组成,具有理气、活血、止痛之功效,临床上用于治疗气滞血瘀所致胃痛、胁痛、头痛及痛经等[3],其疗效确切,现已被列入国家医保甲类药品、国家重要保护品种目录。目前,对元胡止痛方的药理研究及临床应用已有较多的研究报道,而对元胡止痛方的化学物质组研究多侧重于特征图谱的建立、主要成分及共有峰的分离鉴别[4-6],仍缺乏对其物质组系统全面的阐释。本研究采用HPLC-QTOF/MS技术,建立了一种快速灵敏的定性分析实验方法,对元胡止痛方的物质基础进行了全面分析,为其质量控制、明确药效物质基础、阐明作用机制提供了参考依据。
材料与方法仪器与试剂 Agilent 1260高效液相色谱仪 (美国Agilent公司),micrOTOF-QⅡ质谱仪 (德国Bruker公司),AB204-N电子天平 (德国Mettler公司)。乙腈 (色谱纯,美国Merck公司),乙酸铵 (美国Sigma公司),冰乙酸 (分析纯,天津市康科德科技有限公司)。延胡索甲素、D-四氢药根碱、四氢小檗碱、原阿片碱、黄连碱、荷包牡丹碱、欧前胡素、异欧前胡素、白当归脑、白当归素、异补骨脂素、白花前胡乙素、紫花前胡苷、佛手柑内酯对照品购于成都曼斯特生物科技有限公司 (纯度≥98%)。别隐品碱、药根碱、小檗碱、巴马汀、延胡索乙素、7-羟基香豆素对照品购于上海将来试剂有限公司 (纯度≥98%)。去氢延胡索甲素、东莨菪素和花椒毒素对照品购于上海融禾医药科技有限公司 (纯度≥98%)。
试药 本实验所用延胡素和白芷药材由甘肃陇神戎发制药有限公司提供,经天津药物研究院张铁军研究员鉴定为罂粟科植物延胡索 (Corydalis yanhusuo W. T. Wang) 的干燥块茎和伞形科植物白芷 [Angelica dahurica (Fisch. Ex Hoffm.) Benth. Et Hook. f.] 的干燥根,标本现存于天津药物研究院中药质量控制技术工程实验室。
供试品溶液和对照品溶液的制备
全方溶液的制备 按原方中药材比例称取延胡索 (醋制) 和白芷药材适量,按照元胡止痛方制备工艺制得浸膏。精密称定浸膏1 g(1.118 0 g),置于50 mL量瓶中,加入适量60% 乙醇,超声1 h,冷却至室温后定容至刻度,0.45 μm滤膜滤过,取续滤液作为元胡止痛方供试品溶液。
药材溶液的制备 精密称定延胡索 (醋制) 5.135 9 g、白芷2.556 5 g(等生药量),分别置于两个100 mL圆底烧瓶中,精密加入60% 乙醇50 mL,精密称定,加热回流3 h,冷却至室温,用60% 乙醇补足减失的重量,摇匀滤过,即得延胡索及白芷药材溶液。
分别取上述对照品适量,精密称定,置于10 mL量瓶中,加甲醇制成含23个对照品的混合对照品溶液。
液相条件 色谱柱为Ultimate C18 (4.6 mm × 250 mm,5 μm)。流动相: A: 乙腈,B: 0.4‰乙酸铵溶液 (冰醋酸调pH 5.0) 。梯度洗脱程序: 0~40 min,10%~25% A; 40~45 min,25% A; 45~80 min,25%~80% A; 80~85 min,80%~100% A。流速为1.0 mL·min-1,柱温30 ℃,样品室温度25 ℃,进样量10 μL。
质谱条件 实验采用正、负两种模式测定,参数如下: 采用电喷雾 (ESI) 离子源; V模式; 毛细管电压正模式3.0 kV,负模式2.5 kV; 锥孔电压30 V; 离子源温度110 ℃; 脱溶剂气温度350 ℃; 脱溶剂氮气流量600 L·h-1; 锥孔气流量50 L·h-1; 检测器电压正模式1.9 kV,负模式2 kV; 采样频率0.1 s,间隔0.02 s; 质量数检测范围50~1 500 Da; 柱后分流,分流比为1∶5; 内参校准液采用甲酸钠溶液。
结果 1 元胡止痛方的物质基础鉴定及归属在对元胡止痛方中化学物质进行一级质谱测定后,可以得到物质准分子离子峰 ([M]+、[M+H]+或[M-H]-) 的相关信息。在此基础上,以准分子离子为母离子在相应的模式下进行二级碎片的测定,根据二级质谱结构信息,结合相关文献的报道以及对照品信息,对元胡止痛方的化学物质组进行了鉴定分析,共鉴定出51个化合物,其中包括28个生物碱类成分和23个香豆素类成分。元胡止痛方、延胡索、白芷药材及混标正负模式总离子流图见图 1,具体鉴定结果参见表 1[4-17]。
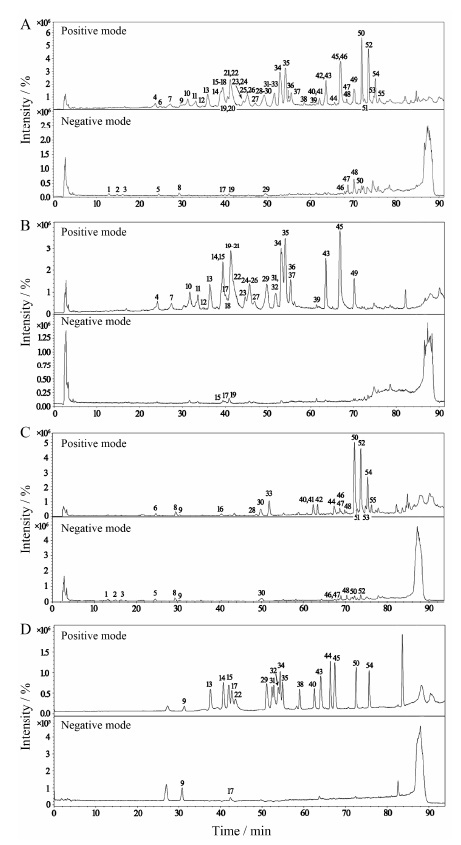
|
Figure 1 Total ion chromatograms of YHZT (A),Corydalis Rhizoma (B),Angelicae Dahuricea Radix (C),standards (D) in positive and negative ESI mode. The peak numbers were in accordance with Table 1 |
| Table 1 MS/MS data in the positive and negative ESI modes and the identification results of YHZT. Source 1: Corydalis Rhizoma; Source 2: Angelicae Dahuricea Radix; aVerification with reference standards |
四氢原小檗碱型生物碱的基本骨架 (图 2A) 是苯二甲基与四氢异喹啉的两处连接构成了一个中间有脂肪环的四环系统,可发生Retro-Diels-Alder (RDA) 裂解,形成互补离子,这是在电喷雾质谱下区分其他类型生物碱的最大特征。其结构中的取代基仅出现在A环的C2和C3位,C环的C13位,以及D环的C9和C10位。A环和D环的取代基一共有3种形式,即甲氧基、羟基和亚甲二氧基。而C环只有1种取代形式即甲基。这种取代形式应该是与延胡索中的生物碱生物合成途径有关,这种取代形式为质谱结构的分析也提供了一系列有价值的信息[13, 15]。45号延胡索甲素的质谱裂解规律见图 3。
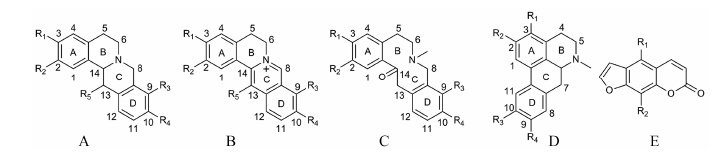
|
Figure 2 Mother structures of tetrahydroproberberines (A),berberines (B),protopines (C),aporphines (D) and coumarins (E) |
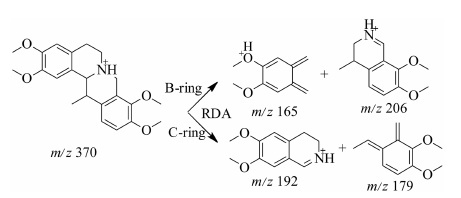
|
Figure 3 Proposed major fragmentations of corydaline |
原小檗碱型生物碱的母核结构见图 2B,结构中的取代基规律同四氢原小檗碱型。在其他取代基相同的情况下,如果A环C2和C3位的取代基为甲氧基,那么在同类的这一系列成分中,这种结构的分子量应该是最高的,如果其中的一个取代位点变成了羟基,那么该化合物分子量则降低了14 Da,而如果变成了甲二氧基取代,那么该化合物分子量就会降低16 Da。由于结构中C环是吡啶环结构,因此无法发生RDA裂解,它的裂解途径主要以取代基的碎裂为主,其碎片离子集中在m/z 280~350左右,由于氮原子以直接带正电荷的形式存在,且C环和D环存在较大的共轭结构,因此与四氢原小檗碱型生物碱相比,其取代基碎裂形成的碎片离子结构更稳定,相对丰度更大[15]。31号小檗碱的质谱裂解规律见图 4。
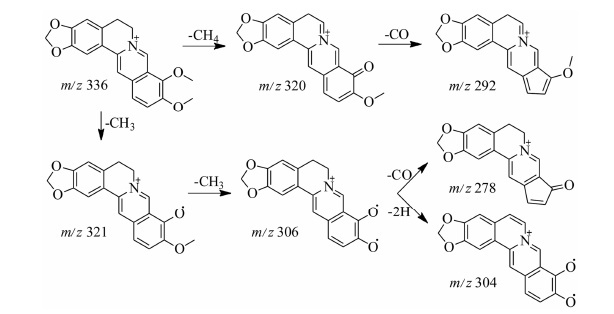
|
Figure 4 Proposed major fragmentations of berberine |
原阿片碱类生物碱的母核结构见图 2C。其分子骨架和取代基的性质都类似于四氢原小檗碱型生物碱,所以两类生物碱的裂解方式相似,都可发生RDA裂解,在m/z 150~210的质谱区域形成相对丰度最高的碎片离子。但其结构与四氢小檗碱的差别之处在C14位上,原阿片碱类生物碱不仅没有与氮原子相连,而且还与氧相连形成羧基,经过重排可以失去一分子水,这个裂解途径不仅在母离子的碎裂中极易发生,而在其RDA裂解形成的碎片离子中也极易发生,使得在质谱中相对丰度最高的碎片离子并不是由RDA裂解直接产生,而是RDA裂解后再脱水产生。这也造成质谱上的互补离子相加并不是准分子离子峰,而与其脱水后的分子量呈稳定的数量关系,因此可以将两类生物碱进行很好的区分[12]。13号原阿片碱质谱裂解规律见图 5。
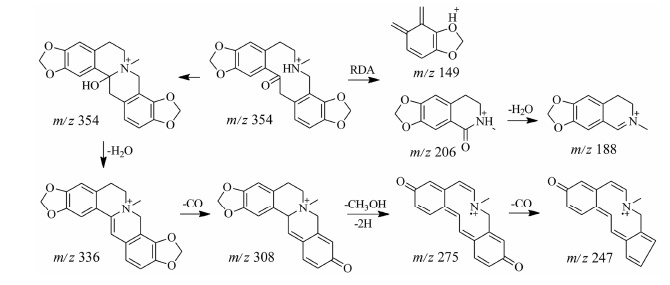
|
Figure 5 Proposed major fragmentations of protopine |
延胡索生物碱中还有一类成分呈现出与前3种不同的裂解规律,就是阿朴啡类生物碱,该类生物碱母核结构见图 2D。这种化学成分的碎片离子主要集中在m/z 290~350的高端质谱区。与原小檗碱型生物碱不同的是,该类生物碱主要是通过失去31 Da的甲氧基而形成丰度最高的碎片离子。22号海罂粟碱质谱裂解规律见图 6。
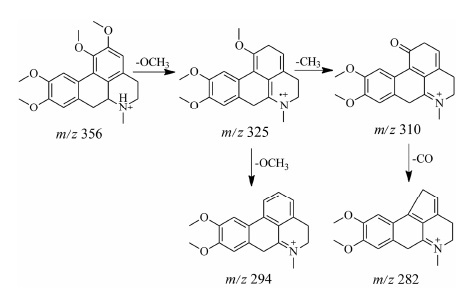
|
Figure 6 Proposed major fragmentations of glaucine |
香豆素的母核结构见图 2E。早期对香豆素类化合物的质谱裂解规律研究主要采用电子轰击型 (EI) 离子源进行。经研究发现香豆素本身主要的裂解规律为连续的失去一系列的CO基团,再失去氢和乙炔,因此,其裂解途径是: M-CO-CO-H-C2H2。内酯结构使其较容易失去质量为44的CO2分子。香豆素类化合物主要有两种碎裂形式失去羰基,由环上的羰基 (5、8位) 碎裂、酯键上的羰基碎裂[7, 14]。50号欧前胡素的质谱裂解规律见图 7。
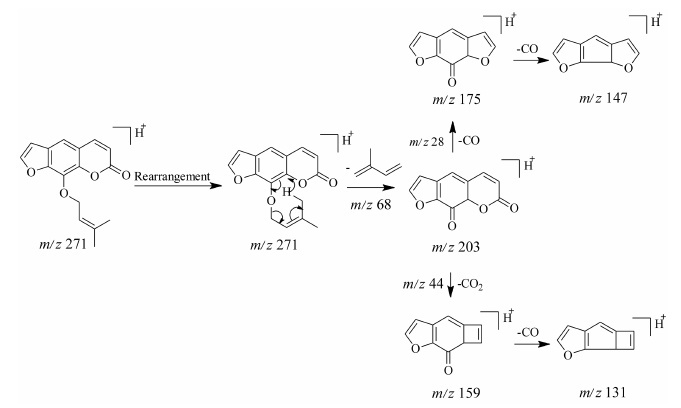
|
Figure 7 Proposed major fragmentations of imperatorin |
本研究共鉴定出元胡止痛方中的51种化学成分,其中来源于延胡索药材的有28种,主要为生物碱类成分,包括原小檗碱型生物碱 (叔胺类: 延胡索甲素、延胡索乙素等; 季铵类: 小檗碱、巴马汀等)、原阿片碱型生物碱 (原阿片碱、α-别隐品碱等)、阿朴菲型生物碱 (D-海罂粟碱等); 来源于白芷药材的有23种,主要为以欧前胡素、异欧前胡素为主的香豆素类成分。本课题组前期药理研究[18]发现,元胡止痛滴丸在0.8~1.6 g·kg-1剂量下,通过调节5-HT、NO、DA、β-EP等与疼痛相关的血管活性物质及神经递质的水平,显著改善了血管舒缩功能障碍,对实验性偏头痛模型大鼠有显著镇痛作用; 网络药理学研究[19]发现, 元胡止痛滴丸中的生物碱和香豆素类成分通过作用于和激素调节、中枢镇痛、解痉、炎症及免疫相关的多个靶点蛋白和多条信号通路,起到治疗原发性痛经的作用。方中延胡索具有活血、行气、止痛的功效,现代药理研究表明[20, 21],延胡索生物碱具有显著的镇痛、镇静和催眠作用,对冠心病、心律失常、胃溃疡等多种疾病有较好的效果,是主要的药效物质; 白芷具有散风除湿、通窍止痛和消肿排脓的功效,白芷香豆素具有抗炎、镇痛、抑制病原微生物、抗肿瘤、保肝等多种药理活性[22, 23]。
本研究通过HPLC-QTOF/MS方法,对元胡止痛方的化学成分进行了分析鉴定,较为全面地阐释了其物质基础,这对质量控制提升、明确药效物质基础及作用机制以及确保临床用药安全有效等方面有着重大意义。
| [1] | Liu XT, Wang XG, Yang Y, et al. Qualitative and quantitative analysis of lignan constituents in Caulis Trachelospermi by HPLC-QTOF-MS and HPLC-UV[J]. Molecules, 2015, 20: 8107–8124. DOI:10.3390/molecules20058107 |
| [2] | Kang LP, Zhao Y, Yu HS, et al. Identification of chemical constituents in Qiliqiangxin capsule by UPLC-Q-TOF/MSE[J]. Acta Pharm Sin (药学学报), 2011, 46: 1231–1236. |
| [3] | Chen YT, Cao Y, Xie YH, et al. Traditional Chinese medicine for the treatment of primary dysmenorrhea:how do Yuanhu painkillers effectively treat dysmenorrhea?[J]. Phytomedicine, 2013, 20: 1095–1104. DOI:10.1016/j.phymed.2013.05.003 |
| [4] | Liu Y, Chen B, Le J, et al. Rapid and sensitive liquid chromatography with tandem mass spectrometry method for the simultaneous determination of 11 major components of Yuanhu-Baizhi herb-pair in rat perfusion fluids[J]. J Sep Sci, 2014, 37: 1429–1437. DOI:10.1002/jssc.v37.12 |
| [5] | Tang DQ, Zheng XX, Chen X, et al. Quantitative and qualitative analysis of common peaks in chemical fingerprint of Yuanhu Zhitong tablet by HPLC-DAD-MS/MS[J]. J Pharm Anal, 2014, 4: 96–106. DOI:10.1016/j.jpha.2013.12.004 |
| [6] | Zhang YC, Xu HY, Chen XM, et al. Simultaneous quantifycation of 17 constituents from Yuanhu Zhitong tablet using rapid resolution liquid chromatography coupled with a triple quadrupole electrospray tandem mass spectrometry[J]. J Pharm Biomed Anal, 2011, 56: 497–504. DOI:10.1016/j.jpba.2011.06.008 |
| [7] | Li B, Zhang X, Wang J, et al. Simultaneous characterisation of fifty coumarins from the roots of Angelica dahurica by offline two-dimensional high-performance liquid chromatography coupled with electrospray ionisation tandem mass spectrometry[J]. Phytochem Anal, 2014, 25: 229–240. DOI:10.1002/pca.v25.3 |
| [8] | Zhou Q. Studies on Chemical Constituents and Chemical Characteristics Expression of Traditional Chinese Medicine System (延胡索化学成分研究及其中草药特色体系化学特征表达)[D]. Beijing:Chinese Academy of Medical Sciences & Peking Union Medical College, 2012. |
| [9] | Chen J. Studies on Chemical Constituents of Atractylodes lancea (Thunb.) DC. and Angelica dahurica (Fisch. Ex Hoffm.) Benth. et Hook. f. var. formosana (Boiss.) Shan et Yuan (茅苍术和白芷化学成分研究)[D]. Nanjing:Nanjing Agricultural University, 2007. |
| [10] | Shi JM, Han WL, Ye WC, et al. Phytochemical investigation of Corydalis yanhusuo[J]. Nat Prod Res Dev, 2011, 23: 647–651. |
| [11] | Hu TT. Studies on Chemical Constituents and Bioactivity of Corydalis yanhusuo W.T.Wang (延胡索的化学成分和生物活性研究)[D]. Shenyang:Shenyang Pharmaceutical University, 2009. |
| [12] | Ding B, Zhou TT, Fan GR, et al. Qualitative and quantitative determination of ten alkaloids in traditional Chinese medicine Corydalis yanhusuo W.T.Wang by LC-MS/MS and LC-DAD[J]. J Pharm Biomed Anal, 2007, 45: 219–226. DOI:10.1016/j.jpba.2007.06.009 |
| [13] | Sun MQ, Liu JX, Lin CR, et al. Alkaloid profiling of the traditional Chinese medicine Rhizoma Corydalis using high performance liquid chromatography-tandem quadrupole timeof-flight mass spectrometry[J]. Acta Pharm Sin B, 2014, 4: 208–216. DOI:10.1016/j.apsb.2014.04.003 |
| [14] | Kang J, Zhou L, Sun JH, et al. Chromatographic fingerprint analysis and characterization of furocoumarins in the roots of Angelica dahurica by HPLC/DAD/ESI-MSn technique[J]. J Pharm Biomed Anal, 2008, 47: 778–785. DOI:10.1016/j.jpba.2008.03.010 |
| [15] | Zhang J, Jin Y, Dong J, et al. Systematic screening and characterization of tertiary and quaternary alkaloids from Corydalis yanhusuo W.T. Wang using ultra-performance liquid chromatography-quadrupole-time-of-flight mass spectrometry[J]. Talanta, 2009, 78: 513–522. DOI:10.1016/j.talanta.2008.12.002 |
| [16] | Deng GG, Yang XW, Zhang YB, et al. Chemical constituents from lipophilic parts in roots of Angelica dahurica var. formosana cv. Chuanbaizhi[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 2148–2156. |
| [17] | Liao C, Chang S, Yin S, et al. A HPLC-MS/MS method for the simultaneous quantitation of six alkaloids of Rhizoma Corydalis Decumbentis in rat plasma and its application to a pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2014, 944: 101–106. DOI:10.1016/j.jchromb.2013.11.010 |
| [18] | Feng Y, Hu JF, Qiu ZQ, et al. Analgesic effect of Yuanhu Zhitong Dropping Pills on experimental migraine in rats induced by nitroglycerin and its mechanism[J]. Drugs Clin (现代药物与临床), 2016, 31: 423–426. |
| [19] | Han YQ, Xu J, Zhang TJ, et al. Network pharmacology-based study on mechanism of Yuanhu Zhitong Dropping Pills in the treatment of primary dysmenorrhea[J]. Acta Pharm Sin (药学学报), 2016, 51: 380–387. |
| [20] | He K, Gao JL, Zhao GS. Advances in studies on chemistry, pharmacology, and quality control of Corydalis yanhusuo[J]. Chin Tradit Herb Drugs (中草药), 2007, 38: 1909–1912. |
| [21] | Wang H, Tian M, Wang M, et al. Modern pharmacological studies and clinical trials of Corydalis Rhizoma[J]. Acta Chin Med Pharmacol (中医药学报), 2010, 38: 108–111. |
| [22] | Zhu YX, Li BL, Ma HS, et al. Research progress of Angelica dahurica for extracting effective components, pharmacological action and clinical application[J]. China Med Her (中国医药导报), 2014, 11: 159–162. |
| [23] | Ban HS, Lim SS, Suzuki K, et al. Inhibitory effects of furanocoumarins isolated from the roots of Angelica dahurica on prostaglandin E2 production[J]. Planta Med, 2003, 69: 408–412. DOI:10.1055/s-2003-39702 |
 2017, Vol. 52
2017, Vol. 52


