2. 郑州大学第一附属医院, 河南 郑州 450052;
3. 河南中医药大学, 河南 郑州 450046
2. The First Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China;
3. Henan University of Chinese Medicine, Zhengzhou 450046, China
表观遗传调控主要涉及DNA甲基化和组蛋白修饰,组蛋白修饰是发生在组蛋白N端的共价修饰,主要包括甲基化、乙酰化和泛素化等在调控基因表达过程中发挥重要作用[1, 2],同时影响细胞分化和组织器官的发育。Lu等[3]研究发现,不同发育阶段的C57BL/6小鼠表观遗传修饰存在差异,如表观修饰酶和核小体重塑分子在胎鼠中的表达水平显著高于成年鼠,而且表观遗传修饰在肝脏、肾脏及小肠存在差异,且转录因子则可介导组蛋白甲基化或去甲基化等,激活或沉默基因,通过表观遗传机制发挥发育调控作用。
组蛋白赖氨酸特异性去甲基化酶(lysine-specific demethylase 1,LSD1) 是组蛋白去甲基化酶家族成员,可去除组蛋白H3第4位赖氨酸二甲基及一甲基修饰 (dimethylation or mono-methylation of histone H3 at lysine 4,H3K4me2 or H3K4me1) ,为胚胎发育所必需[4, 5]。优降宁 (pargyline) 属于单胺氧化酶抑制剂,可显著抑制LSD1活性,解除LSD1靶基因的转录抑制,促进靶基因转录。由于大多数的表观修饰酶自身没有结合DNA的能力,通过转录因子募集这些具有酶活性的蛋白,精准靶向作用于DNA序列,发挥重要调控作用。
前期研究[6]发现,人个体发育过程中细胞色素P450 3A4 (cytochrome P450 3A4,CYP3A4) 主要在成人肝脏表达,CYP3A7主要在胎儿肝脏表达,肝细胞核因子4A(hepatocyte nuclear factors 4A,HNF4A) 是成人肝脏调控CYP3A4基础表达的重要核受体,而糖皮质激素受体(glucocorticoid receptor,GR) 在胎儿肝脏调控CYP3A7表达中发挥至关重要的作用。利用染色质免疫沉淀高通量测序 (chromatin immunoprecipitation sequencing,ChIP-seq) 技术发现: 胎儿肝脏特异性高表达的基因如CYP3A7、开叉蛋白A3 (forkhead box protein A3,FOXA3) 、甲胎蛋白 (alpha fetoprotein,AFP) 和白蛋白 (albumin,ALB) 等启动子区H3K4me2富集程度显著高于成人; 与胎儿比较,成人肝脏特异性高表达基因如CYP3A4,其启动子区H3K4me2修饰富集程度显著高于胎儿,但目前调控人肝脏发育过程中CYP3A4/3A7差异性表达的机制尚不清楚。因此,本研究旨在探讨LSD1抑制剂优降宁对CYP3A4/3A7基因启动子及增强子区组蛋白甲基化修饰及其转录的影响,提高个体发育中药物代谢酶调控机制认知水平,更好地预测婴幼儿对药物代谢能力的显著差异,从而改善儿童患者用药的有效性与安全性。
材料与方法药品与主要试剂 人肝癌细胞株HepG2(中国科学院上海细胞库); 细胞培养基DMEM、胎牛血清、Hank’s液、Welliams’E、左旋谷氨酰胺、青链霉素混合液、Hepes液、Ⅰ型鼠尾胶原 (Lot#1612737) (美国Life公司); 胰岛素-转铁蛋白-硒混合物 (ITS mix 100×,美国Gibco公司); 优降宁 (5 g,纯度97%,Lot#STBB4251V)、地塞米松 (Lot# BCBL8331V) (Sigma-aldrich公司); 胶原酶P (collagenase P,500 g,Lot#10089621,Roche公司); ChIP级Dimethyl-Histone H3 (Lys4) 抗体 (Millipore 17-677) 、Normal Mouse IgG抗体 (Millipore 12-371) (默克密理博公司); DNA纯化试剂盒 (上海碧云天生物公司); PrimeScript RT reagent Kit (AK3301) 、SYBR Premix Ex Taq™ (AK5101) (TaKaRa公司); Reatime PCR、CHIP-qPCR所用引物由上海生物工程公司设计合成。
缓冲液A (NaCl 1.42 mol·L-1、KCl 67 mmol·L-1、HEPES 100 mmol·L-1); Hank’s平衡盐 (5 mmol·L-1 CaCl2、0.03% collagenase P,Roche公司); Welliams’ E-S培养基 (10%灭活胎牛血清、2 mmol·L-1 L-谷氨酰胺、1 μmol·L-1地塞米松、10 μg·mL-1胰岛素、5.5 μg·mL-1转铁蛋白、6.7 ng·mL-1硒、100 u·mL-1青霉素、100 μg·mL-1链霉素)。
胎儿肝脏样本 胎儿肝脏组织样本取材于郑州大学第一附属医院产科,并获得伦理委员会的批准及家属的知情同意,胎儿肝脏组织均是经合法流产,并经超声诊断确定估计孕龄 (estimated gestational age,EGA),所有孕妇查HCV-Ab、HBV及HIV-Ab均为阴性,肝功能谷丙转氨酶和ALB等均在正常水平。胎儿肝脏组织重量6~8 g,为避免影响分离后肝细胞活力,冷却血时间控制在30 min内,样本详细资料见表 1。
| Table 1 Demographic data for fetal liver samples. EGA: Estimated gestational age; f: Fetal liver |
原代胎肝细胞的分离培养[7, 8] 取新鲜刚娩出死亡胎儿肝脏,75%乙醇消毒置超净台,无菌镊取组织块放入平皿,注射器多点注入预热的37 ℃缓冲液A,灌流清洗去除结缔组织。用Hank’s平衡盐灌流至灌流液变得清亮,肝组织块由暗红色变为灰白色,质地变软。钝性分离剪碎,转入15 mL离心管,加入0.03%胶原酶P 37 ℃消化30 min,吹打细胞悬液,置于冰上,80 μm细胞筛过滤, 滤液置于离心管中,离心160 g × 5 min,4 ℃下Welliams’E-S培养基洗涤重悬2次。倒置显微镜下观察肝细胞形态,调整肝细胞数为每平方厘米3×105个接种于铺有Ⅰ型鼠尾胶原包被的6孔培养板,置于5% CO2、37 ℃培养箱中培养,镜下观察大部分细胞贴壁后,继续培养,每天换液观察细胞生长情况。
HepG2 细胞传代与培养 复苏HepG2细胞用高糖DMEM培养基,加入10% FBS,加入1% 青霉素、链霉素,培养条件为37 ℃、5% CO2,贴壁后生长融合到60%~70%,用PBS洗涤后加入适量0.25% 胰酶,置37 ℃孵育5 min,镜下观察至细胞变圆,中止消化,反复吹打成单细胞悬液后传至皿中。
优降宁对原代胎肝细胞及HepG2细胞CYP3A4/ 3A7表达影响 以上述方法分离新鲜的胎儿肝细胞,分为空白对照组、溶媒组、优降宁低、中、高浓度组,倒置显微镜下观察,培养6 h后贴壁生长良好; 培养48 h后加入优降宁使终浓度分别为0.6、1.2和2.4 mmol·L-1。48 h后收集细胞,提取各组RNA,按PrimeScriptTM RT with gDNA Eraser reagent Kit 说明书合成cDNA,按ABI PRISM7500 Fast操作说明书进行Real-Time quantitive PCR (qPCR),反应体系20 μL: 模板2 μL,上游下游引物各0.4 μL,SYBR 10 μL,灭菌水6.8 μL,反应条件: 95 ℃预变性30 s,95 ℃ 3 s,60 ℃ 30 s共40个循环,GAPDH为内参基因,检测CY3A7等基因表达,引物序列见表 2。HepG2 细胞培养48 h后,分组方法同上,加入优降宁使终浓度分别为0.03、0.3和3 mmol·L-1,48 h后收集细胞,提取各组RNA,反转录后qPCR定量检测基因表达,方法同上。
| Table 2 Primer sequences for real-time qPCR |
优降宁对CYP3A4/3A7启动子及增强子区组蛋白甲基化修饰及其转录的影响
细胞培养及药物处理 HepG2细胞置于10% FBS,含1% 青霉素、链霉素双抗高糖DMEM培养基中培养,贴壁后生长融合到60%~70% 加入终浓度3 mmol·L-1优降宁处理,不加药培养皿中的细胞为对照。
细胞的甲醛交联与超声破碎 取48 h后生长状态良好的细胞 (1×107~2×107),除去培养基,PBS洗涤后每皿中加入37% 甲醛243 μL,使得终浓度为1%,室温孵育10 min,加入2 mol·L-1甘氨酸562.5 μL,使得终浓度为0.125 mol·L-1,混匀,室温下放置5 min终止交联。弃掉含甲醛和甘氨酸的缓冲液,加预冷含1 mmol·L-1苯甲基磺酰氟 (phenylmethanesulfonyl fluoride,PMSF) 的PBS,刮下细胞后收集到离心管中; 按照每1×107细胞加入ChIP lysis Buffer 750 μL,将裂解液超声 (diagenode bioruptor pico,Belgium) 处理10 min (30 s超声间歇30 s) 使DNA断裂成约200~500 bp片段。取10%超声后样本作为Input,100 μL加入5 mol·L-1 NaCl 4 μL,65 ℃处理过夜解交联,凝胶电泳分离DNA片段检测超声破碎效果。
免疫复合物的沉淀及洗涤 优降宁处理组、对照组分别取上清液100 μL加H3k4me2抗体、IgG抗体,再加入含1 mmol·L-1 PMSF CHIP dilution buffer稀释使终体积为1 mL。于4 ℃加入70 μL protein A/G beads缓慢摇摆转动混匀60 min,以减少protein A/G beads与目的蛋白或DNA序列的非特异性结合。4 ℃,2 795 ×g离心2 min,转上清至离心管中加入适量一抗4 ℃缓慢转动过夜,加入protein A/G 100 μL,以沉淀一抗识别的蛋白DNA结合的复合物,4 ℃静置,2 795 ×g 离心2 min,弃液体勿触及沉淀。依次用如下缓冲溶液低盐、高盐、LiCl和TE缓冲液洗涤沉淀,洗涤液用量为1 mL,4 ℃缓慢转动5 min后,2 795 ×g离心 2 min,弃液体勿触及沉淀,加入新鲜配制的洗脱液250 μL进行洗涤,室温下旋转30 min静置后,4 ℃下2 795 ×g离心2 min,收集上清液,最终洗脱液每管500 μL。
解交联、蛋白酶消化及DNA分离纯化 每管中加入5 mol·L-1 NaCl 20 μL混匀,65 ℃解交联过夜,每管加入下列溶液: 0.5 mol·L-1 EDTA 10 μL、1 mol·L-1 Tris-HCl (pH 6.5) 20 μL、蛋白酶K (20 mg·mL-1) 1 μL,45 ℃孵育1.5 h。应用DNA纯化试剂盒进行DNA纯化。
CYP3A4/3A7启动子及增强子区位点的qPCR检测 引物设计根据文献[9, 10]报道,选取在CYP3A4启动子区 (-362~+53) 及增强子区 (-7 836~-6 093) 的HNF4A的结合位点; 在CYP3A7的启动子区(-163~+103) 及增强子区 (-4 054~-3 421,-6 265~-6 247) ,由上海生物工程公司合成,引物序列及产物片段见表 3。反应体系20 μL: ChIP DNA或Input control 15 ng,dH2O根据DNA体积而调整,上游、下游引物各0.4 μL,SYBR 10 μL,反应条件: 95 ℃预变性30 s,95 ℃ 3 s,60 ℃ 30 s共40个循环,Real time qPCR结果分析如下: Input Ct值用Input稀释因子校正后,标准化DNA的量 (normalize DNA); 应用2-ΔCt[normalized ChIP]计算ChIP反应样品中DNA目的片段占Input control百分比 (% Input)。
| Table 3 Primer sequences for ChIP qPCR |
统计学方法 以均数 ± 标准差 (mean ± SD) 表示所有计量资料,采用SPSS 19.0统计软件分析,多组间比较采用单因素方差分析,两组间均数用独立样本的t检验分析均数显著性,且P < 0.05表示差异具有显著的统计学意义。
结果 1 人原代胎肝细胞形态观察在倒置相差显微镜观察人原代胎肝细胞形态,接种约6 h后肝细胞部分贴壁,24 h时大部分肝细胞由球形伸展形成梭形; 48 h变为扁平的多面梭形细胞生长增殖较快; 72 h生长迅速继续保持梭形; 第5天增殖转变为多边形状,细胞浆丰富,核清晰,具有非常典型的肝细胞形态结构特征,有双核或多核 (图 1),肝细胞在William’s E完全培养基中培养时,多边形的正常形态可维持到分离的第7天,细胞失去正常的形态,折光性减弱,细胞自然失去继续增殖的能力而死亡。
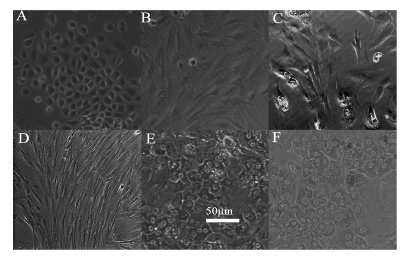
|
Figure 1 Primary culture of human fetal cells (200×). Cells culture for A: 6 h; B: 24 h; C: 48 h; D: 72 h; E: 5 days; F: 7 days |
经1.5% 琼脂糖凝胶电泳,5S、18S和28S条带清晰,二者之比约为1∶2 (图 2),RNA OD260/OD280大于1.85。
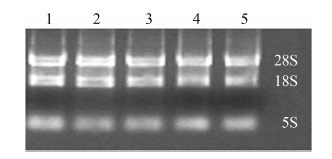
|
Figure 2 1.5% Denaturing agarose gel of total RNA,1-5: control,vehicle,pargyline treatment (0.6,1.2,2.4 mmol·L-1) in primary human fetal cells) |
Real-time qPCR方法检测结果显示,LSD1抑制剂优降宁处理48 h,能促进原代胎肝细胞的增殖生长,且具有剂量依赖性。与溶媒对照组相比,1.2和2.4 mmol·L-1浓度组CYP3A7的表达水平显著升高,且差异具有统计学意义 (P < 0.05,P < 0.01,图 3A); 2.4 mmol·L-1浓度组的FOXA3 表达水平显著升高,且差异具有统计学意义 (P < 0.01,图 3B); 1.2和2.4 mmol·L-1浓度组的ALB表达水平显著升高,且差异具有统计学意义 (P < 0.001,图 3C); 1.2和2.4 mmol·L-1浓度组的AFP表达水平显著升高,且差异具有统计学意义 (P < 0.05,P < 0.001,图 3D)。
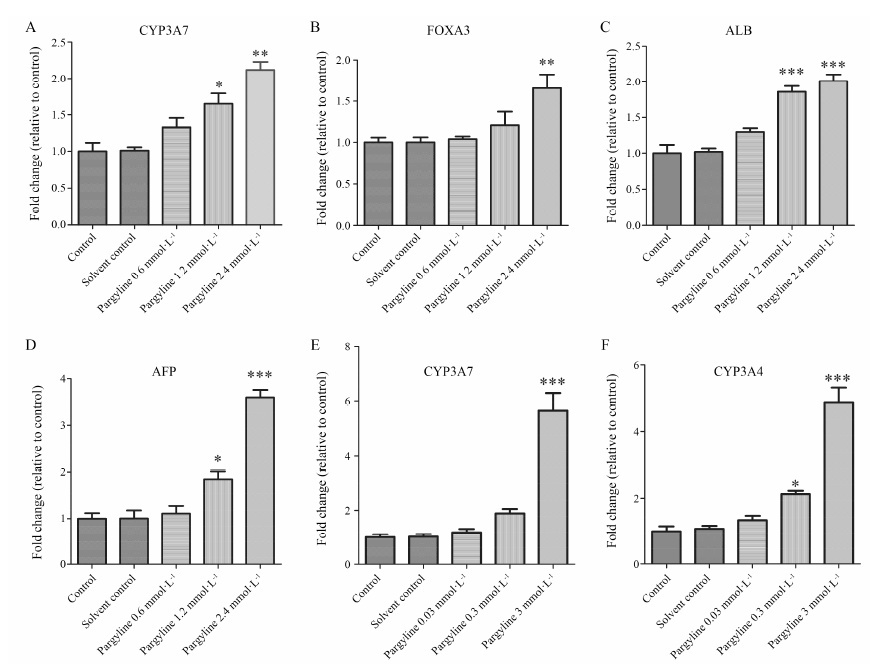
|
Figure 3 Effects of methylation of histone on CYP3A4/3A7 expressions. A-D: realtime qPCR results for CYP3A7,forkhead box protein A3 (FOXA3) ,albumin (ALB),alpha fetoprotein (AFP),genes following vehicle or pargyline treatment (0.6,1.2,2.4 mmol·L-1) in primary human fetal cells. Realtime qPCR results for CYP3A7 (E),CYP3A4 (F) genes following vehicle or pargyline treatment (0.03,0.3,3 mmol·L-1) in HepG2 cells. Data were shown as mean ± SD (n = 3) . P<0.05,**P<0.01,***P<0.001 vs solvent control group |
LSD1抑制剂优降宁能促进HepG2细胞的增殖生长,且促进CYP3A4/3A7基因表达,呈剂量依赖性,与溶媒对照组相比,3 mmol·L-1浓度优降宁组CYP3A7的表达水平显著升高,且差异具有统计学意义 (P < 0.001,图 3E); 0.3和3 mmol·L-1浓度优降宁组CYP3A4的表达水平显著升高,且差异具有统计学意义 (P < 0.05,P < 0.001,图 3F)。
3 优降宁对CYP3A4/3A7启动子及增强子区组蛋白甲基化修饰状态的影响 3.1 样品超声碎断DNA片段大小检测及DNA浓度检测Tiangen D2000 (marker) 上样6 μL,处理组与未处理组样本DNA上样2 μL,电压150 V,电泳40 min,2% 琼脂糖凝胶电泳检测结果如图 4。凝胶电泳条带显示主要分布100~500 bp,且主要条带明显。

|
Figure 4 Agarose gel electrophoresis of DNA fragments after ultrasonication. M: Marker; 1: Pargyline treatment group; 2: Control group |
在CYP3A4近端启动子区 (-362~+53) 及增强子区 (-7 836~-6 093) 的转录因子HNF4A结合位点H3K4me2富集情况下,优降宁未处理组H3K4me2部分修饰,处理组均表现H3K4me2高度修饰,而在阴性对照组IgG中,几乎不发生H3K4me2的富集; CYP3A7的启动子区 (-163~+103) 及增强子区GR的结合位点 (-4 054~-3 421,-6 265~-6 247) H3K4me2富集情况: 优降宁未处理组H3K4me2部分修饰,处理组均表现H3K4me2高度修饰,而在阴性对照组IgG中,几乎不发生H3K4me2的富集 (图 5)。

|
Figure 5 ChIP-qPCR validation of hepatocyte nuclear factors 4A (HNF4A) or glucocorticoid receptor (GR) binding in CYP3A4/3A7 promoter and enhancer in HepG2 cells. ChIP-qPCR enrichment,shown as % of input DNA; error bars are standard deviation from triplicate experiments. Data were shown as mean ± SD (n = 3) . P<0.05,**P<0.01,***P<0.001 vs control group |
个体发育过程中,从胎儿到成人,CYP3A4/3A7活性并非呈线性发育,随个体的生长发育发生较大变化,直接影响儿童安全用药。因此,了解发育过程中CYP3A4/3A7的变化规律,探讨其基因启动子区、增强子区组蛋白的甲基化修饰对其基因转录活性的影响,有可能预测不同个体对药物代谢能力,从而有效改善儿童患者治疗效果,为儿童患者合理、安全和有效用药提供更坚实的依据。
优降宁可显著抑制LSD1酶活性,而LSD1可特异性去除H3K4me2二甲基。Whyte等[11-13]应用胚胎干细胞CHIP-seq分析结果显示,LSD1主要富集在激活基因的增强子区及核心启动子区,发挥抑制转录调控作用,因此,优降宁可解除LSD1靶基因的转录抑制,促进靶基因转录。
本研究应用优降宁处理分离培养人原代胎肝细胞、HepG2细胞48 h后,结果显示优降宁能促进原代胎肝细胞、HepG2细胞的增殖生长,促进CYP3A4/ 3A7基因表达。文献[14]报道中草药异鼠李素可以通过激活PXR可促CYP3A4 mRNA表达,而HNF4A主要调控肝脏CYP3A4等特异性靶基因的基础表达[9, 15]。CYP3A7主要在胎儿肝脏中高表达且活性高度变异[16-19]。GR可调控CYP3A7等代谢酶及核受体基因的表达[20, 21]。ChIP-qPCR检测结果也充分显示,优降宁处理组在CYP3A4近端的启动子区 (-362~+53) 及增强子区 (-7 836~-6 093) 转录因子HNF4A结合位点,CYP3A7的启动子区 (-163~+103) 及增强子区GR的结合位点 (-4 054~-3 421,-6 265~ -6 247) 均存在H3K4me2高度修饰。
因此,HNF4A介导CYP3A4表达变化及GR调控CYP3A7的组蛋白修饰机制,可能涉及CYP3A4及CYP3A7启动子区及增强子区核受体与染色质的相互作用。优降宁处理HepG2细胞后,抑制LSD1特异性识别活化基因启动子区H3K4me2甲基化位点,导致去除H3K4me2甲基受阻,从而解除对靶基因CYP3A4/3A7的转录抑制作用,促进基因转录进行,充分说明了动态H3K4me2修饰标志对CYP3A4/3A7基因发育表达的重要性,组蛋白修饰可能通过调节染色体结构,改变了转录因子的易接近性,HNF4A、GR介导的CYP3A4/3A7发育表达改变可能涉及与靶基因启动子区及增强子区高度富集的H3K4me2相互作用、相互协同,促进CYP3A4/3A7基因的转录。H3K4me2作为基因转录过程中关键的调控因子已经明确,但LSD1介导的组蛋白H3K4去甲基化在人发育过程中CYP3A亚型表达变化及对临床用药的影响的机制尚需进一步探讨。
致谢: 郑州大学第一附属医院麻醉科主任张卫教授、产科扬凯护士长及产科所有老师在收集标本中给予大力的帮助与支持; 郑州大学基础医学院臧明玺教授在CHIP-qPCR实验中所涉及的技术方法中给予的指导和帮助。| [1] | Kouzarides T. Chromatin modifications and their function[J]. Cell, 2007, 128: 693–705. DOI:10.1016/j.cell.2007.02.005 |
| [2] | Kim TH, Barrera LO, Zheng M, et al. A high-resolution map of active promoters in the human genome[J]. Nature, 2005, 436: 876–880. DOI:10.1038/nature03877 |
| [3] | Lu H, Cui JY, Gunewardena S, et al. Hepatic ontogeny and tissue distribution of mRNAs of epigenetic modifiers in mice using RNA-sequencing[J]. Epigenetics, 2012, 7: 914–929. DOI:10.4161/epi.21113 |
| [4] | Foster CT, Dovey OM, Lezina L, et al. Lysine-specific demethylase 1 regulates the embryonic transcriptome and CoREST stability[J]. Mol Cell Biol, 2010, 30: 4851–4863. DOI:10.1128/MCB.00521-10 |
| [5] | Fang R, Barbera AJ, Xu Y, et al. Human LSD2/KDM1b/AOF1 regulates gene transcription by modulating intragenic H3K4me2 methylation[J]. Mol Cell, 2010, 39: 222–233. DOI:10.1016/j.molcel.2010.07.008 |
| [6] | |
| [7] | Deurholt T, ten Bloemendaal L, Chhatta AA, et al. In vitro functionality of human fetal liver cells and clonal derivatives under proliferative conditions[J]. Cell Transplant, 2006, 15: 811–822. DOI:10.3727/000000006783464417 |
| [8] | Vondran FW, Katenz E, Schwartlander R, et al. Isolation of primary human hepatocytes after partial hepatectomy:criteria for identification of the most promising liver specimen[J]. Artif Organs, 2008, 32: 205–213. DOI:10.1111/aor.2008.32.issue-3 |
| [9] | Tegude H, Schnabel A, Zanger UM, et al. Molecular mechanism of basal CYP3A4 regulation by hepatocyte nuclear factor 4alpha:evidence for direct regulation in the intestine[J]. Drug Metab Dispos, 2007, 35: 946–954. DOI:10.1124/dmd.106.013565 |
| [10] | Pang XY, Cheng J, Kim JH, et al. Expression and regulation of human fetal-specific CYP3A7 in mice[J]. Endocrinology, 2012, 153: 1453–1463. DOI:10.1210/en.2011-1020 |
| [11] | Whyte WA, Bilodeau S, Orlando DA, et al. Enhancer decommissioning by LSD1 during embryonic stem cell differentiation[J]. Nature, 2012, 482: 221–225. |
| [12] | Nair VD, Ge Y, Balasubramaniyan N, et al. Involvement of histone demethylase LSD1 in short-time-scale gene expression changes during cell cycle progression in embryonic stem cells[J]. Mol Cell Biol, 2012, 32: 4861–4876. DOI:10.1128/MCB.00816-12 |
| [13] | Rudolph T, Beuch S, Reuter G. Lysine-specific histone demethylase LSD1 and the dynamic control of chromatin[J]. Biol Chem, 2013, 394: 1019–1028. |
| [14] | Ding LL, Zhang JJ, Dou W. Effects of isorhamnetin on CYP3A4 and herb-drug interaction[J]. Acta Pharm Sin (药学学报), 2012, 47: 1006–1010. |
| [15] | Bolotin E, Liao H, Ta TC, et al. Integrated approach for the identification of human hepatocyte nuclear factor 4alpha target genes using protein binding microarrays[J]. Hepatology, 2010, 51: 642–653. DOI:10.1002/hep.23357 |
| [16] | Leeder JS, Gaedigk R, Marcucci KA, et al. Variability of CYP3A7 expression in human fetal liver[J]. J Pharmacol Exp Ther, 2005, 314: 626–635. DOI:10.1124/jpet.105.086504 |
| [17] | Vyhlidal CA, Pearce RE, Gaedigk R, et al. Variability in expression of CYP3A5 in human fetal liver[J]. Drug Metab Dispos, 2015, 43: 1286–1293. DOI:10.1124/dmd.115.064998 |
| [18] | Shuster DL, Risler LJ, Prasad B, et al. Identification of CYP3A7 for glyburide metabolism in human fetal livers[J]. Biochem Pharmacol, 2014, 92: 690–700. DOI:10.1016/j.bcp.2014.09.025 |
| [19] | Burk O, Tegude H, Koch I, et al. Molecular mechanisms of polymorphic CYP3A7 expression in adult human liver and intestine[J]. J Biol Chem, 2002, 277: 24280–24288. DOI:10.1074/jbc.M202345200 |
| [20] | Pascussi JM, Drocourt L, Gerbal-Chaloin S, et al. Dual effect of dexamethasone on CYP3A4 gene expression in human hepatocytes. Sequential role of glucocorticoid receptor and pregnane X receptor[J]. Eur J Biochem, 2001, 268: 6346–6358. DOI:10.1046/j.0014-2956.2001.02540.x |
| [21] | Nicolaides NC, Galata Z, Kino T, et al. The human glucocorticoid receptor:molecular basis of biologic function[J]. Steroids, 2010, 75: 1–12. DOI:10.1016/j.steroids.2009.09.002 |
 2017, Vol. 52
2017, Vol. 52


