2. 天津药物研究院, 释药技术与药代动力学国家重点实验室, 天津 300193;
3. 天津大学, 天津 300191
2. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
3. Tianjin University, Tianjin 300191, China
药物进入体内后一般以原形或代谢物的形式消除, 在参与药物代谢的各类酶中, 占主导地位的是细胞色素P450酶(cytochrome P450, CYP450)[1], 其中5种主要同工酶CYP3A4、CYP1A2、CYP2C9、CYP2C19和CYP2D6在药物代谢中起着重要作用[2]。抑制或诱导CYP450的药物可能影响其他合用药物的药代动力学, 导致药物-药物相互作用(drug-drug interaction, DDI)的发生。CYP酶抑制引起的DDI大多会增加暴露量, 对于治疗窗较窄的药物易引起临床不良反应, 严重时可危及生命; CYP酶诱导引起的DDI可减少暴露量, 降低药物的疗效。预测基于CYP酶的DDI是新药研发中评价候选药物特性的重要内容。
抗乙肝候选新药替芬泰(研究中曾用名Y101, 图 1)是基于抗乙肝病毒苗药马蹄金(Dichondra repens Forst.)的主要活性成分马蹄金素设计和合成的具有新型化学骨架的苯丙氨酸二肽类衍生物[3], 其抗病毒机制与以往抗乙肝病毒药物不同, 能强烈抑制HBV-DNA和cccDNA (covalently closed circular DNA)的活性, 具有良好的抗乙肝病毒作用, 且不易产生耐药性及停药反跳现象[4-7]。
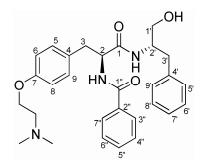 | Figure 1 Chemical structure of bentysrepinine (Y101) |
本文应用基于荧光测定的高通量CYP450酶抑制剂筛选试剂盒, 测定Y101在CYP1A2、CYP3A4、CYP2C9、CYP2C19和CYP2D6各自对应的激发波长和发射波长下的荧光强度, 计算体外抑制的酶活性, 评价Y101对CYP酶的抑制潜能。应用人原代培养肝细胞, 以“Cocktail”法混合加入CYP1A2、CYP2B6和CYP3A4的探针底物进行反应, 采用液相色谱-质谱联用(LC-MS/MS)法同时测定3种探针底物经CYP同工酶代谢的代谢产物浓度, 据此计算人原代培养肝细胞中CYP酶的剩余酶活性, 通过阳性对照组及实验组与空白对照组酶活性比值的比较, 评价Y101对CYP酶的诱导潜能。上述实验可以为阐明基于CYP酶抑制和诱导的Y101代谢性相互作用提供科学依据和参考。
材料与方法 药品与试剂Y101 (纯度99.9%, 批号20110302)由贵州省中国科学院天然产物化学重点实验室合成。利福平由Gibco公司出品, 批号109K1417;地塞米松磷酸钠注射液由湖北天药药业股份有限公司生产, 批号1204121;非那西丁由梯希爱(上海)化成工业发展有限公司生产, 批号NU3QA-FS; 对乙酰氨基酚为中国食品药品检定研究院产品, 批号100018-200408;睾酮由Acros公司出品, 批号A0286811; 6β-羟基睾酮为BD公司出品, 批号47083;盐酸安非他酮为BD公司出品, 批号33785;羟基安非他酮为BD公司出品, 批号59887;注射用奥美拉唑钠由常州四药制药有限公司生产, 批号20120329D1;苯巴比妥钠注射液为天津市人民制药厂出品, 批号20120325;内标吲达帕胺, 天津金耀氨基酸有限公司, 批号Y0703003。
体外培养体系高通量CYP450酶抑制剂筛选试剂盒, 包括以下: CYP1A2/CEC, 批号2163924; CYP2C9/MFC, 批号2139892; CYP2C19/CEC, 批号37665; CYP2D6/AMMC, 批号2317594; CYP3A4/BFC, 批号2354637, 均为美国BD-Gentest公司出品。每一试剂盒包括重组的人CYP同工酶及其专一性底物和阳性对照, 具体见表 1; 此外, 还包括NADPH生成系统、终止液和缓冲液。
| Table 1 Specific probe substrates and positive inhibitors on CYP isoforms |
人原代肝细胞由Celsis公司出品, 批号EPB, 规格为每管5×106个。多聚赖氨酸包被24孔培养板由CHI Scientific公司出品, 生产批号20120801; Williams’ E培养基、胎牛血清(fetal bovine serum, FBS)、胰岛素-转铁因子-硒补充剂(100×)、青链霉素混合液(100×)均由Gibco公司出品。
仪器Zenyth 1100荧光扫描仪为奥地利Anthos仪器公司产品; 荧光扫描专用96孔板为美国Costar公司产品; 长风牌三用电热恒温水箱为北京长风仪器仪表公司产品。HERAcell 150i二氧化碳培养箱为美国Thermo Scientific公司产品; API 4000 Q-trap LC/MS/ MS为美国Applied Biosystems公司产品; AB54-S型分析天平为梅特勒-托利多仪器(上海)有限公司产品; 3K15型高速冷冻离心机为德国Sigma公司产品; Turbo Vap LV型样品浓缩仪为美国Caliper公司产品。
体外抑制作用实验CYP2D6、CYP1A2、CYP2C9、CYP2C19和CYP3A4同工酶的抑制实验操作过程基本相同, 因此以CYP2D6的操作步骤为例进行说明: ① 溶液配制: NADPH生成系统用预热为37 ℃的水稀释成应用液1, 然后加入乙腈, 配成应用液2;取CYP2D6酶液和AMMC底物液加入到缓冲液中, 配成CYP2D6/AMMC混合液; 称取适量Y101, 以乙腈溶解并稀释至1 mmol·L-1。② 荧光测定:按实验设计在加入Y101和阳性抑制剂奎尼丁的96孔板中加入应用液1、应用液2和Y101的乙腈溶液, 用吸液管混匀; 在Y101和奎尼丁所对应行的第2~8行逐级进行稀释; 盖上96孔板, 在37 ℃恒温箱中预热10 min; 在Y101和奎尼丁所对应列每孔加入CYP2D6/AMMC混合液; 37 ℃恒温反应30 min; 加入终止液并混匀; 在荧光扫描仪上读出96孔板的荧光强度值(激发波长390 nm, 发射波长460 nm), 上述实验步骤平行操作。③ 按上述方法采用其余同工酶的试剂盒测定Y101对其他酶的荧光强度值, 荧光测定的波长分别如下: CYP1A2 (激发波长409 nm, 发射波长460 nm), CYP2C9 (激发波长409 nm, 发射波长530 nm), CYP2C19 (激发波长409 nm, 发射波长460 nm), CYP3A4 (激发波长409 nm, 发射波长538 nm), 其余实验操作步骤同CYP2D6。
IC50计算相同药物相同浓度的两个数据的平均值减去0%酶活性的平均值所得的差除以100%酶活性的平均值减去0%酶活性的平均值的差, 所得的商即为对应浓度的剩余酶活性(%), 用GraphPad Prism软件将剩余酶活性对抑制剂浓度的对数值作图, 以非线性回归分析计算半数抑制浓度(half maximal inhibitory concentration, IC50)。若IC50 < 1 μmol·L-1, 表明药物对CYP同工酶具有较强的抑制能力; 若IC50 > 1 μmol·L-1, 表明药物对CYP同工酶具有中等抑制能力; 若IC50 > 10 μmol·L-1, 表明药物对CYP同工酶有较弱的抑制能力; 若IC50 > 100 μmol·L-1, 表明药物对CYP同工酶产生抑制作用的可能性较小[8, 9]。
体外诱导作用实验平行设置空白对照组、阳性诱导剂对照组以及Y101组。用阳性诱导剂或含Y101的细胞培养液在人原代肝细胞培养72 h, 每个浓度重复3次; 诱导期结束后, 吸去含药培养液, 换用等体积含CYP2B6、CYP3A4和CYP1A2的混合探针底物的细胞培养液孵育1 h。具体操作如下: ① 从液氮罐中取出肝细胞冻存管, 立即放入37 ℃恒温水浴锅中快速晃动, 使冻存的肝细胞快速融化; ② 将冻存肝细胞的塑料管外表用75%乙醇擦拭消毒, 然后在超净工作台上打开管盖, 将细胞悬液移入离心管, 缓慢加入预温的无血清肝细胞培养基, 离心(1 200 r·min-1) 5 min后弃去上清液; ③ 用12 mL含10% FBS的肝细胞培养基悬浮沉淀细胞, 将细胞接种于赖氨酸包被的24孔培养板中, 每孔0.5 mL, 放入二氧化碳培养箱中, 在37 ℃、5% CO2下培养4 h后更换无血清的肝细胞培养基; 24 h后更换含诱导剂的培养基, 其中实验组为1、10和30 μmol·L-1 Y101;阳性对照为10 μmol·L-1利福平(CYP3A4诱导剂)、50 μmol·L-1奥美拉唑(CYP1A2诱导剂)和1 mmol·L-1苯巴比妥钠(CYP2B6诱导剂); 空白对照为0.1% DMSO。每隔24 h更换一次相同的培养基, 细胞与Y101和诱导剂的作用时间为72 h。④ 完成诱导的肝细胞用磷酸盐缓冲液洗涤一次后, 加入37 ℃预温的含混合底物(100 μmol·L-1非那西丁、200 μmol·L-1睾酮、100 μmol·L-1安非他酮)培养基, 在37 ℃保温1 h, 取肝细胞培养上清液, -80 ℃保存待测。
LC-MS/MS测定条件色谱柱: Diamonsil C18, 5 μm, 4.6 mm × 100 mm; 流动相:甲醇-甲酸铵溶液(20 mmol·L-1, 含0.1%甲酸) (65:35, v/v); 柱温: 35 ℃; 流速: 0.5 mL·min-1; 进样器温度: 4 ℃; 进样体积: 5 μL。离子化源:电喷雾离子化源, 正离子检测; 离子喷雾电压: 4.5 kV; 温度: 600 ℃; 卷帘气: 20 psi (1 psi ≈ 6.9 kPa); 喷雾气: 50 psi; 加热气: 85 psi; 碰撞气: 10 psi。扫描方式:多反应监测。
肝细胞培养的上清液样品处理肝细胞培养上清液(或空白肝细胞培养液) 100 μL, 加甲醇100 μL (或混合标准代谢产物)及内标吲达帕胺甲醇溶液(100 ng·mL-1) 200 μL, 涡旋2 min混匀, 低温12 000 r·min-1离心10 min, 分取上层有机相, 进样5 μL, 进行LC-MS/MS分析。
酶活性计算使用Analyst 1.5.2数据处理软件, 分别对对乙酰氨基酚、羟基安非他酮、6β-羟睾酮和内标吲达帕胺进行积分, 得出峰面积。以各代谢产物浓度(x)为横坐标, 各代谢产物与内标的峰面积比值(y)为纵坐标, 用加权最小二乘法(权重为1/x2)进行回归运算, 求得的直线回归方程即为校正曲线。
经校正曲线计算当日所测的各代谢产物浓度, 用于定量分析人肝细胞CYP酶代谢探针底物产生的代谢产物生成量。人肝细胞CYP同工酶的活性以各代谢产物的浓度来衡量, 计算方法见公式1。
| $ {\rm{Enzyme activity}} = \frac{{{\rm{Metabolite Conc}}{\rm{. (nmol}} \cdot {{\rm{L}}^{{\rm{ - 1}}}}{\rm{)}} \times {\rm{Volume (1}}{\rm{.5 mL)}}}}{{{\rm{Cultured time (60 min) }}}} \times 1000 $ |
参照美国FDA 2012年发布的《药物相互作用研究指导原则草案》将阳性对照组的酶活性与空白对照组进行比较, 酶活性提高2倍以上表明阳性对照组的诱导模型建模成功[10]。
以受试组相对于阳性诱导剂组的酶活性百分比评价Y101对CYP1A2、CYP2B6和CYP3A4的诱导潜能, 受试组的酶活性改变≥空白对照组的40%可判定为受试药具有酶诱导潜能。由公式2计算相对于阳性对照组的百分比。
| $ {E_{\rm{r}}}(\% ) = \frac{{{C_{{\rm{test}}}} - {C_{{\rm{control}}}}}}{{{C_{{\rm{positive control}}}} - {C_{{\rm{control}}}}}} \times 100 $ |
式2中, Er代表受试药的相对诱导百分比, Ctest、Ccontrol和Cpositive control分别代表受试组、空白对照组和阳性对照组探针底物代谢产物生成量。
结果 1 阳性抑制剂对CYP同工酶的抑制作用5种已知的专一性CYP同工酶阳性抑制剂均能明显抑制各自对应的CYP同工酶反应, 其抑制曲线均呈现倒S曲线, 抑制曲线见图 2。阳性抑制剂奎尼丁、磺胺苯吡唑和酮康唑对人重组CYP同工酶CYP2D6、CYP2C9、CYP3A4的IC50均小于1 μmol·L-1, 表明具有较强的抑制能力; 呋拉茶碱和反苯环丙胺对人重组CYP1A2、CYP2C19的IC50均大于1 μmol·L-1, 表明具有中等抑制能力。IC50的计算结果见表 2。上述结果表明, 所选CYP同工酶的专一性抑制剂均呈阳性的抑制作用, 因此该实验体系可以满足人重组CYP同工酶的抑制作用活性评价的要求。
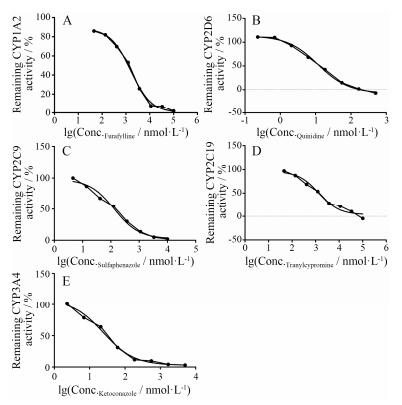 | Figure 2 Inhibition curves for furafylline inhibition of CYP1A2 with CEC as substrate (A), quinidine of CYP2D6 with AMMC as substrate (B), sulfaphenazole of CYP2C9 with MFC as substrate (C), tranylcypromine of CYP2C19 with CEC as substrate (D) and ketoconazole of CYP3A4 with BFC as substrate (E) |
| Table 2 IC50 values of five known specific inhibitors on specific CYP isoforms |
Y101对人重组CYP同工酶的抑制作用结果见表 3, 结果表明Y101对CYP2D6、CYP1A2、CYP2C9、CYP2C19和CYP3A4的IC50均大于100 μmol·L-1, 提示产生抑制作用的可能性较小。
| Table 3 Remaining enzyme activity of Y101 on CYP isoforms at serial concentrations |
含Y101的培养液作用于肝细胞后, 采用“Cocktail”法加入CYP1A2、CYP2B6和CYP3A4的混合底物(100 μmol·L-1非那西丁、100 μmol·L-1安非他酮和200 μmol·L-1睾酮), 37 ℃培养1 h后, 采用LC-MS/MS和“Cocktail”法同时测定经人原代培养肝细胞的CYP1A2、CYP2B6和CYP3A4代谢探针底物产生的代谢产物对乙酰氨基酚、羟基安非他酮和6β-羟睾酮的浓度, 按照公式1计算酶活力, 结果见表 4。
| Table 4 Enzyme activity of CYP isoforms in human hepatocyte after cultured with inducers and Y101. n=3, x±s. mmol·L-1 |
计算阳性对照及不同浓度的Y101对人肝细胞中CYP1A2、CYP2B6和CYP3A4的酶活性与阴性对照组酶活性的比值, 结果见图 3。阳性对照组CYP1A2、CYP2B6和CYP3A4的酶活性增加倍数达到2.82、9.88和2.06倍, 表明阳性诱导剂奥美拉唑、苯巴比妥、利福平均对相应CYP同工酶有诱导作用, 证明该方法可以用于Y101对CYP同工酶的诱导潜能研究。
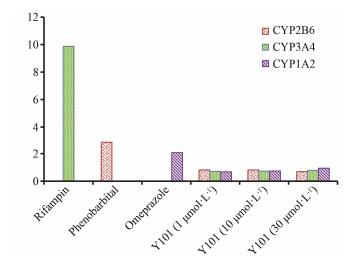 | Figure 3 Enzyme activity ratio of positive inducers and Y101 to control |
Y101以不同浓度1、10和30 μmol·L-1对原代培养人肝细胞作用72 h后, CYP1A2、CYP2B6和CYP3A4酶活性变化均较小, 与空白对照相比的酶活性比值均小于1 (在0.662至0.928之间), 与阳性对照组相比均小于其诱导能力的40%, 上述结果表明Y101对CYP1A2、CYP2B6和CYP3A4无诱导潜能。
讨论CYP酶抑制的体外评价研究方法有单一底物法、荧光测定法及LC-MS/MS和“Cocktail”法, 有研究者对上述3种方法进行比较, 结果表明3种方法获得的抑制常数IC50值均在同一数量级, 且对CYP450的抑制趋势相似[11, 12]。由于药物研发早期尽早识别具有CYP酶抑制和诱导潜质的药物可降低后期开发的费用和失败率, 而荧光测定法在研发早期显示出其他方法不可比拟的优点, 如灵敏度高、操作简便、检测快速、数据获得直接、一次实验可对多个化合物进行检测且实验周期短、可实现高通量等[13-16]。因此, 本研究采用基于荧光测定法的高通量CYP450酶抑制筛选试剂盒对Y101在CYP同工酶的抑制潜能进行初步研究, 结果显示, Y101对CYP1A2、CYP3A4、CYP2C9、CYP2C19和CYP2D6基本无抑制潜能。
鉴于CYP酶对诱导剂的反应存在明显的种属差异[17], 目前主要应用人源化体外模型进行酶诱导实验研究。人原代培养肝细胞的代谢处理系统基本保留了正常组织内的细胞活性, 能全面反映药物进入人体内的真实状态, 因此被认为是CYP诱导实验的金标准[18], 并被FDA认证为有效的诱导评价工具[10]。然而, 人原代培养肝细胞的来源紧缺且存在明显的个体间差异[19, 20], 因此实际研究中常使用冻存细胞, 并经“快速解冻”的方法[21]。该方法的优势在于[22, 23]: ① 人肝细胞CYP1A2、CYP2B6和CYP3A4的活性及mRNA的蛋白表达量均足以被标准的诱导剂所诱导; ② 克服了新鲜肝细胞由于供体间的差异导致的重复性差的问题; ③ 解决了冻存细胞贴壁难, 复苏后存活率低的问题。
本文根据2012年FDA发布的药物相互作用指南草案推荐的人肝细胞阳性诱导剂及应用浓度, 分别选用利福平、苯巴比妥、奥美拉唑作为CYP3A4、CYP2B6和CYP1A2的阳性诱导剂, 其中利福平也是CYP2C9和CYP2C19的阳性诱导剂[24]。各阳性诱导组与空白对照组相比诱导倍数均大于2, 证明采用经冻存后快速解冻的人原代培养肝细胞, 可以满足药物对CYP同工酶的诱导潜能研究的需要。
通常情况下, 体外酶抑制和诱导作用的浓度点设置, 主要是参考临床前动物体内有效剂量下的血药浓度情况。前期大鼠灌胃给予3个剂量(25、50和100 mg·kg-1)的Y101, 其最大血药浓度(Cmax)约为2 μmol·L-1。在体内CYP酶有限的情况下, 过高的浓度可能会出现酶饱和现象, 因此超出合理范围的体外浓度设置并不能真实反映体内的过程。通常体外酶抑制实验选择的最大浓度高于Cmax一个数量级即可。因此本研究初步预设Y101体外酶抑制作用的浓度为20 μmol·L-1, 酶诱导作用的最大浓度设置为30 μmol·L-1。
CYP酶活性以及mRNA转录水平和酶蛋白水平均可以作为酶诱导评价的终点指标, 有研究表明以mRNA为指标测定时高估了体内DDI, 而以酶活性为指标预测的DDI较为准确[25]。本研究应用酶活性测定作为评价终点, 这也是美国FDA指南草案推荐的酶抑制活性评价方法以及酶诱导评价的方法之一。这一方法的优点在于酶活性的改变直接反映了药物抑制或诱导CYP酶活性的影响, 酶活性的改变可评价其自身或其他合用药物清除率的变化。
虽然酶活性评价是决定药物对酶诱导能力的重要指标, 但该法存在不足是受试药对CYP酶有较强的抑制作用时, 有可能掩盖其对酶的诱导潜能。通常转录水平和酶活性之间有较好的相关性, 但在受试药既是酶抑制剂又是酶诱导剂的情况下, 对酶的最终效应则取决于抑制和诱导的程度以及用药的时程, 最初的表现可能是酶的抑制, 随着新蛋白的合成, 酶的诱导作用才逐渐显现出来[21]。因此通常情况下, 可同时测定酶活性和mRNA转录水平的变化, 排除受试物及其代谢产物的酶抑制作用对酶诱导作用等干扰因素的影响, 从而获得更为可靠的结果和合理的解释。本研究结果表明Y101对CYP3A4、CYP1A2、CYP2C9、CYP2C19和CYP2D6产生抑制作用的可能性较小, 因此酶抑制对诱导作用的干扰可能性也较小; 另一方面, 通过酶活性法评估Y101酶诱导作用的研究结果表明, Y101对CYP1A2、CYP2B6和CYP3A4无诱导潜能。基于此, 未对mRNA转录水平进行进一步的研究。
Y101对CYP450酶的体外抑制和诱导实验结果表明, Y101对CYP同工酶基本无抑制和诱导潜能, 因此也将潜在的基于CYP酶的DDI风险降至很低, 意味着Y101可能不会在联合用药的过程中产生基于CYP酶抑制或诱导的代谢性相互作用。
| [1] | Soars MG, Mc Ginnity DF, Grime K, et al. The pivotal role of hepatocytes in drug discovery[J]. Chem Biol Interact, 2007, 168 :2–15. DOI:10.1016/j.cbi.2006.11.002 |
| [2] | Wienkers LC, Heath TG. Predicting in vivo drug interactions from in vitro drug discovery data[J]. Nat Rev Drug Discov, 2005, 4 :825–833. DOI:10.1038/nrd1851 |
| [3] | Xu B, Huang Z, Liu C, et al. Synthesis and anti-hepatitis B virus activities of Matijing-Su derivatives[J]. Bioorg Med Chem Lett, 2009, 17 :3118–3125. DOI:10.1016/j.bmc.2009.03.003 |
| [4] | Xu Y, Huang ZM, Xu BX, et al. Effect of phenyialanine dipeptide compounds 073 on duck hepatitis B virus[J]. Clin J New Drug Clin Rem (中国临床新药杂志), 2010, 29 :217–220. |
| [5] | Xu Y, Huang ZM, Xu BX, et al. Effect of phenyialanine dipeptide compounds 073 on HBsAg and HBeAg of serection in cultured cell line 2.2.15[J]. Pharm J Chin People's Liberation Army (解放军药学学报), 2009, 25 :120–124. |
| [6] | Liu QC, Wang CY, He ST, et al. Effects of phenylalanine dipeptide compound Y101 on DHBV-DNA. Effects of phenylalanine dipeptide compound Y101 on DHBV-DNA[J]. Chin Pharm Bull (中国药理学通报), 2012, 28 :1389–1392. |
| [7] | Meng FC, Xu WR, Li YZ, et al. In silico molecular docking study of repensine and bentysrepinine against HBV DNA polymerase[J]. Chin Herb Med, 2015, 7 :39–44. DOI:10.1016/S1674-6384(15)60018-1 |
| [8] | Bjornsson TD, Callaghan JT, Einolf HJ, et al. The conduct of in vitro and in vivo drug-drug interaction studies:a PhRMA perspective[J]. J Clin Pharmacol, 2003, 43 :443–469. DOI:10.1177/0091270003252519 |
| [9] | Sun HX, Li H, Zhuang XM, et al. In vitro inhibition of cytochrome P450 activities by active constituents of Chinese herbal drugs[J]. Chin Pharmacol Bull (中国药理学通报), 2011, 27 :519–523. |
| [10] | U.S. Food and Drug Administration. Guidance for Industry:Drug Interaction Studies-Study Design, Data Analysis, and Implications for Dosing and Labeling[S/OL]. 2014-05-24[2016-03-12]. http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm292362.pdf. |
| [11] | Cali JJ, Ma D, Sobol M, et al. Luminogenic cytochrome P450 assays[J]. Expert Opin Drug Metab Toxicol, 2006, 2 :629–645. DOI:10.1517/17425255.2.4.629 |
| [12] | Turpeinen M, Korhonen LE, Tolonen A, et al. Cytochrome P450(CYP) inhibition screening:comparison of three tests[J]. Eur J Pharm Sci, 2006, 29 :130–138. DOI:10.1016/j.ejps.2006.06.005 |
| [13] | Yan Z, Rafferty B, Caldwell GW, et al. Rapidly distinguishing reversible and irreversible CYP450 inhibitors by using fluorometric kinetic analyses[J]. Eur J Drug Metab Pharmacokinet, 2002, 27 :281–287. DOI:10.1007/BF03192339 |
| [14] | Nayadu S, Behera D, Sharma M, et al. Fluorescent probe based CYP inhibition assay:a high throughput tool for early drug discovery screening[J]. Int J Pharm Pharm Sci, 2013, 5 :303–307. |
| [15] | Di L, Kerns EH, Li SQ, et al. Comparison of cytochrome P450 inhibition assays for drug discovery using human liver microsomes with LC-MS, rhCYP450 isozymes with fluorescence, and double cocktail with LC-MS[J]. Int J Pharm, 2007, 335 :1–11. DOI:10.1016/j.ijpharm.2006.10.039 |
| [16] | Donato MT, Jiménez N, Castell JV, et al. Fluorescence-based assays for screening nine cytochrome P450(P450) activities in intact cells expressing individual human P450 enzymes[J]. Drug Metab Dispos, 2004, 32 :699–706. DOI:10.1124/dmd.32.7.699 |
| [17] | Lin JH. CYP induction-mediated drug interactions:in vitro assessment and clinical implications[J]. Pharm Res, 2006, 23 :1089–1116. DOI:10.1007/s11095-006-0277-7 |
| [18] | Sinz M, Wallace G, Sahi J. Current industrial practices in assessing CYP450 enzyme induction:preclinical and clinical[J]. AAPS J, 2008, 10 :391–400. DOI:10.1208/s12248-008-9037-4 |
| [19] | Odette A, Fahmi OA, Boldt S, et al. Prediction of drug-drug interactions from in vitro induction data:application of the relative induction score approach using cryopreserved human hepatocytes[J]. Drug Metab Dispos, 2008, 36 :1971–1974. DOI:10.1124/dmd.108.021907 |
| [20] | Madan A, Gramham R, Carroll KM, et al. Effects of prototypical microsomal enzyme inducers on cytochrome P450 expression in cultured human hepatocytes[J]. Drug Metab Dispos, 2003, 31 :421–431. DOI:10.1124/dmd.31.4.421 |
| [21] | Chu V, Einolf HJ, Evers R, et al. In vitro and in vivo induction of cytochrome P450:a survey of the current practices and recommendations:a pharmaceutical research and manufactures of America perspective[J]. Drug Metab Dispos, 2009, 37 :1339–1354. DOI:10.1124/dmd.109.027029 |
| [22] | Hengstler JG, Utesch D, Steinberg P, et al. Cryopreserved primary hepatocytes as a constantly available in vitro model for the evaluation of human and animal drug metabolism and enzyme induction[J]. Drug Metab Rev, 2000, 32 :81–118. DOI:10.1081/DMR-100100564 |
| [23] | Hewitt NJ, Lechón MJ, Houston JB, et al. Primary hepatocytes:current understanding of the regulation of metabolic enzymes and transporter proteins, and pharmaceutical practice for the use of hepatocytes in metabolism, enzyme induction, transporter, clearance, and hepatotoxicity studies[J]. Drug Metab Rev, 2007, 39 :159–234. DOI:10.1080/03602530601093489 |
| [24] | U.S. Food and Drug Administration. Drug development and drug interactions:table of substrates, inhibitors and inducers[EB/OL]. 2014-10-27[2016-03-15]. http://www.fda.gov/Drugs/DevelopmentApprovalProcess/DevelopmentResources/DrugInteractionsLabeling/ucm093664.htm. |
| [25] | Shou M, Hayashi M, Pan Y, et al. Modeling, prediction, and in vitro in vivo correlation of CYP3A4 induction[J]. Drug Metab Dispos, 2008, 36 :2355–2370. DOI:10.1124/dmd.108.020602 |
 2016, Vol. 51
2016, Vol. 51


