2. 甘肃省人民医院, 甘肃 兰州 730000;
3. 解放军95577部队卫生队, 云南 陆良 655601
2. The People's Hospital of Gansu Province, Lanzhou 730000, China;
3. Health Team, Chinese PLA 95577 Forces, Luliang 655601, China
Brugada综合征(Brugada syndrome, BrS)是一种离子通道编码的常染色体显性遗传疾病。主要表现为右束支不典型传导阻滞伴右胸导联ST段抬高及T波倒置等心脏节律紊乱, 其猝死率高达4%~8%[1]。该综合征的发病人群主要分布在亚洲, 尤以东南亚国家为甚。由于导致BrS的发生确切机制并不明确, 药物治疗效果欠佳, 植入埋藏式心律转复除颤器的对症治疗为主要的有效手段。BrS是一种家族性原发性心电疾病, 其中由编码钠离子通道基因SCN5A突变引起的该综合征占总发病率的15%~30%[2, 3]。其细胞水平主要电生理特征表现为峰钠电流降低, 导致1相复极的内、外向电流失衡, 从而缩短动作电位时程, 加速复极, 最终诱发BrS[4]。因此, 从BrS的发生机制入手进行干预, 寻找新的治疗药物, 将是一个发展方向。
大蒜素(allitridum, All)是大蒜中的主要生物活性物质, 既往研究证实它具有心血管保护作用。本课题组前期研究发现, All对自发性高血压大鼠的心室肌细胞膜上的瞬时外向钾电流(Ito)和心房肌细胞超速激活延迟整流钾电流(IKur)均有作用, 从而减少心律失常的发生。尤其发现All可以拯救SCN5A-T353I突变所致的通道蛋白迁移缺陷, 增加峰钠电流, 提示其可能对BrS有一定的潜在治疗作用[5, 6]。前期本课题组虽然观察了All对SCN5A-F1473S的影响, 但并未就其作用机制进行探讨。故本研究应用细胞外直接灌流及与携带SCN5A-F1473S突变的HEK293细胞共培养策略, 观察All对SCN5A-F1473S电流的作用特点及可能的机制, 以期为其治疗BrS提供实验依据。
材料与方法 主要试剂及仪器HEPES、蛋白酶E (pronase E)、L-谷氨酸(L-glutamic acid)、K-aspartame acid、GTP、多非利特(dofetilide, Dof)为美国Sigma公司产品; EGTA购自美国Fluka Biochemika公司; CdCl2、TTX和CsCl购自美国Sigma公司; DMEM细胞培养基购自Thermo公司; 胎牛血清(FBS)、Lipofectamine转染试剂、Dynabead CD8磁珠为美国Invitrogen公司产品。
实验分为对照组(WT)、突变组(F1473S)和突变给药组(FS-All 30 μmol·L-1) 3组。All购于索莱宝试剂公司, 纯品是无色或淡黄色油状物, 相对分子质量为162, 结构式见图 1。将All用二甲基亚砜溶解后制备成储备液, 临用时采用细胞外液稀释成终浓度30 μmol·L-1。采用局部灌流装置, 于细胞外采用恒流灌流方式给药。为确保药物效应的一致性, 待稳定5 min后再记录电流。同时, 将空白溶解All所需体积的二甲基亚砜溶液加入细胞外液, 没有发现对电流产生影响。
 | Figure 1 Chemical formula of allitridum (All), an alkaloid extracted from Corydalis decumbens (Thunb.) Pers. Papaveraceae |
AXON-700B膜片钳系统、Digidata 1440A数模转换器、pCLAMP10.2数据处理软件(美国MDC (AXON)公司); pp-83微电极拉制仪(日本Narishige公司); MP-285三维纤维操纵仪(美国Sutter公司); SF-77B快速灌流给药系统、TC-334B双自动温控仪(美国Water公司)。
溶液的配制细胞内液(mmol·L-1): K-aspartame acid 140、MgATP 4、MgCl2 1、EGTA 10、GTP 0.1、HEPES 10, KOH调至pH 7.3;细胞外液(mmol·L-1): NaCl 140、KCl 4、CaCl2 1、MgCl2 1、HEPES 10、葡萄糖5, NaOH调至pH 7.4。
HEK293细胞培养与pcDNA3.1-SCN5A-F1473S质粒转染培养HEK293细胞系, 取镜下观察培养良好的HEK293细胞, 细胞状态应符合以下条件: ① 镜下观察细胞内无明显颗粒和空泡; ② 培养液清亮, 无偏酸或偏碱征象; ③ 相差显微镜下观察培养液无黑色颗粒和小碎片; ④ 细胞分布均匀; ⑤ 细胞边界清晰; ⑥ 细胞贴壁生长融合率达到50%~70%。转染步骤参考试剂盒中说明书, 应用Lipofectamine-2000转染试剂进行转染, 加入绿色荧光蛋白(GFP)表达质粒0.2 μg, 与含有目的基因的质粒共转染, 作为阳性转染细胞的指示剂, 再根据质粒的浓度加入所需转染的相应质粒体积目的质粒pcDNA3.1-SCN5A-F1473S 0.5 μg。选取转染后48~72 h, 荧光显微镜下观察转染效率为50%~80%的HEK293细胞。使用PBS冲洗1次, 加入胰酶消化约1 min后, 迅速加入培养基终止消化。吹打后, 以1:10比例传至35 mm培养皿, 放置于细胞培养箱中5 h, 荧光显微镜下观察转染情况, 将转染阳性的细胞用于膜片钳记录[6]。
全细胞膜片钳的电流记录在倒置荧光显微镜下观察, 选择边缘清楚、表面光滑、大小适中、呈球形或多边形, 不与其他细胞连结且带有绿色荧光的细胞进行操作。连接Axon-700B膜片钳放大器与计算机。由软件(pCLAMP10.2)控制, 应用Digidata 1440A数模转换器采集刺激信号及电压输入信号。GG-17玻璃毛坯经pp-83微电极拉制仪拉制成尖端直径2~4 μm, 入液电阻为2.0~5.5 MΩ的电极。电极入液后进行液接电位补偿校正, 使电位小于±2 mV, 调节三维操纵器使电极尖端移向细胞表面进行封接, 使电阻达1 GΩ以上形成高阻封接(giga seal), 进行快电容补偿以消除仪器引入的电容误差, 采用脉冲式方式负压吸破细胞膜形成全细胞记录模式。测定电容时, 施以0.4 V·s-1的斜坡刺激, 测电流并按方程Cm=I/(dV/dt)计算(Cm为膜电容, I为电流值, dV/dt即电压斜率)。采用全细胞膜片钳记录方法, 在电压钳制下记录电流。为消除细胞间的误差, I值以电流密度(pA/pF)表示。信号经截止频率为1 kHz的四阶贝塞尔低通滤波器滤波, 采样率为5 kHz。串联电阻补偿90%~95%以消除电压偏差; 应用仪器自动进行约85%~90%慢电容补偿, 以消除细胞膜电容导致的充放电影响。所有实验均在细胞破膜后稳定2~3 min, 再刺激并记录给药前的数据, 其后用药物灌流5 min并记录给药后的数据。为避免通道电流的衰减现象(rundown)对实验结果产生影响, 控制在细胞破膜后20 min内完成实验[6, 7]。储存采样后的数据, 以供测量和分析通道的电生理特性。整个实验在室温下(22~24 ℃)进行。
电流记录程序及数据分析INa记录 保持电位-120 mV, 施予50 ms, 阶跃10 mV, -70~+40 mV的去极化脉冲, 记录INa电流。
INa的稳态激活(steady-state activity, SSA)曲线 保持电位-90 mV, 施予-70~+40 mV, 500 ms的去极化脉冲, 阶跃为10 mV, 记activityl。将电流标准化, 以各电压下的刺激脉冲为横轴, 标准化尾电流为纵轴作图。并用Boltzmann方程(G/Gmax=1/{1+exp[(V1/2-Vm)/k]})进行曲线拟合求出半激活电压(V1/2, act)和激活曲线斜率(kact)[8]。
INa的稳态失活(steady-state inactivity, SSI)曲线 保持电位-90 mV, 施予-120~10 mV, 阶跃10 mV, 1 000 ms的快速脉冲, 紧接着在每一条件脉冲后紧跟一固定去极化至-35 mV, 50 ms的测试脉冲, 记录INa。用Boltzmann方程(I/Imax=1/{1+exp[(Vm-V1/2)/k]})进行曲线拟合求出半失活电压(V1/2, inact)和曲线斜率(kinact)。
INa的中间态失活(intermediate-state inactivity, ISI)曲线 采用双刺激模型引出, 施予-10 mV, 1、2、5、10、25、50、100、250、500、2 000和5 000 ms不同时间的刺激, 回复至110 mV, 间隔20 ms, 再给予-10 mV, 25 ms记录电流, 曲线用单项指数式拟合, 中间态失活时间常数(τ)被求算。
INa的关闭态失活(closed-state inactivity, CSI)曲线 采用双刺激模式, 钳制电位为-80 mV, 在刺激电位-70 mV, 给予1、2、4、10、20、50、100、200、400、500、1 000和2 000 ms等不同时间, 然后阶跃到-10 mV, 25 ms记录电流, 决定通道在与刺激期间的可利用性(availability)。关闭态失活时间常数用单项指数式: I/Imax=I0 + A*EXP (t/τ)拟合。τ为关闭态失活时间常数[9]。
共聚焦显微镜检测通道蛋白的分布转染后HEK293细胞再继续培养36 h后, 使用4%多聚甲醛进行固定, 对细胞的固定一般需要15 min, 之后再用0.3% Triton X-100透化处理。以上处理完成后, 加入10%牛血清白蛋白(BSA)封闭, 再用兔抗鼠Nav1.5一抗和GFP荧光的二抗孵育后, 适量的抗荧光猝灭封固液, 封片固定。之后利用Zeiss Ism 510 Meta荧光共聚焦成像显微镜进行观察, 采集图像后保存[10]。
Western blot技术检测通道蛋白表达取各组HEK293细胞, 用胞膜制备试剂盒来提取膜蛋白及总蛋白, 加入预冷的蛋白裂解液1 mL, 在冰上匀浆30 min, 使通道蛋白充分裂解。将匀浆后的组织液倒入1.5 mL EP管中煮沸5 min, 10 000 r·min-1离心1 min, 放于-80 ℃冰箱。BCA法进行蛋白定量, SDS-PAGE电泳分离样品后电转移至PVDF膜, 4 ℃封闭过夜。加入1:400兔抗鼠Nav1.5抗体, 4 ℃孵育过夜后加入羊抗兔二抗(Alexa Fluor 700, 1:1 000) 37 ℃孵育1 h显色, 采用凝胶成像分析系统测定各条带的吸光度值以此代表蛋白表达量。
统计学处理所有数据以x±s表示, 采用pCLAMP10.2进行数据处理, spss17.0软件进行统计学处理, 多组间数据比较用ANOVA方差分析, 组间两两比较用SNK-q检验, P < 0.05具有显著性差异。
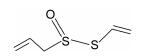
结果 1 All对SCN5A-F1473S电流密度的作用SCN5A-F1473S突变的INa峰电流密度明显低于WT, 峰电流密度从WT的298.2±17.5 pA/pF降至132.1±15.3 pA/pF (n=12, P < 0.01)。应用All 30 μmol·L-1于细胞外灌流15 min后, 突变电流明显回升, 电流密度增加至269.8±16.6 pA/pF (n=15, P < 0.01), 见图 2A, B。进一步将终浓度为1、3、10、30和100 μmol·L-1 All加入细胞外液, 观察对电流的影响, 发现其作用呈浓度依赖性, 半数有效浓度(EC50)为25.21 μmol·L-1, Hill系数为0.90, 见图 2C。电流-电压曲线显示, 在-30~0 mV的刺激范围内, 药物对突变的钠电流有明显的增加效应, 尤其在峰至附近更为显著, 对WT电流也有增加, 但幅度较少, 见图 2D。
 | Figure 2 Effect of SCN5A-F1473S channels by All. A, B: Representative F1473S and WT current traces recorded from the cells after incubating with All 30 μmol·L-1. The F1473S sodium peak current (132.1±15.3 pA/pF, n=12, P < 0.01) is obviously lower than that of control group (298.2±17.5 pA/pF). The FS-ALL sodium peak current (269.8±16.6 pA/pF, n=15, P < 0.01) increases significantly, compared with F1473S; C: Concentration-response relationship of the effects of All. EC50 of All is 25.21 μmol·L-1; D: A representative current-voltage relationship for FS current. All increases the sodium current obviously with stimulation between -30 -0 mV. **P < 0.01 vsWT; ##P < 0.01 vs F1473S |
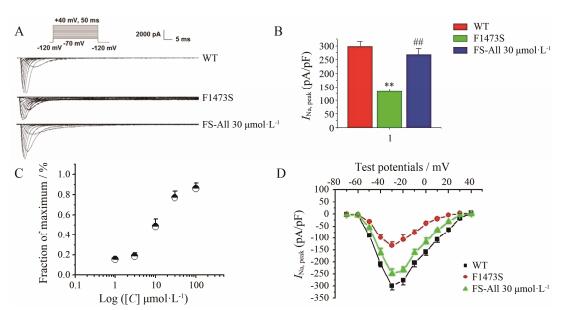
图 3A显示, INa的稳态激活曲线在应用All 30 μmol·L-1后基本不变, V1/2, act突变电流为-27.2±3.1 mV, 而用药组为-29.8±1.4 mV, 二者的k值变化也不大。图 3B显示, 突变细胞的INa电流的稳态失活曲线向超极化方向移动, V1/2, inact由-72.4±5.3 mV移至-88.7±3.6 mV (n=15, P < 0.01)。应用All 30 μmol·L-1后, V1/2, inact恢复至-79.5±2.4 mV (n=15, P < 0.01)。
 | Figure 3 Effects of All on the steady-state activation (SSA) and steady-state inactivation of SCN5A (SSI). A: Steady-state activation curves are not shown different. B: In the absence and the presence of All 30 μmol·L-1, steady-state inactivation curves of F1473S were showed. The steady-state inactivation curve of the mutational group (-88.7±3.6 mV, n=15, P < 0.01) moves to the super polarization direction, compared with control group (-72.4±5.3 mV). The mutational group V1/2, inact returns to -79.5±2.4 mV after using All (n=15, P < 0.01) |
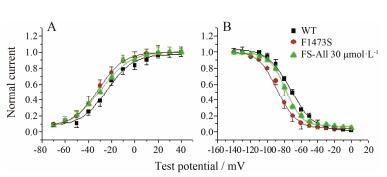
如图 4A, B所示, 与WT相比, 突变电流中间态失活的时间常数明显缩短, 从WT的643.8±32.5 ms缩短至451.2±26.4 ms, 在应用All 30 μmol·L-1后, 中间态失活的时间常数延长至598.1±22.6 ms (n=15, P < 0.01);而关闭态失活的时间常数在野生型、突变及用药后分别为388.4±36.3、366.9±19.1和375.2±20.0 ms, 虽有差异, 但无统计学意义, 见图 4C, D。
 | Figure 4 Effect of All on intermediated-state inactivation (ISI) and closed-state inactivation of SCN5A current (CSI). A, B: Representative time constants of ISI are changed by All 30 μmol·L-1 (n=15, P < 0.01). C, D: Representative time constants of CSI are not affected by All 30 μmol·L-1. All represents allitridum. ISI represents intermediated-state inactivation. CSI represents closed-state inactivation |
图 5A显示荧光显微镜检测结果, 与WT相比突变钠通道在细胞膜分布明显降低, 即存在通道迁移缺陷, 在应用All 30 μmol·L-1与携带SCN5A-F1473S编码的Nav1.5钠通道的HEK293共同培养24 h后, 细胞膜钠通道分布增加, 提示药物对突变通道蛋白有一定的逆转作用。采用Western blot检测也发现, 突变钠蛋白在细胞膜表达下调(与WT相比, P < 0.01), 与药物共同培养后, 细胞膜突变钠通道蛋白细胞上调(与F1473S相比, P < 0.01), 而3组细胞总蛋白中钠通道蛋白无统计学差异, 见图 5B。
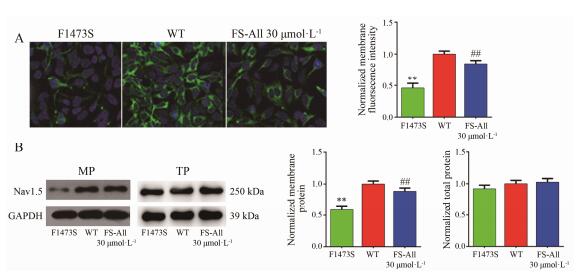 | Figure 5 Effect of All on the cellular distribution of SCN5A channels relative to the plasma membrane. A: The confocal imaging was performed using HEK293 cells expressing SCN5A-GFP (n=15, P < 0.01). B: Western blot analysis of the expression of SCN5A channel protein instably transfected HEK293 cells. The expression of channel proteins in the cell membrane decreases in mutational group (n=15, P < 0.01), withal increases after using All (n=15, P < 0.01). The expression of total channel proteins is not statistically significant in each group. **P < 0.01 vs WT. ##P < 0.01 vsF1473S. TP: Total protein; MP: Membrane protein |
BrS治疗关键在于防止室颤的发生, 减少猝死率。理论上, 任何基因或药物的干预可能减少Ito电流或增加INa电流, 可纠正心电图异常, 抑制BrS波的发生。但目前尚缺乏这种理想的有效药物, IA类和IC类中普鲁卡因胺、氟卡胺等药物不但不改善Ito离子, 还阻滞INa, 加重BrS心电图特征, 甚至诱发室颤[11]。奎尼丁因具有对Ito阻滞特性, 同时抑制2相折返和室速的发生, 纠正心电图异常, 防止室颤出现, 成为目前推荐治疗BrS的唯一药物, 但其抑制INa临床价值尚待研究。寻找新的抗遗传性BrS的药物显得十分重要。Chen等最早证实了编码心脏钠通道基因(SCN5A)的α亚单位突变是BrS的遗传学基础之一[11, 12], 其中约20%~25% BrS来自编码心脏钠通道(Nav1.5) α亚基的SCN5A基因功能丧失型突变, 其细胞电生理的典型标志是钠峰电流降低[13, 14]。因此, 针对SCN5A基因突变寻找抗遗传性BrS新药的策略, 会有较好的前景。
本实验发现, All对于SCN5A-F1473S突变的电流降低有显著的缓解作用, 可以使峰钠电流密度显著增加。研究发现, 峰钠电流密度作为遗传性BrS在细胞水平的重要电生理标志, 其减少意味着动作电位0相除极速度和幅度降低, 引起传导减弱。提示由于超射降低, 与1相复极的外向Ito电流比例失衡, 从而缩短1相或2相复极, 或导致复极的不均一性, 进而诱发BrS波。钠电流的改变, 尤其是峰电流的降低, 可以引起心肌细胞去极化速度和幅值降低, 表现为Vmax和动作电位幅度减少, 进而导致心肌组织传导减慢, 主要为有效不应期延长, 临床上以BrS为主要表型。而作者发现应用All后, 峰钠电流增加, 将缓解上述电生理的异常改变, 可望对BrS有抑制效应。
通道门控机制研究发现, All可以使突变通道的稳态失活右移, 提示在同样去极化电位时, 钠通道减弱; 并且药物可以使SCN5A-F1473S通道的中间态失活时间常数增加, 延长通道的慢失活时间, 但药物并未影响通道的稳态激活过程和关闭态失活时间常数。因此, 认为All增加峰钠电流在通道动力学层面的机制主要是通过改善突变通道的失活特别是慢失活过程实现的。研究显示, 钠通道基因突变导致的峰电流降低多与通道蛋白从细胞内向膜迁移发生障碍有关, 而SCN5A-F1473S突变同样可引起Nav1.5通道蛋白的迁移缺陷。因此, 进一步观察了All对突变通道在细胞膜的分布和表达的影响, 发现可增加通道蛋白在细胞膜的分布, 上调Nav1.5通道蛋白在细胞膜上的表达。突变通道电流的改变来自两方面:一是通道门控动力学改变, 主要表现为稳态失活左移(超极化), 同时, 中间态失活加速, 从而导致电流降低。应用大蒜素后, 可以逆转上述两个过程。二是突变通道蛋白向细胞膜迁移发生障碍, 使得细胞膜有效通道数量减少, 进而引起电流下降。药物可以影响突变蛋白在细胞膜上的分布和表达, 提示药物对突变通道有一定的逆转效应, 使得细胞膜有效蛋白的数量增加, 导致峰钠分流的恢复, 最终影响复极。因此, All对突变通道迁移障碍的作用也是峰钠电流增加的主要机制之一。
本研究在排除其他干扰电流的前提下, 仅观察单独表达的SCN5A-F1473S电流的药物效应。但已知心脏电活动由多种离子流共同构成, 由于携带SCN5A-F1473S突变的心肌或类心肌细胞较难获得, 故本研究未涉及All对细胞动作电位的影响, 其影响有待进一步的研究阐明。
| [1] | Zhang J, Chen Y, Yang J, et al. Electrophysiological and trafficking defects of the SCN5A T353I mutation in Brugada syndrome are rescued by alpha-allocryptopine:consensus report[J]. Eur J Pharmacol, 2015, 746 :333–343. DOI:10.1016/j.ejphar.2014.09.028 |
| [2] | Clancy CE, Wehrens XH. Mutation-specific effects of lidocaine in Brugada syndrome[J]. Int J Cardiol, 2007, 121 :249–252. DOI:10.1016/j.ijcard.2007.05.060 |
| [3] | Wilde AA, Antzelevitch C, Borggrefe M, et al. Proposed diagnostic criteria for the Brugada syndrome:consensus report[J]. Circulation, 2002, 106 :2514–2519. DOI:10.1161/01.CIR.0000034169.45752.4A |
| [4] | Priori SG, Napolitano C, Paganini V, et al. Molecular biology of the long QT syndrome:impact on management[J]. Pacing Clin Electrophysiol, 1997, 20 :2052–2057. DOI:10.1111/pace.1997.20.issue-8 |
| [5] | Chen C, Wang Y, Zhang DX, et al. Effects of allitridum on ultra rapid delayed rectifier potassium current in rabbit atrial cardiomyocytes[J]. Chin J Mult Organ Dis Elderly (中华老年多器官疾病杂志), 2013, 12 :381–386. |
| [6] | Zhang J, Lin K, Wei Z, et al. Effects of allitridum on rapidly delayed rectifier potassium current in HEK293 cell line[J]. J Southern Med Univ (南方医科大学学报), 2015, 35 :1128–1132. |
| [7] | Dan Q, Zhao Y, Wu ZJ, et al. Effect of allitridum on remodeling of the transient outward potassium current of ventricular myocytes of spontaneously hypertensive rats[J]. Acta Pharm Sin (药学学报), 2015, 50 :39–44. |
| [8] | Lan Y. Effects of Nerve Growth Factor on the Myocardial Cells and Sympathetic Nerve of Non-infarcted Zone in a Rabbit Model of Healed Myocardial Infarction (神经生长因子对陈旧性心梗兔非梗死区心肌细胞及交感神经作用机制的研究)[D]. Beijing:PLA Medical School, 2011. |
| [9] | Liu Y. Effects of Oxidative Stress on Electrophysiology in Rabbit Atrial Myocytes and Protective Effects of Drugs (氧化应激对兔心房肌细胞电生理的影响及药物的保护作用)[D]. Beijing:PLA Medical School, 2012. |
| [10] | Hu P, Du Y, Wang Y, et al. Construction and verification of R104W mutant of SCN5A sodium channel[J]. J Xi'an Jiaotong Univ (Med Sci) (西安交通大学学报(医学版)), 2015, 36 :435–438. |
| [11] | Xiang JT. Ventricular fibrillation domestic literature statistical analysis between 1998 and 2005[J]. Chin J Cardiac Pacing Electrophysiol (中国心脏起搏与心电生理杂志), 2006, 20 :387–390. |
| [12] | Chen J, Zheng L, Li J, et al. The frameshift mutation of gene SCN5A leads to Brugada syndrome[J]. Chin J Cardiol (中华心血管病杂志), 2002, 30 :538–541. |
| [13] | Ren F, Yang J, Li W, et al. The novel SCN5A mutation of Brugada syndrome in a Chinese male patient[J]. Chin J Cardiac Arrhyth (中华心律失常学杂志), 2003, 7 :336–339. |
| [14] | Kapplinger JD, Tester DJ, Alders M, et al. An international compendium of mutations in the SCN5A-encoded cardiac sodium channel in patients referred for Brugada syndrome genetic testing[J]. Heart Rhythm, 2010, 7 :33–46. DOI:10.1016/j.hrthm.2009.09.069 |
 2016, Vol. 51
2016, Vol. 51


