鞘脂类是生物膜的重要组成成分, 具有保护细胞内物质的作用。近年来, 随着生物技术的发展以及人类疾病谱的复杂化, 人类对鞘脂类的认识不断深入。现在认为, 鞘脂类不仅是生物膜的重要组成成分, 同时还在细胞生命活动信号转导中发挥重要作用。鞘氨醇-1-磷酸(sphingosine-1-phosphate, S1P)是近年来发现的具有重要生理功能的生物活性脂类, 广泛存在于血液、淋巴液、红细胞、中性粒细胞、血小板等体液和细胞中。S1P由神经鞘磷脂经多步酶促反应生成, 受到多种酶的调控。神经鞘磷脂在鞘磷脂酶(sphingomyelinase, SMase)的催化下生成神经酰胺, 在神经酰胺酶(ceramidase, CDase)的催化下生成鞘氨醇, 在鞘氨醇激酶(sphingosine kinase, SPHK)的催化下生成S1P[1]。细胞在形成S1P的同时, 可经S1P磷酸化酶(S1P phosphorylase)作用脱去磷酸基生成鞘胺醇, 也可经S1P裂解酶(S1P lyase, S1PL)不可逆地分解为磷脂酰乙醇胺和棕榈醛, 从而保证了人体生理环境中S1P的动态平衡。S1P既可作为第二信使直接作用于细胞内靶标, 也可经转运蛋白转运到细胞外与相应的受体结合[2], 激活一系列下游信号通路产生重要生理功能, 如细胞的增殖、迁移、存活、凋亡和细胞通讯等, 参与免疫调节、造血调控、同种异体移植反应、糖代谢调节和炎症调节[3]等多种生理功能。近年来, 基于S1P信号通路的药物研发已成为自身免疫疾病、肿瘤等相关领域的研究热点。本文将对S1P信号通路相关的药物研究进展进行归纳和总结, 为进一步的新药研发提供参考。S1P代谢途径及信号通路示意图见图 1。
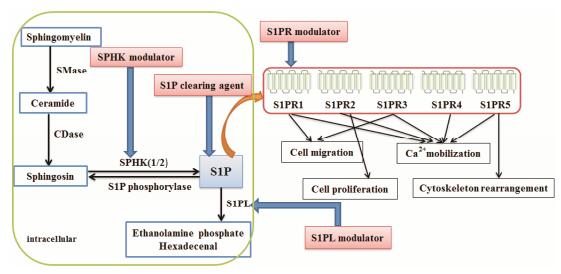 | Figure 1 S1P metabolism and S1P receptor-mediated signaling pathway |
由于S1P分布的广泛性和功能的多样性, 使其与多种生理和病理过程相关。所以通过对酶或受体的调节, 使疾病部位S1P的浓度发生改变, 从而起到治疗和缓解疾病的目的。
在心血管系统中, S1P主要参与血管生长和血管紧张度调节等重要功能, 在抑制动脉粥样斑块生长、治疗心肌梗死、调节心肌肥大中发挥重要作用[4]。有研究发现, S1P可以通过PI3K/Akt信号通路减轻心肌缺血再灌注损伤, 具有保护心肌的作用[5]; 此外, S1P和ERK1/2信号通路对小鼠肥厚心肌缺血再灌注具有缺血后适应保护作用[6]; 还有研究表明, 经S1P处理的原代骨髓间充质干细胞(BM-MSCs)更易内皮化[7], 从而促进BM-MSCs更好地修复损伤的心肌细胞, 促进BM-MSCs的临床应用。
在糖代谢方面, S1P可增加胰岛素抵抗细胞摄取葡萄糖的能力, 改善糖代谢。在胰岛素诱导正常人肝L02细胞成功构建的胰岛素抵抗模型中, 有研究发现S1P可以促进模型细胞的糖代谢, 提示S1P可以作为筛选降糖药的新靶点[8]。也有研究发现, 高血糖可以激活S1P/SPHK1信号通路[9], 使肾小球系膜细胞增殖, 与糖尿病肾病的发生发展相关, 为临床糖尿病肾病的治疗提供了新的思路。
在免疫系统中, 抑制SPHK激活能显著或者甚至完全阻断促炎物质引起的细胞反应, 如Ca2+的代谢、脱颗粒、趋化性和细胞因子的分泌。此外, S1P还可通过与细胞表面的S1P受体结合, 使受体内陷, 诱导淋巴细胞回巢, 抑制淋巴细胞自外周淋巴结及次级淋巴器官的外流, 阻止淋巴细胞到达炎性损害或移植物的位置, 具有免疫调控的作用。S1P信号通路参与多种自身免疫病的发生发展, 如多发性硬化症、系统性红斑狼疮、类风湿性关节炎、溃疡性结肠炎[10]等。S1P拮抗剂可使淋巴细胞停留在淋巴组织内, 防止进入外周血和炎性病变部位, 从而抑制外周的免疫反应。近年来, S1PR的选择性和非选择性调节剂的研发已成为治疗自身免疫病药物的新趋势。
肿瘤方面, 神经酰胺和鞘氨醇主要引起细胞周期阻滞和促进细胞凋亡, 而S1P则主要促进细胞存活。催化S1P生成的关键酶SPHK1由于具有肿瘤的癌基因特性且在多种肿瘤细胞中高表达, 上调SPHK1的表达能够增强细胞的致癌性[11], 所以S1P与鞘氨醇之间的平衡决定了细胞的命运, SPHK已成为肿瘤治疗的靶点, SPHK的选择性和非选择性抑制剂已在不同的研发阶段。
在呼吸系统中, 最近在肺部炎症研究中发现, 其血清和肺泡灌洗液中S1P及SPHK表达增加, 并通过S1P/SPHK信号通路调节肺血管重塑、气道高反应性和平滑肌收缩等, 从而影响肺部相关疾病的发生发展[12], 如哮喘、肺纤维化、肺炎、肺癌和慢性阻塞性肺病等。S1P信号通路相关药物的研发可能为肺部难治性疾病提供新的治疗靶点。
在其他方面, S1P可以提高骨骼肌成肌细胞DNA合成、促进细胞生长[13], 在肌损伤细胞移植治疗中具有重要作用。S1P在缺氧条件下对人视网膜色素上皮细胞的增生有促进作用, 对细胞的凋亡有抑制作用[14], 由于缺氧是脉络膜新生血管的关键因素, 也是许多眼部疾病的病理基础, 所以随着S1P研究的进一步深入, 其相关机制有望成为脉络膜新生血管治疗的新靶点。最近研究还发现, SPHK/S1P/S1PR信号系统介导的血管生成在肝纤维化中起重要作用[15], 可能会为肝纤维化治疗提供新的思路。
总之, S1P作为生物活性脂质与很多生理和病理过程相关, 与其相关的药物研发已成为医药领域研究的热点。
2 S1P信号通路相关的药物研究进展在S1P信号通路上, 某些药物可以通过激动或抑制S1P受体从而改变S1P在不同疾病中的生理功能。S1P受体属于G蛋白偶联受体, 有5个亚型, 即S1PR1-5, 其中S1PR1-3广泛表达于各种组织, S1PR4主要在淋巴系统和血液系统中表达, S1PR5主要在中枢神经系统中表达[16], 而S1PR不同亚型的选择性或非选择性的调节剂已作为自身免疫疾病的治疗药物。此外, SPHK和S1P裂解酶是影响S1P发挥重要生理功能的关键酶, 通过增加或减弱相应酶的活性调节S1P在不同细胞中的浓度, 从而起到治疗不同疾病的作用。S1P在血液和淋巴液中的含量丰富, 但是在组织液中的含量很低, 这就形成了组织和血液淋巴液之间的S1P梯度[17], 这种S1P梯度导致了T、B淋巴细胞、树突状细胞等的迁移。SPHK作为S1P生物合成中的关键酶, 有SPHK1和SPHK2两个亚型, 有大量报道显示前者与肿瘤相关, 所以SPHK目前主要作为开发肿瘤化疗药物的新靶点。
2.1 S1P受体调节剂S1P受体调节剂是目前研发最多且很重要的炎症和免疫应答的调节剂, 是自身免疫病治疗的新靶点。S1P受体调节剂的研究始于FTY-720, 是第一个被FDA批准的, 由诺华公司研发的用于治疗多发性硬化症(MS)的一线口服药物, 作用于除S1PR2以外的其他4种受体, 其磷酸化产物FTY-720-P与S1P分子结构类似, 可竞争性结合S1PR1, 使受体发生内陷, 抑制淋巴细胞自外周淋巴结及次级淋巴器官的外流, 使外周淋巴细胞减少, 发挥免疫抑制作用。FTY-720诱导淋巴细胞“归巢”的作用是可逆的, 停药后淋巴细胞可恢复至正常水平, 较少影响机体的正常免疫功能。目前FTY-720处于MS的Ⅲ期临床试验, 对自身免疫病、同种异体移植反应、肿瘤[18]等疾病均有治疗作用。但随着FTY-720临床深入研究, 发现FTY720的受体选择性不高, 在激动S1PR1的同时也可激动S1PR3, 引起心肌传导G蛋白的门控内向整流钾通道激活, 从而导致临床出现心动过缓、房室传导阻滞等不良反应, 极大程度地限制了其应用。这就需要研发选择性更强、不良反应更小的S1P受体调节剂。
通过对FTY-720疏水侧链的结构修饰, 诺华公司又研发了BAF312, 是S1PR1和S1PR5的双重激动剂, 其对S1PR1和S1PR5的激动作用超过S1PR2-4的1 000倍, 并能显著而持久地诱导S1PR1内在化, 由于对S1PR3激活较弱, 因此心脏的不良反应较小[19], 目前在进展型MS的Ⅲ期临床试验、多肌炎和复发缓解型多发性硬化症(RRMS)的Ⅱ期临床试验中[20]。最近的研究发现, BAF312可以调节神经胶质细胞功能、减轻神经脱髓鞘, 所以BAF312可治疗除MS外的神经脱髓鞘紊乱疾病[21]。FTY-720的另一个衍生物是KRP-203, 具有较高的S1PR1选择性, 对S1PR1的选择性是S1PR3的1 000倍, 并未观察到引起心动过缓的不良反应[22], 现已在溃疡性结肠炎(UC)和全身性红斑狼疮的Ⅱ期临床试验中[20], 并有研究发现KRP-203可以显著延长同种异体移植胰岛的存活期[23], 这为糖尿病的治疗带来了新的希望。日本小野药品工业公司开发的ONO-4641是一种S1PR1和S1PR5高选择性的激动剂, 用于MS的治疗, 已进入Ⅱ期临床研究, 但临床数据报道很少[22]。日本Daiichi Sankyo公司研制的用于MS的药物CS-0777, 对S1PR1具有很高的选择性, 现已进入Ⅱ期临床试验, 在小鼠的实验性自身免疫性脑脊髓炎模型中表现出对MS有较好的疗效[24]。
瑞士Actelion生物制药公司通过高通量筛选技术研发出的ACT-128800 (Ponesimod), 是选择性的S1PR1调节剂, 免疫抑制作用具有剂量依赖性。与FTY-720相比半衰期更短, 免疫抑制作用的可逆性更高。Ⅱ期临床试验显示ACT-128800对牛皮癣有治疗作用, 这个发现提示S1PR1的调节剂对自身免疫病有疗效。目前在复发型MS的Ⅲ期临床中检测其安全性和有效性, 同时宿主移植反应的Ⅱ期临床试验也在进行[25]。
Arena制药公司研发的APD334是一种结构新颖的选择性S1PR1功能抑制剂, 临床前试验数据显示具有良好的药效和药动学特性, 在小鼠实验性自身免疫性脑脊髓炎模型中药效良好, 并对大鼠胶原介导的关节炎模型有作用[26]。目前在一系列自身免疫病治疗的Ⅰ期临床中[20]。Gonzalez研究小组研发的化合物CYM5442是选择性S1PR1激动剂, 与鞘氨醇结构类似, 是一种真菌的代谢产物, 最近研究发现CYM5442可能作为移植抗宿主病(GVHD)的潜在治疗药物[27], 在不影响供体T细胞向靶器官渗入的前提下, 可以显著降低GVHD器官中的巨噬细胞水平。Recepto公司开发的RPC1063也是S1PR1的选择性激动剂, 现在已进入RRMS和UC的Ⅱ期临床试验, 并已在健康志愿者体内证明在治疗剂量下不会延长QT间期, 也不会改变心率[20]。
此外, 还有一些正在临床前试验的S1PR选择性调节剂, 如SEW2871是S1PR1的选择性激动剂, 在小鼠的缺血再灌注损伤模型中可以减弱CD4+ T细胞的炎症反应, 从而减轻肾损伤。最近又在小鼠IL-/-模型中发现可以改善结肠炎症状[28], 有望成为人类克罗恩病的治疗药物。ASP4058是一种结构新颖的S1PR1和S1PR5激动剂, 在体外GTPγS结合实验中优先激动S1PR1和S1PR5, 大鼠口服给药后可以减少外周淋巴细胞数, 并抑制实验性自身免疫脑脊髓炎的发展, 并能阻止复发缓解型脑脊髓炎的复发[29], 与FTY-720相比安全性更高。这些都有望成为治疗人类自身免疫病更安全有效的药物。
2.2 SPHK调节剂神经酰胺和鞘氨醇可以引起细胞的周期阻滞和促进细胞凋亡, 而S1P主要促进细胞的存活, 所以鞘氨醇与S1P之间的平衡决定细胞的命运。S1P由SPHK磷酸化鞘氨醇而来, 所以调节SPHK也会引起S1P浓度的改变。大量数据说明SPHK与肿瘤相关, 即SPHK已经成为肿瘤治疗的新靶点。SPHK有两个亚型, 即SPHK1和SPHK2, 虽然高度同源, 但在表达、调控及亚细胞定位上差别很大[30], 这也就说明其功能存在差异, SPHK1主要促进细胞的存活与增殖, SPHK2的功能相对比较复杂, 所以对于SPHK1的研究更为深入, 而SPHK的调节剂也主要是SPHK1的抑制剂。
药理学模型中常用的SPHK1抑制剂主要为鞘氨醇类似物, 如二羟基神经酰胺(DHS)和N, N-二甲基鞘氨醇(DMS), 它们在多种肿瘤细胞中都显示出诱导肿瘤细胞凋亡的作用, 但二者的选择性较差, 除了抑制SPHK1的活性, 还可以作用于PKC等其他激酶, 从而产生肝毒性和红细胞溶血[31]等不良反应。另一种鞘氨醇类似物的SPHK1抑制剂沙芬戈(safingol), 作用于SPHK1、PKC和PI3K, 在结肠癌中可引起自噬反应[32]。此外, 水溶性的鞘氨醇类似物SK1-Ⅰ是特异性的SPHK1抑制剂, 对SPHK2、神经酰胺酶和其他蛋白激酶均无影响, 可以诱导急性骨髓性白血病细胞凋亡[33], 另有实验证实SK1-Ⅰ还可以延长颅内恶性胶质瘤异种细胞移植的裸鼠生存期[34]。
SPHK1抑制剂除了鞘氨醇类似物之外, 通过人重组的SPHK1筛选出第一类非脂类的SPHK抑制剂, 其中SKⅠ-Ⅱ通过降低SPHK1蛋白的表达而减少S1P的生成[35], 对多种癌细胞具有细胞毒性且口服有效。有研究表明SKⅠ-Ⅱ在人胃癌细胞中可以逆转耐药性, 并可以加强抗癌药物顺铂的抗癌活性[36], 而与低剂量的DNA烷化剂替莫唑胺合用可以克服后者的耐药性并增强细胞毒性, 更快地诱导恶性胶质瘤细胞凋亡[37], 近期研究发现SKⅠ-Ⅱ除了抑制SPHK1之外, 对SPHK2也有一定的抑制作用并且Ki值明显低于SPHK1。苯妥帝尔(phenoxodiol)是一种异黄酮的衍生物, 通过改变NADH氧化酶的活性影响SPHK1的活性, 目前正在进行顺铂和紫杉醇耐药卵巢癌的Ⅲ期临床试验[38]。PF-543是一种吡咯烷醇类化合物, 是目前报道的抑制作用最强的新型的选择性SPHK1抑制剂, 可与鞘氨醇竞争性结合SPHK1的活性位点, 能够有效地抑制人全血中SPHK1的活性[39], 降低镰刀型红细胞数, 无溶血不良反应[40], 为镰刀型细胞疾病(SCD)的治疗带来了希望。
虽然SPHK1的抑制剂研究较多, 但首先进入临床试验的是SPHK2抑制剂ABC294640, 目前正在进行实体瘤患者的Ⅰ期临床试验。ABC294640对SPHK2具有较高的选择性, 能够抑制乳腺癌、胰腺癌和肾癌细胞的增殖, 在动物模型上有效且无全身毒性。有趣的是, ABC294640还可以与雌激素受体结合, 具有抗雌激素的效应[41], 所以在雌激素阳性乳腺癌治疗过程中, ABC294640通过对SPHK和雌激素的双重抑制产生更好疗效。最近又有研究发现, ABC294640在体内外实验中均可抑制结直肠癌细胞的生长[42], 这为国内发病率较高的结直肠癌的治疗带来了新的希望。K145是SPHK2的选择性抑制剂, 人白血病U937细胞实验研究结果表明, K145可通过抑制SPHK2的活性而降低U937细胞中S1P的浓度, 并促进U937细胞的凋亡; 裸鼠腹腔注射或口服K145后可抑制U937癌细胞的增殖[43], K145的发现推进了寻找SPHK2选择性抑制剂的进程, 为人类白血病的治疗带来了希望。
还有一些天然产物如白藜芦醇和作用较强的脒类化合物都是正在研究的SPHK的抑制剂。SPHK抑制剂为肿瘤化疗药物的发展提供了新的靶点, 也为肿瘤耐药提供了新的解决方案。
2.3 S1P裂解酶调节剂S1P在裂解酶的催化下生成磷脂酰乙醇胺和棕榈醛, 是不可逆的降解反应。高浓度S1P可以介导S1P受体的内在化, 在免疫系统中减少淋巴细胞向外迁移, 从而起到免疫抑制效果。而S1P在组织-血液淋巴液之间的浓度梯度依赖于S1PL的活性。S1PL抑制剂可以抑制S1P的降解, 产生免疫抑制效果, 用于自身免疫疾病的治疗。
有研究发现食物和饮品中着色剂成分2-乙酰-4-四羟基丁基咪唑(THI)可诱导动物免疫系统的淋巴细胞减少[44]。此外, S1PL的辅酶是吡哆醛磷酸盐(PLP), 维生素B6的类似物4-脱氧吡哆醛(DOP)通过抑制PLP而降低S1PL的活性, 从而提高S1P的水平, 但由于影响其他酶的活性而不良反应较多。这些结果提示, 可以从食品、天然产物中寻找先导物, 也可通过抑制辅酶降低S1PL的活性, 但需要提高特异性, 降低对其他酶的影响。相信随着研究的深入开展, 会开发出高效低毒的用于自身免疫病治疗的S1PL抑制剂。
2.4 S1P的清除剂SPHK调节剂和S1P裂解酶调节剂都是作用于S1P的合成和分解过程, 从而降低或提高不同疾病部位S1P的浓度, 达到治疗疾病的目的。而S1P清除剂是直接作用于S1P, 减少肿瘤、炎症、纤维化等疾病部位S1P的浓度而抑制其功能。最早发现的S1P清除剂是抗S1P的抗体, LT1009是鼠科单克隆抗体LT1002的人源化单抗, 能够与S1P特异性结合, 体外生物实验表明LT1009可以抑制S1P介导的血管生成反应, 且对其他脂类无交叉作用[45], 目前正在进行肿瘤和老年黄斑病变的Ⅰ期临床试验。S1P清除的另一种方法是可溶性S1PL重组酶的应用, 小鼠静脉注射原核生物的S1PL重组酶, 可以降低血浆中的S1P水平[46]。S1P清除剂的出现为肿瘤等疾病带来了新的希望, 但用于临床则需要考虑过敏反应等问题。
3 展望S1P是具有重要生理功能的活性脂质, 与自身免疫性疾病、肿瘤等多种疾病相关, S1P信号通路上的药物可通过调节S1P受体、调控S1P生成或降解酶从而起到治疗和缓解疾病的目的。目前上市的S1P受体调节剂主要是以FTY720为代表, 但由于FTY720受体选择性不高, 出现心动过缓等不良反应, 从而限制其临床应用, 新药研发者为了降低这些不良反应, 通过结构修饰和优化, 研发出受体选择性更高的多类化合物, 目前已进入不同的临床试验阶段。此外, 影响S1P浓度的SPHK调节剂、S1PL调节剂、S1P清除剂也日益引起关注, 目前一些小分子化合物、抗体或重组酶正在进行临床前或临床试验研究。相信随着研究的不断深入, S1P通路调节剂将为自身免疫性疾病、肿瘤等相关疾病的治疗带来新的靶向和希望。
| [1] | Duan HF, Wang LS, Wu ZZ. Progress in the study of physiological function of sphingosine 1-phosphate[J]. Prog Physiol Sci (生理科学进展), 2003, 34 :16–20. |
| [2] | Liu X, Zhang QH, Yi GH. Regulation of metabolism and transport of spingosine-1-phosphate in mammalian cells[J]. Mol Cell Biochem, 2012, 363 :21–33. DOI:10.1007/s11010-011-1154-1 |
| [3] | Baranowski M, Gorski J. Heart sphingolipids in health and disease[J]. Adv Exp Med Biol, 2011, 721 :41–56. DOI:10.1007/978-1-4614-0650-1 |
| [4] | Sun LX, Mei HF, Li H, et al. Sphingosine-1-phosphate signaling pathway:a novel therapeutic target for cardiovascular diseases[J]. Prog Pharm Sci (药学进展), 2014, 38 :886–891. |
| [5] | Del Re DP, Miyamoto S, Brown JH. Focal adhesion kinase as a RhoA-activable signaling scaffold mediating Akt activetion and cardiomyocyte protection[J]. J Biol Chem, 2008, 283 :35622–35629. DOI:10.1074/jbc.M804036200 |
| [6] | Li HX, Li XM, Chen BD, et al. Effects of ischemic postconditioning on hypertrophic myocardium by sphingosine-1 phosphate signal transduction pathways[J]. Hainan Med J (海南医学), 2015, 26 :1–4. |
| [7] | Yang L, Chang N, Liu X, et al. Bone marrow-derived mesenchymal stem cells differentiate to hepatic myofibroblasts by transforming growth factor-1 via sphingosine kinase/sphingosine 1-phosphate (S1P)/S1P receptor axis[J]. Am J Pathol, 2012, 181 :85–97. DOI:10.1016/j.ajpath.2012.03.014 |
| [8] | Fang HJ, Feng Q, Wang Q, et al. Effect of S1P on the glucose metabolism of L02 liver cells insulin resistance model[J]. Basic Clin Med (基础医学与临床), 2015, 35 :1025–1030. |
| [9] | Deng YH, Lan T, Huang J, et al. Sphingosine kinase-1/sphingosine 1-phosphate pathway in diabetic nephropathy[J]. Chin Med J, 2014, 127 :3004–3009. |
| [10] | Liang J, Naqahashi M, Kim EY, et al. Sphingosine 1-phosphate links persistent STAT3 activation, chronic intestinal inflammation and development of colitis-associated cancer[J]. Cancer Cell, 2013, 23 :107–120. DOI:10.1016/j.ccr.2012.11.013 |
| [11] | Zhang CX, He HW, Shao RG. Sphingosine kinase 1 and tumor[J]. Acta Pharm Sin (药学学报), 2013, 48 :971–978. |
| [12] | Dai FF, Zhu LM, Dai AG. Research progress of sphingosine 1-phosphate and lung disease[J]. J Clin Pathol Res (临床与病理杂志), 2014, 35 :111–117. |
| [13] | Yu H, Xiong JJ, Chen PL, et al. Effects of sphingosine 1-phosphate (S1P) on DNA synthesis of skeletal myoblast cells in rats[J]. Fudan Univ J Med Sci (复旦学报·医学版), 2013, 40 :423–427. |
| [14] | Fan Y, Lu H, Hou DS, et al. Promoting proliferation and inhibiting apoptosis effects of sphingosine-1-phospate on human retinal pigment epithelium cells under the hypoxic condition[J]. China J Exp Ophthalmol (中华实验眼科杂志), 2015, 33 :33–37. |
| [15] | Yang L, Yue S, Yang L, et al. Sphingosine kinase/sphingosine 1-phosphate (S1P)/S1P receptor axis is involved in liver fibrosis-associated angiogenesis[J]. EASL J Hepatol, 2013, 59 :114–123. DOI:10.1016/j.jhep.2013.02.021 |
| [16] | Lynch KR, Macdonald TL. Sphingosine-1-phosphate chemical biology[J]. Biochim Biophys Acta, 2008, 1781 :508–512. DOI:10.1016/j.bbalip.2008.06.006 |
| [17] | Hla T, Venkataraman, Michaud J. The vascular S1P gradient cellular sources and biological significance[J]. Biochim Biophys Acta, 2008, 1781 :477–482. DOI:10.1016/j.bbalip.2008.07.003 |
| [18] | Zheng MK, Xiao H, Li Y, et al. A novel immunosuppressant fingolimod:research advances[J]. J Int Pharm Res (国际药学研究杂志), 2013, 40 :100–104. |
| [19] | Pan S, Gray NS, Gao W, et al. Discovery of BAF312(siponimod), a potent and selective S1P receptor modulator[J]. ACS Med Chem Lett, 2013, 4 :333–337. DOI:10.1021/ml300396r |
| [20] | Urbano M, Guerrero M, Rosen H, et al. Modulators of the sphingosine 1-phosphate receptor 1[J]. Bioorg Med Chem Lett, 2013, 23 :6377–6389. DOI:10.1016/j.bmcl.2013.09.058 |
| [21] | O'Sullivan C, Schubart A, Mir AK, et al. The dual S1PR1/S1PR5 drug BAF312(siponimod) attenuates demyelination in organotypic slice culture[J]. J Neuroinflammation, 2016, 13 :31–45. DOI:10.1186/s12974-016-0494-x |
| [22] | Komiya T, Sato K, Shioya H, et al. Efficacy and immunomodulatory actions of ONO-4641, a novel selective agonist for sphingosine-1-phosphate 1 and 5, in preclinical models of multiple sclerosos[J]. Clin Exp Immunol, 2013, 171 :54–62. DOI:10.1111/cei.2013.171.issue-1 |
| [23] | Khattar M, Deng R, Kahan BD, et al. Novel sphingosine 1-phosphate receptor modulator KRP203 combined with locally-delivered regulatory T-cells induces permanent acceptance of pancreatic islet allografts[J]. Transplantation, 2013, 95 :919–927. DOI:10.1097/TP.0b013e3182842396 |
| [24] | Nishi T, Miyazaki S, Takemoto T, et al. Discovery of CS-0777:a potent, selective, and orally active S1P1 agonist[J]. ACS Med Chem Lett, 2011, 2 :368–372. DOI:10.1021/ml100301k |
| [25] | D'Ambrosio D, Freedman MS, Prinz J, et al. Ponesimod, a selective S1P1 receptor modulator:a potential treatment for multiple sclerosis and other immune-mediated diseases[J]. Ther Adv Chronic Dis, 2016, 7 :18–33. DOI:10.1177/2040622315617354 |
| [26] | Buzard DJ, Kim SH, Lopez L, et al. Discovery of APD334:design of a clinical functional antagonist of sphingosine-1 phosphate-1 receptor[J]. ACS Med Chem Letters, 2014, 5 :1313–1317. DOI:10.1021/ml500389m |
| [27] | Cheng Q, Ma SB, Lin DD, et al. The S1P1 receptor-selective agonist CYM-5442 reduces the severity of acute GVHD by inhibiting macrophage recruitment[J]. Cell Mol Immunol, 2015, 12 :681–691. DOI:10.1038/cmi.2014.59 |
| [28] | Dong J, Wang H, Wu G, et al. Oral treatment with SEW2871, a sphingosine 1-phosphate type 1 receptor agonist, ameliorates experimental colitis in interleukin-10 gene deficient mice[J]. Clin Exp Immunol, 2014, 177 :94–101. DOI:10.1111/cei.2014.177.issue-1 |
| [29] | Yamamoto R, Okada Y, Hirose J, et al. ASP4058, a novel agonist for sphingosine 1-phosphate receptors 1 and 5, ameliorates rodent experimental autoimmune encephalomyelitis with a favorable safety profile[J]. PLoS One, 2014, 9 :e110819. DOI:10.1371/journal.pone.0110819 |
| [30] | Taha TA, Hannun YA, Obeid LM. Sphingosine kinase:biochemical and cellular regulation and role in disease[J]. J Biochem Mol Biol, 2006, 39 :113–131. |
| [31] | Pyne NJ, Pyne S. Sphingosine 1-phosphate and cancer[J]. Nat Rev Cancer, 2010, 10 :489–503. DOI:10.1038/nrc2875 |
| [32] | Pitman MR, Pitson SM. Inhibitors of the sphingosine kinase pathway as potential therapeutics[J]. Curr Cancer Drug Targets, 2010, 10 :354–367. DOI:10.2174/156800910791208599 |
| [33] | Paugh SW, Paugh BS, Rahmani M, et al. A selective sphingosine kinase-1 inhibitor intergrates multiple molecular therapeutic targets in human leukemia[J]. Blood, 2008, 112 :1382–1391. DOI:10.1182/blood-2008-02-138958 |
| [34] | Kapitonov D, Allegood JC, Mitchell C, et al. Targeting sphingosine kinase-1 inhibits Akt signaling, induces apoptosis, and suppresses growth of human glioblastoma cells and xenografts[J]. Cancer Res, 2009, 69 :6915–6923. DOI:10.1158/0008-5472.CAN-09-0664 |
| [35] | Ren S, Xin C, Pfeilschifter J, et al. A novel mode of the putative sphingosine kinase inhibitor 2-(p-hydroxyanilino)-4-(p-chlorophenyl) thiazole (SKⅠ-Ⅱ):induction of lysosomal sphingosine kinase-1 degradation[J]. Cell Physiol Biochem, 2010, 26 :97–104. DOI:10.1159/000315110 |
| [36] | Liu Y, Zhu Z, Cai HX, et al. SKⅠ-Ⅱ reverses the chemoresistance of SGC7901/DDP gastric cancer cells[J]. Oncol Lett, 2014, 8 :367–373. |
| [37] | Noack J, Choi J, Richter K, et al. A sphingosine kinase inhibitor combined with temozolomide induces glioblastoma cell death through accumulation of dihydrosphingosine and dihydroceramide, endoplasmic reticulum stress and autophagy[J]. Cell Death Dis, 2014, 5 :e1425. DOI:10.1038/cddis.2014.384 |
| [38] | Mahoney S, Arfuso F, Millward M, et al. The effects of phenoxodiol on the cell cycle of prostate cancer cell lines[J]. Cancer Cell Int, 2014, 14 :110–122. DOI:10.1186/s12935-014-0110-z |
| [39] | Schnute ME, Mcreynolds MD, Kasten T, et al. Modulation of cellular S1P levels with a novel, potent specific inhibitor of sphingosine kinase-1[J]. Biochem J, 2012, 444 :79–88. DOI:10.1042/BJ20111929 |
| [40] | Zhang Y, Berka V, Song A, et al. Elevated sphingosine-1-phosphate promotes sickling and sickle cell disease progresssion[J]. J Clin Invest, 2014, 124 :2750–2761. DOI:10.1172/JCI74604 |
| [41] | Antoon JW, White MD, Meacham WD, et al. Antiestrogenic effects of the novel sphingosine kinase-2 inhibitor ABC294640[J]. Endocrinology, 2010, 151 :5124–5135. DOI:10.1210/en.2010-0420 |
| [42] | Xun C, Chen MB, Qi L, et al. Targeting sphingosine kinase 2(Sphk2) by ABC294640 inhibits colorectal cancer cell growth in vitro and in vivo[J]. J Exp Clin Res, 2015, 34 :94–103. DOI:10.1186/s13046-015-0205-y |
| [43] | Liu K, Guo TL, Hait NC, et al. Biological characterization of 3-(2-amino-ethyl)-5-[3-(4-butoxyl-phenyl)-propylidene]-thiazolidine-2, 4-dione (K145) as a selective sphingosine kinase-2 inhibitor and anticancer agent[J]. PLoS One, 2013, 8 :e56471. DOI:10.1371/journal.pone.0056471 |
| [44] | Ohtoyo M, Tamura M, Machinaga N, et al. Sphingosine 1-phosphate lyase inhibitor by 2-acetyl-4-(tetrahydroxybutyl) imidazole (THI) under conditions of vitamin B6 deficiency[J]. Mol Cell Biochem, 2015, 400 :125–133. DOI:10.1007/s11010-014-2268-z |
| [45] | O'Brien N, Jones ST, Williams DG, et al. Production and characterization of monoclonal anti-sphingosine-1-phosphate antibodies[J]. J Lipid Res, 2009, 50 :2245–2257. DOI:10.1194/jlr.M900048-JLR200 |
| [46] | Huwiler A, Bourquin F, Kotelevets N, et al. A prokaryotic S1P lyase degrades extracellular S1P in vitro and in vivo:implication for treating hyperproliferative disorders[J]. PLoS One, 2011, 6 :e22436. DOI:10.1371/journal.pone.0022436 |
 2016, Vol. 51
2016, Vol. 51


