2. 中国中医科学院中药资源中心, 道地药材国家重点实验室培育基地, 北京 100700
2. State Key Laboratory of Dao-di Herbs, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
24-烷基甾醇是植物中起主导作用的甾醇, 它可构成膜结构并对植物生长发育有重要调节作用[1]。在高等植物中, 24-烷基甾醇主要包括24-甲基甾醇、24-乙基甾醇及24-去甲基甾醇[2]。植物甾醇经异戊二烯途径合成, 其上游合成途径与三萜类化合物一致, 在鲨烯合酶 (squalene synthase, SQS) 的作用下两分子的法呢酯焦磷酸 (farnesyl diphosphate, FPP) 缩合生成鲨烯 (squalene, SQ)[3], 继而经鲨烯环氧酶 (squalene epoxidase, SE) 催化生成2, 3-氧鲨烯 (2, 3-oxidosqualene), 在此植物甾醇与三萜类化合物的分支点上, 环阿屯醇合酶(cycloartenol synthase, CAS) 促进代谢流向甾醇方向流动[4], 而此后阶段的初始步骤则是由甾醇C-24甲基转移酶 (SMT) 催化, 它是植物甾醇生物合成途径上的重要限速酶[1]。SMT主要通过修饰侧链C24位发挥作用, C24位侧链的不同使得高等植物与脊椎动物间甾醇化合物的种类有所区别[5]。SMT分为两个家族, 分别催化甾醇生物合成途径上的两个步骤, SMT1催化环阿屯醇生成24-亚甲基环阿屯醇, 进而生成24-甲基甾醇, 在此途径中, 中间产物24-亚甲基胆甾烯醇被SMT2催化形成一个新的分支, 从而形成24-乙基甾醇[6]。
雷公藤Tripterygium wilfordii作为我国传统中药, 具有清热解毒、消肿散结、活血化瘀等多种功效[7]。药理研究表明具有免疫调节、抗炎、骨保护、抗肿瘤等多种活性, 在临床上常用于治疗麻风、类风湿性关节炎等疾病[8], 同时在抗肿瘤、抗器官移植排斥等方面作用显著[9]。
本课题组通过比较转录组方法, 发现并克隆鉴定了一系列参与雷公藤次生代谢的重要功能基因[10-16], 其中, 三萜类化合物作为雷公藤重要活性组成成分, 其生物合成的中上游基因基本已被克隆, 并进行了功能鉴定, 决定其化学构型的下游生物合成途径关键酶基因研究也已陆续展开, 甾醇类化合物与三萜类化合物的上游合成途径基本相同, 其下游合成途径处于三萜类途径的旁路, 对雷公藤甾醇类化合物途径上相关基因的研究一方面可能对雷公藤生长发育起调节作用, 另一方面可通过突变等方法抑制该通路基因的表达以提高其旁路三萜类的生物合成。为此, 从雷公藤悬浮细胞转录组数据中, 发现一条甾醇C-24甲基转移酶基因, 并对其进行了全长的克隆, 利用生物信息学的方法对其全长序列进行分析后, 预测所得基因应归属SMT2家族; 进一步对此基因进行茉莉酸甲酯 (MJ) 诱导表达分析及IPTG诱导蛋白表达分析。
作为甾醇生物合成途经上的重要限速酶, 已有研究表明, 将SMT2基因过表达后, 在24-乙基甾醇含量提高的同时, 24-甲基甾醇含量会有所下降, 并可进一步引起植株生长发育不良, 导致植株相对矮小, 但可通过提高24-甲基甾醇中菜油甾醇的含量弥补这一缺陷, 说明甾醇类化合物含量变化对植物生长发育有重要调节作用[17-19]。因此, 本研究将对进一步研究SMT2基因功能及调节雷公藤生长发育方面的研究奠定基础。
材料与方法植物材料 雷公藤悬浮细胞为本实验室在0.5 mg·L-1 2, 4-D + 0.1 mg·L-1 KT + 0.5 mg·L-1 IBA的MS液体培养基中, 25 ℃、120 r·min-1暗培养所得。
菌株 实验使用的E.coli trans 5α及BL21 (DE3) 菌株均购自北京全式金生物技术有限公司。
试剂及仪器 RNA纯化试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒购自天根生化科技 (北京) 有限公司, SMARTer™ RACE cDNA Amplification Kit购自美国Clontech公司; pEASY-T3 Cloning Kit, 2×EasyTaq PCR SuperMix、一抗Anti-MBP Mouse mAb、二抗Goat Anti-Mouse lgG、HRP购自北京全式金生物技术有限公司; DNase I、Phusion HF PCR Master Mix、BamHI内切酶、Xba I内切酶及T4 DNA连接酶购自NEB (北京) 有限公司; IPTG为Sigma品牌, 购自北京普益华科技有限公司; KAPA SYBR® FAST Universal qPCR Kit购自KAPA Biosystems公 司; 荧光定量PCR仪型号为LightCycle®480Ⅱ; PCR扩增仪型号为ABI verity; 蛋白电泳仪型号为: BIO- RAD Mini-PROTEAN® Tetra System; 蛋白扫描仪型号: UMAX PowerLOOK 21OOXL-USB; Western Blot凝胶成像系统型号: chemidoc MP; Western blot超敏发光液溶液A及溶液B均购自北京普利莱基因技术有限公司; 其他化学试剂为国产分析纯。
雷公藤悬浮细胞RNA的提取 取培养10天的雷公藤悬浮细胞用茉莉酸甲酯 (MJ) 诱导, MJ终浓度为50 μmol·L-1, 分别于诱导后的4、12、24、72、120 h取材用CTAB法提取总RNA, 后经DNase I和RNA纯化试剂盒纯化, 去除基因组污染。用1% 琼脂糖凝胶电泳检测以确保RNA质量。
TwSMT2末端快速扩增 采用SMARTer™ RACE cDNA Amplification Kit试剂盒将雷公藤悬浮细胞的提取RNA反转录成cDNA, 根据雷公藤转录组数据, TwSMT2 5' 端序列完整, 3' 端缺失, 为获得全长序列设计3'-RACE Primer, 引物序列为TwSMT2 (3' RACE Primer CCCTTCCATCCCAGGCAAATCTCAC)。以3'-RACE Ready cDNA为模板进行扩增。3' RACE 50 μL反应体系为2.5 μL cDNA、5 μL 10×UPM、1 μL 3' RACE Primer (10 μmol·L-1)、34.5 μL PCR-grade water、5 μL 10×Advantage 2 PCR Buffer、1 μL dNTP mix (10 mmol·L-1) 及1 μL 50×Advantage 2 polymerase。反应程序为: 94 ℃反应5 min; 94 ℃ 30 s, 68 ℃ 30 s, 72 ℃ 3 min共25个循环; 最后72 ℃保持7 min。PCR产物经切胶回收后按照pEASY-T3 载体试剂说明书操作, 与pEASY-T3载体连接, 转化大肠杆菌trans 5α感受态细胞, 选取阳性克隆进行测序。对3'测序结果进行拼接, 得到TwSMT2 cDNA全长序列。
TwSMT2全长cDNA的克隆 将3' RACE与转录组数据进行拼接, 得到TwSMT2全长序列, 用ORF Finder找到TwSMT2基因ORF序列, 并在其两端设计特异性引物TwSMT2 F: ATGGATTCTCTGGTTC TATTCTGTA, TwSMT2 R: TTAAGACGAAGCGGTT CTGG扩增TwSMT2 ORF全长, 以5' RACE cDNA 为模板, 50 μL反应体系包括: 25 μL 2×Phusion HF PCR Master Mix、1 μL cDNA、TwSMT2正反引物 (10 μmol·L-1) 各2.5 μL、19 μL ddH2O。反应程序为: 预变性98 ℃ 30 s; 98 ℃ 10 s , 55 ℃ 20 s , 72 ℃ 40 s 重复35个循环; 终延伸72 ℃ 7 min。扩增产物经琼脂糖凝胶纯化试剂盒纯化后, 连接pEASY-T3, 而后转化大肠杆菌trans 5α感受态细胞, 挑取单克隆菌斑进行菌液PCR鉴定, 并选择将阳性克隆送测序获取TwSMT2全长ORF序列。
TwSMT2全长基因生物信息学分析 将测序获取的基因全长序列在NCBI (http://www.ncbi.nlm.nih.gov/) 网站进行Blast蛋白质及核酸同源比对, 并用DNAMAN软件翻译成氨基酸序列后与其他物种进行多重序 列比对, 用MEGA 5.1建立系统进化树以分析与其他物种的亲缘关系, Compute PI/Mw (http://web.expasy. org/compute_pi/) 在线预测蛋白质分子质量与理论等电点, predictprotein (http://www.predictprotein.org/) 进行二级结构预测, SWISS-MODEL (http://swissmodel. expasy.org/) 三维同源建模。
MJ诱导表达TwSMT2基因 将不同时间点MJ诱导雷公藤悬浮细胞所提取的RNA反转成cDNA, 用RT-PCR方法检测TwSMT2表达含量变化。所用看家基因引物为β-actin F: AGGAACCACCGATCCA GACA; β-actin R: GGTGCCCTGAGGTCCTGTT。根据RT-PCR引物设计原则设计TwSMT2特异性引物, 引物序列为TwSMT2 F: TTTGAGGTCGTGAAGGAG AA; TwSMT2 R: TAATCAGCGGTGTGGAACA。反应体系为: 10 μL 2×KAPA SYBR® FAST qPCR Master Mix2 Universal、正反向引物各0.5 μL、cDNA模板 1 μL, 用水补足至20 μL。反应条件采用两步法: 95 ℃反应5 min; 95 ℃ 3 s, 60 ℃ 33 s, 重复40个循环。每个反应做3次技术重复, 用2-ΔΔCt法分析TwSMT2基因相对表达量。
pMAL-c2X-TwSMT2载体构建 构建蛋白表达的载体为pMAL-c2X, 根据载体序列, 选取两个酶切位点BamH I和Xba I, 在得到的全长TwSMT2 cDNA开放阅读框两端设计含有酶切位点的引物TwSMT2F (BamH I): CGGATCCATGGATTCTCTGGTTCTATTC TGTA, TwSMT2R (Xba I): CTCTAGAAGACGAAGC GGTTCTGG) 进行PCR扩增, 并经琼脂糖凝胶纯化试剂盒纯化后得到含有酶切位点的目的片段, pMAL- c2X载体与目的片段同时用BamH I和Xba I内切酶37 ℃反应3 h进行双酶切, 酶切产物经切胶回收后, 测所回收DNA片段浓度, 并按照T4 DNA连接酶说明书配反应体系16 ℃连接过夜, 连接产物转化trans 5α感受态细胞后涂布于LB+100 (mg·L-1) Amp的固体培养基上培养, 而后选取单克隆菌斑进行菌液PCR, 选取阳性克隆测序进一步验证, 以确保阳性克隆准确性。将测序正确的菌液提取质粒, 得到重组质粒pMAL-c2X-TwSMT2。
IPTG诱导蛋白表达及蛋白提取纯化 将重组质粒与空载体pMAL-c2X分别转化到大肠杆菌表达型感受态细胞BL21 (DE3), 选取阳性单克隆菌落37 ℃ 250 r·min-1摇14 h后, 按1.5‰的比例各扩大培养50 mL, 37 ℃摇到OD600约为0.8后, 加入异丙基硫代半乳糖苷 (IPTG) 至终浓度1 mmol·L-1, 低温16 ℃诱导表达20 h。低温诱导的菌液4 ℃ 10 000×g离心15 min收集菌体, resuspension buffer 10~20 mL·L-1 (菌液), 重悬菌体。加入chicken white lysozyme (50 mg·mL-1) 于重悬菌体中, 至终质量浓度0.5 mg·mL-1, 混均, 冰上静置20 min。加入10% Triton X-100至终浓度0.1%。加入1/10体积的5 mol·L-1 NaCl溶液, 超声破碎 5 min (超声5 s, 暂停5 s, 功率30 w), 重复破碎一次, 4 ℃、12 000×g离心30 min。将上清液与1 mL amylose resin混匀 (resin事先用5倍柱体积wash buffer清洗), 4 ℃离心1 h, 静置15 min, 10倍柱体积wash buffer清洗后再用10倍柱体积resuspension buffer清洗。 加入2倍柱体积elution buffer洗脱, 4 ℃静置10 min, 收集洗脱液, 重复此步骤两次, 收集洗脱液。过蛋白超滤管 (100 kDa) 进行浓缩。提取纯化过程中用到的试剂配方见表 1。
| Table 1 The formula of buffers in the process of purifying proteins |
诱导蛋白表达检测 分别将上述纯化蛋白进行SDS-PAGE及Western blot检测。均取5 μL浓缩液 进行电泳, SDS-PAGE检测需在经考马斯亮兰染色及洗脱液脱色后用蛋白扫描仪扫描检测蛋白表达; 而Western blot检测方法为: 在电泳结束前20 min开始着手配制电转液 (Tris 58 g、Gly 29 g、SDS 3.7 g, 加入200 mL甲醇, 加入去离子水至1 L)。转膜之前将海绵、胶、滤纸都用预冷的电转液浸泡20 min, PVDF膜有疏水性, 用甲醇泡10 min。将阴极碳板 (黑)、海绵、滤纸、胶、膜、滤纸、海绵、阳极碳板 (白) 按顺序摆放放入电泳盒中, 100 V、60 min, 冰浴中进行转膜。将转好的PVDF膜取出, 用双蒸水洗5 min, 再用5% 脱脂奶溶液置于振荡器上封闭1 h, 取出用PBST洗3遍, 每遍5 min, 继而进行一抗杂交, 加入10 mL 5% 脱脂奶溶液, 再以2 000∶1比例加入一抗Anti-MBP Mouse mAb, 置于振荡器上封闭1 h, 取出用PBST洗3遍, 每遍5 min; 后加入10 mL 5% 脱脂奶溶液, 再以5 000∶1比例加入二抗Goat Anti-Mouse IgG, HRP, 置于振荡器上封闭1 h, 取出用PBST洗3遍, 每遍5 min; 将Western blot超敏发光液溶液A和溶液B两种显色底物1∶1 (700 μL) 等体积混合后将其覆盖在膜表面使其均匀, 用透明薄膜把膜包起来, 用Western blot凝胶成像系统检测蛋白表达。
结果与分析 1 雷公藤TwSMT2全长cDNA的获得根据转录组数据, 设计特异性引物进行PCR扩增, PCR产物经1% 琼脂糖凝胶电泳检测, 在约1 000 bp处得到一条明亮条带 (图 1), 经测序验证后, 得到TwSMT2基因ORF序列。
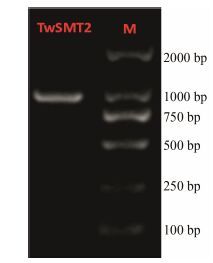
|
Figure 1 The ORF of TwSMT2 |
TwSMT2基因全长1 631 bp, ORF Finder分析其开放阅读框1 080 bp, 编码359个氨基酸。将此TwSMT2基因用DNAMAN软件翻译成氨基酸序列后与其他物种的SMT1、SMT2两个家族的氨基酸序列进行比对, 结果显示此TwSMT2含有SMT2家族基因的4个保守序列, 同时Blast结果显示, TwSMT2氨基酸序列与多个物种具有较高同源性, 其中与可可树 (Theobroma cacao) 同源性高达89%, 与陆地棉 (Gossypium hirsutum) 和大豆 (Glycine max) 相似性为88%, 与拟南芥 (Arabidopsis thaliana) 相似性86%, 与其他物种的多重序列比对结果如图 2。

|
Figure 2 Sequence alignment of amino acids of TwSMT2 with SMT1 and SMT2 families in other species. The sequences in four red boxes shows the conservative motifs of SMT2 and the sequences in three blue boxes shows the conservative motifs of SMT1. Theobroma cacao SMT2 XP_007017914.1, Gossypium hirsutum SMT2 ABY49843.1, Morus notabilis SMT2 XP_010100118.1, Arabidopsis thaliana (SMT1 NP_001078579.1, SMT2-1 CAA61966.1, SMT2-2 AAB62809.1), Glycine max SMT1 AAB04057.1, Dioscorea zingiberensis SMT1 CBX33151.1 |
将TwSMT2氨基酸序列与其他物种中克隆得到的SMT1、SMT2家族基因进行系统进化树分析, 见图 3, 结果显示, 系统进化树分为两大分支, 所有SMT1家族序列聚为一类, SMT2序列聚为另一大类, 而本实验从雷公藤中克隆得到SMT基因归为SMT2序列分支, 进一步确定其为二型SMT基因。
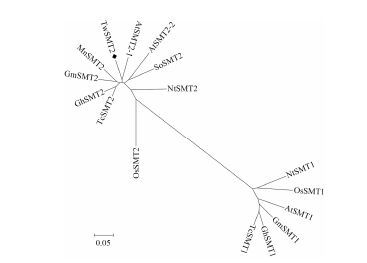
|
Figure 3 Phylogenetic tree of two families (SMT1 and SMT2) from different species. Arabidopsis thaliana (SMT1 NP_001078579.1, SMT2-1 CAA61966.1, SMT2-2 AAB62809.1), Nicotiana tabacum (SMT1 AAC34951.1, SMT2 AAB62807.1), Oryza sativa (SMT1 AAC34988.1, SMT2 AAC34989.1), Spinacia oleracea SMT2 AHM10393.1, Morus notabilis (SMT2 XP_010100118.1), Theobroma cacao (SMT1 XP_007052489.1 SMT2 XP_007017914.1), Glycine max (SMT1 AAB04057.1, SMT2 HM185389.1), Gossypium hirsutum (SMT1 AAZ83345.1, SMT2 ABY49843.1) |
ExPASy在线预测TwSMT2蛋白分子质量为40.0 kDa, 理论等电点6.43。predictprotein预测蛋白质二级结构显示其以有螺旋为主 (49.58%), 其次是成环结构 (37.05%), 线性结构仅占13.37%。蛋白3D结构预测见图 4, 以2 057.1 A为同源建模模板, 序列同源度为22.22%, 建模范围为68~356位氨基酸残基。
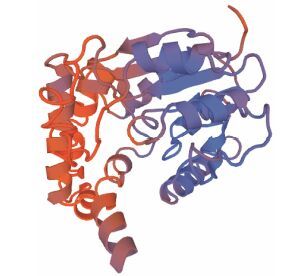
|
Figure 4 3D model prediction of TwSMT2 |
用2-ΔΔCt的方法分析TwSMT2基因的相对表达量, 结果如图 5所示, 经MJ诱导后, 相比于空白对照组,在4 h和12 h, 诱导组与对照组表达量无显著差异, 24 h时, 诱导后的TwSMT2基因表达量明显提高, 随后呈现下降趋势。
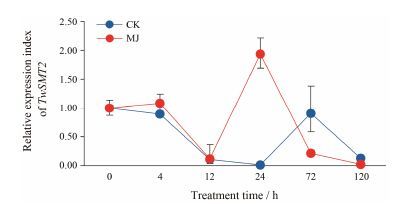
|
Figure 5 Relative expression analysis of TwSMT2 after inducing by MJ |
图 6A为SDS-PAGE 结果, 实验表明, 在BL21 (DE3) 菌株中经IPTG诱导表达后, pMAL-c2X在42 kDa处表达了MBP标签蛋白, 而含有重组质粒pMAL- c2X-TwSMT2的菌株在约82 kDa处表达蛋白, 后进一步经Western blot证实蛋白表达, 结果见图 6B, 含有MBP标签的空载及重组质粒蛋白均显示印迹条带, 说明目的基因的TwSMT2蛋白(分子质量为40.0 kDa) 得到表达。
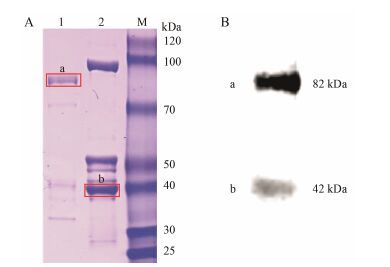
|
Figure 6 Protein expression after inducing by IPTG. The result of SDS-PAGE was showed in Figure 6 (A) [1: pMAL-c2X- TwSMT2 in BL21 (DE3) was expressed; 2: pMAL-c2X in BL21 (DE3) was expressed], while the protein labeled with a and b in Figure 6 (A) was corresponding with the a, b in Figure 6 (B) which shows the result of Western Blot (the band marked “a” was the protein of pMAL-c2X-TwSMT2 and the “b” was the pMAL- c2X) |
目前, 已经从许多植物中克隆得到SMT2基因, 如大豆[20]、拟南芥[21]、烟草[5]等, 24-烷基甾醇作为甾醇类化合物中的重要组成部分, 对植物生长发育及组成膜的结构具有重要作用, SMT2作为此生物合成途径上重要限速酶, 在多种植物中已被证实其转录水平可影响总甾醇含量及甾醇化合物种类。例如, 在烟草中过量表达AtSMT2-1基因后, 甾醇的代谢流向24-乙基甾醇方向流动, 24-甲基甾醇的含量明显减少, 同时通过影响细胞分裂抑制植物生长[2]。
雷公藤红素作为雷公藤中具有重要药理活性的三萜类化合物[22], 具有抗炎等药理活性[23], 利用突变或干扰等方法影响甾醇生物合成途径基因可能有利于雷公藤三萜类化合物如雷公藤红素的累积。本研究成功从雷公藤中克隆得到一条SMT基因, 在线对其蛋白质理化性质进行预测、多重序列比对及进化树分析将此SMT归为SMT2家族; 与拟南芥AtSMT2-1 (GenBank: CAA61966.1) 的相似性为84.76, 表明可能具有催化24-亚甲基胆甾烯醇生成24-亚乙基胆甾烯醇的作用。为了进一步研究TwSMT2蛋白质功能, 将TwSMT2的编码区构建到pMAL-c2X蛋白表达载体, 获得pMAL-c2x-TwSMT2重组质粒, 并转化大肠杆菌BL21 (DE3), 表达出TwSMT2可溶性蛋白。研究结果为TwSMT2基因深入研究和阐述雷公藤甾醇生物合成途径奠定基础。
| [1] | Shi J, Gonzales RA, Bhattacharyya MK. Identification and characterization of an S-adenosyl-L-methionine: Δ24-sterol-C-methyltransferase cDNA from soybean[J]. J Biol Chem , 1996, 271 :9384–9389. DOI:10.1074/jbc.271.16.9384 |
| [2] | Schaeffer A, Bouvier-Navé P, Benveniste P, et al. Plant sterol-C24-methyl transferases: different profiles of tobacco transformed with SMT1 or SMT2[J]. Lipids , 2000, 35 :263–269. DOI:10.1007/s11745-000-0522-1 |
| [3] | Ginzberg I, Thippeswamy M, Fogelman E, et al. Induction of potato steroidal glycoalkaloid biosynthetic pathway by overexpression of cDNA encoding primary metabolism HMG-CoA reductase and squalene synthase[J]. Planta , 2012, 235 :1341–1353. DOI:10.1007/s00425-011-1578-6 |
| [4] | Yuan MQ, Ding CB, Tao L, et al. Cloning and sequence analysis of cycloartenol synthase gene from Paris polyphylla var. yunnanensis[J]. Chin Tradit Herb Drugs (中草药) , 2012, 43 (11) . |
| [5] | Bouvier-Navé P, Husselstein T, Benveniste P. Two families of sterol methyltransferases are involved in the first and the second methylation steps of plant sterol biosynthesis[J]. Eur J Biochem , 1998, 256 :88–96. DOI:10.1046/j.1432-1327.1998.2560088.x |
| [6] | Niklas H, Mark H, Gibbard CL, et al. Sterol C-24 methyltransferase type 1 controls the flux of carbon into sterol biosynthesis in tobacco seed[J]. Plant Physiol , 2002, 130 :303–311. DOI:10.1104/pp.004226 |
| [7] | Chinese Materia Medica Committee. Chinese Materia Medica (中华本草). Shanghai: Shanghai Scientific Technical Publishers[M]. 1999 : 4134 . |
| [8] | Huang L. Advances in the pharmacological effects of Tripterygium wilfordii[J]. Jiangxi J Tradit Chin Med (江西中医药) , 2000 (2) :45–46. |
| [9] | Pan XD, Chen XC. Advances in the study of immunophar-macological effects and mechanisms of extracts of Tripterygium wilfordii Hook. f. in neuroimmunologic disorders[J]. Acta Pharm Sin (药学学报) , 2008, 43 :1179–1185. |
| [10] | Zhao YJ, Chen X, Zhang M, et al. Molecular cloning and characterisation of farnesyl pyrophosphate synthase from Tripterygium wilfordii[J]. PLoS One , 2015, 10 :1–13. |
| [11] | Zhang M, Su P, Zhou YJ, et al. Identification of geranylgeranyl diphosphate synthase genes from Tripterygium wilfordii[J]. Plant Cell Rep , 2015, 34 :2179–2188. DOI:10.1007/s00299-015-1860-3 |
| [12] | Tong YR, Su P, Zhao YJ, et al. Molecular cloning and char-acterization of DXS and DXR genes in terpenoid biosynthetic pathway from Tripterygium wilfordii[J]. Int J Mol Sci , 2015, 16 :25516–25535. DOI:10.3390/ijms161025516 |
| [13] | Zhao YJ, Zhang M, Liu YJ, et al. Cloning and expression analysis of a acetyl-CoA U-acetyltransferase gene (TwAACT) from Tripterygium wilfordii[J]. China J Chin Mater Med (中国中药杂志) , 2015, 40 :847–852. |
| [14] | Zhang M, Su P, Liu YJ, et al. Cloning and bioinformatics analysis of geranylgeranyl diphosphate synthase gene of Tripterygium wilfordii[J]. China J Chin Mater Med (中国中药杂志) , 2015, 40 :1066–1070. |
| [15] | Tong YR, Su P, Zhao YJ, et al. Cloning and expression analysis of 4-(cytidine-5-diphospho)-2-C-methyl-D-erythritol kinase gene in Tripterygium wilfordii[J]. China J Chin Mater Med (中国中药杂志) , 2015, 40 :4165–4170. |
| [16] | Tong YR, Su P, Zhang M, et al. Cloning and expression analysis of 2-C-methyl-D-erythritol 4-phosphate cytidylyl-transferase gene in Tripterygium wilfordii[J]. China J Chin Mater Med (中国中药杂志) , 2015, 40 :4378–4383. |
| [17] | Schaeffer A, Bronner R, Benveniste P, et al. The ratio of campesterol to sitosterol that modulates growth in Arabidopsis is controlled by sterol methyltransferase 2; 1[J]. Plant J , 2001, 25 :605–615. |
| [18] | Schaller H, Bouvier-Navé P, Benveniste P. Overexpression of an Arabidopsis cDNA encoding a sterol-C24(1)-methyltrans-ferase in tobacco modifies the ratio of 24-methyl cholesterol to sitosterol and is associated with growth reduction[J]. Plant Physiol , 1998, 118 :461–469. DOI:10.1104/pp.118.2.461 |
| [19] | Sitbon F, Jonsson L. Sterol composition and growth of transgenic tobacco plants expressing type-1 and type-2 sterol methyltransferases[J]. Planta , 2001, 212 :568–572. DOI:10.1007/s004250000417 |
| [20] | Neelakandan AK, Song Z, Wang J, et al. Cloning, func-tional expression and phylogenetic analysis of plant sterol 24C-methyltransferases involved in sitosterol biosynthesis[J]. Phytochemistry , 2009, 70 :1982–1998. DOI:10.1016/j.phytochem.2009.09.003 |
| [21] | Husselstein T, Gachotte D, Desprez T, et al. Transforma-tion of Saccharomyces cerevisiae with a cDNA encoding a sterol C-methyltransferase from Arabidopsis thaliana results in the synthesis of 24-ethyl sterols[J]. FEBS Lett , 1996, 381 :87–92. DOI:10.1016/0014-5793(96)00089-0 |
| [22] | Chen MX, Feng YJ, Wang DY, et al. Research progress of celastrol[J]. Chin Tradit Pat Med (中成药) , 2010, 32 :473–476. |
| [23] | Zhang LX, Yu FK, Zheng QY, et al. Immunosuppressive and antiinflammatory activities of tripterine[J]. Acta Pharm Sin (药学学报) , 1990, 25 :573–577. |
 2016, Vol. 51
2016, Vol. 51


