溶胀是高分子材料的重要特性,可以用热力学理论来阐释高分子材料溶胀行为与交联网状结构的关系[1]。观察高分子材料的溶胀行为并测定此过程中相关参数,有助于了解材料宏观功能性与微观性质的关系[2]。
贝特类降血脂药因其不会引起胰岛素抵抗而加重患者病情或影响其血糖控制,是糖尿病患者高脂血症治疗的首选药物,在临床上有着广泛应用[3]。其代表性药物非诺贝特为BCS Ⅱ类药物,水溶性较差。非诺贝酸胆碱盐 (choline fenofibrate) 与非诺贝特进入人体后都转化为非诺贝酸发挥药效。相比于非诺贝特,非诺贝酸胆碱盐在小肠内有良好的溶解度,其生物利用度更高。将其制成缓释制剂,可以避免药物在小肠由于较高溶解度引起的突释,同时减少患者用药次数,提高顺应性。
选择羟丙基甲基纤维素 (HPMC) 为骨架材料制备的亲水凝胶骨架片,其释药机制一般被分为扩散和溶蚀两个过程[4]: ① 药片进入水溶液后,表面被润湿,HPMC开始从外向里逐渐水化形成凝胶层,其中药物也逐渐溶解,通过凝胶层扩散至溶液; ② 凝胶层扩散到一定程度后,凝胶表面的HPMC充分水化,凝胶结构逐渐松散溶蚀,其中的药物 (可溶性或难溶性药物) 也随之进入溶液,溶蚀过程可一直进行至药片全部溶解或分散在溶液中为止。
由此可见,凝胶骨架片的释药过程是伴随其溶胀过程进行的。因此,研究骨架片的溶胀行为,并结合其释药曲线,对于了解骨架片释药机制,建立溶胀与释药的关联具有重要意义。
使用显微摄像机研究溶胀在材料化工领域中应用较为广泛,如图像法测定黏土[5]和炭块[6]的溶胀行为,但在药学领域中应用较少。常用扫描电子显微镜来表征物体溶胀行为[7],该方法侧重于物体溶胀过程中微观结构的变化,无法反映物体宏观体积及形态的改变,而这些参数对于了解骨架片释药过程和机制有着重要意义。
本文利用动态图像分析法研究不同处方非诺贝酸胆碱盐凝胶骨架片的溶胀行为,旨在了解溶胀与释放的关系,为亲水凝胶骨架片的设计提供参考。
材料与方法材料 非诺贝酸胆碱盐 (99.9%,宁夏康亚药业有限公司); 羟丙基甲基纤维素 (K15M,K4M)、预胶化淀粉 (pregelatinized starch) (上海卡乐康包衣技术有限公司); 聚乙烯吡咯烷酮 (PVP K30,博爱开源制药股份有限公司); 氢氧化钠 (sodium hydroxide,AR,天津市博迪化工有限公司); 磷酸二氢钾(potassium dihydrogen phosphate,西陇化工有限公司); 去离子水 (自制)。
主要仪器 紫外-可见分光光度计(UV-2000,尤尼柯仪器有限公司); 溶出测定仪 (RC-6,天津市光学仪器厂); CCD显微摄像机 (MV-1300,维视图像有限公司); 可调亮度冷光LED光源 [E27-5W,飞利浦 (中国) 投资有限公司]; 工作计算机 [A4800V,联想 (北京) 有限公司]。
骨架片的制备 非诺贝酸胆碱盐占主药加干辅料总重的60%; 以HPMC (K15M和K4M) 为骨架材料,预胶化淀粉为填充剂,PVP-70%乙醇溶液为黏合剂,采用湿法制粒,混以适量硬脂酸镁,压制成直径为3 mm的骨架片,硬度约为30 N。处方组成是影响制剂体外释放的重要因素[8, 9],对于以HPMC为基质的亲水凝胶骨架片,凝胶骨架材料HPMC的用量和类型以及黏合剂的用量决定了其释药特性。选取3个因素: HPMC用量、HPMC中K15M所占的比例和PVP-70%乙醇溶液的浓度,分别制备高低两水平的骨架片,处方组成见表 1。
| Table 1 The formulations of different matrix tablets. HPMC: Hydroxypropyl methylcellulose; PVP: Polyvinylpyrrolidone |
实验装置 设计的研究装置由可调亮度冷光LED光源、三轴可调载物台、高分辨率CCD显微摄像机和工作计算机组成,如图 1所示,背光灯发出均匀平行白光,比色皿中的骨架片遮挡白光留下黑影,CCD显微摄像机实时监测观察,拍照 (或录像) 并保存至计算机。
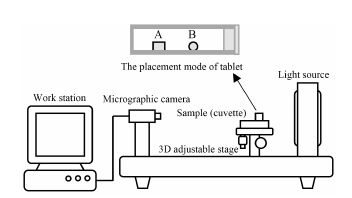
|
Figure 1 The apparatus of dynamic image analysis and the placement mode of tablets |
图像的获取 以pH 6.8磷酸盐缓冲液为溶胀介质,超声脱气后,置于37 ℃水浴中预热备用; 比色皿用溶胀介质润洗后,将两粒骨架片轻轻放置于比色皿毛玻璃面内壁,保持骨架片中心轴与水平面平行,其中一粒中心轴与光线投射方向垂直,用以观察其轴向尺寸变化 (图 1A); 另一粒中心轴与之平行,观察骨架片径向尺寸变化 (图 1B); 稍等数秒,待骨架片黏在比色皿内壁后,加入溶胀介质4.0 mL并塞紧; 放入调整好焦距的影像系统中,拍照记录0时刻图像; 将比色皿放入37 ℃水浴中,在15、30、45、60、75、90、105、120、150、180、210、240、270、300、330和360 min拍摄照片,得到图片 (图 2)。

|
Figure 2 The shape change of tablets with time (front view A,side view B) |
图像的处理 本文采用Image Pro Plus 6.0对所得图片进行处理。使用irregular AOI功能,人工绘制骨架片轮廓; 选择测量项目截面积 (area,A)、图像宽度 (box width,W)、图像高度 (box height,H),并将测量结果导入Excel表。此时所得尺寸以像素 (pix) 为度量单位。使用千分尺测量0时刻骨架片尺寸,并结合所得图像像素尺寸,可以方便地对像素和实际尺寸进行转换[10]。本文中若无特别说明,尺寸单位均为像素 (pix)。
数据处理
体积溶胀率 骨架片吸水溶胀后,体积发生显著改变,测算骨架片体积溶胀率 (SR) 随时间的变化趋势,可以了解骨架片溶胀行为[11]。体积溶胀率用公式1计算。
| $\text{SR}\left( \text{%} \right)\text{= }\frac{{{V}_{t}}-{{V}_{0}}}{{{V}_{0}}}\times 100$ | (1) |
Vt、V0分别是t时刻和0时刻骨架片的体积。
骨架片溶胀过程中的形态及几何简化示意图如图 3所示。
方法1 如图 3所示,骨架片在溶胀过程中的形态近似为圆柱体。在正视图A中,WA为圆柱体高,HA为圆柱体底面直径,计算公式如式 (2) 所示。
| ${{V}_{\text{1}}}\text{= }\frac{1}{4}\pi H_{\text{A}}^{2}{{W}_{\text{A}}}$ | (2) |
方法2 用侧视图截面积AB作为圆柱底面积。计算公式如式3所示。
| ${{V}_{2}}~=~{{A}_{B}}\cdot {{W}_{A}}$ | (3) |
方法3 结合骨架片正视图A和俯视图C,可知随着溶胀时间增加,骨架片几何形状越来越偏离圆柱体,实际为两头尖中间粗的类纺锤体。
众所周知,几何体的体积是面积沿线段的积分。将此类纺锤体分割足够薄 (dw) 时,每小段都是一个圆柱体,此时体积为小圆柱体之和。
| ${{V}_{3}}~=\sum a\cdot dw$ | (4) |
| $a=\frac{1}{8}{{W}^{2}}(2\pi -\theta +\sin \theta )$ | (5) |
| $\theta \text{= 2arc cos}\frac{2H-W}{W}$ | (6) |
其中,a是每个小圆柱体底面积; 其中,θ为圆缺中心角,弧度制; H为正视图A中对应位置轮廓两点垂直距离,W为俯视图C中对应位置轮廓两点垂直距离,用Image Pro Plus软件获取骨架片正视图和俯视图轮廓。由于分割间距dw较小,计算量较大,几乎无法人工测算; 因此利用Matlab 7.0软件对轮廓图像处理[12],将图片中每个像素点坐标位置以及RGB参数生成一个三维矩阵; 遍历矩阵中所有元素,并识别出图片中轮廓点坐标,将其坐标生成一个二维矩阵; 所有横坐标相同的纵坐标生成约600个数组; 数组中最大值和最小值之差即为目标数据。分别处理正视图A和侧视图C得对应的H、W。带入式4~式6即可求得体积。
侧视图中的高宽比 骨架片受重力作用与比色皿内壁挤压形成平面,反映到侧视图B中,所得图形为一个圆缺 (HB ≠ WB)。显然骨架片凝胶强度越大,受挤压程度越小,所得圆缺越接近于圆,HB和WB的长度差别越小。选用高宽比 (k,式7) 来表征凝胶强度; k越大,凝胶强度越大。
| $k~=~{{H}_{B}}~/~{{W}_{B}}$ | (7) |
溶胀速率 根据SR对时间 (t) 变化趋势,以SR为自变量,t为因变量,选用二次多项式模型进行拟合; 以零时刻 (溶胀率为0) 作为边界条件,从而可以得到SR与t的函数关系,模型方程如式8所示。
| $t~=~{{a}_{1}}\cdot S{{R}^{2}}~+~{{b}_{1}}\cdot SR$ | (8) |
根据导数的定义可知,溶胀速率 (VSR) 即SR对t的导数,如式9、式10所示。
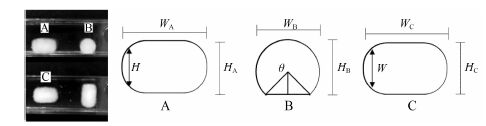
|
Figure 3 The shape of tablets during the swelling process (front view A,side view B and top view C) |
| ${{V}_{\text{SR}}}\text{= }\frac{d\text{SR}}{dt}=\frac{1}{2{{a}_{1}}\cdot \text{SR}+{{b}_{1}}}$ | (9) |
| ${{V}_{\text{SR}}}\text{= }\frac{d\text{SR}}{dt}=\frac{1}{\sqrt{4{{a}_{1}}\cdot t+b_{_{1}}^{2}}}$ | (10) |
体积溶胀率与累积释放度 按照释放度测定法 (中国药典2010年版二部附录Χ C第二法) 测定各处方骨架片在pH 6.8磷酸盐缓冲液中的释放曲线,取样时间点为15、30、60、90、120、240和360 min。所得释放曲线与体积溶胀率曲线进行对比; 观察累积释放度 (Q) 随对应时间点SR的变化趋势,将SR取自然对数后与Q进行线性拟合,模型方程如式11所示,计算得到回归系数与相关系数以验证Q与SR的相关性。
| $Q~=~{{a}_{2}}\cdot lnSR\text{ }+~{{b}_{2}}$ | (11) |
溶胀速率和释药速率 相邻两时间点的累积释放度相减求斜率,近似作为两时间点中间时刻的释药速率 (VRE),得到7.5、22.5、45、75、105、180和300 min的释药速率; 采用公式10求得相应时刻VSR; 观察VRE对VSR的变化趋势,将VSR取自然对数后与VRE取进行线性拟合,模型方程如式12所示,计算得到回归系数与相关系数以验证VRE与VSR的相关性。
| ${{V}_{RE}}~=~{{a}_{3}}\cdot ln{{V}_{SR}}~+~{{b}_{3}}$ | (12) |
使用方法1 (V1)、方法2 (V2) 以及不同精度方法3 (V3) 求处方1骨架片溶胀150 min时的体积分别为V1 = 122.1,V2 = 137.7,V3 (dw 1) = 112.8,V3 (dw 10)= 113.2,V3 (dw 50) = 116.4,单位为10-6 pix3。
根据V1、V2的计算公式可知,方法1中HA即为底面半径,而由于重力造成的挤压作用,实际底面半径(WB) 大于HA; 方法2直接用底面圆缺面积,因而所求体积V2 > V1。由于溶胀后的实际几何形状并非圆柱体,因此方法1和方法2所求的体积都偏大; 方法3采用分割趋近的方法,更接近真实体积,所以求得体积最小,且随着dw增大而增大。
如前所述,方法1所用底面半径偏小,因而求得体积偏小,补偿了使用圆柱体近似体积求法的偏大效果。但在实验过程中发现,在溶胀前期,骨架片结构强度比较大,重力挤压作用不够明显,此时方法1的结果更接近真实值; 在溶胀后期,骨架片逐渐松散[13],重力挤压作用使得骨架片更为扁平,此时方法1中所用底面直径HA更小,补偿作用太大而造成求得的体积过小,影响了实验的准确性。
方法3所求体积更为精确,可利用软件自动求算,还可以设置不同dw值,满足不同的实验精度; 但是此法需要拍摄3幅图,且计算量巨大,尽管利用计算机软件自动求算,每次计算时间动辄十几分钟甚至30 min。因此,此法更像是一种方法学上的理论补充。除非实验精度要求特别高,这种方法实用性欠佳。
综上所述,方法2最为稳定方便,且精度良好,因此,非诺贝酸胆碱盐凝胶骨架片的溶胀体积的求算采用方法2。
2 不同处方骨架片的体积溶胀率不同处方骨架片体积溶胀率随时间变化如图 4所示。
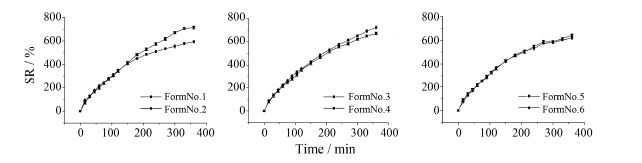
|
Figure 4 The volume swelling ratio (SR) profiles of different formulations (FormNo.1-6) |
处方1和处方2相比,前150 min骨架片的体积溶胀率基本一致; 150 min后,处方1仍保持较快溶胀速率,而处方2溶胀速度减缓,最终形成较大差距。相比处方2,处方1的HPMC含量较高,说明HPMC是骨架片发生溶胀的主要辅料,高HPMC含量意味着更高的溶胀潜能。在溶胀前期,骨架片水化程度低,且所用HPMC型号一致,体现不出量上的差异; 而在溶胀后期,骨架片的水化较为充分,处方1由于HPMC含量高,可以进一步吸水膨胀[14],其溶胀速率未发生很大变化; 处方2的溶胀速率则趋于平缓,在最终体积上小于处方1 (594% < 713%)。
处方3和处方4在溶胀前期即出现差别,且处 方3的溶胀率一直低于处方4。相比处方4,处方3中HPMC K15M的比例较高; HPMC K15M相比于HPMC K4M黏度更高,处方3在表面水化后,由于 形成的凝胶层黏度更大[15],阻碍了水分向片芯进一步扩散,造成其溶胀速率慢于处方4。
处方5和处方6的溶胀曲线无显著差别。两处方区别在于所用黏合剂PVP-70%乙醇溶液的浓度不同,说明黏合剂PVP的用量对骨架片的体积溶胀率无显著影响。
3 溶胀速率各处方SR对t拟合方程的回归系数及相关系数见表 2。所有方程的R2 > 0.980 0,说明所选模型方程拟合度良好。
| Table 2 The regression coefficients (a1,b1) and correlation coefficients (R) of the equations about t and SR |
此外,根据式9、式10可知,骨架片的溶胀速率随时间增大 (或溶胀率增大) 而减小,初始溶胀速率为1/b1。
4 不同处方骨架片的高宽比不同处方骨架片在溶胀介质中侧视图宽高比随时间变化如图 5所示。
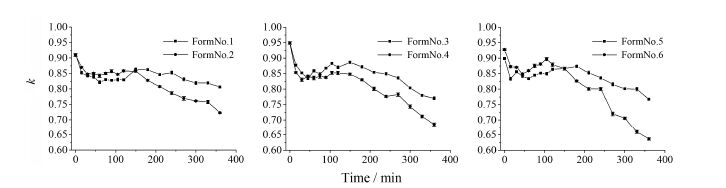
|
Figure 5 The height/width (k) profiles of different formulations (FormNo.1-6) |
处方1和处方2在前150 min宽高比的变化趋势相当,处方2略高; 150 min后,处方2的宽高比开始快速下降,而处方1下降较为平缓,最终宽高比为处方1 > 处方2。相比于处方2,处方1的HPMC用量较高,骨架片表面HPMC水化形成的松软凝胶层较厚[16],受到重力的挤压作用更明显,因而宽高比较小; 150 min后,随着水化由片表面向片中心进行,处方1中HPMC用量高,具有更高的溶胀潜力,可以继续维持凝胶层强度,所以宽高比下降平缓; 而处方2由于HPMC用量少,开始进入溶蚀阶段,凝胶层强度大幅降低,表现为宽高比迅速下降。提示若设计以扩散为主要释药机制的骨架片,应提高HPMC的用量。
处方3的宽高比始终高于处方4。相比于处方4,处方3中HPMC K15M的比例较高,其更高的黏度使形成的凝胶层强度更高,因而宽高比较高,提示若设计以溶蚀为主要释药机制的骨架片时,应选用低黏度型号的HPMC。
处方6的宽高比前100 min高于处方5; 100 min后开始迅速下降,150 min后开始低于处方5,并最终形成较大差距。相比于处方5,处方6所用黏合剂中PVP含量更高,在溶胀前期,高PVP含量使得骨架片硬度更高,水化速度较慢,所以宽高比下降少,而随着骨架片溶胀,高比例的PVP溶解后,破坏了凝胶的交联结构,形成的凝胶强度较低,更容易受重力影响,宽高比大幅下降。结果提示调整黏合剂PVP的用量可以调整骨架片的释药机制。
5 溶胀行为与释放特性的关联 5.1 体积溶胀率曲线与释放曲线的直观比较所得释放曲线与对应体积溶胀率曲线对比如图 6所示。相比于处方2,处方1释药较慢,且在4 h左右处方2释药完全,而处方1继续释放。结合溶胀曲线,处方2在4 h后溶胀缓慢,此时骨架片已完全水化,药物释放完毕; 处方1由于高HPMC含量带来的高溶胀潜力,在4 h后溶胀程度较处方2低,对药物释放具有阻滞作用,表现为释药不完全。相比于处方4,处方3

|
Figure 6 The release curves and the volume swelling ratio profiles of FormNo.1-4 |
前期释药较慢,两者均在4 h左右释药完全。结合溶胀曲线,处方3溶胀较慢,这是由于K15M含量高,形成的凝胶层黏度较大,阻碍水分进入片芯内部,同时较大黏度的凝胶层也会阻碍药物扩散释放[11],所以其溶胀和释药速率均较慢。
5.2 体积溶胀率与累积释放度各方程回归系数及相关系数见表 3。所有回归方程的相关系数R2 > 0.960 0,说明体积溶胀率与累积释放度有着强烈的相关性。
| Table 3 The regression coefficients (a2,b2) and correlation coefficients (R) of the equations about Q and SR |
各方程回归系数及相关系数见表 4。所有回归方程的相关系数R2 > 0.950 0,说明体积溶胀率与累积释放度的密切相关。
| Table 4 The regression coefficients (a3,b3) and correlation coefficients (R) of the equations about VRE and VSR |
综上所述,骨架片的释药特性与溶胀行为有紧密的联系,HPMC的用量及类型的不同,使得骨架片溶胀行为不同,进而导致其释药特性的不同。结果提示在设计亲水凝胶骨架片时,不妨先研究辅料的溶胀特性,这将对实现目标释药曲线提供一定的参考。
结论本文采用动态图像分析法研究骨架片的溶胀行为,可以实时观察溶胀过程,并获得该过程中关键参数。实验结果表明,亲水凝胶骨架片的释药特性与其溶胀行为密切相关。处方组成可以影响骨架片的溶胀行为,进而影响其释药特性; 骨架片中HPMC用量高时,溶胀潜力高,凝胶层强度高,释药机制以扩散为主; 低黏度规格的HPMC所制备的骨架片凝胶层强度较低,药物倾向于溶蚀释放; 黏合剂PVP的量对体积溶胀率几乎无影响,但可以通过影响凝胶层强度来调节骨架片释药机制。该研究可以对亲水凝胶骨架片的设计提供参考。
| [1] | Barba AA, D'Amore M, Chirico S, et al. Swelling of cellulose derivative (HPMC) matrix systems for drug delivery[J]. Carbohyd Polym , 2009, 78 :469–474. DOI:10.1016/j.carbpol.2009.05.001 |
| [2] | Hou YL, Li HR, Gao YN, et al. The rheology properties of common hydrophilic gel excipients[J]. Acta Pharm Sin (药学学报) , 2014, 49 :1181–1187. |
| [3] | Masana L, Cabré A, Heras M, et al. Remarkable quantita-tive and qualitative differences in HDL after niacin or fenofibrate therapy in type 2 diabetic patients[J]. Atherosclerosis , 2015, 238 :213–219. DOI:10.1016/j.atherosclerosis.2014.12.006 |
| [4] | Zhao CS, He ZG, Cui SM, et al. Study on the release mechanism of fenoprofen calcium from hydrophillic sus-tained-release matrix[J]. Acta Pharm Sin (药学学报) , 2001, 36 :63–66. |
| [5] | Hedan S, Hubert F, Prêt D, et al. Measurement of the elas-tic properties of swelling clay minerals using the digital image correlation method on a single macroscopic crystal[J]. Appl Clay Sci , 2015, 116 :248–256. |
| [6] | Gao H, He JC, Cai JJ, et al. An improved three-dimensional microscope image analysis method for studying solvent swelling of single coal particles[J]. Energ Fuel , 2009, 23 :342–348. DOI:10.1021/ef8006454 |
| [7] | Azizi E, Namazi A, Haririan I, et al. Release profile and stability evaluation of optimized chitosan/alginate nanoparticles as EGFR antisense vector[J]. Int J Nanomedicine , 2010, 5 :455–461. |
| [8] | Lin X, Tang X, Xu YH, et al. Preparation and evaluation of risperidone-loaded microsphere/sucrose acetate isobutyrate in situ forming complex depot with double diffusion barriers[J]. Acta Pharm Sin (药学学报) , 2015, 50 :775–782. |
| [9] | Wu QL, Quan GL, Hong Y, et al. Preparation and release behaviour of mesoporous silica/ethylcellulose sus-tained-release mini-matrix[J]. Acta Pharm Sin (药学学报) , 2015, 50 :492–499. |
| [10] | Yassin S, Su K, Lin H, et al. Diffusion and swelling meas-urements in pharmaceutical powder compacts using tera-hertz pulsed imaging[J]. J Pharm Sci , 2015, 104 :1658–1667. DOI:10.1002/jps.24376 |
| [11] | Lamoudi L, Chaumeil JC, Daoud K. Swelling, erosion and drug release characteristics of sodium diclofenac from heterogeneous matrix tablets[J]. J Drug Deliv Sci Technol , 2016, 31 :93–100. DOI:10.1016/j.jddst.2015.12.005 |
| [12] | Yang S, Wang CF, Li X, et al. Release kinetics of single pellets and the multi-pellet system of tamsulosin hydrochloride sustained release pellets[J]. Acta Pharm Sin (药学学报) , 2014, 49 :535–542. |
| [13] | Asare-Addo K, Kaialy W, Levina M, et al. The influence of agitation sequence and ionic strength on in vitro, drug release from hypromellose (E4M and K4M) ER matrices-the use of the USP III apparatus[J]. Colloids Surf B Biointerf , 2013, 104 :54–60. DOI:10.1016/j.colsurfb.2012.11.020 |
| [14] | Hua DD, Li HR, Yang BX, et al. Determination of contact angle of pharmaceutical excipients and regulating effect of surfactants on their wettability[J]. Acta Pharm Sin (药学学报) , 2015, 50 :1342–1345. |
| [15] | Oh CM, Ru SSC, Wan SHP, et al. Impact of HPMC on the physical properties of spray-congealed PEG microparticles and its swelling effect on rifampicin dissolution[J]. Drug Dev Ind Pharm , 2016, 42 :403–411. DOI:10.3109/03639045.2015.1061536 |
| [16] | Qu C. Wettability and swelling behavior of a weak poly-basic brush: influence of divalent salts in the environment[J]. Physics , 2015, 48 :1–7. |
 2016, Vol. 51
2016, Vol. 51


