苯二氮䓬类药物在临床上具有多种治疗作用, 包括镇静催眠、抗焦虑、肌肉松弛及抗惊厥等, 此类药物是临床上最常用的镇静催眠药[1-3], 应用过量会导致神经肌肉阻滞, 甚至引起死亡, 这增加了自杀以及潜在的成瘾和滥用的犯罪案件的发生, 是急诊药物中毒的常见药物, 此外, 此类药物的使用导致行为能力的下降是影响驾驶安全的主要因素, 同时测定生物基质中苯二氮䓬类药物一直是临床医生、法医毒理学家及交通领域学者关注的问题。
目前, 文献[4]报道苯二氮䓬类药物检测方法有GC-MS法, 但是, 由于许多苯二氮䓬类药物是极性且非挥发性化合物, 因此, 不适于采用这种方法进行多成分分析; 也有文献[5-8]报道采用HPLC法、反相高效液相色谱法、液相色谱-串联质谱法分析该类药物, 其中样本前处理大多采用液液萃取或固相萃取法, 提取过程复杂、费时。本研究拟建立一种样品处理简便、高灵敏、高准确性的超高效液相色谱-质谱联用法(UHPLC-MS/MS), 同时测定血浆中咪达唑仑、硝西泮、艾司唑仑、氯硝西泮、劳拉西泮、三唑仑和地西泮共7种苯二氮䓬类药物的浓度, 为临床治疗抢救、刑事案件的侦破及药物影响驾驶安全提供参考方法。
材料与方法药品与试剂 氢溴酸西酞普兰对照品 (纯度≥99.8%, 批号: 100790-200501)、地西泮对照品 (纯度为99.9%, 批号: 171225-201304)、艾司唑仑对照品 (纯度为99.7%, 批号:171219-201003)、马来酸咪达唑仑对照品 (纯度为99.8%, 批号: 171250-201002)、劳拉西泮对照品 (纯度≥99.8%, 批号:171253-201102)、氯硝西泮对照品 (纯度为99.7%, 批号: 171227-201404)、硝西泮对照品 (纯度为99.9%, 批号:171227-201403)、三唑仑对照品 (纯度为99.7%, 批号: 171230-201203), 购自中国食品药品检定研究院; 甲醇和甲酸均为色谱纯; 去离子水由美国Millipore公司Milli-Q Advantage A10超纯水系统制备。
仪器 AcquityTM TQMS质谱仪 (配有三重四极杆质量分析器) 和Masslynx 4.1分析软件 (美国Waters公司)、AcquityTM UHPLC超高效液相色谱仪 (配有二元梯度洗脱泵, 自动进样器和在线脱气机)。
色谱条件 色谱柱为Waters CORTECS UHPLC C18柱 (2.1 mm × 100 mm, 1.6 μm); 流动相为含0.01% 甲酸水溶液-含0.01% 甲酸甲醇溶液 (0~7 min, 60∶40 → 10∶90; 7~8 min, 10∶90; 8~8.1 min, 10∶90 → 60∶40; 8.1~11 min, 60∶40); 流速为0.3mL·min-1; 柱温: 40 ℃; 进样室温度10℃; 进样体积3 μL。
质谱条件 离子源为电喷雾离子源 (ESI源), 离子源温度120℃, 采用多反应监测, 结合正离子分段扫描分析; 咪达唑仑、西酞普兰 (内标)、三唑仑、劳拉西泮、氯硝西泮、艾司唑仑、硝西泮和地西泮的锥孔电压(cone voltage) 分别为38、64、54、30、50、46、44和48 V, 碰撞能量 (CE) 分别为26、24、24、20、18、26、24和28 V, 正离子扫描分析; 用于定量分析检测的离子分别为m/z 325.98 → 291.06、m/z 325.13 → 109.04、m/z 343.01 → 308.02、m/z 320.98 → 275.02、m/z 316.01 → 270.04、m/z 295.04 → 267.01、m/z 282.05 → 236.04和m/z 285.04 → 154.04。
储备液、工作液和质控样品的制备 分别精密称取7种对照品约1 mg分置于10 mL量瓶中, 各加入10 mL甲醇制备成质量浓度约为1.0 mg·mL-1的标准储备液, 精密量取上述各贮备液适量, 置同一量瓶中, 加甲醇定容, 摇匀, 即得混合对照品溶液, 随后用甲醇梯度稀释混合对照品溶液, 制得系列混合标准工作液。另外分别量取上述各贮备液适量, 制备上述对照品质控样品 (QC) 储备液, 然后用甲醇梯度稀释获得低、中、高浓度的QC样品。精密称取适量西酞普兰加入甲醇制备成1.003 mg·mL-1的内标标准储备液, 精密量取内标标准储备液于量瓶中以甲醇稀释至2.006 μg·mL-1的内标工作液。在空白血浆中加入不同质量浓度的7个化合物的对照品溶液和内标液, 配制成一系列质量浓度的质控血浆样品。
血浆样品的处理 量取血浆样品200 μL, 置于1.5 mL塑料离心管中, 加入内标工作液5 μL涡旋混合30 s。加入乙腈600 μL, 涡旋混合60 s, 4 ℃、1.2×104 r·min-1离心10 min, 取上清液3 μL进行LC-MS/MS分析。
标准曲线 取空白血浆200 μL, 分别依次加入各浓度混合标准工作溶液10 μL和内标液5 μL, 配制成一系列质量浓度的标准曲线血浆样品。按“血浆样品的处理”项下操作, 以待测物质量浓度 (X) 为横坐标, 待测物和内标峰面积的比值 (Y) 为纵坐标, 其加权(1/X) 线性回归后, 所得的直线回归方程即为标准曲线。每天建立标准曲线, 连续3天。
专属性 取6个不同来源的人空白血浆样品, 混合均匀后取200μL, 不加内标, 直接加入乙腈600 μL, 按“血浆样品的处理”项下操作。另配制7种定量下限浓度的血浆样品, 加入内标工作液后同法处理分析 (n = 3), 考察专属性。
精密度与准确度 取空白人血浆, 配制7个化合物的定量下限、低、中、高质量浓度的QC样品, 按“血浆样品的处理”项下操作。每质量浓度5份同日测定, 连续测定3天。以当日的随行标准曲线计算样品的测定质量浓度, 与配制的质量浓度对照, 求得本方法的精密度与准确度。
基质效应 取6种不同来源的空白人血浆200 μL, 经乙腈沉淀蛋白得到空白血浆提取液, 分别向其加入7种化合物对照品溶液适量和内标溶液 (2.006 μg·mL-1西酞普兰, 5 μL), 制备成低、中、高质量浓度的质控样品, 得到的色谱峰面积与相应质量浓度的标准溶液直接进样获得的色谱峰面积比较, 计算本方法的基质效应。
提取回收率 取空白人血浆, 配制7个化合物的低、中、高质量浓度的质控样品, 按“血浆样品的处理”项下操作。每质量浓度5份同日测定, 连续测定3天。将质控样品与空白血浆提取后加入对照品溶液后进样测得的峰面积相比, 考察方法的提取回收率。
稳定性 配制7个化合物低、中、高浓度的质控样品, 考察室温 (24 ℃) 放置8 h、冰箱 (4 ℃) 放置24 h、-20 ℃冰箱冷冻放置30天、反复冻融3次 (-20 ℃) 和进样器内 (10 ℃) 放置24 h等5种条件下的稳定性, 每次处理均对低、中、高3种质控浓度各5份样品进行分析。
方法学应用 临床试验经民航总医院伦理委员会批准, 受试者签署知情同意书后, 对2例服用镇静催眠药的临床患者血液样本进行了分析。以当日的随行标准曲线计算样品的测定质量浓度, 再换算成样品的血药浓度。
结果 1 质谱分析苯二氮䓬类镇静催眠药结构中含有碱性氮原子, 质谱电离时易获得质子, 优先选择正离子监测模式, 在此模式下, 咪达唑仑、西酞普兰、三唑仑、劳拉西泮、氯硝西泮、艾司唑仑、硝西泮和地西泮主要生成[M+H]+ 峰, 分别为m/z 325.98、325.13、343.01、320.98、316.01、295.04、282.05、285.04。选择性对[M+H]+ 峰进行产物离子扫描分析, 生成的主要碎片离子分别为m/z 291.06、109.04、308.02、275.02、270.04、267.01、236.04和154.04 (图 1)。在此基础上, 对碰撞能量和锥孔电压进行优化。
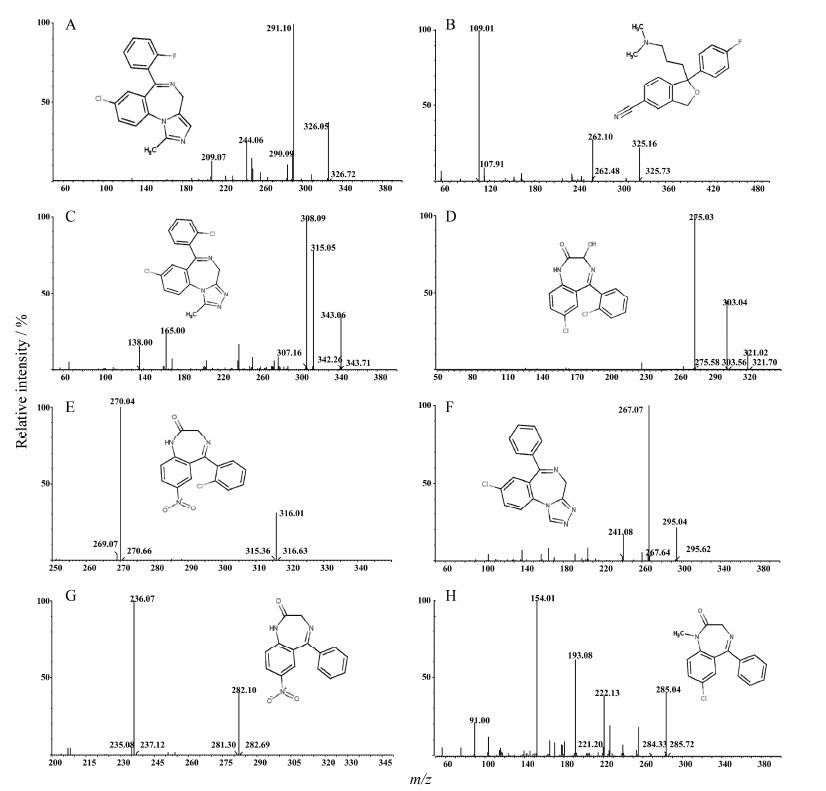
|
Figure 1 The chemical structures, parent ion and product ion spectra of midazolam (A), citalopram (B), triazolam (C), lorazepam (D), clonazepam (E), estazolam (F), nitrazepam (G) and diazepam (H) |
西酞普兰、咪达唑仑、硝西泮、艾司唑仑、氯硝西泮、劳拉西泮、三唑仑和地西泮的保留时间分别为1.79、2.13、3.15、3.45、3.19、3.73、3.68和4.61 min; 血浆中内源性物质不干扰以上化合物的测定, 见图 2。
2.2 标准曲线与定量下限咪达唑仑、硝西泮、艾司唑仑、氯硝西泮、劳拉西泮、三唑仑和地西泮的回归方程分别为Y = 0.021 X + 0.004 8(r = 0.999 4)、Y = 0.025 X + 0.000 32(r = 0.998 1)、Y = 0.017 X - 0.020(r = 0.994 7)、Y = 0.007 0 X - 0.003 2 (r = 0.997 9)、Y = 0.007 0 X - 0.020 (r = 0.997 4)、Y = 0.018 X - 0.031 (r = 0.990 2)、Y = 0.026 X + 0.001 2 (r = 0.998 8)。其质量浓度分别在1.05~840、2.06~824、2.02~1 616、6.18~2 472、6.12~2 448、3.02~2 416和1.02~816 ng·mL-1内线性关系良好, 定量下限分别为1.05、2.06、2.02、6.18、6.12、3.02和1.02 ng·mL-1。最低检出限分别为0.02、0.52、0.51、1.55、0.77、0.76和0.02 ng·mL-1。
2.3 精密度与准确度本方法的精密度与准确度结果见表 1。
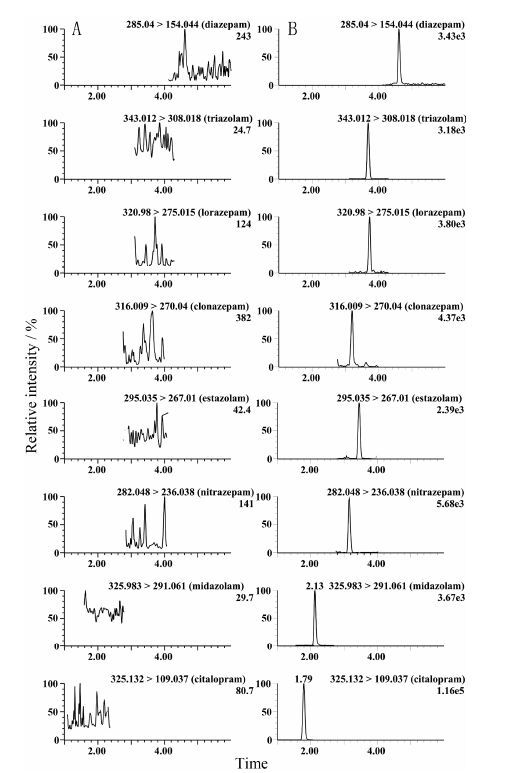
|
Figure 2 Representative chromatograms of citalopram, midazolam, nitrazepam, estazolam, clonazepam, lorazepam, triazolam and diazepam. A: Blank plasma; B: Blank plasma spiked with citalopram (50 ng·mL-1), midazolam (LLOQ, 1.05 ng·mL-1), nitrazepam (LLOQ, 2.06 ng·mL-1), estazolam (LLOQ, 2.02 ng·mL-1), clonazepam (LLOQ, 6.18 ng·mL-1), lorazepam (LLOQ, 6.12 ng·mL-1), triazolam (LLOQ, 3.02 ng·mL-1) and diazepam (LLOQ, 1.02 ng·mL-1) |
结果表明, 各待测化合物低、中、高质量浓度的的基质效应均在82.34%~109.87%, RSD < 9.36%; 内标西酞普兰的基质效应值为 (112.45 ± 10.08)%, RSD为8.96%。
2.5 提取回收率结果表明, 7个化合物的相对提取回收率均在81.46%~106.53%; 内标西酞普兰的相对提取回收率为102.60%, RSD为7.25%。
2.6 稳定性室温 (24 ℃) 放置8 h、冰箱 (4 ℃) 放置24 h、-20 ℃冰箱冷冻放置30天、反复冻融3次 (-20 ℃) 和进样器内 (10 ℃) 放置24 h条件下的稳定性结果表明, 准确度RE%分别在-2.12%~10.93%、2.87%~8.94%、-3.77%~2.18%、5.36%~8.74%、-2.38%~6.58%之间。
3 方法学应用对两例服用镇静催眠药的临床患者血液样本进行了分析。以当日的随行标准曲线计算样品的测定质量浓度, 再换算成样品的血药浓度。测定结果为: 咪达唑仑, 161.79 ± 6.23 ng·mL-1, RSD为3.85%; 地西泮, 441.75 ± 33.66 ng·mL-1, RSD为7.62%。
| Table 1 The precision and accuracy of midazolam, triazolam, lorazepam, clonazepam, estazolam, nitrazepam and diazepam in human plasma. n = 6, x± s |
本研究采用乙腈沉降蛋白处理血浆, 处理方法简单、快速, 测得各化合物的最低检出限均较低, 且准确度、精密度和提取回收率良好。苯二氮䓬类药物结构中含有碱性氮原子, 在酸性条件下容易质子化, 本研究在流动相中加入低浓度甲酸, 提高待测物的质子化效率, 改善峰形[9]。由于此类药物结构和性质相似, 保留时间相近, 因此采用梯度洗脱使各化合物获得良好的峰形和足够的响应。此外, 本研究结合人体有效血药浓度[10]确定线性范围, 该范围比Nakamura等[7]研究中同类药物的范围宽。本研究也从专属性、线性关系、回收率、基质效应、稳定性等各方面对方法进行了验证, 符合生物样品测定相关要求[11-13], 可用于临床中毒抢救、刑事案件的侦破及药物影响驾驶安全研究。
| [1] | McCall WV. A psychiatric perspective on insomnia[J]. J Clin Psychiatry , 2001, 62 (Suppl 10) :27–32. |
| [2] | Brett J, Murnion B. Management of benzodiazepine misuse and dependence[J]. Aust Prescr , 2015, 38 :152–155. DOI:10.18773/austprescr.2015.055 |
| [3] | Chen XQ, Jin YY, Tang G. New Edited Materia Medica (新编药物学)[M]. Beijing: People's Health Publishing House, 2002 : 169 . |
| [4] | Jiang ZL, Tan JY, Yao LJ, et al. Screening analysis of benzodiazepine medicines and selected metabolites in plasma and urine using gas chromategraphy with nitrogen phosphorus detection[J]. J Anal Sci (分析科学学报) , 2005, 6 :639–642. |
| [5] | Wang LM. Rapid determination of plasma concentrations of four commonly used sedative hypnotics by solid phase extraction-HPLC[J]. Proc Clin Med (临床医药实践) , 2004, 4 :303–304. |
| [6] | Liang XH, Dai ZY, Liu WE. Simultaneous determination of 5 sedative hypnotics in human plasma by reversed phase high-performance liquid chromatography[J]. J Cent South Univ (Med Sci) (中南大学学报医学版) , 2009, 7 :689–693. |
| [7] | Nakamura M, Ohmori T, Itoh Y, et al. Simultaneous deter-mination of benzodiazepines and their metabolites in human serum by liquid chromatography-tandem mass spectrometry using a high-resolution octadecyl silica column compatible with aqueous compounds[J]. Biomed Chromatogr , 2009, 23 :357–364. DOI:10.1002/bmc.v23:4 |
| [8] | Lee HH, Lee JF, Lin SY, et al. Simultaneous quantification of urine flunitrazepam, nimetazepam and nitrazepam by us-ing liquid chromatography tandem mass spectrometry[J]. Clin Chim Acta , 2013, 420 :134–139. DOI:10.1016/j.cca.2012.10.023 |
| [9] | Zhao Y, Wang L, Bao Y, et al. A sensitive method for the detection and quantification of ginkgo flavonols from plasma[J]. Rapid Commun Mass Spectrom , 2007, 21 :971–981. DOI:10.1002/(ISSN)1097-0231 |
| [10] | Schulz M, Iwersen-Bergmann S, Andresen H, et al. Thera-peutic and toxic blood concentrations of nearly 1000 drugs and other xenobiotics[J]. Crit Care , 2012, 16 :R136.. DOI:10.1186/cc11441 |
| [11] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the the People's Republic of China (中华人民共和国药典)[M]. Vol II. 2015 ed. Beijing: China Medical Science Press, 2015: Appendix XIX B. |
| [12] | US Food and Drug Administration. Guidance for Industry: Bioanalytical Method Validation (draft)[S/OL]. 2013[2016-07-22]. http://www.fda.gov/downloads/Drugs/GuidanceCompli-anceRegulatoryInformation/Guidances/UCM368107. |
| [13] | European Medicines Agency. Guideline on Bioanalytical Method Validation[S/OL]. 2011[2016-07-22]. http://www.ema.europa.eu/docs/en_GB/document_library/Scien-tific_guideline/2011/08/WC500109686.pdf. |
 2016, Vol. 51
2016, Vol. 51


