2. 解放军302医院中西医结合医学中心, 北京 100039
2. Integrative Medicine Center, 302 Military Hospital, Beijing 100039, China
近年来中医药科技领域取得系列成果世人瞩目,显示了中医药的巨大临床价值。安全是疗效的前提,有关中药安全性的问题更是不容忽视。随着中草药在全球范围内的广泛应用及药品不良反应监测体系的不断完善,中药相关不良反应/事件的报道呈升高趋势,特别是一些传统不认为有毒的中药也发生了不良反应/事件,诸如日本柴胡事件、新加坡黄连素事件,国内何首乌事件、延胡索事件等,对中药的临床应用造成了一定的负面影响,加强传统无毒中药安全性评价成为目前中药现代化战略中重要的研究方向之一。
当今医学正大踏步进入精准医学(precision medicine)时代。从某种程度上来说,中医个体化诊疗是精准医学的先驱,中医辨证用药减毒是古人对精准毒理学的早期实践。但传统中医药学这些个体化用药的思想仍然是较为朴素的,还不是真正意义上的精准医学。此外,尽管当前精准医学倚重的基因测序对提高用药精准性具有重要价值,但临床上疾病的发生不仅局限在基因水平,同时还与机体状态及组织细胞微环境密切相关。通过对机体状态的辨识即辨证用药,实现减毒增效,是中医药个体化用药的本质和优势所在。就安全性方面而言,辨证用药减毒是中医药精准医学的重要研究内容。但需要指出的是,传统中药与现代化学药在医学理论、用药历史、配伍规律、药理毒理作用特点以及安全性评价需求等方面存在明显不同[1],特别是针对一些传统无毒中药不良反应/事件的安全性评价时,照搬现有化学药安全性评价规范,由于常常忽视临床病证、基础疾病、体质和遗传差异等机体因素对药物毒性应答的差异性,难以解决中药安全性评价问题。
为此,本文在系统分析中药和化学药在毒性特点、用药规律、评价需求等方面异同的基础上,提出中药病证毒理学(disease-syndrome-based toxicology)思想,构建关联临床病证的中药安全性评价新策略和方法,以期科学认知和精准评价中药毒性的相对性、易感性及可控性,为提高中药安全性评价水平和保障临床用药安全提供参考思路,促进中医药精准医学发展。
1 中药安全性评价的挑战与对策现代药物临床前安全性评价体系历经数十年发展,已形成国际共识性评价规范和定式,对于避免或降低药物临床严重不良反应发生起到重要作用。药 物毒性分为固有毒性(intrinsic toxicity)和特异质毒性(idiosyncratic toxicity)两类,前者在临床前安全性评价阶段通过常规毒理学实验大多可以被发现; 而后者往往在临床评价阶段才被发现,是当前药物上市后出现严重不良反应以及导致药物退市的主要原因[2]。由于药物特异质毒性往往具有隐匿性、偶发性的特点,与剂量、疗程缺少关联,致使常规安全性评价难以发现。药物特异质毒性评价和预测是极具挑战的国际性难题,尚缺少成熟的评价模式和方法,也是当前该领域国内外研究的前沿热点。
中药(复方)已有数千年的人体应用历史和安全性经验,除小部分毒剧类中药为固有毒性外,大部分传统无毒中药的临床不良反应与特异质毒性有关,即其发生与临床疾病、证候、机体状态、体质等个体因素密切相关。然而,在以正常健康动物为主要评价载体的常规药物安全性评价体系中,这些病、证相关因素往往难以涉及和评价,造成中药尤其是传统无毒中药安全性实验评价结果与临床实际不一致、难以指导临床精准用药的困境,传统无毒中药安全性评价需要在研究思路和方法学寻求新的突破(图 1)。
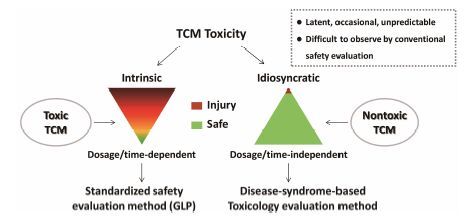
|
Figure 1 Difficulties and strategies in safety assessment of traditional “nontoxic” Chinese medicines |
事实上,传统中医药理论特别强调机体病证状态对药物疗效和安全性的影响,即“辨证用药思想”,是指导中药临床应用的基本原则。而这种机体病证状态对药物安全性的影响,早在《黄帝内经•素问》就提出了“有故无殒,亦无殒也”的辨证认识思想,即“有病则病受之”[3]、无病则体受之,提示在评价中药安全性时,要充分考虑到机体状态或疾病状态的变化: 在没有病邪存在的情况下,中药的偏性作用于正常机体,即使是传统认为“无毒”的中药也可能会出现毒性病理学反应; 在对症(证)的情况下,即使是被认为是“大毒”的中药,也可以表现为良好的治疗作用,取得治疗收益和风险的良好平衡。如源于砒霜而发现的亚砷酸,对急性早幼粒细胞性白血病疗效显著获得国际认可[4]。但是若把砷制剂用于正常人或者不符合适应证的病人很可能会产生严重不良反应。又比如,对于阳厥证患者,使用较大剂量附子“回阳救逆”是恰当的,但若将相同剂量的附子用于正常人或者不对证的患者,则可能导致严重不良反应甚至死亡。
《素问•五常政大论篇》曰: “人有能耐毒者,有不胜毒者,能毒者以厚药,不胜毒者以薄药”,提示机体间差异对药物不良反应的反应性或应答程度存在显著差异,因此评价中药安全性不能割裂中药与机体间的关系,要在其所含化学成分的基础上,研究不同机体状态对中药安全性的影响规律。其中,机体状态包括正常状态、病证状态、体质耐受或不耐受特异状态等。体质耐受或不耐受特异状态主要指不同年龄、性别、种族和遗传背景的人由于其药物代谢酶系统和免疫遗传多态性差异,进而对药物毒性的敏感性与耐受性表现出显著差别。很多研究证实机体状态差异会在很大程度上影响到中药的安全性,如附子对正常大鼠的心脏毒性强于肾阳虚模型和脾阳虚模型大鼠[5, 6]; 雷公藤多苷对正常大鼠的肝功能血生化指标的影响大于关节炎模型大鼠[7]。
因此,在进行中药安全性评价时,基于中医“有故无殒”理论,采用证候或疾病动物模型,更能准确反映中药应用于临床患者的真实情况[8, 9]。这种研究思路和模式,即病证毒理学评价模式,可作为传统无毒中药安全性评价的重要模式和方法,对传统无毒中药的安全性风险进行科学评价和有效预警,践行中医药辨证用药减(避)毒理论,促进中医药精准医学发展。
2 基于病证毒理学的中药安全性评价模式病证毒理学是指以临床真实世界和“拟临床”的病证模型为评价载体,采用系统毒理学、预测毒理学等评价方法,对比研究药物在不同机体状态(正常、疾病、特异质)模型上的毒性敏感性与耐受性差异规律,从而科学评价和预测中药安全性的研究模式和方法。该研究模式包括两个部分: 一是基于病证或疾病模型动物,与正常动物平行对比阐明药物的“证(病)-量-毒-效”关系,发现其适宜的病证和可能的“治疗窗”范围,为临床精准辨证(病)用药提供参考,主要适用于有毒或药性峻猛中药; 二是基于易感性和特异质模型评价药物的安全性,评价药物应用于不同特异质患者的安全性风险,揭示易感因素、机制和生物标志物,为临床筛查易感人群和精准用药提供参考,主要适用于传统无毒中药。病证毒理学理念为中药安全性评价提供了重要的原创思维,对科学地认知和精准评价中药毒性的相对性、易感性及可控性提供可借鉴的新思维和新思路。
首先,病证毒理学为中药安全性评价提出了新的研究方向。尽管现代药物安全性评价体系已形成广泛采用的规范和定式,但常规的中药安全性评价主要是针对固有型药物毒性而设置的,中药特异质毒性的评价和预测几乎是一个空白。以药物特异质肝损伤为例,这是一种在临床剂量范围内、仅发生于少数病人(发生率通常介于0.01%~5%)、与药物的药理效应无关、无明显临床剂量-效应关系的药物不良反应[10]。中药特异质毒性的发生机制主要分为免疫特异质和代谢-免疫特异质两种类型(图 2),其中免疫特异质主要与机体自身免疫异常或者免疫功能紊乱(如过敏、免疫应激)有关,代谢-免疫特异质主要是与免疫系统和药物代谢酶的基因多态性有关。根据目前较广泛接受的半抗原假说(hapten hypothesis),药物活性代谢产物(半抗原)与内源性蛋白质等共价结合产生具有免疫原性的药物-蛋白质复合物,从而诱发免疫细胞活化,进而产生过度炎症反应和急性损伤。其中免疫系统基因多态性是目前研究发现最多的药物特异质肝损伤机制,主要靶标是人类白细胞抗原(human leukocyte antigen,HLA)基因突变[11]。值得一提的是,对于传统有毒中药,临床应用往往较为注意,不良反应评价和风险控制相对较为容易; 而传统无毒中药毒副反应主要和特异质毒性有关,往往具有隐匿性和难以预测性,还缺少系统的科学研究。病证毒理学的核心思想即是重视机体状态差异对中药安全性的影响,也就是主要针对特异质毒性的评价,为中药安全性评价提出了新的研究领域。
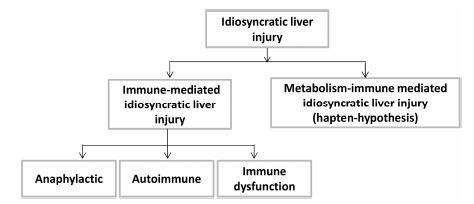
|
Figure 2 Main types of drug-induced idiosyncratic toxicity |
其次,病证毒理学为中药安全性评价提供了新的研究理论。尽管传统中医药理论体系强调辨证用药减(避)毒、“有故无殒”等,但这些大多还是一些零散的理念,缺少系统的理论认识,特别是缺少现代科学视角的阐释,导致传统中医药毒性理论研究大多停留在理论思辨、主观推理和个人经验总结的层面,难以开展现代科学机制的研究,也难以被现代医学和科学体系接受。病证毒理学首次从现代毒理科学的视角审视传统中医药辨证用药减(避)毒理论体系,结合系统毒理学、预测毒理学和精准医学理念,系统提出了机体状态差异影响中药安全性的理论认识,这种机体状态差异不仅仅包括病证、疾病差异,而且包括代谢和免疫状态、体质、遗传多态性差异,而这种差异的生物学基础是基因、酶、代谢物及其共同组成的组织细胞微环境的差异,为从细胞和分子水平探究中医药传统毒性理论的科学机制提供了理论上的系统指导,使中医辨证用药减(避)毒、“有故无殒”等研究从主观思辨向客观评价的转变成为可能。
第三,病证毒理学为中药安全性评价提供了新的研究模式。长期以来,中药安全性评价主要参考和借鉴了化学药安全性评价的研究模式,即主要以正常动物为研究载体进行毒理学评价的模式。由于化学药通常是新化合物没有人体应用,因此采用正常动物评价的模式对于发现药物量-时-毒关系、毒性损伤靶器官及各种潜在毒性风险等具有重要参考意义,通常也适合于毒性较大或“量-时-毒”关系明确中药的安全性评价。然而,大多数中药的毒性较小或“量-时-毒”关系不明显,其在临床上的不良反应往往与特异质毒性有关,采用正常动物评价很难发现特异质毒性,评价结果往往与临床实际需求脱节,因此长期以来限制了中药安全性评价研究的发展。病证毒理学以临床真实世界和“拟临床”的病证模型为评价载体,采用系统毒理学、预测毒理学等评价方法,对比研究药物在不同机体状态(正常、疾病、特异质)模型上的毒性敏感性与耐受性差异规律,更加贴近中药临床实际需求,为中药安全性评价提供了新的研究模式。
3 中药特异质肝损伤新理论:“免疫应激三因致毒”假说传统无毒中药肝毒性问题是业内外热议和争议焦点。由于传统无毒中药肝损伤往往具有隐匿性、个体差异性和难预测性等特点,如何科学评价和揭示传统无毒中药肝损伤易感性及其机制,是当前中药安全性评价研究领域极具挑战的国际性难题,但同时也是研究较少、迫切需要解决的关键科学问题之一。
作者在前期研究中证实何首乌在部分易感人群较易发生肝损伤[12, 13],且主要与机体免疫状态具有较大相关性,结合肝脏免疫因素与药物肝毒性的国际前沿研究发现[14, 15],以及何首乌自身较强的促进免疫作用和何首乌中个别成分具有潜在肝损伤作用,提出了中药(何首乌)免疫应激三因致毒假说(图 3),并成功建立了免疫应激介导的何首乌肝损伤评价模型[16],揭示了免疫应激与何首乌肝损伤易感性的关系。中药(何首乌)免疫应激三因致毒假说是指当机体免疫处于异常活化状态时(易感人群),何首乌中促进免疫物质(如反式二苯乙烯苷)可能会进一步增强机体免疫活化(免疫应激),同时使肝脏对某些潜在的肝损伤易感物质(如二苯乙烯苷二聚物[17]、顺式二苯乙烯苷等)的易感性增强,出现炎症因子过表达,从而诱发免疫应激性肝损伤。通俗地讲就是“柴-油-火星子假说”,机体免疫处于异常活化状态相当于“柴”,何首乌中促进免疫物质相当于“油”,而潜在的肝损伤易感物质相当于“火星子”,单独一种风险因素不会着火,当3种风险因素同时具备时,1个小小的火星子将引起熊熊大火。本文首次提出并初步证实的中药“免疫应激三因致毒”假说紧密结合中药临床肝损伤的发生特点和风险因素,充分考量了机体病证状态对药物肝损伤易感性的影响,为认识传统无毒中药的特异质毒性提供了新的视角。
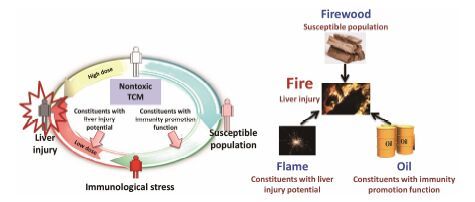
|
Figure 3 The immunological stress-mediated tri-element injury hypothesis of idiosyncratic toxicity of traditional Chinese medicines |
中药特异质肝毒性是当前安全性研究的重点和难点。近年来,国内外有关传统无毒中药何首乌及其制剂肝损伤不良反应的报道逐渐增多[18],包括服用生首乌、制首乌、含何首乌的复方、中成药或保健食品等。美国国家医学图书馆发布的LiverTox肝毒性药物数据库对何首乌进行了专题记录[19]。2006年英国、澳大利亚和加拿大药监部门先后发布了何首乌肝损伤警告信息; 2006年、2013年和2014年我国药监部门也多次发布了含首乌制剂肝损伤警示和监管通告。社会上甚至有“千年何首乌,今朝肝毒性”的耸听危言,何首乌肝毒性的问题引起国内外高度关注。
通过整合证据链方法客观辨识[18, 20]和药物流行病学调查,传统无毒中药何首乌具有较典型的特异质肝损伤特征[12, 13]: ① 临床上偶见何首乌肝损伤[21],但未呈明显的剂量、疗程依赖关系,也未见有明显的年龄、性别差异; ② 何首乌肝损伤病例多见于与免疫异常活化相关疾病如脱发、白发、白癜风、银屑病、类风湿关节炎等; ③ 单用何首乌或含何首乌复方制剂、生首乌或制首乌均有肝损伤临床病例报道,生首乌多于制首乌; ④ 生药学溯源鉴定和外来有害物质检测表明,何首乌肝损伤典型病例所服何首乌均为正品药材且无农残、重金属和微生物毒素超标[21],可以排除何首乌肝损伤原因“伪品说”和“黄曲霉毒素说”; ⑤ 根据没食子酸及鞣质类、蒽醌类等成分在食品和中药分布的广泛性和极罕见有肝损伤报道,亦可以排除何首乌肝损伤原因“没食子酸说”、“鞣质说”、“蒽醌说”; ⑥ 历代本草已认识到何首乌有一定毒性,故特别强调炮制减毒的重要性,如《本草汇言》云首乌“制非九次,勿寝其毒”,而目前何首乌几乎没有九蒸九晒炮制品,减毒不充分很可能也是增加何首乌肝损伤风险的重要原因之一[22]。
通过上述分析可以看出,何首乌肝损伤原因是多方面的,与机体特异质状态及易感性密切相关,同时与质量也不无关系。特别是通过对患者机体状态和临床病证分析发现,何首乌肝损伤病例大多为前述免疫异常活化相关疾病,属中医辨证血热伤阴、阴虚阳亢者,往往具有免疫功能活化或炎症因子表达升高,而何首乌本身具有较强的免疫促进作用,可能进一步诱发免疫活化或应激。为此,笔者课题组提出何首乌特异质肝损伤的免疫应激三因致毒假说(图 3)。该假说经动物模型得到了实验证实,并据此首次建立了基于免疫应激的何首乌特异质肝毒性评价模型[16],
通过考察量-毒和时-毒关系,发现生首乌在临床常用剂量(12 g/日)的2倍量可引起肝损伤,表现为引起TLR4-NF-KB等信号通路的活化、炎症细胞分化和激活、诱导TNF-α、IL-1β、IL-6、MIP-2、MCP-1等炎症因子和趋化因子释放,组织内环境稳定性破坏,使肝脏对药物敏感性大大增强而出现药物特异质肝损伤。在免疫应激模型上,何首乌的中毒剂量与临床实际发生肝损伤患者服药剂量基本一致,而何首乌在正常健康动物上即使是临床常用剂量的70倍也未表现出肝损伤作用。该结果表明所建立的评价模型可作为何首乌特异质肝损伤评价、毒性物质基础和科学机制研究的重要模型工具,对指导临床从免疫应激角度筛选何首乌肝损伤易感人群和生物标志物,避免易感人群用药引起的肝损伤风险 ,解决何首乌肝损伤问题有重要参考价值。
5 基于有故无殒理论的中药证(病)-量-毒-效关系及治疗窗研究大黄是我国特产的世界著名传统药物,广泛应用于胃肠道疾病、肝病、肾病等的长期治疗。据统计,全国8 000余种中成药制剂约有10% 含有大黄。但近年国外报道长期应用大黄中蒽醌类成分可致肝、肾损害以及潜在的致癌风险[23],大黄及相关中成药临床应用的安全性受到质疑。然而,大黄一方面用于慢性肝炎、肾炎的治疗,另一方面又可引发肝、肾损伤,看似一个悖论。如何科学认识其药效和毒性“双向作用”的客观真实性?或者说,如何科学认识大黄量-效/毒关系?为此,笔者课题组根据“有故无殒”思想,以大黄为例,开展了基于病理毒理学的中药证(病)-量-毒-效关系研究,即同时采用正常和疾病动物(肝炎、肾炎模型),比较和综合阐明大黄证(病)-量-毒-效关系及其影响因素,以期为大黄合理利用提供科学依据,同时为中药证(病)-量-毒-效关系及治疗窗研究提供实例参考。
综合研究和分析表明,大黄及其炮制品在不同病证状态如慢性肝损伤、急或慢性肾衰竭、以及不 同年龄大鼠的耐受性和量-毒-效关系存在显著差异[24-29]。其中CCl4致慢性肝损伤模型大鼠的耐受性显著高于正常大鼠约2~4倍,在安全剂量和适宜时间范围内表现出剂量依赖的治疗效果[27-29](图 4左),其保护作用主要体现在降低细胞损伤因子(保护肝细胞),而其损伤作用主要体现在增加肝纤维化因子(诱导肝纤维化),在2~14.67 g·kg-1剂量内主要表 现为保肝降酶作用,药效随剂量增加显著提高; 在14.67~40 g·kg-1剂量内,虽仍可降低转氨酶等肝功能生化指标,但同时表现为致肝纤维化作用,且随剂量增加显著增强。由此可以得出大黄治疗慢性肝损伤可能的“治疗窗”为2~14.67 g·kg-1(相当于人用剂量0.3~2.5 g·kg-1·d-1)[29]。上述结果提示,通过合理选择治疗适应证、控制大黄的治疗剂量和用药周期,可实现辨证(病)用药减毒存效(图 4右); 代谢过程研究表明大黄游离蒽醌(大黄素、大黄酸、芦荟大黄素)在正常大鼠肝、肾、脾的组织浓度均高于CCl4致慢性肝损伤模型大鼠,与大黄治疗肝损伤“有故无殒”现象具有显著相关性[30, 31],揭示了大黄治疗慢性肝损伤“有故无殒”现象的可能机制。这一发现印证了清代张锡纯《医学衷中参西录》所载“大黄之力虽猛,然有病则病当之,恒有多用不妨者”; 同时也证明大黄“有故无殒”现象客观存在: 在一定剂量范围内,大黄对“有故”(肝损伤)机体,正确辨病(证)施治,能够达到“无殒”的目的,科学澄清大黄既有肝肾毒性报道又可用于肝肾疾患治疗的双重性。
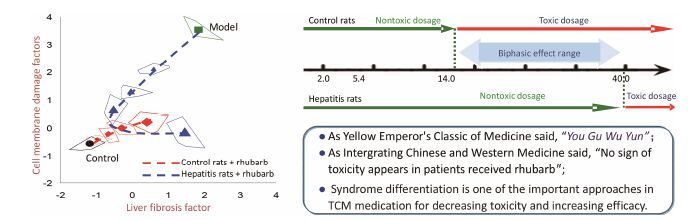
|
Figure 4 Differential effects of rhubarb in hepatitis or normal control rats[30]. In left panel: the dosages of rhubarb were 2, 5. 4, 14.69 and 40 g raw material/kg, respectively |
综合分析基于“有故无殒”思想和病理毒理学的大黄量-效/毒关系研究结果,对大黄临床应用建议如下: ①《中国药典》2010年版的最大剂量30 g/天仍有提升空间,但鉴于动物实验与临床应用的差距,该结果还有待于进一步结合临床验证,暂定大黄临床日用剂量不宜超过30 g。② 在准确辨证情况下,临床长期大剂量应用大黄时,宜根据不同病证选用相应炮制品,定期检查患者肝肾功能。③ 针对临床上体质有明显差异的老年及怀孕患者等人群,应严格控制用药剂量和疗程,定期做肝肾功能检查。④ 大黄在临床应用前应根据蒽醌、鞣质两类主要成分的理化性质差异,选择适宜的提取纯化方式进行炮制,发挥“增效减毒”的作用[32, 33],使临床疗效尽可能最大化。⑤ 含有大黄及其主要成分的保健品少量短期服用尚可,长期大剂量服用应有专业人士指导。
6 结语与展望当前,社会对中药安全性问题的关注度很高,而且某种程度上比对化学药的关注度更高。然而,囿于研究理论、思路和模式的局限,以及中药自身的复杂性,中药安全性研究相对滞后,远远不能满足公众日益增长的对中药安全用药的需求,这已成为当前中药安全性研究的主要矛盾。21世纪是精准医学时代,提高安全性评价的针对性、精准性和可转化性是中 药现代化发展的必然要求,也是提高中药安全用药水平的必然要求。中医传统理论的辨证用药、因人 施药、“有故无殒”等思想,在某种程度上是精准医学思想的先驱,但这些思想仍是相对朴素的科学理念,还需要现代医学、药学和生物学的科学阐释与具象化,从而转化为现实可行的、精准可控的技术手段。因此,以中医药辨证用药减(避)毒、“有故无殒”等传统理论为指导,融合系统毒理学、预测毒理学和精准医学思想和方法,提出发展中药病证毒理学(disease-syndrome-based toxicology),构建关联临床病证的中药安全性评价新策略和方法,将对科学认知和精准评价中药毒性的相对性、易感性和可控性提供可资借鉴的新视角和新思路。
| [1] | Wang JB, Xiao XH, Du XX, et al. Identification and early diagnosis for traditional Chinese medicine-induced liver injury based on translational toxicology[J]. China J Chin Mater Med (中国中药杂志) , 2014, 39 :5–9. |
| [2] | Navarro VJ, Senior JR. Drug-related hepatotoxicity[J]. N Engl J Med , 2006, 354 :731–739. DOI:10.1056/NEJMra052270 |
| [3] | Zhang XC (Qing dynasty). Intergrating Chinese and West-ern Medicine[M]. Taiyuan: Shanxi Science and Technology Press, 2013 . |
| [4] | Zhang XW, Yan XJ, Zhou ZR, et al. Arsenic trioxide con-trols the fate of the PML-RAR alpha oncoprotein by directly binding PML[J]. Science , 2010, 328 :240–243. DOI:10.1126/science.1183424 |
| [5] | Wang XJ, Tan Y, Zhao HY, et al. Influence of white pre-pared lateral root of aconite on cardiac enzymes in normal and kidney-yang insufficiency rats[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志) , 2009, 15 :52–55. |
| [6] | Tan Y, Lv C, Zhao HY, et al. Influence of white prepared lateral root of aconite on blood biochemical indicators in normal and kidney yang deficient rats[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志) , 2010, 17 :31–33. |
| [7] | Lv YH, Lv C, Tan Y, et al. Effect of Tripterygium wilfordii polyglycosidium on blood biochemical indexes in adju-vant-induced arthritic rats[J]. Chin J Basic Med Tradit Chin Med (中国中医基础医学杂志) , 2009 (3) :213–214. |
| [8] | Ning KY, Yang W. Investigate the application of animal disease models in non-clinical safety evaluation[J]. Chin Pharm Bull (中国药理学通报) , 2014, 30 :1462–1467. |
| [9] | Ning KY, Min L. Application of morbid animal model in drug safety evaluation of traditional Chinese medicine[J]. Front Pharmacol , 2015, 6 :37. DOI:10.3389/fphar.2015.00037 |
| [10] | Chalasani NP, Hayashi PH, Bonkovsky HL, et al. ACG clinical guideline: the diagnosis and management of idiosyn-cratic drug-induced liver injury[J]. Am J Gastroenterol , 2014, 109 :950–966. DOI:10.1038/ajg.2014.131 |
| [11] | Wang Q, Mei H, Zhang YL, et al. The associations be-tween idiosyncratic adverse drug reactions and HLA alleles and their underlying mechanism[J]. Acta Pharm Sin (药学学报) , 2013, 48 :799–808. |
| [12] | Zhu Y, Niu M, Chen J, et al. Comparison between Chinese herbal medicine and western medicine-induced liver injury of 1985 patients[J]. J Gastroenterol Hepatol , 2016 . DOI:10.1111/jgh.13323 |
| [13] | Zhu Y, Liu SH, Wang JB, et al. Clinical analysis of drug-induced liver injury caused by Polygonum multiflorum and its preparations[J]. Chin J Integr Tradit West Med (中国中西医结合杂志) , 2015, 35 :1442–1447. |
| [14] | Fontana RJ. Pathogenesis of idiosyncratic drug-induced liver injury and clinical perspectives[J]. Gastroenterology , 2014, 146 :914–928. DOI:10.1053/j.gastro.2013.12.032 |
| [15] | Tailor A, Faulkner L, Naisbitt DJ, et al. The chemical, genetic and immunological basis of idiosyncratic drug-induced liver injury[J]. Hum Exp Toxicol , 2015, 34 :1310–1317. DOI:10.1177/0960327115606529 |
| [16] | Li CY, Li XF, Tu C, et al. The idiosyncratic hepatotoxicity of Polygonum multiflorum based on endotoxin model[J]. Acta Pharm Sin (药学学报) , 2015, 50 :28–33. |
| [17] | Li RY, Feng WW, Li XF, et al. Influence of metal ions on stability of 2,3,5,4'-tetrahydroxy stilbene-2-O-β-D-glucoside contained in Polygoni Multiflori Radix[J]. Acta Pharm Sin (药学学报) , 2016, 51 :116–121. |
| [18] | Wang JB, Li CY, Zhu Y, et al. Integrated evidence chain-based identification of Chinese herbal medicine-induced hepa-totoxicity and rational usage: exemplification by Polygonum Multiflorum (He shou wu)[J]. Chin Sci Bull (科学通报) , 2016, 61 :971–980. |
| [19] | Hoofnagle JH, Serrano J, Knoben JE, et al. Liver Tox: a website on drug-induced liver injury[J]. Hepatology , 2013, 57 :873. DOI:10.1002/hep.26175 |
| [20] | China Association of Chinese Medicine. Guideline for Diagnosis and Treatment of Herb-Induced Liver Injury (T/CACM 005-2016) (中草药相关肝损伤临床诊疗指南)[S]. Beijing: Chinese Press of Traditional Chinese Medicine, 2016: 04. |
| [21] | Wang JB, Ma ZJ, Niu M, et al. Evidence chain-based causality identification for herb-induced liver injury: exemplification of a famous liver-restorative herb Polygonum multiflorum[J]. Front Med , 2015, 9 :457–467. DOI:10.1007/s11684-015-0417-8 |
| [22] | Cui HR, Bai ZF, Song HB, et al. Investigation of potential toxic factors for fleece-flower root: from perspective of proc-essing methods evolution[J]. China J Chin Mater Med (中国中药杂志) , 2016, 41 :333–339. |
| [23] | National Toxicology Program, 2001. Technical report on the toxicology and carcinogenesis studies of emodin in F344/N rats and B6C3F1 mice. Series No. 493. NIH Publication No. 01-3952. U.S. Department of Health and Human Services, Public Health Service, National Institutes of Health, Research Triangle Park, NC. |
| [24] | Wang JB, Zhao YL, Xiao XH, et al. Assessment of the renal protection and hepatotoxicity of rhubarb extract in rats[J]. J Ethnopharmacol , 2009, 124 :18–25. DOI:10.1016/j.jep.2009.04.018 |
| [25] | Wang JB, Kong WJ, Wang HJ, et al. Toxic effects caused by rhubarb (Rheum palmatum L.) are reversed on immature and aged rats[J]. J Ethnopharmacol , 2011, 134 :216–220. DOI:10.1016/j.jep.2010.12.008 |
| [26] | Zeng LN, Ma ZJ, Zhao YL, et al. The protective and toxic effects of rhubarb tannins and anthraquinones in treating hexavalent chromium-injured rats: The Yin/Yang actions of rhubarb[J]. J Hazard Mat , 2013, 246-247 :1–9. DOI:10.1016/j.jhazmat.2012.12.004 |
| [27] | Qin LS, Zhao HP, Zhao YL, et al. Protection and bidirec-tional effect of rhubarb anthraquinone and tannins for rats' liver[J]. Chin J Integr Tradit West Med (中国中西医结合杂志) , 2014, 34 :698–703. |
| [28] | Wang YH, Zhao HP, Wang JB, et al. Study on dos-age-toxicity/efficacy relationship of prepared rhubarb on basis of symptom-based prescription theory[J]. China J Chin Mater Med (中国中药杂志) , 2014, 39 :2918–2923. |
| [29] | Wang JB, Zhao HP, Zhao YL, et al. Hepatotoxicity or hepatoprotection? Pattern recognition for the paradoxical effect of the Chinese herb Rheum palmatum L. in treating rat liver injury[J]. PLoS One , 2011, 6 :e24498. DOI:10.1371/journal.pone.0024498 |
| [30] | Fang F, Wang JB, Zhao YL, et al. Tissue distribution of free anthraquinones in SD rats after orally administered extracts from raw and prepared rhubarbs[J]. Acta Pharm Sin (药学学报) , 2011, 46 :350–354. |
| [31] | Fang F, Wang JB, Zhao YL, et al. A comparative study on the tissue distributions of rhubarb anthraquinones in normal and CCl4-injured rats orally administered rhubarb extract[J]. J Ethnopharmacol , 2011, 137 :1492–1497. DOI:10.1016/j.jep.2011.08.028 |
| [32] | Wang JB, Ma YG, Jin C, et al. Study toxicity-attenuating effect and dose-toxicity relationship of rhubarb by processing based on correspondence analysis[J]. China J Chin Mater Med (中国中药杂志) , 2009, 19 :2498–2502. |
| [33] | Wang JB, Ma YG, Zhang P, et al. Effect of processing on the chemical contents and hepatic and renal toxicity of rhubarb studied by canonical correlation analysis[J]. Acta Pharm Sin (药学学报) , 2009, 44 :1–6. |
 2016, Vol. 51
2016, Vol. 51


