2. 天津中医药大学第二附属医院, 天津 300150 ;
3. 天津药物研究院, 释药技术与药代动力学国家重点实验室, 天津 300193
2. Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300150, China ;
3. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
在创新药物研发链中, 口服固体药物制剂的溶出和跨膜透过是体内吸收、分布、代谢和排泄等体内过程的开端, 是生物药剂学分类系统(biopharma ceutics classification system, BCS)的分类依据, 是体内外相关性(in vitro-in vivo correlation, IVIVC)预测的关键指标, 是体内生物利用度(bioavailability, BA)的制约因素。因此, 越来越多的研究者致力于体外溶出技术和体外跨膜透过技术的研究[1, 2], 通过胃肠道(gastrointestinal tract, GIT)生理特性的模拟, 预测口服药物制剂在体内溶出和吸收过程。
体外溶出模型和体外跨膜透过模型, 分别从药物的溶出特征和跨膜透过特征预测口服制剂在体内的过程。目前, 常用的体外溶出法有转篮法、桨法和流通池等, 多国药典均有收载。该类方法主要用于药物研发前期的处方筛选、制剂的IVIVC预测及其后期的常规质量控制[1, 3]。近年来, 基于对GIT生理条件的模拟, 药物溶出评价技术在连续、动态和仿真方面取得较大的进展[1, 4]。单房室动态模型有人工胃模型(human gastric simulator, HGS)[5]、动态胃模型(human gastric simulator, DGM)[6]、大肠模型(TNO intestinal model 2, TIM2)[7]和结肠模型(artificial colon)[8]等; 双房室动态模型有胃-十二指肠仿生系统(artificial stomach-duodenal system, ASD)[9]、FloVitroTM溶出系统[10]等; 多房室动态模型有人肠道微生物生态系统模型(simulator of human intestinal microbial ecosystem, SHIME)[11]、TNO肠道模型(TNO intestinal model 1, TIM1)[12]等; 特殊生理特征的溶出模拟技术有重结晶预测系统(precipitation prediction system)[13]、肠蠕动仿生模型(peristaltic movement simulating test)[14]和溶出压力波仿生模型(biorelevant dissolution stress test device)[15]等。常用的体外跨膜透过方法主要有外翻肠囊法、外翻环法、组织流动室法和细胞培养模型法等。单纯的体外溶出法和跨膜透过法, 尚不能同时反映药物制剂的溶出和透过两大基本特征。研究者开始尝试将溶出模型和透过模型结合起来, 同步评价药物在GIT内的药代动力学(pharmacokinetics, PK)过程。
口服药物在体内的溶出和跨膜透过过程是连续、动态、同步进行的过程。2004年, 美国食品药品管理局(Food and Drug Administration, FDA)发表《创新/停滞:新医疗产品的关键路径上的挑战与机遇》白皮书[16], 推出“关键路径计划” (critical path initiative, CPI)以加快新医疗产品研发进度, 并呼吁努力改进研发过程中使用的科学工具[17]。药物溶出/跨膜透过特征同步评价技术, 将溶出模型和跨膜透过模型有机结合, 同步解析药物在体内的溶出和跨膜透过过程, 正符合“关键路径计划”优先发展领域-“开发更好的评价工具”的需要[18]。该类同步评价技术的研究和应用在逐年增多, 但是系统地概述药物溶出/透过同步评价技术理论基础及研究近况的相关报道尚不多见。基于此, 本文系统地阐述了基于胃肠道多元医学信息驱动的药物溶出/吸收同步评价技术理论基础, 汇总了近年来国内外相关药物溶出/吸收同步评价模型的研究进展, 并对主要评价模型的优缺点、适用范围等特征进行对比研究。以期推动溶出/吸收同步评价技术的进一步发展, 进而缩短药物的研发周期。
1 胃肠道多元医学信息驱动的药物溶出/吸收特征口服药物在GIT生理环境中, 要经历一个连续、动态的溶出和吸收过程[19]。胃既有储存机能, 又有“泵”的作用。胃液中含有胃蛋白酶和0.4%~0.5%盐酸, 具有稀释、消化食物的作用。胃黏膜有许多褶襞, 缺乏绒毛, 吸收面积有限, 除一些弱酸性药物有较好吸收, 大多数药物吸收较差。胃通过慢紧张性收缩运动和波形向前推进的蠕动作用, 既能充分混合食物, 又将内容物向小肠推进。胃排空50%所需要的时间30~90 min。小肠是药物的主要吸收部位, 由十二指肠、空肠和回肠组成。药物在十二指肠与胆汁盐、磷脂质、胰酶和碳酸盐等混合, 中和部分胃酸, pH值从酸性(1~3)急剧地升至近中性(5~6.5)。弱碱性药物由于过饱和状态, 可能发生重结晶现象, 形成溶液和沉淀的动态守恒[20]。小肠黏膜层存在环状皱褶、绒毛和微绒毛, 极大增加了吸收面积。肠道黏膜的各种消化酶和菌群产生的酶, 使药物尚未被吸收就发生代谢反应而失活。小肠的节律性分节运动、蠕动运动和黏膜与绒毛运动, 促进固体制剂进一步崩解、分散, 使之与肠液充分混合。药物在小肠转运时间3~5 h, 不受剂型因素和食物的影响。大肠是由盲肠、结肠和直肠组成, 有效吸收表面积小, 肠道菌群丛生。结肠靠“质量运动”将药物和食物向下推进。
药物在溶出和吸收过程中受诸多因素影响。Yu等[21]在房室吸收-转运(compartmental absorption and transit, CAT)模型基础上, 提出高级房室吸收-转运(advanced compartmental absorption and transit, ACAT)模型[22]。该模型将药物吸收的影响因素分为3类:胃肠生理学因素(胃排空、小肠转运时间、GIT的pH、流体动力学、肠壁代谢酶、肠壁转运体、胃肠血流速度、食物效应等); 药物理化因素(解离度与脂溶性、溶解度与溶出速率、肠腔侧降解率、跨膜渗透性、肠壁代谢和转运稳定性等); 剂型因素(赋形剂、制备工艺和处方组成)。其中, 肠壁上皮细胞存在多种代谢酶[23]如Ⅰ相酶CYP3A4/3A5、2C9、2C19、2D6和2J2, Ⅱ相酶UGTs、SULTs和GSTs等; 肠腔侧有多种转运体[24, 25]如MDR1、MRP2、BCRP、MRP4、PEPT1/2、MCT1、OATP1A2、OATP2B1、OCT3、ASBT、CNT1/2和OCTN1/N2等, 基底侧有MRP1、MRP3、MRP4、MRP5、MCT1、ENT1/2、OATP3A1/4A1和OCT1/2等。ACAT模型不但考虑到线性转运和非线性代谢/转运, 而且包括药物的代谢首过效应和结肠吸收作用。该模型(图 1)假定药物经历9个虚拟房室(胃、7个小肠段和结肠), 6种存在状态(未释放、未溶出、溶出、分解、代谢和吸收)和3种排泄形式(未释放、未溶出和溶出)[22, 23]。
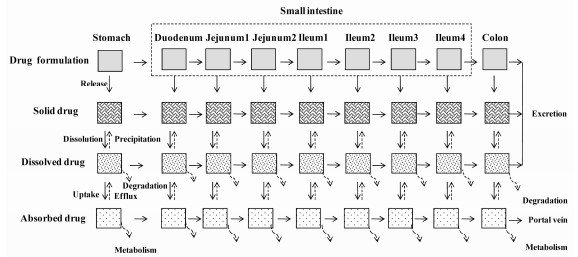
|
图 1 Schematic diagram of drug dissolution and absorption from solid dosage form in gastrointestinal tract (GIT) |
药物溶出过程发生在固体药物与液体介质接触的界面上, 当药物与溶剂间的吸引力大于固体药物粒子间的内聚力时, 会发生溶出。溶出的速度取决于药物在溶剂中的溶解度和药物从溶出界面进入溶液的速度。药物粒子与胃肠液接触后, 药物溶解于胃肠介质, 并形成扩散层[26]。在GIT中, 溶出的药物不断地透膜吸收入血, 形成漏槽状态。药物溶出速度(Fd)可用Noyes-Whitney方程描述, 如公式1所示:
| $ {{F}_{\text{d}}}\text{=}\frac{dM}{dt}=\frac{DA}{h}({{C}_{\text{s}}}-{{C}_{\text{b}}}) $ | (1) |
其中, M是药物分子质量, D是溶解药物扩散系数, A是固体药物表面积, h是扩散层厚度, Cs是饱和溶解度, Cb是t时药物的浓度。
2.2 药物跨膜透过理论药物通过跨膜吸收进入血液循环的量(Jw)取决于肠壁的渗透性(有效渗透性, Pw)和肠壁细胞内药物的浓度(Cw), 如公式2所示。假设, Pw和Cw随着时间变量和空间变量而变化, 上皮细胞内药物浓度是零, 肠腔对药物无损失, 可求得药物吸收速度(Fa), 如公式3所示[27]。
| $ {{J}_{\text{W}}}\text{=}{{P}_{\text{W}}}{{C}_{\text{W}}} $ | (2) |
| $ {{F}_{\text{a}}}\text{=}\frac{dm}{dt}=\int{\int_{A}{{{P}_{\text{W}}}{{C}_{\text{W}}}dA}} $ | (3) |
其中, m是药物分子质量, A是有效吸收表面积。
2.3 药物溶出和跨膜透过同步评价技术理论基于质量守恒原理, Polli等[28]将溶出速率(kd)和跨膜透过速率(kp)与吸收百分数(Fa)和体外溶出百分数(Fd)建立关联, 同步解析药物在胃肠道溶出过程和跨膜透过过程, 以及两者之间关系。假设体外与体内溶出行为相同, 口服药物溶出和吸收过程中Fa与Fd关系式如下:
| $ {{F}_{\text{a}}}\text{=}\frac{\text{1}}{{{f}_{\text{a}}}}(1-\frac{\alpha }{\alpha -1}(1-{{F}_{\text{d}}})+\frac{1}{\alpha -1}{{(1-{{F}_{\text{d}}})}^{\alpha }}) $ | (4) |
其中α=kp/kd, fa是t在∞时体内吸收百分数。该公式是非线性方程。理论上, 随着α变化, Fa和Fd将描绘出系列曲线(图 2)。溶出限速型药物(α > 1)产生“直线型”相关曲线; 透过限速型药物(α < 1)产生“倒L型”相关曲线; 透过和溶出混合限速型药物(α ≈ 1)产生“曲棍型”相关曲线。
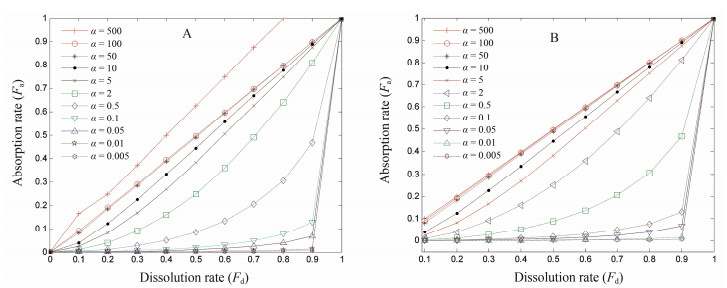
|
图 2 Family of curves for fa=0.6 (A) and fa=1.0 (B)[28]. The theoretical relationship between Fa and Fd is illustrated for a range of α. A greater fraction of dose dissolved yields a greater fraction of the total amount of drug absorbed. For low values of α, where absorption is permeation-rate-limited, the relationship between Fa and Fd is highly nonlinear |
对于难溶性药物, 溶解度是吸收的限速步骤, 在胃肠道内吸收与剂量可能呈现非线性关系。Johnson等[29, 30]报道了一种最大吸收剂量(maximum absorbable dose, MAD)理论, 该理论在药物开发早期得到广泛的应用。
| $ \text{MAD=}{{C}_{\text{s}}}\times {{P}_{\text{eff}}}\times \text{SA}\times \text{SITT} $ | (5) |
其中, Cs是药物饱和溶解度, Peff是有效渗透系数, SA是小肠有效表面积, SITT是药物在小肠转运时间。
从公式(1)~(5)看出, 口服药物的溶出和跨膜透过参数与药物分子特性及生理参数之间有着密切的关系, 三者之间的关系如表 1所示。
| 表 1 Effect of drug chemical properties and physiological parameters to the dissolution and absorption behavior of orally administrated dosage forms |
本文将药物溶出/透过同步评价系统分为两类—溶出/非生物膜系统和溶出/生物膜系统。选择合适的生物膜、非生物膜, 是溶出装置-透过装置对接成功的关键。常用的非生物膜主要有平行人工膜渗透模型(PAMPA)[31]和中空过滤膜(hollow filter membrane)。该类膜系优点在于其高通量、低成本和用药量少, 可以用于快速检测被动扩散机制药物的渗透率; 缺点在于其不可模拟肠上皮细胞代谢酶和转运体, 不能准确预测主动转运药物的渗透率, 不可判断亲脂性小分子化合物转运基质。近年来, 越来越多研究者致力于生物膜介导溶出和跨膜透过评价技术。常用的生物膜[32]主要有单层细胞系(Caco-2、MDCK等)、转染细胞系(Caco-2/3A4、MDR1-MDCK/3A4等)和离体肠管组织。
3.1 溶出/非生物膜系统 3.1.1 赛多利斯吸收模型20世纪70年代, 研究者开始试图将溶出装置和跨膜透过装置结合起来, 同步预测药物在体内的溶出和吸收特征[33, 34]。初始设备是药物在三相之间重新分配, 即由水相到脂相再到另一水相, 中间脂相是概念化的“生物膜”。该脂相“生物膜”比体内肠管组织薄, 透过量偏大。1969年, Dibbern等[33]借助高分子聚合物人工膜将水相分开, 解决了上述“生物膜”的缺陷, 提高了药物在体内吸收的预测能力。1976年, Heppt-Becker等[34]建立一个动态的赛多利斯吸收模型(sartorius absorption model, SAM, 图 3), 同步评价口服药物的体外溶出和跨人工膜透过特征。该模型设置两个储液器, 分别装有人工胃液和人工肠液。恒流蠕动泵连接储液器和扩散装置, 不断的传输溶出介质。1980年, Koch等[35]也报道一个同步评价设备, 在两个可以旋转的烧瓶之间添加一层有机膜, 将整个体系分为有机相和水相两部分。尽管不是生理脂质生物膜, 但由于其理念的简便易行性, 可以用于被动转运药物的评价。2006年, Corti等[36]考察了阳性对照药萘普生在SAM设备中, 跨膜透过PAMPA的表观渗透系数(apparent permeability coefficient, Papp)。研究结果显示SAM的Papp值(4.88 × 10-5 cm·s-1)与常规Caco-2单层细胞实验结果一致, 与人体内吸收百分数相符, 表明了SAM设备的可行性。该类装置优点是构造简单、操作方便, 但人工脂质生物膜不是生理意义上的肠管组织, 在评价未知化合物和代谢物前体药物时仍存在不足。因此, 一般用于新药研发早期的快速筛选, 或被动扩散药物制剂溶出和透过特征的预测。
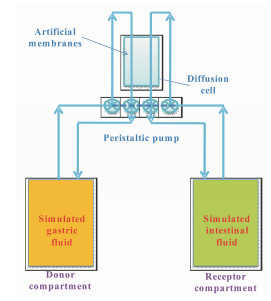
|
图 3 Schematic of the sartorius absorption model (SAM, adapted from Heppt-Beeker et al[34]) |
2012年, Lamberti等[37]通过蠕动泵装置将两个USP2溶出设备(桨法)和一个中空过滤膜(hollow fiber membranes)有机组合起来, 形成双流体循环系统的肠吸收仿真模型(intestinal absorption simulation model, 图 4)。与Heppt-Becker等[34]的SAM相比, 相同点是这两种模型都是将模拟胃腔和模拟肠腔制备成两个独立运行的体系。但是, 该肠吸收仿真模型的优势, 在于其引入了各国药典均有收载的经典溶出度评价设备—桨法。传统溶出设备的引入, 使得该新型模型在溶出特征评价上具有成熟的理论基础。在实践上, 研究者[37]基于质量守恒原理和一定的数学模型理论, 比较了茶碱控释制剂在该肠吸收仿真模型和传统溶出仪(桨法)释药动力学行为的异同。茶碱控释片在肠吸收仿真模型的溶出室(模拟肠)浓度低于桨法, 表明该模型可以有效地用于药物制剂溶出/透过特征的预测。与SAM模型相似, 该肠吸收仿真模型的优点在于其简单、易于操作、重现性好。受限于非生物膜系统的特点, 该模型的缺点是不适用于主动转运药物渗透特征的研究。目前, 主要适用于被动扩散药物研发初期, 为新型药物传递系统的设计和处方筛选提供一种简易的评价工具。
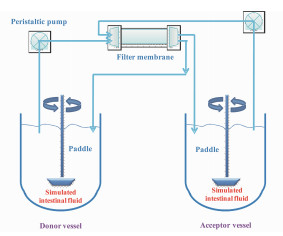
|
图 4 Schematic of the intestinal absorption simulation model (adapted from Lamberti et al[37]) |
TNO肠道模型(TNO intestinal model, TIM, 图 5), 是Minekus等[38]发明的一种新型多房室人工消化道动态系统。该动态系统构建了模拟胃、模拟十二指肠、模拟空肠和模拟回肠4个房室, 并借助计算机技术模拟了健康人体空腹和进食状态的生理条件。与上述的SAM和肠吸收仿真模型比较, TIM对胃肠道生理环境(胃蠕动、胃排空、胃液pH、胃蛋白酶、肠蠕动、肠液pH、肠消化酶以及胃肠转运时间等)的模拟有很大进展, 但是模型的复杂程度也很显著。在模型应用上, Souliman等[39]以对乙酰氨基酚片作为模型药, 以中空过滤膜为模拟肠壁, 将TIM与中空过滤膜结合, 同时模拟胃肠液消化酶、胃肠pH、胃肠蠕动和转运时间等因素对口服药物制剂体外溶出和跨膜透过的影响。TIM模型在禁食状态模拟肠液(fasted-state simulated intestinal fluid, FaSSIF)[40, 41]条件下的体外渗透率与临床试验的体内吸收百分数进行线性回归, 相关系数r=0.912 8;在进食状态模拟肠液(fed-state simulated intestinal fluid, FeSSIF)[40, 41]条件下的体内外相关系数r=0.998 4。与传统的USP2溶出度实验结果相比, TIM模型模拟的禁食状态和进食状态的体外透过率与人体内吸收百分数均存在显著的体内外相关性(最高水平相关)。显然地, 该模型的优点在于其能够更完整、更精密、更准确地描述口服药物制剂在胃肠道的崩解、溶出和跨膜透过的复杂过程; 缺点在于其结构的复杂性、操作的繁琐性、影响因素的不确定性以及主动转运药物评价的局限性。因此, TIM不仅可以用于新药研发早期药物制剂溶出和吸收特征的精准预测, 用于临床患者胃肠道真实生理状态的模拟, 还可以通过更精细地仿真不同胃肠道生理环境来替代受限于伦理学要求的人体试验研究。
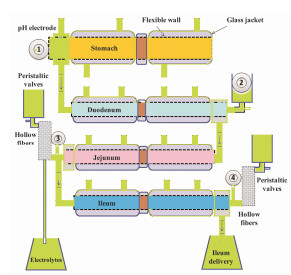
|
图 5 Schematic of the TNO intestinal model (TIM, adapted from Minekus et al[38]). 1: Gastric secretions, hydrochloric acid/water and meal; 2: Pancreatic secretions, biliary secretions, and electrolytes sodium/bicarbonates secretions; 3: Sodium bicarbonate; 4: Sodium bicarbonate |
1999年, Ginski等[42, 43]报道了一个药物溶出/Caco-2动态系统(continuous dissolution/Caco-2 system, 图 6)。该闭合式系统的溶出部分是USP2 (桨法)装置, 透过部分是嵌合Caco-2单层细胞膜的扩散池装置, 通过恒流蠕动泵将两装置相连接。整个实验过程中, 药物一直在体系中循环, 故该动态模型是一个闭合式系统。该闭合式体系中的溶出介质和透过介质都是Hank's balanced salt solution (HBSS, pH 6.8)[44]。与药物溶出/非生物膜系统比较, 药物溶出/Caco-2动态系统最大进步在于其即可以用于被动转运药物透过研究, 又可以用于主动转运药物的跨膜透过特征研究。Ginski等[42, 43]考察了酒石酸美托洛尔(BCSⅠ)、吡罗昔康(BCSⅡ)、盐酸雷尼替丁(BCS Ⅲ)体外溶出/跨膜透过的特征, 并与体内溶出和吸收数据进行相关性比较; 考察了交联甲羧纤维素钠对雷尼替丁溶出/透过比值的影响; 并评价了增溶剂对吡罗昔康溶出/透过比值的影响。他们发现, 使用吡罗昔康缓释制剂时, 药物的溶出特性是吸收限速步骤; 而使用吡罗昔康速释制剂时, 药物的渗透性是吸收限速步骤。该结果也验证了Polli等[28]基于物料平衡理论提出的药物溶出/吸收非线性关联理论。该模型主要优势在于Caco-2细胞的引入, 其主要装置(桨法溶出仪和扩散池)均是目前广泛使用的模型; 其缺点是药物溶出介质的pH环境较为单一, 不可模拟胃肠道急剧的pH变化, 不适用pH依赖性药物溶出特征研究。因此, 药物溶出/Caco-2动态系统可以用于BCS不同分类的药物及其制剂, 用于比较药物溶出率和跨膜透过率对吸收的贡献程度, 从而克服了线性相关法适用药物范围小的局限性。另外, 该模型还可以用于考察崩解剂、增溶剂等制剂辅料对药物溶出/吸收的影响。
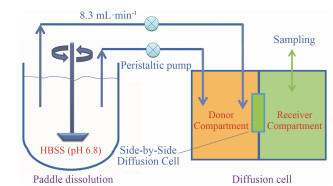
|
图 6 Schematic of continuous dissolution/Caco-2 system (adapted from Ginski et al[43]) |
2003年, Kataoka等[45]开发一种可以同步评价药物溶出/渗透系统(dissolution/ permeation system, D/P系统, 图 7)。该装置类似扩散池, 有给药室、接收室和嵌合在两者之间的Caco-2单层细胞膜三部分构成, 是一个闭合式系统。D/P系统模拟人体的胃肠液环境: ①给药室溶出介质体积(8 mL), 相当于人体胃肠液体积1%; ②给药室(8 mL)和接收室(5.5 mL), 分别加入5 mmol·L-1牛磺胆酸盐和4.5%牛血清白蛋白, 增加药物的透过量; ③投药剂量相当于临床剂量的1%; ④ 120 min实验时程模拟药物在小肠的平均滞留时间。2006年, Kataoka等[46]选取13种模型药物和不同的模拟肠液, 成功建立了药物在D/P系统与人体吸收特征之间的相关性。2009年, Buch等[47]在FaSSIF和FeSSIF的两种介质环境, 分别建立了非诺贝特5种不同剂型在D/P系统和人体药动学参数(Cmax和AUC)之间的IVIVC。Takano等[30]基于MAD理论假设, 选取吸收分数在15%~95%的一系列模型药物, 分别考察了不同辅料、吸收促进剂和食物效应等因素对药物跨膜透过特征的影响, 并比较了D/P系统和in silico计算机仿真技术两种不同模型之间吸收预测结果的相关性。D/P装置相当于一个改进的扩散池, 主要创新点在于其小型化、设备干扰少、潜在误差小, 以及模拟胆汁(增溶剂)的引入等; 但是在漏槽条件的实现、较大规格完整制剂的评价方面依然存在缺点。因此, 该D/P装置可以用于直接评价药物溶出、跨膜透过特征, 用于间接预测食物摄取对口服药物体内吸收的影响, 尤其在难溶性药物制剂处方筛选方面有明显的优势。
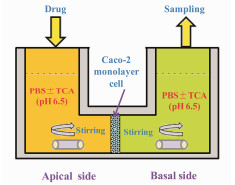
|
图 7 Schematic of the drug dissolution and permeation system (D/P system, adapted from Kataoka et al[45]) |
2007年, Motz等[48]将流通池溶出装置(USP4)与Caco-2透过装置(flow through Caco-2 permeation cell, FTPC, 图 8)关联起来。FTPC两侧处于不同的流体动力学体系中, 左侧是开放式溶出部分, 右侧是闭合式透过部分。USP4借助玻璃珠, 将池内溶出介质形成层流。层流的形成, 可以模拟药物在胃肠道内流体动力学特征, 使得药物制剂边缘的固-液层保持新鲜介质, 进而营造漏槽条件。溶出介质和透过介质主要是Kreb's-ringer buffer (KRB)或Kreb's-ringer bicarbonate buffer (KBR), 前者更常用。分流器将溶出介质流速分为两种不同流速, 即能满足禁食状态和进食状态肠液生理体积, 又能确保细胞膜的完整性。同年, Motz等[49]以盐酸普萘洛尔片为模型药物, 验证了该预测系统同步评价药物制剂溶出特征和跨膜透过特征的精密性和重现性。2010年, Muendoerfer等[50]通过Caco-2单层细胞跨膜电阻变化的在线同步监测和细胞屏障完整性的实时监测, 考察了EDTA对跨膜电阻和细胞连接紧密性的影响, 验证了辅料对细胞跨膜转运的影响。USP4/Caco-2系统, 通过流速转换器将流通池溶出装置和扩散池装置有机地结合起来, 其评价结果的可再现性和准确性获得了广泛认可, 但是依然不能较好地模拟胃肠道pH的连续变化过程。因此, 该模型在同步评价完整药物制剂溶出和跨膜透过的特征方面具有显著优势。
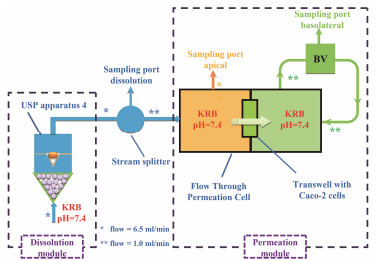
|
图 8 Schematic of the Caco-2 monolayer cell combining with the USP4 (adapted from Motz et al[48]) |
药物溶出/吸收仿生系统(drug dissolution/ absorption simulating system, DDASS, 图 9)是近几年发展起来的, 同步解析口服药物固体制剂在GIT溶出和跨膜透过特征的新型评价体系, 受到同行的关注。2001年, Kobayashi等[51]利用Caco-2细胞模型, 建立了新型药物溶解与吸收体外预测体系。2003年, He等[52]完善了该体系, 将该体系用于解析口服药物的崩解、溶出和膜透过的规律, 并将此规律用数学模型加以描述, 用浓度时间方程表征药物在体内变化的规律和用动力学参数表征药物的动力学特点。2004年, He等[53]在比较FaSSIF、FeSSIF、Modified FaSSIF、Modified FeSSIF、HBSS、KRS和KBR等[40, 41, 44, 49]模拟胃肠液处方的基础下, 优化了DDASS的donor solution和acceptor solution (表 2), 并建立了不同的胃酸模型, 分别阐明了在正常胃酸、低胃酸、由于合并用药造成的一时性胃酸升高或服用抗酸药造成胃酸降低等不同情况下对制剂的溶出率和吸收率的影响。He等[54]用大鼠肠管代替药物溶解与吸收体外预测体系中的Caco-2单层细胞膜, 准确预测了酯前体药物pivampicillin经小肠降解代谢为ampicillin后的吸收率。2005年, Sugawara等[55]将此新型药物溶解与吸收体外预测体系用于缓控释制剂的吸收评价获得成功。2010年, Zhu[56]和Li等[57]基于对DDASS的改进(Module 1, 图 9A), 分别建立了黄芩苷3种固体制剂和丹酚酸B缓释片在《中国药典》体外释放度实验法(桨法)与DDASS法之间的溶出相关性, 将研究对象从药物固体粉末或颗粒扩大到片剂、软胶囊和硬胶囊等多种剂型。2011年, Li等[58]以单硝酸异山梨酯为模型药物, 建立了该药4种剂型在DDASS溶出/跨膜透过与Beagle犬体内吸收之间良好的A水平IVIVC。随后, Liu等[59]基于对该系统溶出装置构造和介质组成的完善(Module 2, 图 9B), 建立了定位释放制剂奥美拉唑肠溶片在单池DDASS与Beagle犬体内吸收之间的线性/非线性IVIVC。
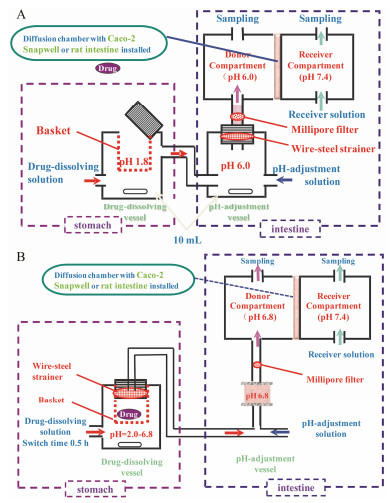
|
图 9 Schematic of the drug dissolution/absorption simulating system (DDASS). A: Double-cell DDASS (Module 1, adapted from Li et al[58]); B: Single-cell DDASS (Module 2, adapted from Liu et al[59]) |
| 表 2 Compositions (mmol·L-1) of various buffers for combined dissolution and permeation measurement. FaSSIF: Fasted-state simulated intestinal fluid; FeSSIF: Fed-state simulated intestinal fluid; HBSS: Hank's Balanced Salt Solution; KBR: Kreb's-ringer bicar bonate buffer; KRB: Kreb's-ringer buffer |
DDASS的药物溶出室容积较小, 受到漏槽条件的限制, 在评价难溶性药物制剂时可能存在局限。但是, 由于药物溶出液在不断的供给, 同时溶解的药物连续被转运出去, 保证药物溶出室有尽量多的新鲜溶出介质, 减小了其局限性。缓释制剂的成功评价验证了上述推测。该新型DDASS, 最大的优势在于其不仅考虑到GIT急剧的pH变化, 并且可以连续模拟药物在胃内的溶解过程、移行至肠道以及透过肠黏膜的吸收过程。因此, DDASS可以用于完整口服固体制剂体内溶出和吸收特征的同步预测, 尤其适用于pH依赖性释放的药物制剂、缓释制剂和定位释放制剂等。
4 总结固体药物制剂的溶出和跨膜透过的特征, 能为体内BA和PK的预测提供重要依据, 为新剂型的设计提供可控因素[60]。药物在GIT从崩解、溶出、跨膜透过至吸收入血是一个复杂的动态过程, 受诸多因素影响[61], 如胃肠生理学因素、药物理化因素和剂型因素。体外药物溶出/同步评价系统的开发, 需要最大程度地模拟胃肠道的生理条件[62]。药物溶出/透过同步评价系统, 不但可以同时捕获体外瞬时溶出曲线和瞬时跨膜透过曲线、累积溶出曲线和累积跨膜透过曲线、溶出速率与透过速率之间的关系及其衍生的其他重要参数等多种有效信息, 而且考虑到制备工艺、赋形剂和处方组成等制剂因素对吸收的影响。近年来, 基于胃肠道多元医学信息驱动的药物溶出/吸收同步评价技术的理论基础、模型构建的仿真性、适用的领域范围和体内预测结果的精准程度等方面都取得了较大进展, 但是在实验装置、溶出/透过介质和生物膜等方面存在尚待完善之处[1]。在溶出/吸收同步评价技术的发展方向和模型的选择上, 既要最大程度模拟药物溶出和跨膜透过过程的诸方面影响因素, 又要权衡体外设备的全方位仿真性和简便易行性, 以期通过关键路径研究, 推动创新药物的研发进程, 提高药物的成药性, 并为新型药物剂型的开发提供新的技术平台。
| [1] | Li ZQ, He X. Physiologically based in vitro models to predict the oral dissolution and absorption of a solid drug delivery system[J]. Curr Drug Metab , 2015, 16 :777–806. DOI:10.2174/1389200216666150812123836 |
| [2] | Aurélie G, Lucie EM, Valérie L, et al. Relevance and challenges in modeling human gastric and small intestinal digestion[J]. Trends Biotechnol , 2012, 30 :591–600. DOI:10.1016/j.tibtech.2012.08.001 |
| [3] | Garbacz G, Klein S. Dissolution testing of oral modifiedrelease dosage forms[J]. J Pharm Pharmacol , 2012, 64 :944–968. DOI:10.1111/j.2042-7158.2012.01477.x |
| [4] | McAllister M. Dynamic dissolution:a step closer to predictive dissolution testing?[J]. Mol Pharm , 2010, 7 :1374–1387. DOI:10.1021/mp1001203 |
| [5] | Kong FB, Singh RP. A human gastric simulator (HGS) to study food digestion in human stomach[J]. J Food Sci , 2010, 75 :E627–E635. DOI:10.1111/j.1750-3841.2010.01856.x |
| [6] | Wickham M, Faulks R. Dynamic gastric model:US, 8092222[P]. 2012-01-10. |
| [7] | Ramasamy US, Venema K, Gruppen H, et al. The fate of chicory root pulp polysaccharides during fermentation in the TNO in vitro model of the colon (TIM-2)[J]. Bioact Carbohydr Dietary Fibre , 2014, 4 :48–57. DOI:10.1016/j.bcdf.2014.06.007 |
| [8] | Blanquet-Diot S, Denis S, Chalancon S, et al. Use of artificial digestive systems to investigate the biopharmaceutical factors influencing the survival of probiotic yeast during gastrointestinal transit in humans[J]. Pharm Res , 2012, 29 :1444–1453. DOI:10.1007/s11095-011-0620-5 |
| [9] | Vatier J, Malikova SE, Vitre MT, et al. An artificial stomachdu odenum model for the in vitro evaluation of antacids[J]. Aliment Pharmacol Ther , 1992, 6 :447–458. |
| [10] | Parikh RK, Parikh DC, Delvadia RR, et al. A novel multicompartment dissolution apparatus for evaluation of floating dosage form containing poorly soluble weakly basic drug[J]. Dissol Technol , 2006, 13 :14–19. DOI:10.14227/DT210314P1 |
| [11] | Terpend K, Possemiers S, Daguet D, et al. Arabinogalactan and fructo-oligosaccharides have a different fermentation profile in the Simulator of the Human Intestinal Microbial Ecosystem (SHIME)[J]. Environ Microbiol Rep , 2013, 5 :595–603. DOI:10.1111/1758-2229.12056 |
| [12] | Ribnicky DM, Roopchand DE, Oren A, et al. Effects of a high fat meal matrix and protein complexation on the bioaccessibility of blueberry anthocyanins using the TNO gastrointestinal model (TIM-1)[J]. Food Chem , 2014, 142 :349–357. DOI:10.1016/j.foodchem.2013.07.073 |
| [13] | Klein S, Buchanan NL, Buchanan CM. Miniaturized transfer models to predict the precipitation of poorly soluble weak bases upon entry into the small intestine[J]. AAPS PharmSciTech , 2012, 13 :1230–1235. DOI:10.1208/s12249-012-9851-y |
| [14] | Bogataj M, Cof G, Mrhar A. Peristaltic movement simulating stirring device for dissolution testing:WO, 2010014046[P]. 2010-04-02. |
| [15] | Garbacz G, Cadé D, Benameur H, et al. Bio-relevant dissolution testing of hard capsules prepared from different shell materials using the dynamic open flow through test apparatus[J]. Eur J Pharm Sci , 2014, 57 :264–272. DOI:10.1016/j.ejps.2013.08.039 |
| [16] | FDA. Challenge and opportunity on the critical path to new medicinal products[EB/OL]. 2004-03-16. http://www.fda.gov/oc/initiatives/criticalpath/whitepaper.pdf. |
| [17] | Parekh A, Buckman-Garner S, Mccune S, et al. Catalyzing the critical path initiative:FDA's progress in drug development activities[J]. Clin Pharmacol Ther , 2014, 97 :221–233. |
| [18] | Janet W. Paving the critical path of drug development:the CDER perspective[J]. Nat Rev Drug Discov , 2014, 13 :783–784. DOI:10.1038/nrd4435 |
| [19] | Yuen KH. The transit of dosage forms through the small intestine[J]. Int J Pharm , 2010, 395 :9–16. DOI:10.1016/j.ijpharm.2010.04.045 |
| [20] | McConnell EL, Fadda HM, Basit AW. Gut instincts:explorations in intestinal physiology and drug delivery[J]. Int J Pharm , 2008, 364 :213–226. DOI:10.1016/j.ijpharm.2008.05.012 |
| [21] | Yu LX, Lipka E, Crison JR, et al. Transport approaches to the biopharmaceutical design of oral drug delivery systems:prediction of intestinal absorption[J]. Adv Drug Deliv Rev , 1996, 19 :359–376. DOI:10.1016/0169-409X(96)00009-9 |
| [22] | Agoram B, Woltosz WS, Bolger MB. Predicting the impact of physiological and biochemical processes on oral drug bioavailability[J]. Adv Drug Deliv Rev , 2001, 50 :S41–S67. DOI:10.1016/S0169-409X(01)00179-X |
| [23] | Kadono K, Akabane T, Tabata K, et al. Quantitative prediction of intestinal metabolism in humans from a simplified intestinal availability model and empirical scaling factor[J]. Drug Metab Dispos , 2010, 38 :1230–1237. DOI:10.1124/dmd.109.029322 |
| [24] | Li D, Sheng L, Li Y. Methods for the study of drug transporters[J]. Acta Pharm Sin (药学学报) , 2014, 49 :963–970. |
| [25] | Wang L, Liu KX. Alteration of related transporters and its application significance in common intestinal disease, liver disease, renal disease and diabetes[J]. Acta Pharm Sin (药学学报) , 2015, 50 :127–132. |
| [26] | Siepmann J, Siepmann F. Mathematical modeling of drug dissolution[J]. Int J Pharm , 2013, 453 :12–24. DOI:10.1016/j.ijpharm.2013.04.044 |
| [27] | Heikkinen AT, Korjamo T, Mönkkönen J. Modelling of drug disposition kinetics in in vitro intestinal absorption cell models[J]. Basic Clin Pharmacol Toxicol , 2010, 106 :180–188. DOI:10.1111/pto.2010.106.issue-3 |
| [28] | Polli JE, Crison JR, Amidon GL, et al. Novel approach to the analysis of in vitro-in vivo relationships[J]. J Pharm Sci , 1996, 85 :753–760. DOI:10.1021/js9503587 |
| [29] | Johnson KC, Swindell AC. Guidance in the setting of drug particle size specifications to minimize variability in absorption[J]. Pharm Res , 1996, 13 :1795–1798. DOI:10.1023/A:1016068705255 |
| [30] | Takano R, Kataoka M, Yamashita S. Integrating drug permeability with dissolution profile to develop IVIVC[J]. Biopharm Drug Dispos , 2012, 33 :354–365. DOI:10.1002/bdd.1792 |
| [31] | Hong Y, Zhou Y, Wang J, et al. Lead compound optimization strategy (4)--improving blood-brain barrier permeability through structural modification[J]. Acta Pharm Sin (药学学报) , 2014, 49 :789–799. |
| [32] | Tian Y, Qu BX, Yao Y, et al. Establishment of BCRP expressed pig kidney cell line LLC-PK1/BCRP and its biological profile[J]. Acta Pharm Sin (药学学报) , 2012, 47 :1599–1604. |
| [33] | Dibbern HW, Scholz GH. Resorption model experiments with artificial lipoid membranes.3.Model experiments for gastroenteral resorption[J]. Arzneimittel-Forschung , 1969, 19 :1140–1145. |
| [34] | Heppt-Becker I, Schunack W. Absorption studies with purines.Part 1:in vitro experiments with the Sartorius absorption model according to stricker[J]. ArzneimittelForschung , 1976, 26 :317–321. |
| [35] | Koch HP. The Resotest Apparatus.A universally applicable biopharmaceutical experimental tool[J]. Methods Find Exp Clin Pharmacol , 1980, 2 :97–102. |
| [36] | Corti G, Maestrelli F, Cirri M, et al. Development and evaluation of an in vitro method for prediction of human drug absorption.I.Assessment of artificial membrane composition[J]. Eur J Pharm Sci , 2006, 27 :346–353. DOI:10.1016/j.ejps.2005.11.004 |
| [37] | Lamberti G, Cascone S, Iannaccone M, et al. In vitro simulation of drug intestinal absorption[J]. Int J Pharm , 2012, 439 :165–168. DOI:10.1016/j.ijpharm.2012.10.012 |
| [38] | Minekus M, Havenaar R.In vitro model of an in vivo digestive tract:US, 5525305[P].1996-06-11. |
| [39] | Souliman S, Blanquet S, Beyssac E, et al. A level A in vitro/in vivo correlation in fasted and fed states using different methods:applied to solid immediate release oral dosage form[J]. Eur J Pharm Sci , 2006, 27 :72–79. DOI:10.1016/j.ejps.2005.08.006 |
| [40] | Nicolaides E, Galia E, Efthymiopoulos C, et al. Forecasting the in vivo performance of four low solubility drugs from their in vitro dissolution data[J]. Pharm Res , 1999, 16 :1876–1882. DOI:10.1023/A:1018959511323 |
| [41] | Patel N, Forbes B, Eskola S, et al. Use of simulated intestinal fluids with Caco-2 cells and rat ileum[J]. Drug Dev Ind Pharm , 2006, 32 :151–161. DOI:10.1080/03639040500465991 |
| [42] | Ginski MJ, Polli JE. Prediction of dissolution-absorption relationships from a dissolution/Caco-2 system[J]. Int J Pharm , 1999, 177 :117–125. DOI:10.1016/S0378-5173(98)00330-5 |
| [43] | Ginski MJ, Taneja R, Polli JE. Prediction of dissolution-absorption relationships from a continuous dissolution/Caco-2 system[J]. AAPS Pharm Sci , 1999, 1 :27–38. |
| [44] | Ingels FM, Augustijns PF. Biological, pharmaceutical, and analytical considerations with respect to the transport media used in the absorption screening system, Caco-2[J]. J Pharm Sci , 2003, 92 :1545–1558. DOI:10.1002/jps.10408 |
| [45] | Kataoka M, Masaoka Y, Yamazaki Y, et al. In vitro system to evaluate oral absorption of poorly water-soluble drugs:simultaneous analysis on dissolution and permeation of drugs[J]. Pharm Res , 2003, 20 :1674–1680. DOI:10.1023/A:1026107906191 |
| [46] | Kataoka M, Masaoka Y, Sakuma S, et al. Effect of food intake on the oral absorption of poorly water-soluble drugs:in vitro assessment of drug dissolution and permeation assay system[J]. J Pharm Sci , 2006, 95 :2051–2061. DOI:10.1002/jps.20691 |
| [47] | Buch P, Langguth P, Kataoka M, et al. IVIVC in oral absorption for fenofibrate immediate release tablets using a dissolution/permeation system[J]. J Pharm Sci , 2009, 98 :2001–2009. DOI:10.1002/jps.21576 |
| [48] | Motz SA, Klimundová J, Schaefer UF, et al. Automated measurement of permeation and dissolution of propranolol HCl tablets using sequential injection analysis[J]. Anal Chim Acta , 2007, 581 :174–180. DOI:10.1016/j.aca.2006.07.080 |
| [49] | Motz SA, Schaefer UF, Balbach S, et al. Permeability assessment for solid oral drug formulations based on Caco-2 monolayer in combination with a flow through dissolution cell[J]. Eur J Pharm Biopharm , 2007, 66 :286–295. DOI:10.1016/j.ejpb.2006.10.015 |
| [50] | Muendoerfer M, Schaefer UF, Koenig P, et al. Online monitoring of transepithelial electrical resistance (TEER) in an apparatus for combined dissolution and permeation testing[J]. Int J Pharm , 2010, 392 :134–140. DOI:10.1016/j.ijpharm.2010.03.046 |
| [51] | Kobayashi M, Sada N, Sugawara M, et al. Development of a new system for prediction of drug absorption that takes into account drug dissolution and pH change in the gastrointestinal tract[J]. Int J Pharm , 2001, 221 :87–94. DOI:10.1016/S0378-5173(01)00663-9 |
| [52] | He X, Sugawara M, Kobayashi M, et al. An in vitro system for prediction of oral absorption of relatively watersoluble drugs and ester prodrugs[J]. Int J Pharm , 2003, 263 :35–44. DOI:10.1016/S0378-5173(03)00343-0 |
| [53] | He X, Kadomura S, Takekuma Y, et al. A new system for the prediction of drug absorption using a pH-controlled Caco-2 model:evaluation of pH-dependent soluble drug absorption and pH-related changes in absorption[J]. J Pharm Sci , 2004, 93 :71–77. DOI:10.1002/jps.10518 |
| [54] | He X, Sugawara M, Takekuma Y, et al. Absorption of ester prodrugs in Caco-2 and rat intestine models[J]. Antimicrob Agents Chemother , 2004, 48 :2604–2609. DOI:10.1128/AAC.48.7.2604-2609.2004 |
| [55] | Sugawara M, Kadomura S, He X, et al. The use of an in vitro dissolution and absorption system to evaluate oral absorption of two weak bases in pH-independent controlled-release fo rmulations[J]. Eur J Pharm Sci , 2005, 26 :1–8. DOI:10.1016/j.ejps.2005.02.017 |
| [56] | Zhu CC, Li ZQ, Liu ZD, et al. Evaluation on the release discipline of baicalin and its three solid preparations using a drug dissolution simulating system[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学) , 2010, 15 :11–20. |
| [57] | Li ZQ, Liu ZD, Gu H, et al. Evaluation on the release discipline of salvianolic acid B sustained-release tablets using a drug dissolution and absorption simulating system[J]. Drug Evaluat Res (药物评价研究) , 2010, 33 :367–373. |
| [58] | Li ZQ, He X, Gao XM, et al. Study on dissolution and absorption of four dosage forms of isosorbide mononitrate:level A in vitro-in vivo correlation[J]. Eur J Pharm Biopharm , 2011, 79 :364–371. DOI:10.1016/j.ejpb.2011.04.015 |
| [59] | Liu WJ, He X, Li ZQ, et al. Development of a bionic system fo r the simultaneous prediction of the release/absorption characteristics of enteric-coated formulations[J]. Pharm Res , 2013, 30 :596–605. DOI:10.1007/s11095-012-0905-3 |
| [60] | Martinez MN, Amidon GL. A mechanistic approach to understanding the factors affecting drug absorption:a review of fundamentals[J]. J Clin Pharmacol , 2002, 42 :620–643. DOI:10.1177/00970002042006005 |
| [61] | Reppas C, Vertzoni M. Biorelevant in-vitro performance testing of orally administered dosage forms[J]. J Pharm Pharmacol , 2012, 64 :919–930. DOI:10.1111/j.2042-7158.2012.01474.x |
| [62] | Gobeau N, Stringer R, De Buck S, et al. Evaluation of the GastroPlusTM advanced compartmental and transit (ACAT) model in early discovery[J]. Pharm Res , 2016, 33 :2126–2139. DOI:10.1007/s11095-016-1951-z |
 2016, Vol. 51
2016, Vol. 51


