2. 重庆莱美药业股份有限公司, 重庆 401336
2. Chongqing Lummy Pharmaceutical Co., Ltd, Chongqing 401336, China
多柔比星(doxorubicin,DOX)属于蒽环霉素类广谱抗肿瘤药物,临床上广泛应用于治疗各种恶性肿瘤[1]。与大多数抗肿瘤药物相同,DOX不良反应较多,最严重的是剂量依赖性心脏毒性,不仅影响了患者的生存质量,而且使DOX的应用受到限制[2, 3]。目前高效低毒的靶向药物研究成为热点[4-7]。
果胶作为天然大分子多聚糖,生物相溶性好,常被用作药物辅料、代血浆和载药载体。所以,选用果胶为载体,将果胶C-6位羧基与DOX C-3' 位氨基以酰胺键偶联[8],制备果胶多柔比星轭合物 (pectin- doxorubicin conjugate,PDC),其重均分子量为6.050× 105,数均分子量为2.110×105,见合成路线1。PDC在体内通过溶酶体酶作用使共价键断裂,释放出游离DOX而发挥药效,达到增效减毒、靶向治疗肿瘤、减少药物毒性的目的[9]。PDC中载体果胶属于天然高分子多聚糖,结构中含大量的羧基与羟基,容易产生氢键,形成刚性结构,结合小分子DOX后,PDC在水中和有机溶剂中的溶解性差。所以,需要对PDC进行增溶处理。目前常用的共溶剂增溶、环糊精包合、乳剂和微乳等技术存在有机溶剂残留、载药量低、稳定性差及制备工艺复杂等局限性。纳米混悬剂被广泛应用于解决药物因溶解性而限制应用的问题[10, 11],优点是处方简单,“纯药物”纳米粒增加比表面积,从而增加药物的溶解度,提高疗效[12-14]。所以,本研究拟采用自上而下的高压均质技术将PDC制备成纳米混悬剂[15],考察其理化性质和体内外释放,并以SKOV3细胞裸鼠移植瘤为模型,初步评价该混悬剂的抗肿瘤活性,为下一步药物开发及临床应用提供参考依据。
|
Scheme1 The synthetic formula of the pectin-doxorubicin (DOX) conjugate nanosuspensions (PDC) |
仪器 超细匀浆器F6/10-8G (上海弗鲁克流体机械制造有限公司); 高压均质机EmulsiFlex-C3 (加拿大AvestinInc公司); 激光粒度分析仪Zerasizer Nano ZS90 (英国Malvern Instruments公司); 紫外分光光度计TU-1810S (北京普析通用仪器有限公司); 透射电子显微镜H-600 (日本日立公司); 透析袋 (MW 3 500,美国Sigma公司); Agilent 1260 [安捷伦科技 (中国) 有限公司]。
药品与试剂 PDC由重庆莱美药业股份有限公司四川大学莱美联合实验室研制,其中DOX购自浙江海正药业股份有限公司; 精制蛋黄卵磷脂 (E80,德国Lipoid GmbH公司); 泊洛沙姆188 (F68,德 国BASF公司); 聚乙烯吡咯烷酮-K30 (PVPK30,杭州恒泉开发有限公司); 羧甲基纤维素钠 (CMC-Na,成都科龙化工试剂); 聚乙二醇400 (PEG 400),十 二烷基硫酸钠 (SDS) (天津致远化学试剂有限公司); 2-羟丙基-β-环糊精 (2-HP-β-CD,Aladdin industrial corporation); 氯仿,二甲基亚砜 (DMSO) (重庆化学试剂有限公司); 异丙醇 (天津市富宇精细化工有限公司); 色谱甲醇和色谱乙腈 (上海科丰化学试剂有限公司)。
细胞株与动物 BALB/c (nu/nu) 裸鼠,家兔(成都达硕生物科技有限公司)。裸鼠许可证号: scxk (川) 2013-24,家兔许可证号: scxk (川) 2013-14。SKOV3细胞 (由四川大学生物治疗国家重点实验室惠赠)。动物的饲养条件: 22 ± 2 ℃,湿度60%。饲养条件为SPF级,整个实验研究过程遵从实验动物饲养管理和使用指南。
PDC纳米混悬液的制备 取10 mg PDC固体 粉末,加入超纯水10 mL,用超速匀浆器以25 000 r·min−1匀浆5 min进行初分散。所得初分散液置于高压均质机中,在110 MPa压力下均质25 min,制得纳米混悬液。
稳定剂的筛选与制备条件优化 分别向PDC中加入质量分数为0.05%、0.1%、0.5%、1% 和2% 的E80、PEG400、F68、PVPK30、CMC-Na和2-HP-β-CD,按上述方法制备,分别测定混悬液的粒径和电位。选取加入上述稳定剂后粒径和多分散指数 (polydispersity index,PI) 较优组,于室温放置,分别在第5、10、15天取样测定粒径,选取粒径较优组对应的稳定剂作为该处方的稳定剂。重新称取10份PDC,均加入选定稳定剂,按如上方法初分散后,分别在80、110、40、180 MPa压力下均质初分散液,在均质次数分别为5、10、15、20、25、30和35时取样,测定粒径和PI。
纳米粒粒径及zeta电位的测定 取纳米混悬液,用超纯水稀释1倍,于ZerasizerNano ZS90测定粒径、PI和电位,每个样品测定3次,取平均值。
重复性与稳定性 按最优处方制备3批PDC纳米混悬液,于室温放置,分别测定各批次样品第5、10、15、30天的粒径、PI和zeta电位。
PDC纳米混悬液形态观察 取适量最优处方制备的PDC纳米混悬液,滴加于覆盖碳膜的铜网上,用磷钨酸负染,待混悬液中载液挥发后,用透射电子显微镜 (TEM) 观察。放大倍数为6.0×104倍。加速电压为75 kV。
载药量测定色谱条件 色谱柱: ZORBAX SB-Aq C18柱,规格: 250 mm× 4.6 mm,填料粒径5 μm。流动相: SDS缓冲液 (SDS 1.44 g、磷酸0.68 mL和水500 mL)∶乙腈∶甲醇为47.2∶47.2∶5.6 (v/v)。流速: 1.0 mL·min−1,柱温: 25 ℃,检测器: DAD,检测波长: 254 nm,进样量: 20 L。
标准曲线的制备 以超纯水为溶剂,配制系列浓度的DOX标准液,HPLC检测,将标准溶液浓度 (Y1) 对峰面积 (X1) 进行线性回归,得回归方程。以水和DMSO混合物 (1∶49,v/v) 作为溶剂,配制系列浓度的DOX标准液,于紫外 (520 nm) 测定吸光度值,将标准溶液浓度 (Y2) 对吸光度 (X2) 进行线性回归,得回归方程。
载药量测定 取适量上述最优处方制备的3个批次PDC纳米混悬液,分别于20 000 r·min−1离心10 min,取上清液,HPLC检测,计算出游离DOX的质量浓度 (B),由于DOX出峰时间为10.055 6 min,而PDC是大分子药物,在该色谱条件下20 min内不出峰,所以该方法能够准确测定游离DOX的量。另量取PDC纳米混悬液1 mL,加入DMSO溶解并定容至50 mL,以相同比例水与DMSO混合物为对照,用紫外分光光度计于520 nm处测定吸光度值,计算出混悬液中DOX的总质量浓度 (D)。PDC载药量 (%) = (D − B) / E × 100 (其中E为PDC质量浓度)。
PDC体外释放研究 以PBS为溶剂,配制系列浓度的DOX标准液,在上述色谱条件下,HPLC检测,将标准溶液浓度 (Y3) 对吸光度 (X3) 进行线性回归,得回归方程。取PDC纳米混悬液 (20 mg·mL−1、载药量25.3%、游离DOX 0.2%) 1 mL和5 mg·mL−1 DOX溶液1 mL分别装入透析袋内,密封后置于40 mL pH为7.4或5.1的PBS中透析,透析条件为: 恒温37 ℃,120 r·min−1。分别于0.5、2、4、6、8、24、32、48和72 h取释放液0.5 mL,在上述色谱条件下,HPLC检测,计算透析液中DOX的质量浓度 (A)。每次取样后及时补加等量放置于37 ℃的PBS。由于PDC中游离DOX含量很低,只占体系DOX总量的0.2%,所以游离DOX对PDC释放率影响很小,释放率 (%) = A / (PDC质量浓度 × 载药量 + 游离DOX质量浓度)。
PDC体内释放研究 标准曲线的制备: 以血浆为溶剂,配制系列DOX标准液,按如下方法萃取: 取标准液1 mL,加入内标柔红霉素溶液 (200 μg·mL−1) 20 μL混匀,加入萃取液 (氯仿−异丙醇3∶1,v/v) 1 mL,漩涡震荡10 min,−80 ℃速冻20 min,取出后12 000 r·min−1离心10 min,得到下层有机层。再重复萃取1次,将2次所得有机层合在一起,40 ℃水浴真空挥干,取流动相1 mL溶解挥干物,在上述色谱条件下 (检测器换成荧光检测器),HPLC检测。将标准溶液浓度 (Y) 对柔红霉素与DOX峰面积之比 (X) 进行线性回归 (已证明柔红霉素与DOX峰面积呈线性关系),得回归方程。
按DOX给药剂量为10 mg·kg−1,分别向家兔腹腔注射预热至37 ℃的PDC纳米混悬液 (20 mg·mL−1、载药量25.3%、游离DOX 0.2%) 或DOX溶液,给 药后5、20、40、60、90、120、180、240、300和360 min从心脏取血,所得血液于2 500 r·min−1离心10 min,取血浆1 mL,按照制备标准曲线的方法萃取后,HPLC检测,计算血浆中DOX浓度。由于PDC中游离DOX仅占体系DOX总量的0.2%,含量极低,所以测定的血浆中DOX的浓度主要是从PDC中解离的DOX,绘制DOX浓度−时间曲线来评价腹腔给药后PDC在血浆中的释放。
PDC对SKOV3细胞裸鼠移植瘤模型的抑制作用 取BALB/c (nu/nu) 裸鼠40只,每只腹腔接种2×106个SKOV3卵巢癌细胞,7天后随机分为5个组,称 重并腹腔给药: DOX组 (DOX 5 mg·kg−1); PDC高剂量组 (含DOX 10 mg·kg−1); PDC中剂量组 (含DOX 5 mg·kg−1); PDC低剂量组 (含DOX 2.5 mg·kg−1) 和阴性对照组 (生理盐水5 mg·kg−1)。常规观察裸鼠生长状态,每隔7天称体重,28天后断颈处死所有裸鼠,解剖并收集腹水与瘤结节,精密称重并计算体重变化 (体重变化为末次称量的平均体重与给药前平均体重的差值,负值表示体重减轻)。
统计方法 采用SPSS统计学软件 (version 17.0) 进行多组间独立样本t检验,P < 0.05说明具有显著差异,P < 0.01说明具有极显著差异,计量数据用x± s表示。
结果 1 稳定剂的筛选与制备条件优化稳定剂种类及用量对PDC纳米混悬剂的粒径和表面电荷影响很大。应用PEG 400和CMC-Na制备的纳米混悬液粒径和PI均较大; 卵磷脂制备的纳米混悬液粒径降低,但PI均大于0.4,说明纳米粒的分散区间比较广,均不符合纳米混悬剂的要求; F68、PVPK30和2-HP-β-CD制得的纳米粒粒径均能达到300 nm以下,较为理想,结果见图 1。

|
Figure 1 Effect of different stabilizers on the mean particle size and polydispersity index (PI) of PDC. a: Polyethylene glycol 400 (PEG 400); b: Poloxamer188 (F68); c: Polyvinylpyrrolidone (PVPK30); d: Sodium carboxyl methyl cellulose (CMC-Na); e: Lipoid (E80); f: (2-Hydroxypropyl)-β-cyclodextrin (2-HP-β-CD). n = 3,x± s |
在室温放置15天,应用PVPK30制备的纳米粒粒径增至589.9 ± 13.3 nm,且纳米混悬液中出现明显絮状物; 2-HP-β-CD制备的纳米粒粒径增至711.3 ± 35.3 nm,且纳米混悬液分层,上层澄清,下层鲜红; F68制备的纳米粒粒径为285.4 ± 8.7 nm,室温放置 15天粒径为281.4 ± 9.2 nm,几乎没有变化,观察外 观,颜色鲜红,分布均一,说明应用F68制备的混悬液能保持体系稳定。故研究选择F68为该处方的稳 定剂,结果见表 1。
| Table 1 Effects of different stabilizers on the stability of PDC under ambient temperature for 15 days. n = 3,x± s |
随着均质压力的增加,粒径快速减小,当压力达到110 MPa,均质次数为25次时,粒径为117.0 ± 13.2 nm,PI为0.113 ± 0.054; 压力继续增加,粒径变化不明显。随着均质次数的增加,粒径减小,PI明显降低,当均质次数达到25次时,PI均小于0.2,体系分散性良好; 当均质次数大于25次时,PI变化不大,结果见图 2。实验发现,均质压力越高,体系产热越严重。采用先低压后高压的方法进行均质,能有效减少仪器产热。根据均质次数筛选结果,采用在80 MPa条件下先均质10次,再在110 MPa条件下均质25次的方法制备纳米混悬液。

|
Figure 2 Effect of homogenization pressure and cycle numbers on the particle size(a) and polydispersity index (PI,b) of the pectin-doxorubicin conjugate nanosuspensions. n = 3,x± s |
3批PDC纳米混悬剂粒径均小于150 nm,平 均粒径为118.8 ± 6.93 nm,PI值为0.14 ± 0.03,平均zeta电位为−27.2 ± 0.36 mV,说明优化处方制备的PDC纳米混悬剂具有很好的重复性。样品于常温下放置5、10和15天,平均粒径小于130 nm,电位为−27.2 ± 0.36 mV,与0天相比变化不大,外观颜色鲜红,体系分散均一,无沉降和絮凝; 第30天平均粒径增至178.1 ± 14.65 nm,溶液出现轻度分层,轻轻振摇后呈现良好的可重悬浮性,说明体系在30天内可以保持良好的稳定性。
3 PDC纳米混悬液形态观察透射电子显微镜下,PDC纳米粒呈圆球状,粒径100 nm左右,见图 3。

|
Figure 3 Transmission electron microscope imaging of PDC |
以水为溶剂得回归方程: Y1 = 0.025 7 X1 + 0.007 4(R2 = 0.999 8),以DMSO与水的混合物为溶剂得回归方程: Y2 = 51.273 0 X2 + 0.088 5 (R2 = 0.999 9)。测定上述3个批次PDC载药量分别为24.9%、25.3% 和25.8%,游离DOX占样品DOX总量的百分比分别为0.3%、0.2% 和0.2%,游离DOX量比较低,主要是由于PDC原料药通过透析等方法纯化除去了一定量的游离DOX及相关物质。
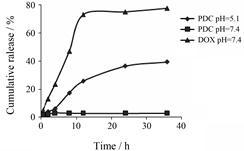
5 PDC体外释放研究以PBS为溶剂得回归方程: Y3 = 0.012 5 X3 + 0.005 6 (R2 = 0.999 6)。当缓冲液pH为7.4时,DOX在10 h内迅速释放,释放率在70% 以上,PDC则基本无释放。当pH为5.1时,PDC在30 h内持续缓慢释放,释放率约为40%,结果见图 4。
|
Figure 4 The release profile of PDC and DOX in phosphate buffered saline (PBS) at pH 5.1 or 7.4 |
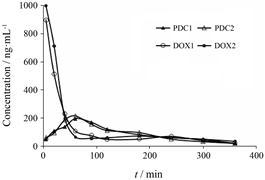
以血浆为溶剂得回归方程: Y4 = 0.000 7 X4 − 0.004 7,R2 = 0.999 6。腹腔给药后,DOX组中血浆DOX浓度5 min内达到1 μg·mL−1左右,2 h内降至60 ng·mL−1左右。PDC组血浆DOX浓度先升高至200 ng·mL−1左右,后降低并维持在60 ng·mL−1左右。每组平行做两次,结果重复性好。由此可见,腹腔给药后,PDC组的血浆DOX浓度比DOX组低,有利于减少DOX全身毒性,结果见图 5。
|
Figure 5 The drug concentration-time curve of DOX. Injected with PDC (DOX was equivalent to 10 mg·kg−1) and DOX (10 mg·kg−1),observed the concentration of DOX in plasma for 360 min |
PDC高、中和低剂量组产生的腹水量分别为0、0.90 ± 0.74和2.02 ± 0.63 g,瘤结节量分别为0.22 ± 0.13、0.58 ± 0.58和1.18 ± 0.28 g; DOX组产生的腹水量为0.18 ± 0.16 g,瘤结节量为0.17 ± 0.12 g; 而阴性对照组产生的腹水量为2.36 ± 0.43 g,瘤结节量为1.20 ± 0.24 g。3个剂量组均能有效的抑制腹水及瘤结节的生长,且呈量效关系。PDC高剂量组腹水和瘤结节基本消失,与DOX组效果相当,3个剂量组与阴性对照组相比有极显著差异 (P < 0.01)。从体重变化来看,PDC高剂量组和DOX组裸鼠体重分别增加0.5 g和减少1.8 g,与阴性对照组 (增加3.2 g) 相比具有极显著差异 (P < 0.01),可能是由于腹水瘤和瘤结节的减小,而DOX组体重轻于PDC高剂量组,可能是由于DOX腹腔注射对裸鼠刺激性大,影响其生长,结果见表 2。
| Table 2 Effect of PDC on the SKOV3 model of nude mice. n = 3,x± s. P < 0.05,**P < 0.01 vs control group; #P < 0.05,##P < 0.01 vs DOX group |
本实验室研制的PDC是一种新型高分子靶向抗肿瘤药物,但因其溶解度差而被限制应用。本文采用高压均质法,对处方及制备条件进行优化,将PDC制备成纳米混悬剂,粒子比表面积增大,药物的溶出速率也得到增加,同时根据Ostwald-Freundlich方程,纳米药物的溶解度增加。通过添加0.5% F68 (w/v),降低纳米粒表面张力,形成空间位阻,维持体系的相对稳定性[16],使其室温条件下放置30天不沉降、不聚积。
PDC在pH 5.1的磷酸盐缓冲液中持续缓慢释放,释放率约为40%,而在pH 7.4的磷酸盐缓冲液中基本不释放,由此可知,PDC在酸性条件下更易于释放。癌细胞在pH值小于7的微酸性体液环境中生长活跃,溶酶体的内环境pH也较低(pH约为5),这些条件均有利于PDC在特定细胞及肿瘤部位的靶向释放。腹腔注射6 h内,PDC组血浆DOX浓度远远低于DOX组,说明PDC在一定程度上可以减少DOX的全身毒性,但需要进一步研究证明。腹腔给药后,PDC能有效抑制SKOV3细胞裸鼠移植瘤模型中腹水及瘤结节的生长,显示出与DOX相当的抗肿瘤活性。综上,PDC有望开发成为一种新型靶向抗肿瘤药物,或许是靶向治疗癌性腹水的腔内治疗药物。
| [1] | Thomas L, Bellmont S, Christen MO, et al. Cardiovascular and survival effects of sympatho inhibitors in adriamycin induced cardiomyopathy in rats[J]. Fundam Clin Pharmarcol , 2004, 18 :649–655. DOI:10.1111/fcp.2004.18.issue-6 |
| [2] | Ewer MS, Ewes SM. Cardiotoxicity of anticancer treatments: what the cardiologist needs to know[J]. Nat Rev Cardiol , 2010, 7 :564–575. DOI:10.1038/nrcardio.2010.121 |
| [3] | Mukherjee S, Banerjee SK, Maulik M, et al. Protection against acute adriamycin-induced cardiotoxicity by garlic: role of endogenous antioxidants and inhibition of TNF-α expres-sion[J]. BMC Pharmacol , 2003, 3 :16. DOI:10.1186/1471-2210-3-16 |
| [4] | Gao HL, Jiang XG. The development of novel tumor targeting delivery strategy[J]. Acta Pharm Sin (药学学报) , 2016, 51 :272–280. |
| [5] | Zhang D, Li JY, Wang XC, et al. Preparation and evaluation of doxorubicin hydrochloride liposomes modified by poly (2-ethyl-2-oxazoline)-cholesteryl methyl carbonate[J]. Acta Pharm Sin (药学学报) , 2015, 50 :1174–1179. |
| [6] | Zhao B, Fan YC, Wang XQ, et al. Cellular toxicity and anti-tumor efficacy of iRGD modified doxorubixin loaded sterically stabilized liposomes[J]. Acta Pharm Sin (药学学报) , 2013, 48 :417–422. |
| [7] | Lu JQ, Zhao WC, Huang YX, et al. Targeted delivery of doxorubicin by folic acid-decorated dual functional nanocarrier[J]. Mol Pharm , 2014, 11 :4164–4178. DOI:10.1021/mp500389v |
| [8] | Cheng M, Xie P, Tang XH, et al. Preparation and lymphatic targeting research of targeting antitumor drug: pectin-adria-mycin conjugates[J]. J Biomed Eng (生物医学工程学杂志) , 2009, 26 :569–574. |
| [9] | Tang XH, Xie P, Ding Y, et al. Synthesis, characterization and in vitro and in vivo evaluation of a novel pectin-adriamycin conjugate[J]. Bioorg Med Chem , 2010, 18 :1599–1609. DOI:10.1016/j.bmc.2009.12.076 |
| [10] | Lipinski CA. Drug-like properties and the causes of poor solubility and poor permeability[J]. Pharmacol Toxicol Methods , 2000, 44 :235–249. DOI:10.1016/S1056-8719(00)00107-6 |
| [11] | Rui TQ, Zhang L, Qiao HZ, et al. Preparation and physico-chemical and pharmacokinetic characterization of ginkgo lactone nanosuspensions for antiplatelet aggregation[J]. J Pharm Sci , 2016, 105 :242–249. DOI:10.1016/j.xphs.2015.10.002 |
| [12] | Perrut M, Jung J, Leboeuf F. Enhancement of dissolution rate of poorly-soluble active ingredients by supercritical fluid processes[J]. Int J Pharm , 2005, 288 :3–10. DOI:10.1016/j.ijpharm.2004.09.007 |
| [13] | Möschwitzer JP, Müller RH. Factors influencing the release kinetics of drug nanocrystal-loaded pellet formulations[J]. Drug Dev Ind Pharm , 2013, 39 :762–769. DOI:10.3109/03639045.2012.702347 |
| [14] | Kalvakuntla S, Deshpande M, Attari Z, et al. Preparation and characterization of nanosuspension of aprepitant by H96 process[J]. Adv Pharm Bull , 2016, 6 :83–90. DOI:10.15171/apb.2016.013 |
| [15] | Van Eerdenbrugh B, Van Den Mooter G, Augustijns P. Top-down production of drug nanocrystals: nanosuspension stabilization, miniaturize-tion and transformation into solid products[J]. Int J Pharm , 2008, 364 :64–75. DOI:10.1016/j.ijpharm.2008.07.023 |
| [16] | Durham OZ, Shipp DA. Suspension thiol-ene photopoly-merization: effect of stabilizing agents on particle size and stability[J]. Polymer , 2014, 55 :1674–1680. DOI:10.1016/j.polymer.2014.02.044 |
 2016, Vol. 51
2016, Vol. 51



