2. 南京中医药大学第三临床医学院, 江苏 南京 210028 ;
3. 江苏省中医药研究院, 国家中医药管理局中药释药系统重点研究室, 江苏 南京 210028
2. The Third Clinical School of Medicine of Nanjing University of Chinese Medicine, Nanjing 210028, China ;
3. Key Laboratory of New Drug Delivery System of Chinese Materia Medica, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China
淫羊藿又名仙灵脾,始载于《神农本草经》,是小檗科 (Berberidacea) 淫羊藿属 (Epimedium) 多年生草本植物。《本草纲目》记载其茎、叶入药,辛温无毒,有坚筋骨、益精气、补腰膝和强心力等作用,为我国传统补益中药。现代研究表明,淫羊藿的主要化学成分包括黄酮类成分和多糖,具有抗肿瘤、增强心血管活动、参与骨代谢、延缓衰老等药理活性[1, 2]。多糖是一种重要的活性物质,作为肿瘤治疗的生物调节剂,已经得到了国内外广泛的认可[3]。它的细胞毒性小,可以促进细胞和体液免疫反应来达到抑制和消除肿瘤细胞的效果[4]。本课题组对药典记载的朝鲜淫羊藿 (Epimedium koreanum Nakai) 已有了一定的研究,主要集中在黄酮类成分抗肿瘤作用方面[5, 6]。综合国内外文献,发现淫羊藿黄酮类成分对肿瘤细胞多数通过直接杀伤作用,而对于淫羊藿多糖免疫调节抗肿瘤活性的研究则偏向于提高机体免疫间接杀伤肿瘤细胞,但越来越多研究表明肿瘤微环境中的免疫负向调节才是促进肿瘤的生长、逃逸和转移等一系列恶性发展的主导,因此有学者指出免疫抑制性因素的存在才是肿瘤免疫失败的关键[7, 8]。总体而言,对淫羊藿多糖的提取分离方法以及调节免疫抗肿瘤活性的研究远落后于淫羊藿黄酮,而对其负向免疫调节抗肿瘤的活性更是鲜有报道,淫羊藿多糖的免疫增强效果也更符合淫羊藿作为传统补益类中药的作用机制,因此本文首先利用响应面对淫羊藿多糖的提取条件进行优化,再对优化条件得到的总多糖进行正向免疫调节功能的影响以及负向肿瘤免疫调节活性的初探,以丰富淫羊藿作为传统补益类中药物质基础的发展。
材料与方法材料与仪器 淫羊藿饮片购自安徽亳州,安徽沪谯中药有限公司,批号: 20140413,经南京中医药大学药学院吴德康教授鉴定为淫羊藿属植物朝鲜淫羊藿 (Epimedium koreanum Nakai); 淫羊藿多糖 (Epimedium polysaccharides,EPS,实验室自制)。注射用环磷酰胺 (cyclophosphamide,Cy) 为江苏省中医药研究院提供,批号010051022,实验前以生理盐水配成溶液。细胞因子IL-2、IFN-γ的ELISA试剂盒 (南京建成生物工程研究所); APC-CD4、PE-CD8a小鼠单克隆抗体 (BD Pharmingen,USA); 兔抗鼠IDO单克隆抗体 (SantaCruz公司); 重蒸酚、浓硫酸、正丁醇和氯仿等 (化学纯,南京化学试剂有限公司)。
全自动酶标仪 (美国Thermo公司); 5430R冷 冻离心机 (德国艾本德公司); 流式细胞仪 (FACS Calibur,美国Becton-Dickinson公司); IX51Olympus显微镜 (日本奥林巴斯公司)。
动物与细胞株 C57BL6小鼠 (雄性) 40只,体重20~22 g,8周龄,由南通大学实验动物中心提供,许可证号: SCXK (沪) 2014-0005,在江苏省中医药研究院实验中心饲养。小鼠肺癌Lewis肿瘤细胞株由本实验室传代保存。
多糖的提取 将淫羊藿药材干燥粉碎,过80目筛,取药材粉末100 g,用8倍80% 石油醚 (60~90 ℃) 搅拌冷浸过夜,过滤去滤液,挥干石油醚备用。准确称取脱脂药材粉末5.00 g,经水提醇沉、sevag脱蛋白和冷冻干燥等步骤得到淫羊藿多糖[9]。
多糖的含量测定 采用苯酚−硫酸法测定多糖。以葡萄糖作为标准品测定提取液中淫羊藿多糖的含量。精密称取干燥恒重的葡萄糖对照品10 mg置于100 mL量瓶中,以蒸馏水定容至刻度,配成0.1 g·L−1标准溶液,分别量取上述葡萄糖溶液0.2、0.4、0.6、0.8、1.0和1.2 mL,加蒸馏水补足至2 mL,摇匀。另精密吸取蒸馏水2 mL作为空白溶液,然后依次加 入5% 苯酚溶液1 mL,在涡旋混合器上充分混匀,迅速加入浓硫酸5 mL,置沸水浴中约15 min,取出室温冷却。在490 nm下测定吸光度值,质量浓度在0.17~0.91 g·L−1呈线性关系,且得到线性回归方程: y = 0.738 8 x + 0.125 4 (R2 = 0.997,n = 6),其中y为吸 光度值,x为葡萄糖质量浓度。计算淫羊藿多糖得率: Y (%) = [(A×B)/C]×100,式中Y为多糖得率 (%),A为由回归方程求得的多糖浓度 (g·L−1),B为多糖溶液体积 (mL); C为淫羊藿药材干品质量 (g)。
多糖的单因素实验 分别以不同的提取温度、提取时间、提取次数和料液比进行单因素实验,每个实验重复3次,取平均值考察各因素对提取淫羊藿多 糖的影响。
响应面优化设计 综合单因素实验结果,以多糖得率为响应值,提取温度、提取时间和料液比为自变量,根据Box-Behnken设计原理[10],进行3因素3水平响应面实验 (表 1),通过Design Expert 8. 0. 6.1软件对数据进行结果分析,模型验证得出淫羊藿多糖的水提醇沉的最优条件。
| Table 1 Factors and levels of Box-Benhnken center-united design |
Lewis肺癌模型的建立及分组 取健康C57/BL6小鼠40只,其中8只为空白对照; 32只建立Lewis肺癌细胞荷瘤小鼠模型,即于每只小鼠左前肢腋下皮下注射Lewis肺癌细胞悬液200 μL。24 h后建模小鼠随机分组: 分别为模型组 (按体重给予相应体积的蒸馏水作为荷瘤小鼠空白对照),阳性环磷酰胺对照组 (20 mg·kg−1),淫羊藿多糖低剂量组 (100 mg·kg#8722;1) 和淫羊藿多糖高剂量组 (400 mg·kg−1)。每组8只,每天灌胃1次,每次0.2 mL,连续给药14天。
细胞因子检测 停药5 h后眼眶取血,放入0.5 mL EP管3 000 r·min−1离心10 min,取上清液−20 ℃保存备用。颈椎脱臼处死小鼠,完整剥离瘤块,称量瘤体湿重,按下列公式计算各指标。抑瘤率 (%) = (模型组平均瘤重 − 实验组平均瘤重) / 模型组平均瘤重 × 100%; 脏器指数[11]: 胸腺指数 = 胸腺质量 (mg) / 小鼠质量 (g),脾指数 = 脾质量 (mg) / 小鼠质量 (g)。血清细胞因子 (IL-2、IFN-γ) 的检测: 应用双抗体夹心ABC- ELISA试剂盒检测血清中IL-2、IFN-γ的含量,严格按试剂盒说明书进行操作。
流式细胞检测EPS对外周血CD4+/CD8+的影响 取1.5 mL EP管,每管加入全血100 μL和FACS红细胞裂解液1 mL,振荡混匀,室温暗处放置10 min。按照检测要求在各管中加入适量小鼠APC-CD4、PE- CD8a抗体,1 000 r·min−1离心5 min,弃上清,再加 入磷酸盐缓冲液 (PBS) 1 mL洗涤,振荡混匀,1 000 r·min−1离心5 min,弃上清。每管加入PBS 500 μL洗涤,振荡混匀后,进行流式细胞仪检测。
免疫组化检测EPS对肿瘤组织IDO的表达 4 μm石蜡切片常规脱蜡至水,将切片放入抗原修复液中加热至煮沸,置于电热器上保持微沸状态20 min,自然冷却后用PBS浸洗3次。每张切片滴加3% H2O2-甲醇溶液2滴,室温 (15~25 ℃) 封闭10 min,PBS浸洗3次。山羊血清封闭,37 ℃,20 min。滴加一抗 (兔抗鼠IDO单克隆抗体),37 ℃,孵育2 h,PBS浸洗 3次。二抗为通用型IgG抗体-Fab段-HRP多聚体,37 ℃,孵育30 min,PBS浸洗3次。滴加2滴新鲜配制的二氨基联苯胺 (DAB) 溶液显色,用自来水轻柔冲洗15 min,蒸馏水终止显色反应。使用苏木素复染,染色10 min,用蒸馏水冲洗干净。脱水,透明,封片。细胞胞浆呈棕黄色者为阳性细胞。采用ImagePro Plus图像分析软件对平均吸光度值反映染色深浅的程度进行分析。
统计学方法 响应曲面模型的回归方程式和显著性统计用Design Expert 8.0.6.1软件进行计算和分析。计量资料以x± s表示,数据结果采用SPSS统计软件包进行方差分析。多组间比较采用单因素方差分析 (one-way ANOVA),组间比较采用t检验,P < 0.05 为有统计学意义。
结果 1 多糖单因素实验结果与分析 1.1 时间对多糖提取的影响在固定提取温度为 90 ℃,料液比1∶20,提取2次的情况下,设定提取时间1、2、3、4和5 h,结果见图 1A。从图中可知,随着提取时间的增加,多糖的得率也呈上升趋势,但在3 h后上升不明显,趋于平稳,故选择提取时间为3h左右。
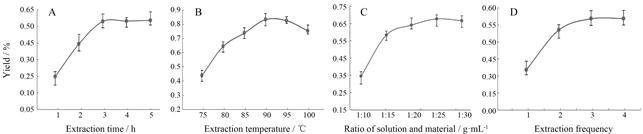
|
Figure 1 Effects of extraction time (A),extraction temperature (B),ratio of solution and material (C),and extraction frequency (D) on the Epimedium polysaccharides (EPS) yield |
在固定提取时间为3 h,料液比1∶20,提取2次的情况下,设定温度为75、80、85、90、95和100 ℃,结果见图 1B。从图中可知,多糖得率在90 ℃前皆逐渐升高,之后则有所下降,可能因为长时间高温对糖类成分有所破坏。故选择提取温度90 ℃左右。
1.3 料液比对多糖提取的影响在固定提取温度为90 ℃,提取时间为3 h,提取2次的情况下,设定料 液比为1∶10、1∶15、1∶20、1∶25和1∶30,结果见图 1C。从图中可知,从1∶10到1∶15有明显的 上升,可能是因为药材吸水量大,而后升幅较小,根据得率结合实际情况选择料液比1∶20左右。
1.4 提取次数对多糖得率的影响在固定提取温度为90 ℃,料液比1∶20,提取时间为3 h的情况下,设定提取次数为1、2、3和4次,结果见图 1D。从图中可知,随着次数的增加,得率逐渐上升,但是2次后的升幅不明显,虽然次数越多提取得率越高,但考虑到实际生产,其得率的少量提升却需要消耗更多的资源和能量,因此选择2次为固定次数,对其他3个因素再进行响应面的模拟。
2 响应面优化实验 2.1 Box-Behnken实验及模型分析在单因素实验结果的基础上,固定提取次数为2次,以提取时间、提取温度和料液比3个因素为自变量 (表 1),以淫羊藿粗多糖提取率为响应值,采用响应面法进行3因素3水平的实验设计,共包括17组实验方案,结果见表 2。
| Table 2 The experiment design and results of response surface methodology (RSM) |
响应面曲面可较直观地反映各因素及两两因素的交互作用对响应值的影响。淫 羊藿多糖提取的等高线图与响应面3D图谱见图 2。首先,提取温度对淫羊藿多糖提取效果的影响最大,呈抛物线型,随温度增加多糖提取率先增加后减少,87 ℃左右提取效果最好。其次,提取时间对淫羊藿多糖提取效果的影响也较为显著,而料液比的影响最小,图形变化平缓。最后,提取温度和料液比对淫羊藿多糖提取的交互作用显著。
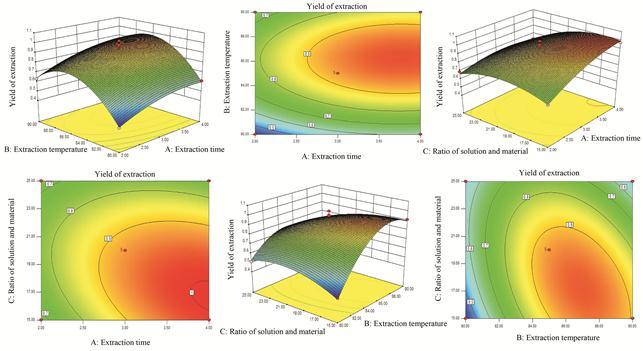
|
Figure 2 Response surface and contour plots showing the effects of operating parameters on the extraction efficiency of Epimedium polysaccharides |
此外,使用响应面模型参数评价实验结果,结果和变量符合多项回归。方差分析表明模型的F值为15.211 48 (P < 0.001),失拟项 (P) 为0.958 2 > 0.05,该模型总决定系数 (R2) 为0.951 3,调整决定系数 (R2adj) 为0.888 9,以上参数说明实验结果具有显著性差异,该二次模型成立,所得模型可以用于预测实验结果,且预测值与实际值高度匹配,可用于淫羊藿多糖提取的优化条件。该模型的回归方程为: Y (%) = 0.93 + 0.093 75 XA + 0.115 XB − 0.068 75 XC + 0.002 5 XAXB − 0.065 XAXC − 0.127 5 XBXC − 0.062 5 XA2 − 0.245 XB2 − 0.102 5 XC2,影响淫羊藿多糖提取率的主次因素是B (温度) > A (时间) > C (料液比),总的来说,因素A、B、C、B2、C2以及交互作用BC都显著影响多糖的得率。
2.3 优化条件的验证实验采用Design-Expert V8.0.6.1软件对方程中Y求解,得到提取淫羊藿多糖的理论最佳条件为: 提取温度87 ℃,提取时间3.84 h,料液比1∶16.33,考虑实际操作的可行性,淫羊藿多糖提取最佳条件修正为提取温度87 ℃,料液比1∶16,提取时间4 h,此条件下进行3组平行实验,所得多糖得率的平均值为1.023%,而回归方程所得的多糖得率理论预测值为1.045%,两者相对误差为2.15%,说明运用响应面法优化得到的模型参数准确可靠。
3 淫羊藿多糖抑制肿瘤细胞生长经过2周灌胃给药,淫羊藿多糖与模型组相比明显抑制肿瘤生长,尤其是高剂量组 (抑制率38.4%,表 3),阳性环磷酰胺组虽然抑制肿瘤效果更好 (抑制率50.2%),但是由于其严重的毒副作用导致小鼠体重下降趋势明显 (图 3),不适合长期给药。
| Table 3 The inhibition effects on LLC-bearing mice of Epimedium polysaccharides (EPS). n = 8,x± s |
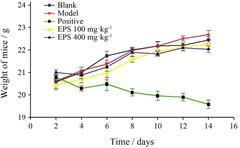
|
Figure 3 The weight change curve of mice in blank group,model group,positive group (cyclophosphamide 20 mg·kg−1),low dose of EPS (100 mg·kg−1),and high dose of EPS (400 mg·kg−1) |
根据相应公式的计算结果,与对照组相比,淫羊藿多糖能明显提高脾脏指数 (P < 0.05),维持胸腺指数平稳,但是阳性环磷酰胺组明显抑制脾脏和胸腺的生长 (P < 0.01),见表 4。由此可见,淫羊藿多糖可以有效阻止肿瘤机体免疫器官的萎缩。
| Table 4 Immune organ index of LLC-bearing mice with or without treatment. n = 8,x± s.*P < 0.05,**P < 0.01 vs blank group |
在血清检测中发现,淫羊藿多糖可以不同程度的提高免疫细胞因子IL-2、IFN-γ的水平 (图 4),进一步证明了其提高机体免疫的作用。值得注意的是,本实验中,高剂量的淫羊藿多糖对提高IFN-γ水平的作用更明显,而对IL-2的效果则不如低剂量,提示剂量的变化对这两种免疫因子水平变化的影响并不一致,是否存在一个最佳的剂量仍需探究。
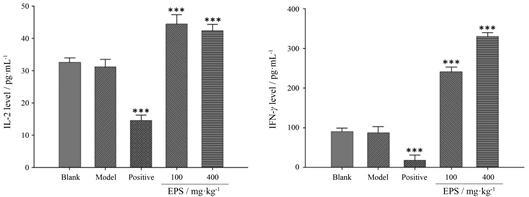
|
Figure 4 Effects of EPS on cytokines content in tumor-bearingmice. n = 8,x± s. ***P < 0.001 vs blank group |
CD4+、CD8+ T细胞在免疫抗肿瘤方面发挥重要作用,在癌症患者体内常伴随着二者的比例下降,而这种不正常的比例关系会阻碍T细胞杀死肿瘤细 胞,造成免疫抑制[12, 13]。图 5显示,在模型组中CD4+/ CD8+比例严重下降,远低于空白组,而阳性环磷酰胺组因损害机体免疫功能,也显著性导致了T细胞两种亚群的比例失调。淫羊藿多糖则可以显著提升CD4+水平 (P < 0.001),恢复CD4+/CD8+比例的失调,体现了EPS对免疫抑制因素的调节作用。
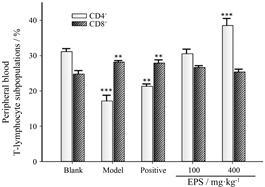
|
Figure 5 Effect of EPS on the percentage of splenic CD4+,CD8+ T lymphocytes. n = 8,x± s. **P < 0.01,***P < 0.001 vs blank group |
色氨酸代谢初始限速酶——吲哚胺2,3-二氧化酶 (indoleamine 2,3-dioxygenase,IDO) 是一种T细胞限速酶,也是造成肿瘤免疫耐受和免疫逃逸的重要因素[14, 15]。免疫组化结果显示,阳性环磷酰胺组中IDO虽然较模型组的表达低,但并未见显著性差异,而淫羊藿多糖可以显著减少IDO在肿瘤组织中的表达 (P < 0.05,P < 0.01),见图 6。
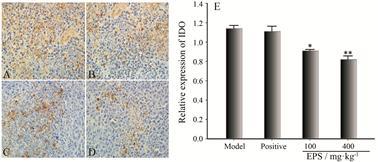
|
Figure 6 Effects of EPS on indoleamine 2,3-dioxygenase (IDO)expression detected by immunohistochemistry in tumor tissue (×400). A: Model group; B: Positive group; C: Low dose of EPS; D: High dose of EPS; E: The protein expression of IDO. n = 8,x± s. P < 0.05,**P < 0.01 vs model group |
Box-Behnken响应面分析法能够在因素和响应值之间建立模型,不仅可以通过相关数据进行拟合,筛选出最佳工艺,克服了正交试验只能给出最佳因素水平组合却无法找出整体因素中最佳组合和响应值的缺点[16]。此外,响应面分析对实验的预测性较 好,图形直观,在未来中药领域的研究中会越来越广泛[17, 18]。本文中响应面实验确定了淫羊藿多糖的最 佳提取条件为提取温度87 ℃,提取时间3.84 h,料液比1∶16.33,此条件下多糖得率为1.023%,回归方程所得的理论预测值为1.045%,二者相对误差小于5%。实际值与模型吻合度较好。
脾脏与胸腺作为机体主要的免疫器官,它们质量上的改变可以直观地说明受试药物对免疫系统的刺激作用。本实验表明淫羊藿多糖可以明显增加脾脏指数; 与空白组相比,对胸腺指数影响虽然不明显,基本是处于一种维持的状态,具体机制可能与胸腺免疫细胞成熟释放较快有关。而阳性药组则明显缩小免疫器官,损害机体免疫。免疫因子是肿瘤发生发展过程的微环境重要组成部分,免疫器官中包含T细胞、B细胞、NK细胞和巨噬细胞等免疫细胞,可以释放各种免疫因子杀伤肿瘤细胞,而多糖可以促进免疫调节因子的释放,间接发挥抗肿瘤作用[19, 20]。因 此,本文从免疫因子水平提高方面出发,对血清免疫因子进行检测,结果表明淫羊藿多糖可以促进IL-2、IFN-γ的产生,在维持机体免疫功能的同时也提高机体杀伤肿瘤细胞能力。此外,免疫抑制性因子干扰机体免疫监视、免疫清除肿瘤细胞的各个环节,它们塑造了利于肿瘤生长的微环境,最终造成肿瘤免疫逃逸。因此,本文又通过对外周血CD4+/CD8+比例失调和肿瘤组织IDO表达异常的检测,发现淫羊藿多糖可以恢复CD4+/CD8+比例,降低IDO水平,进而破坏肿瘤生长的微环境,阻止肿瘤免疫逃逸,再结合其本身提高机体免疫功能的基础,从两方面共同促进其抗肿瘤疗效。当然,这些免疫因子、免疫细胞以及相关蛋白酶的表达之间的具体关系还需要进一步的探索才能全面揭示淫羊藿多糖免疫抗肿瘤的机制。
本文在传统水提醇沉淫羊藿多糖的基础上,设计响应面来提高多糖的得率,并对所得多糖进行体内正向和负向免疫调节抗肿瘤药效的初步探索,为以后更深入研究淫羊藿多糖在免疫提高方面奠定基础,并丰富补益类中药的研究思路。此外,化疗药物虽然有良好的抑癌效果,但长期使用会导致肿瘤免疫抑制。如5-氟尿嘧啶 (5FU)、伊立替康 (CPT-11) 等化疗药在结肠癌、胰腺癌等多种癌症的治疗中所 诱发的髓源性抑制细胞 (MDSC) 能明显抑制T细胞、NK细胞活性,加快肿瘤血管生成,激活免疫抑制性炎症通路,形成利于肿瘤生长的微环境,促进肿瘤生长,造成肿瘤免疫逃逸,大大降低了抗肿瘤疗 效[21-23]。为了达到良好的肿瘤治疗效果又不损害机体免疫功能,提高患者生存质量,越来越多的证据显示免疫治疗手段结合化疗药物是一种行之有效的选择[24]。目前较为普遍的是细胞因子诱导的杀伤细胞作为免疫治疗手段与化疗药相结合[25],而作为具有较强免疫活性的中药多糖也应该加快研究联合治疗的步伐,阐明联合用药减毒增效的分子机制,早日服务于临床。中药是多途径、多靶点协同发挥作用,对淫羊藿多糖的研究也是为了与其他更多有效成分 (如黄酮类) 的有机整合打下基础,促进多糖单方面研究最终回到中药本身这一整体,探索出传承与创新相结合的思路。
| [1] | Zhang YD, Cai YN, Zhang Q, et al. Inhibitory effect of icariin on acetyl-cholinesterase[J]. Acta Pharm Sin (药学学报) , 2012, 47 :1141–1146. |
| [2] | Shindel AW, Xin ZC, Lin G, et al. Erectogenic and neurotro-phic effects of icariin, a purified extract of horny goat weed (Epimedium spp.) in vitro and in vivo[J]. J Sex Med , 2010, 7 :1518–1528. DOI:10.1111/j.1743-6109.2009.01699.x |
| [3] | Samuelsen AB, Schrezenmeir J, Knutsen SH. Effects of orally administered yeast-derived beta-glucans: a review[J]. Mol Nutr Food Res , 2014, 58 :183. DOI:10.1002/mnfr.v58.1 |
| [4] | Iwanowicz LR, Densmore CL, Ottinger CA. Calcein AM release-based cytotoxic cell assay for fish leucocytes[J]. Fish Shellfish Immun , 2004, 16 :127–137. DOI:10.1016/S1050-4648(03)00056-1 |
| [5] | Song J, Huang H, Xia Z, et al. TPGS/phospholipids mixed micelles for delivery of icariside II to multidrug-resistant breast cancer[J]. Integr Cancer Ther , 2015, 38 :1–2. |
| [6] | Song J, Shu L, Zhang Z, et al. Reactive oxygen species- mediated mitochondrial pathway is involved in Baohuoside I-induced apoptosis in human non-small cell lung cancer[J]. Chem Biol Interact , 2012, 199 :9–17. DOI:10.1016/j.cbi.2012.05.005 |
| [7] | Cao XT. Immunology in China: the past, present and future[J]. Nat Immunol , 2008, 9 :339–342. DOI:10.1038/ni0408-339 |
| [8] | Wang XN, Haniffa MA, Holtick U. Regulatory T-cell sup-pression of CD8+ T-cell-mediated graft-versus-host reaction requires their presence during priming[J]. Transplantation , 2009, 88 :188–197. DOI:10.1097/TP.0b013e3181ac14ce |
| [9] | Cheng H, Feng S, Shen S, et al. Extraction, antioxidant and antimicrobial activities of Epimediumacuminatum Franch. polysaccharide[J]. Carbohydr Polym , 2013, 96 :101–108. DOI:10.1016/j.carbpol.2013.03.072 |
| [10] | Kousha M, Daneshvar E, Dopeikar H, et al. Box-behnken design optimization of acid black 1 dye biosorption by different brown macroalgae[J]. Chem Eng J , 2012, 119 :158–168. |
| [11] | Zhou X, Shi HY, Jiang GN, et al. Antitumor activities of ginseng polysaccharide in C57BL/6 mice with Lewis lung carcinoma[J]. Tumour Biol , 2014, 35 :12561–12566. DOI:10.1007/s13277-014-2576-7 |
| [12] | Saavedra D, García B, Lorenzo-Luaces P, et al. Biomarkers related to immunosenescence: relationships with therapy and survival in lung cancer patients[J]. Cancer Immunol Immu-nother , 2016, 65 :37–45. DOI:10.1007/s00262-015-1773-6 |
| [13] | Overgaard NH, Jung JW, Steptoe RJ, et al. CD4+/CD8+ double-positive T cells: more than just a developmental stage?[J]. Leukoc Biol , 2015, 97 :31–38. DOI:10.1189/jlb.1RU0814-382 |
| [14] | Brunner K, Mauel J, Cerottini JC, et al. Quantitative assay of the lytic action of immune lymphoid cells of 51Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs[J]. Immunology , 1968, 14 :181–196. |
| [15] | Ngamwongsatit P, Banada PP, Panbangred W, et al. WST-1-based cell cytotoxicity assay as a substitute for MTT-based assay for rapid detection of toxigenic Bacillus species using CHO cell line[J]. Microbiol Methods , 2008, 73 :211–215. DOI:10.1016/j.mimet.2008.03.002 |
| [16] | Box GEP, Hunter WG. Statistics for Experiments: An Introduction to Design, Data Analysis, and Model Building[M]. NewYork: Wiley, 1990 : 250 . |
| [17] | Mostafa K. Response surface modeling of lead preconcentra-tion from food sample by miniaturised homogenous liquid-liquid solvent extraction: Box-Behnken design[J]. Food Chem , 2011, 129 :1832–1838. DOI:10.1016/j.foodchem.2011.05.123 |
| [18] | Xia XJ, Tao ZH, Ren Y, et al. Preparation and in vitro study of buagafuran solid dispersions[J]. Acta Pharm Sin (药学学报) , 2008, 43 :548–552. |
| [19] | Shang JJ, Wang Y, Wang SC, et al. Effect of Angelica sinensis polysaccharides on lymphocyte proliferation and induction of IFN-γ[J]. Acta Pharm Sin (药学学报) , 2002, 37 :497–499. |
| [20] | Yang TH, Jia M, Mei QB. Immunoloregulation effect of Angelica polysaccharide isolated from Angelica sinensis[J]. Chin Pharm Bull (中国药理学通报) , 2003, 19 :448–451. |
| [21] | Kanterman J, Sade-Feldman M, Biton M, et al. Adverse immunoregulatory effects of 5FU and CPT11 chemotherapy on myeloid-derived suppressor cells and colorectal cancer outcomes[J]. Cancer Res , 2014, 74 :6022–6035. DOI:10.1158/0008-5472.CAN-14-0657 |
| [22] | Takeuchi S, Baghdadi M, Tsuchikawa T, et al. Chemotherapy- derived inflammatory responses accelerate the formation of immunosuppressive myeloid cells in the tissue microenviron-ment of human pancreatic cancer[J]. Cancer Res , 2015, 75 :2629–2640. DOI:10.1158/0008-5472.CAN-14-2921 |
| [23] | Bruchard M, Mignot G, Derangère V, et al. Chemotherapy-triggered cathepsin B release in myeloid-derived suppressor cells activates the Nlrp3 inflammasome and promotes tumor growth[J]. Nat Med , 2013, 19 :57–64. |
| [24] | Di Mitri D, Toso A, Alimonti A. Molecular pathways: targeting tumor-infiltrating myeloid-derived suppressor cells for cancer therapy[J]. Clin Cancer Res , 2015, 15 :3108–3112. |
| [25] | Wang Z, Liu Y, Zhang Y, et al. MDSC-decreasing chemo-therapy increases the efficacy of cytokine-induced killer cell immunotherapy in metastatic renal cell carcinoma and pancre-atic cancer[J]. Oncotarget , 2016, 26 :4760–4769. |
 2016, Vol. 51
2016, Vol. 51


