五味子为传统中药材,应用历史悠久,始载于东汉《神农本草经》,列为上品,因五味俱全而得名。具有收敛固涩、益气生津、补肾宁心之功效[1]。源于木兰科的五味子 [Schisandra chinensis (Turcz.) Bail.] 的干燥成熟果实,习称“北五味子”,现代临床常用炮制品为生制、醋制、酒制[2]。
五味子经过不同炮制工艺加工后药性的变化,一般认为: 生用以敛肺止咳止汗为主; 醋制收敛作用增强,涩精止泻作用增强; 酒制可增强温补的作用,多用于肾虚遗精、心悸失眠。不同的炮制方法能够显著影响五味子药理活性,在生五味子、醋五味子、酒五味子不同炮制品中,醋制品的抗脂质过氧化及提高免疫的作用最为明显,酒制 (蒸制) 品的镇静催眠作用要优于醋制品和生品[3]。
炮制的过程就是药物中化学成分量变和质变的过程,任何单一化合物的改变都不能很好表征整个中药炮制前后功效和药性的变化,只有多种成分的比例、组成变化的综合结果才能更好地解析炮制的机制以及药材炮制后功能变化[4-6]。这种变化,从炮制的过程看,涉及到酶、中间产物、外加条件等诸多因素,十分复杂。但从炮制的结果看,究其根本,是物质基础发生了转变,包括质变 (化学成分识别) 和量变 (变化趋势) 两方面[7-9],是对炮制前后的复杂成分进行整体性、系统性的比较。这个物质基础即化学成分,实质是药用植物的一级代谢物、次级代谢物等,对其采用代谢组学技术,以高通量的检测和数据处理为手段,可以从整体化学物质组成角度对五味子炮制前后化学成分的迁移变化进行全面分析,为更好的继承和发扬五味子不同炮制品的优势和特色提供科学依据。实验所采用的UHPLC-QTOF/MSE质谱数据采集模式,与传统的LC-MS/MS、LC-QTOF/MS相比,MSE具有更高的灵敏度,很少会丢失数据信息,确保了化学成分信息收集的完整性[10]。在此基础上,结合代谢组学技术,将数据进行群组分析,识别并区分炮制前后的差异性成分,并描述经不同炮制工艺之后该化学成分的迁移变化趋势,为认识五味子药性或功能改变提供物质基础[11]。
材料与方法仪器与材料 Waters Acquity I-CLASSTM UHPLC超高效液相色谱系统 (Waters Corporation,Milford,MA,USA); Synapt G2-SiTM高分辨率飞行时间质谱仪(Waters Corporation,Manchester,UK)。北五味子 (9个批次) 分别产自辽宁省本溪市 (20141120,20141210,20141223,20150203,20150405,20150412) 和陕西省商洛市 (20150307,20150312,20150320),经南昌市食品药品检验所主管药师吴蓓鉴定为木兰科植物五味子 [Schisandra chinensis (Turcz.) Baill.] 的干燥成熟果实。乙腈、甲醇 (色谱纯,Fisher Scientific,Fairlawn,NJ,USA); 甲酸(色谱纯,Sigma-Aldrich Co. Ltd,St Louis,MO,USA); 水为纯净水 (杭州娃哈哈集团),其余试剂均为分析纯。五味子甲素 (批号: 110764- 201513)、五味子醇甲 (批号: 110857-201513)、五味子醇乙 (批号: 110765-201311) 均购自中国食品药品检定研究院。
北五味子炮制[2] 五味子生品: 取北五味子药 材,除去杂质后洗净,烘干。酒蒸五味子: 取洗净后五味子生品,加黄酒拌匀,闷润1 h,置蒸器内 (密封) 蒸至上大气,蒸3 h,表面显紫黑色,取出,烘干。每100 g净五味子,用黄酒20 g。醋五味子: 取洗净后 五味子生品,加米醋拌匀,闷润1 h,置蒸器内 (密 封) 蒸至上大气,蒸3 h,表面显黑色,取出,烘干。每100 g加入米醋用量20 g。
供试品及对照品溶液的制备 分别称取9个批次的北五味子生品、酒制品和醋制品各1 g,粉碎,过80目筛后,称取粉末0.25 g,用甲醇15 mL超声 30 min,0.22 μm微孔滤膜抽滤,离心5 min (离心力22 810×g),将上清液转移至25 mL量瓶中,用甲醇稀释至刻度。进样前用甲醇稀释50倍 (取储备液100 μL,加甲醇稀释至5 mL,相当于0.2 mg·mL−1)。精密称取五味子甲素、五味子醇甲、五味子醇乙各2 mg,分别用甲醇稀释,配成100 ng·mL−1的标准溶液,进样前用0.22 μm微孔滤膜过滤。
液相条件 色谱柱: AcquityTM UHPLC BEH C18柱 (100 mm× 2.1 mm,1.7 μm,Waters公司); 柱温为40 ℃,流动相 (A相0.1% 甲酸−水; B相为乙腈),流动相流速为0.4 mL·min−1; 五味子供试品及对照品进样量均为1 μL; B相比例随时间变化: 0~5 min,20%~30%; 5~15 min,30%~60%; 15~20 min,60%~90%; 20~25 min,90%~90%; 25.01~30 min,乙腈 (B相) 比例回到20% 并保持5 min,平衡色谱柱。
质谱条件 采用电喷雾离子源 (ESI),分别比较了正、负离子两种扫描模式,结果发现正离子模式下质谱响应更强,在高能量通道下碎片信息更丰富,故实验最终选择在正离子模式下进行。质谱数据格式 为centroided,雾化气 (N2) 流速为800 L·h−1,脱溶剂气温度为600 ℃,离子源温度120 ℃,毛细管电 压3.0 kV。锥孔电压 (sampling cone) 40 V,补偿电压 (source offset) 80 V。MSE扫描模式检测,低能量扫描时 (function 1) 传输碰撞能量为4 eV,高能量扫描时 (function 2) 传输碰撞能量为20~50 eV,喷雾器压力为6.5 bar (1 bar ≈ 100 kPa),气帘气流速 (cone gas flows) 为50 L·h−1,扫描范围为m/z 100~1 200。亮氨酸− 脑啡肽 (精确质量数m/z 554.261 5) 作为内标 (Lock SprayTM) 进行质量实时校正,流速为5 μL·min−1。
结果 1 五味子数据库的建立基于Chemspider和SciFinder数据库检索工具及五味子相关文献中报道的化学成分建立五味子目标数据库,将高分辨质谱采集到的数据经分子式匹配软件Elemental compositionTM计算后得到化合物的分子式,结构匹配软件MassFragmentTM用于化合物特征碎片辅助解析。通过以上方法共鉴定出20个化合物。五味子醋品的总离子流图如图 1,各化合物的保留时间、相对分子质量及在高能量通道下的特征碎片详见表 1。
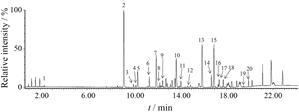
|
Figure 1 Total ion chromatograms of vinegar-processed Schisandra chinensis by UHPLC-QTOF/MSE: 1: Neokadsuranic acid B; 2: Schisandrin; 3: Gomisin D; 4: Gomisin J; 5: Schisandrol B; 6: Angeloyl gomisin H; 7: Tigloylgomisin H; 8: Angeloyl gomisin Q; 9: Gomisin G; 10: Schisantherin A; 11: Schisantherin B; 12: Schisantherin C; 13: Schizandrin A; 14: γ-Schizandrin; 15: Schizandrin B; 16: Schizandrin C; 17: Schisantherin D; 18: 6-O-Benzoylgomisin O; 19: Schisantherin E; 20: Gomisin T |
| Table 1 Identification of chemical constituents from Schisandra chinensis fruit in positive mode |
在五味子的生品及其炮制品的总离子流图中,可以观察到一些含量较高的化合物,对于一些含量极低的化合物,可以通过输入其精确分子量的加合离子峰的理论值得到提取离子流色谱图。在化合物的质谱数据中可以发现,大多数联苯环辛烯类及三萜类化合物低能量通道下的一级母离子均以[M+Na]+为基峰显示且较容易发生源内裂解。在五味子醇甲和五味子醇乙的质谱数据中,均未发现[M+H]+峰,但可以发现化合物失去一个电子产生准分子离子峰,即以[M]+显示,这种由中性分子丢失一个电子后形成的带自由基离子的质荷比为偶数。这可能与联苯环辛烯类化合物的结构特点有关。本实验以化合物1至化合物5为例,详细分析化合物的裂解过程。全部化合物的碎片信息详见表 1。
化合物1 峰1的保留时间为2.32 min,低能量通道下给出的精确质荷比m/z 475.325 0 [M+Na]+、m/z 453.336 9 [M+H]+,通过计算分子式为C30H44O3,初步鉴别该化合物可能为新南五味子酸,其在高能量通道下产生质荷比为m/z 435.325 8、339.268 2、227.179 4等碎片离子能进一步确认该化合物的结构。其中m/z 435.325 8 [M−H2O+H]+为新南五味子酸脱水后产生的碎片。m/z 339.268 2、227.179 4均为新南五味子酸侧链断裂后生成。
化合物2 在图 1中9.19 min处出现的色谱峰信号强度最高,根据低能量通道下的母离子信息m/z 432.214 0 [M−e]+、m/z 455.204 5 [M+Na]+可计算出该化合物分子式为C24H32O7。该化合物在高能量通 道下产生一系列的特征碎片离子,其中m/z 415.211 5 [M−H2O+H]+为该化合物脱水产生的碎片,继续脱去甲基产生m/z 400.184 4 [M−H2O−CH3+H]+的碎片离子; m/z 384.193 2比415.211 5整数部分少31 Da,可推测m/z 384.193 2为[M−H2O+H]+丢失一分子甲氧基后的碎片。m/z 384.193 2继续丢失一分子甲基或一分子甲氧基分别得到m/z 369.167 7和353.170 1的碎片。根据该化合物母离子信息结合二级特征碎片离子,可推断该化合物为五味子醇甲。
化合物3 在保留时间为10.01 min处出现的色谱峰,其低能量通道下出现m/z 531.221 3 [M+H]+及553.205 2 [M+Na]+两个加合离子峰,可得出该化合物分子为C28H34O10,推测该化合物可能为戈米辛D。该化合物在高能量通道下内酯环断裂生成m/z 485.217 0的碎片离子,脱掉内酯环残基生 成m/z 401.160 5碎片,继续脱水得到m/z 383.149 7离子。
化合物4 在保留时间为10.02 min处,出现 一个明显的色谱峰,其低能量通道下中出现m/z 389.197 0 [M+H]+,分子式为C22H28O6,可推测该化合物可能为戈米辛J。该化合物在高能量通道下裂解成m/z 374.170 5、357.170 2、319.118 6、287.092 2 等碎片,m/z 374.170 5 [M−CH3+H]+和357.170 2 [M− OCH3+H]+分别为化合物丢失甲基和甲氧基后的生成碎片离子,m/z 319.118 6为化合物中环辛烯断裂后生成,m/z 287.092 2为319.118 6继续失去甲氧基得到的碎片离子。
化合物5 在保留时间为10.36 min处出现明显的色谱峰,通过低能量下母离子m/z 439.172 9 [M+ Na]+可知该化合物的分子式为C23H28O7,推测该化合物可能为五味子醇乙。在相同保留时间的高能量下的图谱中出现m/z 399.181 2、368.162 4、353.138 2和337.144 1等4个特征碎片; 其中m/z 399.181 2为化合物脱水之后的碎片离子[M−H2O+H]+,m/z 368.162 4为化合物失去水后再丢失甲氧基的碎片离子,继续脱去甲基和甲氧基分别生成m/z 353.138 2和337.144 1的碎片离子。现以化合物5为例,阐明该类成分的裂解路径 (图 2)。
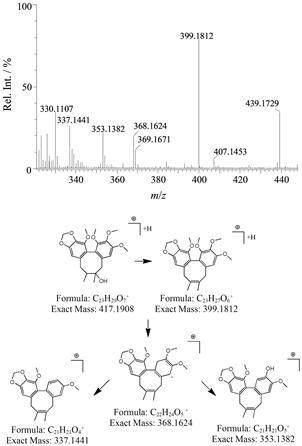
|
Figure 2 The mass spectrum and fragmentation pathway of schisandrol B under MSE data-acquistion mode |
为了验证分析结果的可靠性,将五味子醇甲、五味子醇乙、五味子甲素分别进样分析,实验结果显示,对照品的保留时间、母离子的精确质荷比、特征碎片离子等信息均与样品中的一致。
3 五味子生品及炮制品的差异标志物识别将9个批次的样品分为3组 (每组9份,分别为生品组、酒制品组和醋制品组,共27个样品),在相同的色谱条件和质谱条件下进样,将采集到的3组原始数据导入代谢组学数据处理软件Markerlynx 4.1做PCA模式识别分析,用Ezinfo软件分析处理后的数据,设置权重模式为Pareto Scaling,得到PCA得分图 (scores-plot) 和载荷因子图 (loading plot),如图 3。
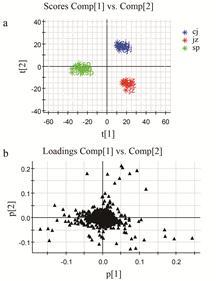
|
Figure 3 The score plot and loading-plot of three groups of Schisandra chinensis fruit samples in positive ion mode. a: Score plot; b: Loading plot. cj: Vinegar-processed; jz: Wine- processed; sp: Crude |
图 3中每个点表示一个样品数据,每个数据的聚集或离散程度取决于主成分分析法降维滤噪处理后各数据接近程度。组内样品相互聚集,3组样品能明显区分开,表明五味子生品及不同炮制品之间存在显著差异。在loading图中,每个点代表一个化合物,横坐标P1代表第1组主成分,纵坐标P2代表第2组主成分,靠近中间部位的化合物为3组样品中差异较小的化合物; P1或P2的绝对值越大,表明化合物差异越明显。为了进一步筛选出3组数据 (n = 9) 中存在的差异标志物,对3组数据做偏最小二乘法 (PLS-DA) 判别分析,选取VIP > 1的数据 (variable importance,VIP > 1,表明差异显著),得到PLS-DA法分析后的loading-plot散点图 (图 4)。在VIP > 1的区域,筛选出具有显著差异的化学标志物,结合该类化合物的保留时间、母离子和特征碎片离子等信息,共鉴定了12个差异明显的化合物。
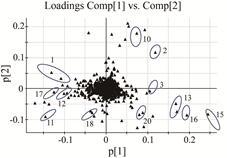
|
Figure 4 PLS-DA-loading plot of three groups of Schisandra chinensis fruit samples in positive ion mode |
通过12个化合物在3组样品中分布情况比较发现,在炮制过程中并未产生新的化学成分,但在含量上存在明显的差异。在五味子生品组中,新南五味子酸 (neokadsuranic acid B)、五味子酯乙 (schisantherin B)、五味子酯丙 (schisantherin C)、五味子酯丁 (schisantherin D) 及6-O-苯甲酰戈米辛O (6-O- benzoylgomisin O) 的含量较其他两组高; 五味子醋制组中,五味子酯甲 (schisantherin A)、五味子醇甲 (schisandrin) 的含量较高; 五味子酒制品组中,五味子甲素 (schizandrin A)、五味子乙素 (schizandrin B)、五味子丙素 (schizandrin B)、戈米辛D (gomisin D) 及戈米辛T (gomisin T) 含量较高。各化合物在不同组别中的相对离子强度变化趋势见图 5。
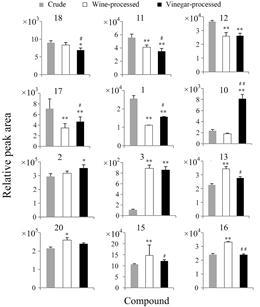
|
Figure 5 Ion intensity trend plots of characteristic compounds (a total of 12 compounds)with significant differences in three groups of Schisandra chinensis fruit samples. P < 0.05,**P < 0.01 vs Crude; #P < 0.05,##P < 0.01 vs Wine-processed |
五味子常见炮制品种有醋五味子、酒五味子、蜜五味子,炮制工艺是否合理、方法是否恰当,直接影响临床疗效。因此,对传统中药炮制过程中化学成分的变化进行监测具有十分重要的意义。
本文采用UHPLC-QTOF/MSE技术对北五味子生品及其炮制品的化学成分进行快速识别,并结合PLS-DA判别模式对不同五味子样品中特征差异性标志物进行区分,为五味子炮制工艺、质量控制与临床合理应用提供了基础。
基于UHPLC-QTOF/MSE结合代谢组学技术,对五味子生品以及炮制后的酒制品和醋制品中的化学成分进行识别分析,最终筛选并鉴定了12个具有显著差异的化学成分。在12个化合物中,除了新南五味子酸为三萜类化合物外,其余均为联苯环辛烯类成分。本实验研究结果表明,6-O-苯甲酰戈米辛O、五味子酯乙、五味子酯丙、五味子酯丁和新南五味子酸在炮制后含量均有一定程度的减少。原因可能是炮制过程中新南五味子酸不稳定,容易发生脱羧作用; 而五味子酯乙、酯丙、酯丁及6-O-苯甲酰戈米辛O的结构中均含有酯键,炮制过程中可能造成酯键水解断裂,从而导致含量减少。五味子甲素、乙素、丙素、戈米辛D及戈米辛T在酒制品中的含量明显大于生品组,原因可能是该类化合物在乙醇环境中溶解度更高,且炮制过程中不易破坏其结构。五味子酯甲在醋制品中含量较高,而五味子醇甲在醋制品中含量略高于生品,推测可能是因为酸性环境下该化合物结构更稳定,其机制尚需要进一步研究。本实验的结果与文献[12-14]报道基本一致,为五味子生品及其不同炮制品中主要差异性化学成分的筛选和鉴定提供了一种快速、可靠的方法,同时也从化学成分的角度证实了炮制能对五味子的功效产生影响,从而为五味子炮制品质量控制及临床应用提供依据。
| [1] | Sun XY, Sun FJ. Shennong Classic of Materia Medica (神农本草经)[M]. Beijing: Science and Technology Literature Press, 1996 : 36 . |
| [2] | Bureau of Drug Policy and Administration of People's Republic of China. Chinese Herbal Medicine Processing Standard (全国中药炮制规范)[M]. Beijing: People's Medical Publishing House, 1988 : 126 . |
| [3] | Zhou R, Gao Y, Zang P, et al. Effect of processing on active components and efficacy of traditional Chinese medicine[J]. Chin J Exp Tradit Med Form (中国实验方剂学) , 2015, 21 :209–212. |
| [4] | Lu TL, Yin FZ, He QX, et al. Effect of processing on phar-macological action of Fructus Schisandrae Chinensis[J]. J Chin Med Mater (中药材) , 2005, 29 :933–935. |
| [5] | Ge H, Jia T. Research on the phamacological effect of the crude and parched Schisanara chinensis Baill[J]. Liaoning J Tradit Chin Med (辽宁中医杂志) , 2007, 34 :636. |
| [6] | Deng C, Zheng J, Jiang Y, et al. The steaming Kadsura japonica with vinegar on distribution of lignans in liver of rat[J]. Chin Tradit Pat Med (中成药) , 2015, 37 :145–149. |
| [7] | Mao S. Preliminary exploration on essence of intrinsic change of Chinese medicines through preparation[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术 -中医药现代化) , 2003, 5 :59–82. |
| [8] | Yin FZ, Lu TL, Cai BC. Influence of processing on total lignans in fruit of Schisandrae chinensis[J]. Chin Tradit Herb Drugs (中草药) , 2009, 37 :1341–1344. |
| [9] | Gao H, Tong X, Pei QY, et al. Contents change of six kinds of lignans from Schisandrae Chiensis Fructus in processing by cinegar[J]. Chin J Exp Tradit Med Form (中国实验方剂学) , 2014, 20 :32–34. |
| [10] | Plumb RS, Johnson KA, Rainville P, et al. UPLC/MSE; a new approach for generating molecular fragment information for biomarker structure elucidation[J]. Rapid Commun Mass Spectrom , 2006, 20 :2800–2806. DOI:10.1002/(ISSN)1097-0231 |
| [11] | Xu N, Jia TZ, Zhou L. Study on materia medica processing by omics method[J]. World Sci Technol/Mod Tradit Chin Med Mater Med (世界科学技术 -中医药现代化) , 2010, 12 :553–557. |
| [12] | Pang SF, Zheng PH, Xu SQ. Influence of processing on lignans of Schisandra chinensis[J]. Chin Tradit Pat Med (中成药) , 2011, 33 :284–286. |
| [13] | Bai J. The influence of different processing procedures on contents of lignanoids in Schisandra chinensis[J]. J Beijing Union Univ (北京联合大学学报) , 2013, 27 :46–48. |
| [14] | Zhang LK. Studies on the Active Constituents and Their Determination of Schisandra chinensis in Raw and Processed Fruits (炮制对五味子中活性成分的影响及其测定方法的研究) [D]. Tianjin: Tianjin University, 2012. |
 2016, Vol. 51
2016, Vol. 51


