2. 中国医学科学院、北京协和医学院药用植物研究所, 中草药物质基础与资源利用教育部重点实验室, 北京 100193
2. Institute of Medicinal Plant Development, Key Laboratory of Bioactive Substances and Resources Utilization of Chinese Herbal Medicine, Ministry of Education, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
云实 [Caesalpinia decapetala (Roth) Alston] 又名“药王子”、“牛王刺”、“朝天子”、“倒挂刺”等,为豆科 (Fabaceae) 云实属植物 [1],生长于我国南部地区,平原地带常载培,常野生于山坡、岩旁、林边、河边或灌木丛中[2]。云实的果、茎皮含单宁,种子可榨油,根茎及果实供药用,具有清热除湿杀虫之功效,民间常用于治疗痢疾、疟疾、消渴、小儿疳积等疾病。目前,对云实化学成分的研究报道较少,仅见报道从中得到了黄酮和甾体类物质[3, 4]。为了寻找云实的活性成分,本课题组对云实种子进行了化学成分研究,从其乙醇提取物中分离得到4个卡山烷二萜类化合物,包括1个新化合物和3个已知化合物,分别鉴定为caesalpinin MQ (1)、neocaesalpin N (2)、caesalmin F (3) 和α-caesalpin (4)。其中化合物1为一新化合物,化合物2~4为首次从该植物中分离得到,结构见图 1。
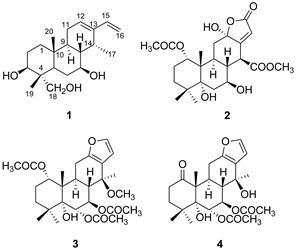
|
Figure 1 Structures of compounds 1−4 |
化合物1 白色粉末 (氯仿)。mp 421~422 ℃; [α]20 D+ 36.3 (c 0.10,MeOH); HR-ESI-MS m/z: 343.223 1 [M+Na]+ (计算值: 343.224 9),确定分子式为C20H32O3,不饱和度为5。UV末端吸收峰λmax (log ε): 207 (3.84) nm。红外光谱显示结构中存在羟基 (3 480 cm−1)、甲基 (2 944、2 876 cm−1)、双键 (1 635 cm−1) 等特征信号峰。
1H NMR谱 (表 1) 显示结构中存在3个甲基信号δH 0.98 (d,J = 7.2 Hz)、0.91 (s)、0.89 (s),2个连氧次甲基信号δH 3.62 (dd)、3.65 (dd),1个羟甲基信号δH 3.40 (d,J = 9.6 Hz)、3.69 (d,J = 9.6 Hz)。烯氢质子 δH 5.61 (t,J = 3.6 Hz) 提示结构中存在1个与亚甲基碳相连的双键,3个相互偶合的烯氢质子δH 6.22 (dd,J = 18.0,11.4 Hz)、4.92 (dd,J = 11.4,2.4 Hz)、5.13(dd,J = 18.0,2.4 Hz) 提示结构中存在乙烯基结构单元。13C NMR谱 (表 1) 共给出20个碳信号,包括 3个甲基碳、6个亚甲基碳 (1个羟甲基碳δC 70.9、 1个烯碳δC 110.3)、8个次甲基碳 (2个连氧碳δC 71.8、76.2,2个烯碳δC 127.9、138.6) 和3个季碳 (1个烯碳δC 141.1)。上述碳数目,说明化合物1为典型的二萜结构类型,结合关键碳信号包括3个甲基碳信号δC 11.9、14.3、14.8和4个烯碳信号,推断该二萜的基本骨架为三环类卡山烷型二萜[5-7]。
| Table 1 NMR data (600 MHz,in CDCl3) for compound 1 |
1H-1H COSY显示 (图 2) H-1/H-2/H-3存在相关; H-5/H-6/H-7/H-8/H-9/H-11/H-12存在相关; H-8/H-14/ H-17存在相关,提示该二萜的A环和B环通过C-5/10相连,B环和C环通过C-8/9相连。HMBC谱中发现,δH 5.61 (t,J = 3.6 Hz,H-12) 与δC 27.1 (C-11)、141.1 (C-13) 存在远程相关,δH 6.22 (dd,J = 18.0,11.4 Hz,H-15) 与δC 141.1 (C-13)、110.3 (C-16) 存在远程相关,说明乙烯基与双键C-12/C-13通过C-13相连。该结果证实了上述推断,说明化合物1为三环类卡山烷类二萜。进一步分析HMBC谱显示 (图 2),δH 3.65 (dd,H-3) 与δC 25.3 (C-2)、42.2 (C-4) 存在远程相关,δH 3.62 (dd,H-7) 与δC 31.3 (C-6)、42.9 (C-8) 存在远程相关,结合HR-ESI-MS提供的分子式,判定C-3和C-7位分别存在羟基取代。羟甲基信号δH 3.40 (d,J = 9.6 Hz)、3.69 (d,J = 9.6 Hz)与C-4 (δC 42.2) 和C-19 (δC 11.9) 存在HMBC相关,提示C-18位甲基被氧化形成羟甲基。卡山烷类二萜为云实属植物的特征性成分,目前所得此类二萜中H-5、H-9均为α构型,H-8、H3-20为β构型[8-10],因此基于生物合成途径的考虑,化合物1应具有同样的母核立体构型。化合物1取代基的立体构型由NOESY谱确定。在NOE谱中,H-3与H-5,H-7和H-9分别存在增益,说明OH-3和OH-7均处于β构型,另外H3-17和H-9存在相关,H3-19和H3-20,H3-20和H-8存在相关,提示H3-17处于α位,H3-19和H3-20处于β位。综上所述,将化合物1的结构确定为caesalpinin MQ,该化合物为一新卡山烷二萜类化合物。
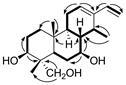
|
Figure 2 Key 1H-1H COSY (Bold bonds) and HMBC (Arrows) correlations of compound 1 |
Bruker Avance Ⅲ 600型核磁共振波谱仪,赛默飞世尔LTQ-Obitrap XL液质联用仪,BYLABUV-Ⅲ紫外灯 (北京炳洋科技有限公司),柱色谱用硅胶 (青岛海洋化工有限公司),薄层色谱用硅胶G、H、GF-254和柱色谱用硅胶 (青岛海洋化工有限公司),Sephadex LH-20凝胶为Pharmacia公司产品,MCI为日本三菱化学公司产品,常规试剂均为分析纯。
云实种子采于广西南宁市,经吉首大学植物资源保护与利用湖南省高校重点实验室陈功锡教授鉴定为云实Caesalpinia decapetala的干燥种子,标本现保存于湖南吉首大学,标本号为No. JIU.WU20130912。
1 提取与分离云实种子 (1.0 kg) 干燥后粉碎过80目筛,药材粉末加10倍量乙醇加热回流提取3次,每次2 h,合并提取液,减压回收溶剂,浓缩后得总浸膏62.0 g。云实种子总浸膏经100~200目硅胶拌样,依次用石油醚、氯仿、乙酸乙酯、丙酮和甲醇洗脱,洗脱液减压浓缩至干。最终得到石油醚部位浸膏12.6 g,氯仿部位浸膏8.7 g,乙酸乙酯部位浸膏6.3 g,丙酮部位浸膏5.9 g,甲醇部位浸膏17.4 g。
取氯仿层浸膏8.7 g经硅胶柱色谱 (100~200目) 分离,氯仿−甲醇 (1∶0~0∶1) 梯度洗脱,得到9个馏分 Fr A~I。其中馏分Fr H (氯仿−甲醇60∶1) 经Sephadex LH-20柱色谱洗脱,除去色素类物质,进一步经ODS中压色谱柱依次用30%、50%、60%、70%、80%、90% 甲醇洗脱。60%、70%、80% 洗脱液经高效液相色谱分离纯化,流动相为甲醇−水 (62∶38),流速2 mL·min−1,检测波长210 nm,得到化合物1(3.5 mg)、2 (7.1 mg)、3 (6.8 mg)、4 (5.4 mg)。
2 结构鉴定化合物1 白色粉末 (氯仿)。mp 421~422 ℃; [α]20 D+ 36.3 (c 0.10,MeOH); HR-ESI-MS m/z: 343.223 1 [M+Na]+ (计算值: 343.224 9),确定分子式为C20H32O3,不饱和度为5。UV末端吸收峰λmax (log ε): 207 (3.84) nm。红外光谱显示结构中存在羟基 (3 480 cm−1)、甲基 (2 944、2 876 cm−1)、双键 (1 635 cm−1) 等特征信号峰。NMR数据见表 1。
化合物2 白色粉末 (氯仿); mp 182~183 ℃; [α]20 D−5.2 (c 0.20,MeOH)。ESI-MS m/z: 475 [M+Na]+。1H NMR (600 MHz,CDCl3) δH: 1.05 (3H,s,H-18),1.07 (3H,s,H-19),1.10 (3H,s,H-20),2.14 (3H,s,OCOCH3-1),4.06 (1H,m,H-7),4.90 (1H,t,J = 1.8 Hz,H-1),5.71 (1H,s,H-15); 13C NMR (150 MHz,CDCl3) δC: 75.1 (C-1),22.9 (C-2),30.1 (C-3),38.5 (C-4),78.9 (C-5),36.6 (C-6),71.8 (C-7),48.2 (C-8),36.2 (C-9),43.6 (C-10),19.4 (C-11),104.8 (C-12),165.9 (C-13),49.1 (C-14),114.7 (C-15),170.4 (C-16),172.9 (C-17),28.1 (C-18),24.8 (C-19),17.1 (C-20),21.5/172.9 (OCOCH3-1),52.7 (OCH3-17)。以上数据与文献[11]报道一致,故鉴定化合物2为neocaesalpin N。
化合物3 白色粉末 (氯仿); mp 173~174 ℃; [α]20 D+27.2 (c 0.22,MeOH)。ESI-MS m/z: 529 [M+Na]+。1H NMR (600 MHz,CDCl3) δH: 1.14 (3H,s,H-19),1.15 (3H,s,H-18),1.28 (3H,s,H-20),1.49 (3H,s,H-17),1.98 (3H,s,OCOCH3-6),2.06 (3H,s,OCOCH3-1),2.08 (3H,s,OCOCH3-7),3.01 (3H,s,OCH3-14),4.86 (1H,t,J = 1.8 Hz,H-1),5.44 (1H,d,J = 8.4 Hz,H-6),5.75 (1H,t,J = 8.4 Hz,H-7),6.23 (1H,d,J = 2.4 Hz,H-16),7.23 (1H,d,J = 2.4 Hz,H-17); 13C NMR (150 MHz,CDCl3) δC: 73.7 (C-1),22.8 (C-2),32.3 (C-3),38.5 (C-4),79.1 (C-5),75.7 (C-6),76.3 (C-7),39.4 (C-8),36.4 (C-9),45.1 (C-10),22.3 (C-11),151.0 (C-12),121.8 (C-13),78.8 (C-14),107.8 (C-15),142.3 (C-16),24.3 (C-17),30.2 (C-18),24.8 (C-19),17.1 (C-20),20.2/170.9 (OCOCH3-1),20.4/171.3 (OCOCH3-6),20.8/ 171.2 (OCOCH3-7),50.1 (OCH3-14)。以上数据与文 献[12]报道一致,故鉴定化合物3为caesalmin F。
化合物4 白色粉末 (氯仿); mp 186~187 ℃; [α]20 D+31.8 (c 0.10,MeOH)。ESI-MS m/z: 471 [M+Na]+。1H NMR (600 MHz,CDCl3) δH: 1.10 (3H,s,H-19),1.28 (3H,s,H-18),1.44 (3H,s,H-20),1.48 (3H,s,H-17),1.95 (3H,s,OCOCH3-6),2.04 (3H,s,OCOCH3-7),5.50 (1H,d,J = 7.8 Hz,H-6),5.54 (1H,t,J = 8.4 Hz,H-7),6.31 (1H,d,J = 2.4 Hz,H-16),7.18 (1H,d,J = 2.4 Hz,H-17); 13C NMR (150 MHz,CDCl3) δC: 211.9 (C-1),35.3 (C-2),39.5 (C-3),38.9 (C-4),82.9 (C-5),74.9 (C-6),73.2 (C-7),48.1 (C-8),36.9 (C-9),55.2 (C-10),25.3 (C-11),149.2 (C-12),124.5 (C-13),72.9 (C-14),107.3 (C-15),141.6 (C-16),24.6 (C-17),29.1 (C-18),25.7 (C-19),16.5 (C-20),21.4/170.9 (OCOCH3-6),21.5/ 169.9 (OCOCH3-7)。以上数据与文献[13]报道一致,故鉴定化合物4为α-caesalpin。
| [1] | Wei XH. Advances on chemical constituents and bioactivities of Caesalpinia decapetala (Roth) Alston[J]. Guangzhou Chem Ind (广州化工) , 2012, 40 :25–27. |
| [2] | Nanjing University of Chinese Medicine. The Dictionary of Chinese Herbal Medicine (中药大辞典)[M]. Shanghai: Shanghai Science and Technology Press, 2005 : 695 . |
| [3] | Zhang Q, Liu XT, Liang JY, et al. The chemical constituents of Caesalpinia decapetala (Roth) Alston[J]. Chin J Nat Med , 2008, 6 :168–172. DOI:10.3724/SP.J.1009.2008.00168 |
| [4] | Li MX, Jia ZP, Zhang CZ, et al. The chemical constituents of Caesalpinia decapetala (Roth) Alston (II)[J]. Chin Tradit Herb Drugs (中草药) , 2004, 35 :741–742. |
| [5] | Koga J, Shimura M, Oshima K, et al. Phytocassanes A, B, C and D, novel diterpene phytoalexins from rice, Oryza sativa L[J]. Tetrahedron , 1995, 51 :7907–7918. DOI:10.1016/0040-4020(95)00423-6 |
| [6] | Chen S, Zhang Y, Niu S, et al. Cytotoxic cleistanthane and cassane diterpenoids from the entomogenous fungus Paraco-niothyrium hawaiiense[J]. J Nat Prod , 2014, 77 :1513–1518. DOI:10.1021/np500302e |
| [7] | Gómez-Hurtado MA, Álvarez-Esquivel FE, Rodríguez-Garcían G, et al. Cassane diterpenes from Caesalpinia platyloba[J]. Phytochemistry , 2013, 96 :397–403. DOI:10.1016/j.phytochem.2013.09.028 |
| [8] | Yang ZY, Yin YH, Lu LH. Five new cassane-type diterpenes from Caesalpinia crista[J]. Helv Chim Acta , 2009, 92 :121–126. DOI:10.1002/hlca.v92:1 |
| [9] | Yodsaou O, Karalai C, Ponglimanont C, et al. Pulcherrins D-R, potential anti-inflammatory diterpenoids from the roots of Caesalpinia pulcherrima[J]. Tetrahedron , 2011, 67 :6838–6846. DOI:10.1016/j.tet.2011.06.087 |
| [10] | Zhao P, Chen H, Wang H, et al. Four new cassane diterpenes from the seeds of Caesalpinia minax[J]. Phytochem Lett , 2013, 6 :606–609. DOI:10.1016/j.phytol.2013.07.013 |
| [11] | Li DM, Ma L, Liu GM, et al. Cassane diterpene-lactones from the seed of Caesalpinia minax Hance[J]. Chem Biodi-vers , 2006, 3 :1260–1265. DOI:10.1002/(ISSN)1612-1880 |
| [12] | Jiang RW, Ma SC, But PPH, et al. New antiviral cassane furanoditerpenes from Caesalpinia minax[J]. J Nat Prod , 2001, 64 :1266–1272. DOI:10.1021/np010174+ |
| [13] | Pudhom K, Sommit D, Suwankitti N, et al. Cassane furano-diterpenoids from the seed Kernels of Caesalpinia bonduc from Thailand[J]. J Nat Prod , 2007, 70 :1542–1544. DOI:10.1021/np070330y |
 2016, Vol. 51
2016, Vol. 51


