2. 上海中医药大学附属曙光医院肝病研究所, 上海 201203
2. Institute of Liver Diseases, Shuguang Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
慢性乙型肝炎 (HBV) 由乙肝病毒引起,全世界感染乙肝病毒的患者有20亿之多,其中慢性感染的患者占3.5亿[1]。目前,已有数种抗病毒药物被应用于治疗慢性乙型肝炎病毒,其中包括拉米夫定、阿德福韦、替诺福韦以及替比夫定等[2,3]。恩替卡韦 (ETV) 是一种能有效抑制HBV复制的鸟嘌呤核苷类似物,是高效选择性HBV多聚酶抑制剂。临床用恩替卡韦治疗病毒复制活跃、血清丙氨酸氨基转移酶 (ALT) 持续升高的慢性乙型肝炎,疗效显著[4,5]。但核苷类药物需要长期服用,同时有可能出现耐药和停药后病毒反弹现象,而这种病毒反弹造成的免疫性肝损伤往往非常严重,特别是对于本身肝脏代偿能力低下的肝硬化患者,停药所带来的后果可能是致命性的[6-9]。由于这些原因,核苷类药物在临床应用时存在很大的局限性。
传统中药被广泛应用于治疗慢性肝炎与肝硬化的历史长达数千年之久[10-12]。黄芪汤出自《太平惠民和剂局方》,重用黄芪为君,黄芪甘草之比为6∶1,故又名黄芪六一汤[13]。近年来对黄芪汤及其组分抗肝纤维化的研究表明,黄芪汤能提高二甲基亚硝胺肝 (DMN) 纤维化大鼠肝组织总超氧化物歧化酶 (SOD) 活性[14],抑制肝星状细胞活化,可以提高肝组织重组人肝细胞生长因子 (HGF) 蛋白表达,减轻肝窦内皮细胞损伤,促进活化的肝星状细胞凋亡、起到抗肝纤维化的作用。并且黄芪对乙型肝炎病毒表面抗原阳性转阴也有一定作用[15-17]。此外,文献[18]报道恩替卡韦与黄芪口服液联合治疗HBV有效且不良反应发生率降低,上海中医药大学附属曙光医院将黄芪汤和恩替卡韦合用治疗乙肝肝硬化患者,具有良好的协同效应。到目前为止,未见黄芪汤对恩替卡韦药动学影响的研究报道。本文建立一种快速灵敏的超高效液相色谱-线性离子阱-静电场轨道阱组合质谱法 (UHPLC-LTQ-Orbitrap) 测定大鼠血浆恩替卡韦浓度,并探索恩替卡韦与黄芪汤联合用药后对恩替卡韦药动学影响的规律,为临床制定合理的恩替卡韦和黄芪汤联合用药方案提供实验基础。
材料与方法仪器 美国Thermo Dionex Ultimate 3000超高效液相色谱仪,包括在线脱气机,四元高压泵,自动进样器和柱温箱; 美国Thermo LTQ-Orbitrap elite高分辨质谱仪,配有ESI电喷雾离子源。
药品与试剂 恩替卡韦对照品 (上海凯试科技有限公司,批号: 20140510,含量: 99.65%); 阿昔洛韦对照品 (中国食品药品检定研究院,批号: 9CDJ- NAE4,含量: 99.8%); 恩替卡韦分散片 (江苏正大天晴药业股份有限公司,规格0.5 mg/片); 黄芪汤颗粒 (江阴天江药业有限公司,每1.2 g粉末相当于6 g黄芪饮片和1 g甘草饮片,批号: 1212353); 乙腈(色谱纯,美国Honeywell公司); 乙酸铵 (色谱级,美国Sigma-Aldrich公司); 乙酸 (色谱级,美国Tedia公司); 胰蛋白酶 (上海Bioshapp公司); 胃蛋白酶 (上海Bioshapp公司) 超纯水经Milli-Q系统纯化制备。其他化学试剂均为分析纯。
实验动物 SD大鼠40只,雌雄各半,体重200 ± 20 g,购自上海斯莱克实验动物有限责任公司,合格证号: SCXK 2012-0002,饲养于12 h昼夜交替的环境控制室中,温度22 ± 2 ℃,湿度60% ± 5%。适应性饲养一周。给药前禁食12 h,自由饮水。
色谱条件 色谱柱: Acquity UPLC® BEH Amide (100 mm × 2.1 mm ID,1.7 μm,Waters公司),流动相为5 mmol·L-1乙酸铵水溶液 (含0.05% 乙酸,A)-乙腈 (B),采用梯度洗脱方式,梯度洗脱程序如下: 0.1~2 min,10% A等度洗脱; 2~5 min,10%~25% A; 5~7 min,25% A等度洗脱,7~8 min,25%~50% A; 8~8.5 min,50% A等度洗脱; 8.5~8.6 min: 50%~10% A; 8.6~10.5 min: 10% A等度洗脱。流速: 0.3 mL·min-1; 柱温: 35 ℃; 进样量: 10 μL。
质谱条件 电喷雾离子源 (ESI源); 喷雾电压为3.5 kV; 离子源雾化温度: 350 ℃; 鞘气和辅助气: 40和5 psi (1 psi ≈ 6.9 kPa); 离子检测方式为选择离子检测 (SRM),正离子检测模式; 待测物的检测离子对为: 恩替卡韦,m/z 278.1→152.1 (碰撞能量35 V); 阿昔洛韦,m/z 226.1→152.1 (碰撞能量32 V)。
系列样品和质控样品的制备 精密称取恩替卡韦和阿昔洛韦内标对照品适量,分别以甲醇配制得质量浓度约为1.00 mg·mL-1的储备液,以大鼠空白血浆稀释恩替卡韦储备液,获得对照系列样品和质量控制 (QC) 样品。恩替卡韦对照系列样品质量浓度分别为0.100、0.200、0.500、2.00、5.00、10.0、15.0和20.0 ng·mL-1。恩替卡韦QC样品的血浆质量浓度分别为0.100 ng·mL-1 (定量下限)、0.200 ng·mL-1 (低浓度)、2.00 ng·mL-1 (中浓度) 和15.0 ng·mL-1 (高浓度)。将阿昔洛韦溶液加入甲醇逐级稀释得100 ng·mL-1 的内标对照品溶液,所有对照品溶液置于-20 ℃保 存待用。
血浆样品的预处理 取血浆样品50.0 μL,置1.5 mL离心管中,加入乙腈溶液250 μL (含内标阿昔洛韦10.0 ng·mL-1),涡流混合1 min,17 000 r·min-1高速离心10 min,吸取上清液10 μL进样分析。
方法学考察选择性 分别取6个不同来源的大鼠空白血浆样品以及相应空白血浆配制的LLOQ (0.100 ng·mL-1) 样品,除不加内标外,其余按“血浆样品的预处理”项下操作,进行UHPLC-LTQ-Orbitrap分析,得空白血浆色谱图、空白血浆加各对照品色谱图。取大鼠给药后收集的血浆样品,同法操作,得大鼠给药后血浆色谱图。
标准曲线与定量下限 分别取恩替卡韦对照系列样品,按“血浆样品的预处理”项下操作,以每个待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,用加权 (W = 1/x2) 最小二乘法进行回归运算,求得直线回归方程即为标准曲线。
精密度与准确度 取低、中、高3个浓度 (恩替卡韦血浆样品质量浓度分别为0.200、2.00和15.0 ng·mL-1) 的质控样品,按“血浆样品预处理”项下操作,每一浓度进行5样本分析,测定3个分析批。根据当日的标准曲线,计算QC样品的测得浓度,根据QC样品结果计算准确度 (RE) 与精密度 (RSD)。
回收率 取低、中、高3个浓度质控样品按“血浆样品预处理”项下操作,每一浓度进行6样本分析。同时另取大鼠空白血浆50.0 μL,除不加内标溶液外,按“血浆样品预处理”项下操作,取全部上清液,加入相应浓度对照质控溶液和内标溶液,涡流混匀后进样分析。以每一浓度两种处理方法的峰面积比计算处理回收率。
基质效应 取6个大鼠空白血浆50 μL,除不加内标溶液外,按“血浆样品的预处理”项下操作,取全部上清液,加入相应浓度对照质控溶液和内标溶液,涡流混匀后进样分析。同时另取50 μL水代替空白血浆,按上述处理。以两种处理方法的峰面积比值计算基质效应。
稳定性 考察了恩替卡韦低、中、高3个浓度的血浆样品在室温放置8 h,自动进样器放置24 h,血浆样品经历3次冷冻-解冻循环和血浆样品-80 ℃放置30天的稳定性。按“血浆样品预处理”方法操作,进样分析,求得RSD和RE。
药动学给药方案 36只SD大鼠随机分成6组,有单次、多次给药,再分别分为单用恩替卡韦组 (ETV组)、恩替卡韦与黄芪汤同时给药组 (ETV-HQD组) 和灌服恩替卡韦2 h后再给药黄芪汤组 (ETV- HQD-2h组) ,每组6只。多次给药组中大鼠在末次给药前连续给药7天,每天灌胃给药一次,末次给药与前一次相隔24 h。恩替卡韦给药剂量为60 μg·kg-1,黄芪汤给药剂量为1.2 g·kg-1 (采用人与动物的体表面积计算法折算后所得,以黄芪汤颗粒配制,每1.2 g粉末相当于6 g黄芪饮片和1 g甘草饮片),给药体积均为10 mL·kg-1。给药后0、0.083、0.25、0.5、1、1.5、2、4、6、8、12、24、36、48和72 h经眼球后静脉丛取血约150 μL,肝素抗凝,4 ℃下4 000 r·min-1离心分离血浆,冻存于-80 ℃冰箱待测。
黄芪汤对恩替卡韦体外吸收人工胃液、肠液实验 考察人工胃液、肠液中黄芪汤对恩替卡韦浓度的影响。人工胃液、肠液根据2010版药典配制[19],将恩替卡韦以含黄芪汤或不含黄芪汤的人工胃液、人工肠液分别稀释 (依据大鼠灌胃给药后胃肠道中估算的浓度,设定恩替卡韦质量浓度为0.5 μg·mL-1,黄芪汤质量浓度为5、10和20 mg·mL-1),37 ℃水浴孵育1 h,测定恩替卡韦在各组中浓度差异。
外翻肠囊实验 依据实验室已发表文献[20]进行。4只大鼠实验前12 h禁食,自由饮水。实验时用20% 乌拉坦腹腔麻醉 (5 μL·g-1),分别取十二指肠、空肠上段、空肠下段和回肠各10 cm,放入37 ℃ Tyrode液中,冲洗肠管,剥离肠段表面的肠系膜和脂肪。实验采用4×4拉丁方设计[21],考察不同浓度黄芪汤、不同肠段以及不同大鼠对恩替卡韦吸收的影响。将肠管 一端结扎于自制塑料套管,小心将肠管翻转,用37 ℃ Tyrode液冲洗后结扎另一端,使之形成囊状肠管。向肠囊内注入空白Tyrode液2 mL,将其放入含黄芪汤药液或不含黄芪汤的恩替卡韦药液15 mL (恩替卡韦质量浓度分别为0.5 μg·mL-1,黄芪汤浓度为5、10和20 mg·mL-1),实验过程中保持37 ℃恒温,并向药液中通入95% O2/5% CO2。分别于给药后0、0.25、0.5、0.75和1 h从肠囊内取样200 μL,同时补足相同体积的空白Tyrode液。检测恩替卡韦在不同组中含量,考察黄芪汤对恩替卡韦大鼠小肠吸收影响。
样品前处理 取体外样品50.0 μL,置1.5 mL离心管中,加入乙腈溶液250 μL (含内标阿昔洛韦10.0 ng·mL-1),涡流混合1 min,17 000 r·min-1高速离心 10 min,吸取上清10 μL进样分析。
统计学分析 采用WinNonlin 6.1软件以非房室模型法计算药动学参数。统计分析经SPSS 18.0计算,其中Cmax、AUC0-t先进行对数转换,然后进行单因素方差分析,再以LSD检验进行两两比较,其余参数进行Mann-Whitney test非参数检验分析,当P < 0.05时认为存在显著性差异。体外吸收环节中,人工胃液、肠液实验采用独立样本t检验分析,外翻肠囊实验采用拉丁方多因素方差分析,当P < 0.05时认为存在显著性差异。
结果 1 方法学考察 1.1 选择性与空白对照对比,空白血浆中的内源性物质不干扰恩替卡韦 (保留时间3.9 min) 及内标 (保留时间3.6 min) 的测定。空白血浆色谱图、空白血浆加各对照品色谱图和给药后血浆色谱图见图 1。
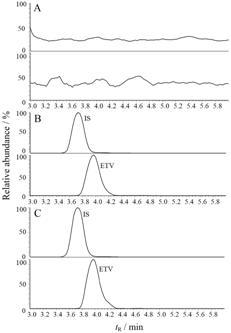
|
Figure 1 Typical SRM chromatograms of acyclovir (IS) and entecavir (ETV). A: Blank rat plasma; B: Blank plasma spiked with reference compounds (0.100 ng·mL-1); C: plasma sample 1.5 h after oral administration of ETV in rats |
恩替卡韦的线性范围为0.100~20.0ng·mL-1,回归方程为: y = 0.132 3 x + 0.016 6 (r = 0.996 4),结果表明,恩替卡韦线性关系良好,定量下限为0.100 ng·mL-1。
1.3 精密度与准确度恩替卡韦低、中、高3种浓度下样品的批内精密度 (RSD) 分别为3.6%、2.9% 和2.0%,批间精密度分别为3.9%、3.6% 和2.9%,准确度 (RE) 在96.8%~109.0% 之间。恩替卡韦低、中、高质控样品的批内、批间精密度和准确度均符合生物样品测定相关要求。
1.4 回收率恩替卡韦低、中、高3种浓度下样品的提取回收率分别为89.4%、91.0% 和92.4%。内标阿昔洛韦同法处理,提取回收率为91.3%。待测物及内标回收率的RSD均小于3.9%,提取回收率重现性好。
1.5 基质效应恩替卡韦低、中、高3个浓度经内标校正的基质效应分别为90.8%、92.5% 和106.0%,RSD均小于5.5%。因此,在本实验选择的色谱和质谱条件下,可忽略基质效应对恩替卡韦测定的影响。
1.6 稳定性大鼠血浆样品室温放置8 h,准确度在101.0%~105.3% 之间; 自动进样器放置24 h,准确度在100.1%~103.2% 之间; 血浆样品经历3次冷冻-解冻循环,准确度在100.2%~104.0% 之间; 血浆样品 -80 ℃放置30天,准确度在100.7%~103.3% 之间。在上述条件下,恩替卡韦血浆样品均稳定。
2 黄芪汤对恩替卡韦大鼠药动学的影响恩替卡韦单、多次给药后的血浆药物浓度-时间曲线见图 2。ETV-HQD组中恩替卡韦血浆浓度在 0~2 h内比其他两组低,但ETV组和ETV-HQD-2h组中恩替卡韦血浆药物浓度-时间曲线趋向于一致。恩替卡韦药动学参数见表 1。单次给药中,与ETV组相比,ETV-HQD组中Cmax降低,tmax延长,AUC0-t减少。ETV-HQD-2h组中黄芪汤与恩替卡韦间隔2 h给药对恩替卡韦药动学行为无显著性影响。多次给药中,与ETV组相比,ETV-HQD组中恩替卡韦Cmax降低,tmax延长,ETV-HQD-2h组中恩替卡韦药动学参数无显著性变化。
| Table 1 Effect of Huangqi decoction (HQD) on pharmacokinetic parameters of ETV after single-dose administration or 7-day-dose administration. ETV-HQD: Intragastric (i.g.) administration of ETV and HQD simultaneously; ETV-HQD-2h: HQD administered i.g. 2 h after ETV; P < 0.05 vs ETV after single-dose administration,△P < 0.05 vs ETV after 7-day-dose administration. Cmax and AUC0-twere performed by ANOVA,other parameters were performed by non-parametric test |
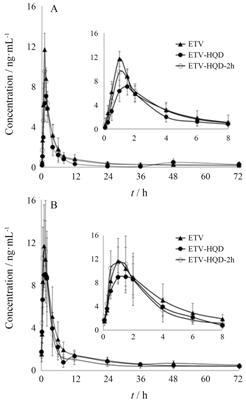
|
Figure 2 Plasma concentration-time curves of ETV after (A) single- and (B) 7-day-dose combined with HQD. n = 6,x± s |
体外实验中,人工胃液、肠液及Tyrode液中恩 替卡韦含量测定方法学验证均符合生物样本分析要求。在人工胃液、肠液实验中,黄芪汤对恩替卡韦浓度无显著性影响 (P > 0.05)。外翻肠囊实验中,不同肠段、不同大鼠对恩替卡韦浓度无显著性影响 (P > 0.05)。不同浓度黄芪汤对恩替卡韦吸收有显著性影响 (P < 0.05),不同浓度黄芪汤组中恩替卡韦0~1 h累计吸收量-时间曲线及1 h累计吸收总量如图 3所示,恩替卡韦的吸收减少与黄芪汤浓度呈浓度依赖性 (r = -0.837,P < 0.01)。
讨论本文建立测定大鼠血浆中恩替卡韦浓度的UHPLC- LTQ-Orbitrap的分析方法,并将所建的方法应用于黄汤对恩替卡韦药动学研究。与文献[22]中所用的固相萃取前处理方法相比,本文建立了简单、灵敏、快速、经济的蛋白沉淀前处理法。方法学研究表明此方法能除去大部分内源性物质,获得较高的回收率,基质效应研究符合生物样本分析要求。恩替卡韦是极性较强的小分子化合物,普通的反相色谱条件并不能满足其测定要求,故本文采用亲水性色谱柱,适用于血浆中恩替卡韦的测定。
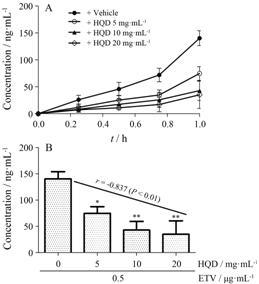
|
Figure 3 The ETV accumulative concentration-time curves in 0-1 h (A) and the correlation analysis of ETV accumulative concentration during 0-1 h with concentrations of HQD (B) in everted intestinal sac assay (the statistical analyses were performed using linear correlation). Added concentration of ETV: 0.5 μg·mL-1. P < 0.05,**P < 0.01 vs 0 mg·mL-1 HQD |
在药动学研究中发现,同时给药黄芪汤降低了恩替卡韦的Cmax和AUC0-t ,提示黄芪汤对恩替卡韦药动学的影响可能在吸收环节。因此,进一步利用人工胃液、肠液实验和外翻肠囊实验考察其吸收环节 的影响。人工胃液、肠液实验中,黄芪汤对恩替卡韦浓度无显著性影响,提示两者无物理化学方面的相互影响。外翻肠囊实验中,黄芪汤阻碍了恩替卡韦在小肠黏膜表面的吸收,进而减少恩替卡韦在大鼠体内的吸收。有文献[23-25]报道了食物对恩替卡韦药动学行为存在相同的影响,推测可能是食物与药物发生共沉淀,或是食物增加小肠黏度而影响恩替卡韦的扩散等,本文采用外翻肠囊法验证了黄芪汤对恩替卡韦吸收影响的环节。文献报道,恩替卡韦为有机阴离子转运体(OAT1、OAT3) 和有机阳离子转运体 (OCT) 的底物[26],黄芪汤中芒柄花素等成分也由OAT介导小肠转运[27]。本文研究结果发现,黄芪汤与恩替卡韦间隔2 h给药对恩替卡韦药动学行为无显著性影响,可能因同时给药时黄芪汤占据吸收位点从而抑制了恩替卡韦的吸收,间隔2 h给药避免了竞争性关系,但其影响机制还需进一步研究。
| [1] | Di Bisceglie AM. Hepatitis B and hepatocellular carcinoma[J]. Hepatology , 2009, 49 (5 Suppl) :S56–S60. |
| [2] | Shamliyan TA, MacDonald R, Shaukat A, et al. Antiviral therapy for adults with chronic hepatitis B: a systematic review for a National Institutes of Health Consensus Development Conference[J]. Ann Intern Med , 2009, 150 :111–124. DOI:10.7326/0003-4819-150-2-200901200-00101 |
| [3] | Zoulim F, Carosi G, Greenbloom S, et al. Quantification of HBsAg in nucleos(t)ide-naive patients treated for chronic hepatitis B with entecavir with or without tenofovir in the BE-LOW study[J]. J Hepatol , 2015, 62 :56–63. DOI:10.1016/j.jhep.2014.08.031 |
| [4] | Zheng MH, Shi KQ, Dai ZJ, et al. A 24-week, parallel-group, open-label, randomized clinical trial comparing the early antiviral efficacy of telbivudine and entecavir in the treatment of hepatitis B e antigen-positive chronic hepatitis B virus infection in adult Chinese patients[J]. Clin Ther , 2010, 32 :649–658. DOI:10.1016/j.clinthera.2010.04.001 |
| [5] | Huang ZB, Zhao SS, Huang Y, et al. Comparison of the efficacy of lamivudine plus adefovir versus entecavir in the treatment of lamivudine-resistant chronic hepatitis B: a systematic review and meta-analysis[J]. Clin Ther , 2013, 35 :1997–2006. DOI:10.1016/j.clinthera.2013.10.002 |
| [6] | Yan JH, Bifano M, Olsen S, et al. Entecavir pharmacokinetics, safety, and tolerability after multiple ascending doses in healthy subjects[J]. J Clin Pharmacol , 2006, 46 :1250–1258. DOI:10.1177/0091270006293304 |
| [7] | Zhu YC, Gao YJ, Yan JW. Severe hepatitis resulted from inappropriate use of nucleoside drugs[J]. J Clini Hepatol (临床肝胆病杂志) , 2010, 26 :596–597. |
| [8] | Zhuang H, Wen XH. Discussion of discontinuation of nucleoside and nucleoside analogs in the treatment of chronic hepatitis B[J]. Chin J Viral Dis (中国病毒病杂志) , 2013, 3 :241–244. |
| [9] | Ahn SH, Chun JY, Shin SK, et al. Performance evaluation of the HepB typer-entecavir kit for detection of entecavir resistance mutations in chronic hepatitis B[J]. Clin Molr Hepatol , 2013, 19 :399–408. DOI:10.3350/cmh.2013.19.4.399 |
| [10] | Chen SR, Chen XP, Lu JJ, et al. Potent natural products and herbal medicines for treating liver fibrosis[J]. Chin Med , 2015, 10 :1–13. DOI:10.1186/s13020-015-0029-x |
| [11] | Li Y, Wang L, Su C, et al. Clinical observation on the treatment of chronic severe hepatitis B by retention enema with Huchang Jiedu Decoction[J]. Chin J Integr Med , 2010, 16 :348–352. DOI:10.1007/s11655-010-0519-8 |
| [12] | Qi FH, Wang ZX, Cai PP, et al. Traditional Chinese medicine and related active compounds: a review of their role on hepatitis B virus infection[J]. Drug Discov Ther , 2013, 7 :212–224. |
| [13] | Luo HL, Zhong J, Ye FY, et al. A systematic quality control method of Huangqi decoction: simultaneous determination of eleven flavonoids and seven triterpenoid saponins by UHPLC-MS[J]. Anal Methods , 2014, 6 :4593–4601. DOI:10.1039/c4ay00193a |
| [14] | Liu C, Wang GQ, Chen GF, et al. Huangqi decoction inhibits apoptosis and fibrosis, but promotes Kupffer cell activation in dimethylnitrosamine-induced rat liver fibrosis[J]. BMC Complement Altern Med , 2012, 12 :51. |
| [15] | Takei H, Baba Y, Hisatsune A, et al. Glycyrrhizin inhibits interleukin-8 production and nuclear factor-κB activity in lung epithelial cells, but not through glucocorticoid receptors[J]. J Pharmacol Sci , 2008, 106 :460–468. DOI:10.1254/jphs.FP0072378 |
| [16] | Yoshida T, Abe K, Ikeda T, et al. Inhibitory effect of glycyrrhizin on lipopolysaccharide and D-galactosamine- induced mouse liver injury[J]. Eur J Pharmacol , 2007, 576 :136–142. DOI:10.1016/j.ejphar.2007.08.012 |
| [17] | Zhan T, Wei X, Chen ZQ, et al. A systematic review of RCTs and quasi-RCTs on traditional Chinese patent medicines for treatment of chronic hepatitis B[J]. J Tradit Chin Med , 2011, 31 :288–296. DOI:10.1016/S0254-6272(12)60006-5 |
| [18] | Ma Z. The clinical observation of entecavir combined astragalus oral liquid on treatment of chronic hepatitis B[J]. J Chin Prescr Drug (中国处方药) , 2015, 13 :58–59. |
| [19] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典). Beijing: China Medical Science Press[M]. 2010 . |
| [20] | Yan DM, Ma BL, Shi R, et al. Involvement of herb-herb interactions in the influences of Radix Scutellaria and Coptis Chinensis on the bioavailability of the anthraquinones form Rhei Rhizoma in rats[J]. Eur J Drug Metab Pharmacokinet , 2015, 40 :103–110. DOI:10.1007/s13318-014-0188-7 |
| [21] | Gressley TF, Davison KA, Macies J. Effect of abomasal carbohydrates and live yeast on measures of postruminal fermentation[J]. J Anim Sci , 2016, 94 :284–296. DOI:10.2527/jas.2015-9324 |
| [22] | Zhao FJ, Tang H, Zhang QH, et al. Salting-out homogeneous liquid-liquid extraction approach applied in sample pre-processing for the quantitative determination of entecavir in human plasma by LC-MS[J]. J Chromatogr B Analyt Technol Biomed Life Sci , 2012, 119 :119–125. |
| [23] | Kearney BP, Sayre JR, Flaherty JF, et al. Drug-drug and drug-food interactions between tenofovir disoproxil fumarate and didanosine[J]. J Clin Pharmacol , 2005, 45 :1360–1367. DOI:10.1177/0091270005281351 |
| [24] | Damle BD, Yan JH, Behr D, et al. Effect of food on the oral bioavailability of didanosine from encapsulated enteric-coated beads[J]. J Clin Pharmacol , 2002, 42 :419–427. DOI:10.1177/00912700222011472 |
| [25] | Zhang QH, Yang J, He Y, et al. Food effect on the pharmacokinetics of entecavir from dispersible tablets following oral administration in healthy Chinese volunteers[J]. Arzneimittelforschung , 2010, 60 :640–644. |
| [26] | Q H, Wang CY, Meng Q, et al. OAT1 and OAT3: Targets of drug-drug interaction between entecavir and JBP485[J]. Eur J Pharm Sci , 2013, 48 :650–657. DOI:10.1016/j.ejps.2012.12.024 |
| [27] | Chen J, Lin H, Hu M. Absorption and metabolism of genistein and its five isoflavone analogs in the human intestinal Caco-2 model[J]. Cancer Chemother Pharmacol , 2005, 55 :159–169. DOI:10.1007/s00280-004-0842-x |
 2016, Vol. 51
2016, Vol. 51


