2. 首都医科大学宣武医院, 北京 100053
2. Xuanwu Hospital of Capital Medical University, Beijing 100053, China
脑缺血再灌注损伤 (cerebral ischemia reperfusion injury,CIRI) 是脑卒中溶栓并发症[1]之一,它的出现严重影响了溶栓治疗的效果,不利于溶栓患者的预后。现代医学认为,脑缺血再灌注损伤主要与细胞内Ca2+超载、自由基连锁反应、兴奋性氨基酸神经毒性、一氧化氮细胞毒作用、氨基酸代谢失衡及基因表达 与蛋白质的磷酸化、缺血区的各种代谢以及水与酸 碱平衡紊乱等因素有关[2]。目前国际上对每一种缺血后损伤机制进行了深入的研究,筛选和研制出近百种动物实验有效的脑保护药物,然而无一种药物临床试验有效的[3],因此寻找新的疗效明确的脑保护药物迫在眉睫。缬芎滴丸是同济医学院老年病研究所受 湖北龙人制药集团公司委托研制,原料为精制缬草油、缬草和川芎的浸提物,其中精制缬草油所含的萜烯类物质占整个复方原料药的质量分数为80%,缬草萜烯的药理学活性有: 镇静催眠、抗惊厥; 改善心肌微循环灌注,增加冠脉流量[4]; 降低神经网络兴奋性,保护神经元[5]。前期实验发现,缬芎滴丸对急性脑缺血有明显的防治作用,并摸索出该中药复方制剂的有效剂量[6],但其在脑缺血再灌注损伤方面的研究尚未见报道,因此本文在原实验基础上,运用大鼠大脑中动脉闭塞 (MCAO) 模型,通过18分改良神经功能评分(modified neurological severity score,mNSS) 法和TTC染色技术探究缬芎滴丸是否能减轻大鼠脑缺血再灌注损伤,并采用Western blot技术检测脑梗死周边组织血管内皮生长因子受体2 (VEGFR2) 蛋白表达量,ki67/lectin免疫荧光双标技术显示新生血管形成,进一步研究缬芎滴丸在促血管新生方面的机制。
材料与方法试药 以精制缬草油、缬草和川芎浸提物加2倍重量的Tween-80、1,2-丙二醇混合物助溶,用蒸馏水稀释配制成50 mg·mL-1复方缬芎滴丸原液; 尼莫地平 (北京拜耳医药保健有限公司,生产批号: 国药准字H20003010)。
主要试剂与仪器 2,3,5-氯化三苯基四氮唑 (TTC,北京鼎国昌盛生物技术有限责任公司,编号: STY102); VEGFR2 (上海艾博抗贸易有限公司,批 号: ab194806)、β-actin (北京中杉金桥生物技术有限公司,批号: TA-09)、山羊抗兔二抗 (北京中杉金桥生物技术有限公司,批号: ZB-2301)、山羊抗小鼠二抗 (北京中杉金桥生物技术有限公司,批号: ZB-2305); Ki67 (上海艾博抗贸易有限公司,批号: AB9260)、Lectin (IF488,上海优宁维生物科技有限公司,批号: DL-1174)、山羊抗兔二抗 (北京中杉金桥生物技术有限公司,批号: ZF-0516); 冰冻切片机 (Thermo 620E,美国Thermo Fisher公司); BCA蛋白定量试剂盒 (P1511,北京普利莱基因技术有限公司)、全波长酶标仪 (Multiskan Spectrum,美国Thermo Fisher公司)、ECL Western Blot显色试剂盒 (32109,美国Thermo- Pierce公司)、化学发光凝胶成像系统 (Image Station 4000R,美国Carestream Health公司); 染色用普通光学显微镜 (CHK213)、拍照用正置荧光显微镜 (BX51) (日本Olympus公司); 线栓 (2634-100,d = 0.26 mm,北京沙东生物技术有限公司)。
实验动物分组及给药 60只SPF级雄性SD大鼠,2~3个月龄,体重 260~280 g,购自北京维通利华实验动物技术有限公司,合格证编号: SCXK (京) 2007-0001。随机分为: 假手术组、模型组、缬芎滴丸低剂量 (30 mg·kg-1) 组、缬芎滴丸高剂量 (50 mg·kg-1) 组和阳性药组 (尼莫地平,10 mg·kg-1),每组大鼠12 只。MCAO手术造模,大鼠清醒后立即对缬芎滴丸 (30、50 mg·kg-1) 组和尼莫地平 (10 mg·kg-1) 组灌胃给药,每次2 mL/只,每天1次,连续7天,每次在同一时间点,假手术组和模型组给予等量的蒸馏水。
MCAO模型制备 MCAO模型采用Zea Longa改良线栓法[7]略加改进。大鼠用10% 水合氯醛0.35 mL·kg-1腹腔麻醉,仰卧位固定于鼠板上,颈部正中切口,钝性分离右侧颈总动脉 (CCA)、颈外动脉 (ECA) 和颈内动脉 (ICA),永久结扎ECA和CCA的近心端,动脉夹临时夹闭ICA,CCA远心端结扎一道缝合线,勿扎紧。CCA接近ECA和ICA分叉处用眼科剪作一斜行细切口 ,插入顶端涂有硅胶的线栓,稍扎紧缝合线,松开动脉夹,推动线栓进入ICA,插入约0.8 cm时注意调整线栓方向,避免误入翼腭动脉,插入约1.8 cm时减慢插线速度,遇轻微阻力时即停止插线,此时MCAO模型制成。记录栓塞开始时间,结扎CCA远心端以固定线栓。缝合肌肉、皮肤。栓塞30 min后拔出线栓。假手术组大鼠除了不插入线栓外,其余操作与手术组相同。
大鼠神经功能评分 大鼠造模清醒后进行第1次评分,模型成功及评价标准参照Longa[8] [4分,无神经系统损伤症状 (0分); 不能完全伸展对侧前爪 (1分); 向左侧转圈 (2分); 向对侧倾斜 (3分); 不能自发行走,意识丧失 (4分)]、Berderson[9] (3分)、平衡木实验 (5分)、视觉亚实验 (2分)、触觉亚实验 (2分) 和本体觉亚实验 (2分) 共18分mNSS评分法。剔除小于7分和大于13分者,并随机补充各组设计所需大鼠数量,本实验中造模成功率为50.73%。大鼠给药7天后采用同样的方法进行第2次评分。神经功能改善程度 = (第1次评分结果) - (第2次评分结果)。
大鼠脑梗死体积测定 大鼠给药7天后,10%水合氯醛腹腔麻醉,血管钳、镊子等剥离取脑,-20 ℃冰箱内急冻5 min后取出,放入脑槽中沿冠状面水平切7刀,取中间6片,每片厚约2 mm。将切片放入2% TTC[10]染液中,严格避光置于37 ℃水浴箱中,每隔10 min摇动一次,30 min 后取出,正常脑组织呈红色,梗死组织呈白色。再将脑片置入4% 多聚甲醛中固定24 h后取出,用数码相机在同样光照条件下拍照,图像分析系统Image J计算每片脑组织的梗死面积、脑片总面积。计算每只大鼠脑梗死体积百分比 = (脑片总梗死面积 / 脑片总面积) × 100%。
Western blot检测VEGFR2表达 大鼠经水 合氯醛麻醉后颈椎脱臼法处死,取新鲜脑组织,分 离右侧脑皮质,充分剥离白色梗死周边的组织,放入标识好的EP管中 (取组织过程均在冰上操作)。加入裂解液,BCA法蛋白定量,样品制备,转膜,封闭,加入一抗 (VEGFR2,1∶500; β-actin,1∶1 000),4 ℃冰箱过夜,二抗(1∶1 000) 室温2 h,电化学发光法 (Electro-Chemi-Luminescence,ECL) 显色,化学发光凝胶成像仪曝光,拍照,以目的条带与内参照β-actin灰度值的比值表示蛋白表达水平,进行半定量分析。
免疫荧光双标染色 (ki67/lectin) 首先将大鼠用多聚甲醛灌注取脑并制作冰冻切片,然后将脑片破膜处理30 min,羊血清封闭2 h,加入兔抗ki67 (1∶200),4 ℃冰箱过夜; 第二天加荧光二抗 (IF594,1∶200),荧光一抗Lectin (IF488,1∶600),室温孵育2 h; 含DAPI封片剂封片,正置荧光显微镜观察拍 照: 每只大鼠选取3张脑组织切片,每张切片选取皮层梗死周边相同部位,100倍镜下拍照,新生血管以 Ki67、Lectin双染阳性的血管表示,计算每个视野下ki67/lectin阳性血管数量。
统计学方法 数据以均数 ± 标准差 (x± s) 表示,组间比较采用SPSS 17.0软件进行单因素方差分析 (one-way ANOVA) 的Tukey HSD和LSD法分析,P < 0.05为具有显著性差异。
结果 1 缬芎滴丸对大鼠神经功能改善程度的影响与假手术组比较,模型组和给药组均出现神经功能缺损; 与模型组比较,缬芎滴丸低剂量 (30 mg·kg-1) 组、缬芎滴丸高剂量 (50 mg·kg-1) 组和尼莫地平 (10 mg·kg-1) 组神经功能改善程度均有明显提高 (P < 0.05,P < 0.001),结果见图 1。
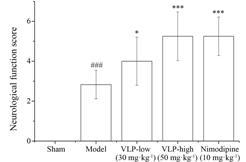
|
Figure 1 Effects of Valerian Ligusticum Pill (VLP) and nimodipine on improvement of neurological function after injury of cerebral ischemia reperfusion in rats. Improvement of neurological function is represented by the difference between the first neurological function score and the second neurological function score. n = 12,x± s. ###P < 0.001 vs sham operation group; P < 0.05,***P < 0.001 vs model group |
TTC染色可见,假手术组大鼠脑片全部染成红色,未出现梗死灶,模型组和给药组大鼠脑片出现明显白色梗死灶,模型组脑梗死体积比值为 (24.14 ± 2.84) %,缬芎滴丸低剂量组为 (10.49 ± 2.76) %,缬芎滴丸高剂量组为 (7.25 ± 2.03) %,尼莫地平组为 (8.04 ± 2.53) %。与模型组比较,各给药组大鼠脑梗死体积明显减少,差异有统计学意义 (P < 0.001),结果见图 2A、B。
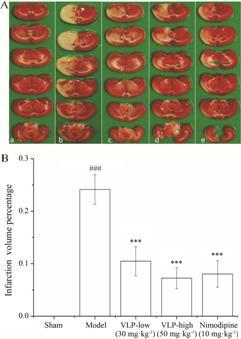
|
Figure 2 Effects of Valerian Ligusticum Pill (VLP) and nimodipine on infarction volume percentage after injury of cerebral ischemia reperfusion in rats. A: The range of cerebral infarction in each group. a: Sham operation group; b: Model group; c: VLP-low (30 mg·kg-1) group; d: VLP-high (50 mg·kg-1) group; e: Nimodipine (10 mg·kg-1) group. B: Infarction volume percentage statistical results. n = 6,x± s. ###P < 0.001 vs sham operation group; ***P < 0.001 vs model group |
假手术组和模型组均未见明显VEGFR2蛋白表达; 与模型组比较,缬芎滴丸低剂量组VEGFR2蛋白表达量增多 (P < 0.05); 缬芎滴丸高剂量组、尼莫地平组VEGFR2蛋白表达量增多更明显 (P < 0.001),结果见图 3A、B。
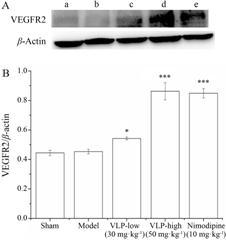
|
Figure 3 Effects of Valerian Ligusticum Pill (VLP) and nimodipine on the expression of VEGFR2 in cerebral infarction peripheral tissue. A: Protein levels of VEGFR2 in each group were quantified by Western blot analysis. a: Sham operation group; b: Model group; c: VLP-low (30 mg·kg-1) group; d: VLP-high (50 mg·kg-1) group; e: Nimodipine (10 mg·kg-1) group. B: VEGFR2/β-actin grayscale scanning results. n = 3,x± s. P < 0.05,***P < 0.001 vs model group |
在荧光显微镜下观察显示,Ki67显示为红色,标记增殖期细胞; Lectin显示为绿色,标记所有血管; 箭头所指红色和绿色重合处为新生血管 (10×)。假手术组血管分布均匀,血管结构正常,几乎无新生血管; 模型组新生血管出现在皮质梗死周边,新生血管数量较假手术组增多但血管较细小而短; 缬芎滴丸低剂量 (30 mg·kg-1) 组新生血管数量较模型组显著增多 (P < 0.05); 缬芎滴丸高剂量 (50 mg·kg-1) 组新生血管数量进一步增多 (P < 0.001),血管增粗而长; 尼莫地平 (10 mg·kg-1) 组新生血管数量与模型组比较差异也有统计学意义 (P < 0.05),结果见图 4A、B。

|
Figure 4 Effects of Valerian Ligusticum Pill (VLP) and nimodipine on the number of new blood vessels in cortex infarction around. A: New blood vessels in each group were quantified by ki67/lectin immunofluorescence double staining method,red for Ki67,marked proliferating cells; green for Lectin,marked all blood vessels; arrows refered to the new blood vessels (10×). a: Sham operation group; b: Model group; c: VLP-low (30 mg·kg-1) group; d: VLP-high (50 mg·kg-1) group; e: Nimodipine (10 mg·kg-1) group. B: Number of new blood vessels statistical results. n = 3,x± s. P < 0.05,***P < 0.001 vs model group |
近年来,人们认识到脑缺血再灌注损伤不仅累及神经元,还可累及脑组织的其他成分,因而先后提出神经血管单元[11]概念和神经血管稳态重构[12]理论,使脑保护的目标从单一的神经保护转变为对神经血管单元多种成分的保护。血管新生是在原来存在的血管结构上长出新血管的生物学过程[13],现代病理生理学认为任何组织的生长和修复都离不开血管新生,它有助于改善缺血脑组织血供,挽救部分可逆性损伤神经元,是缺血脑组织抗损伤和神经元修复的结构基础。祖国传统中医药有注重整体调节和多环节 综合治疗的特点,在防治缺血性疾病方面积累了丰富经验[14,15],虽然中医学中无血管新生的记载,但其经典理论中的“脉、血脉、血络”与西方医学中的“血管”有异曲同工之处,而且中医机制之活血化瘀、益气生血等与血管新生的发生机制及作用有密切关系[16],因此可以从补益心气、调肝理气、活血化瘀和养血生脉的角度探索中药的促血管生成作用。缬芎滴丸的主要成分为缬草和川芎,缬草性辛、甘、温,归心、肝经,有养心安神、理气和活血止痛的功效; 川芎辛散温通,归肝、胆、心包经,具有活血行气、祛风止痛的功效,其药理机制为研究缬芎滴丸的促血管新生作用提供了重要启示。
研究结果显示,缬芎滴丸可以有效改善大鼠脑缺血再灌注损伤后神经功能,明显缩小脑梗死体积,促进脑皮质梗死周边组织表达VEGFR2和新生血管形成。VEGFR2[17]是血管内皮生长因子 (VEGF) 特异性受体,存在于血管内皮细胞表面,当受到内源性或外源性VEGF刺激后,可以激活血管新生相关信号通路,促进新生血管形成。虽然脑缺血损伤本身可以刺激内源性血管新生,但这种自我修复能力有限,不足以改善脑缺血预后,给予缬芎滴丸等药物治疗可使VEGFR2表达量明显增多,说明缬芎滴丸具有放大内源性血管新生的作用。Ki67是一种细胞核抗原,常表达于有丝分裂G1/S期的细胞,与细胞增殖[18]相关; Lectin是一种可从各种动植物中提纯的凝集素,具有专一性结合和多价结合的特点,常用于光镜或电镜水平的免疫细胞化学研究工作。因此实验中Ki67和Lectin双染阳性的血管即为新生血管,新生血管计数[19]用ki67/lectin的表达量表示。免疫荧光染色结果中缬芎滴丸等给药组新生血管数量均高于模型组,再次证明了缬芎滴丸在促血管新生方面的优势。
实验结果表明,缬芎滴丸可以通过促进脑梗死周边血管新生来减轻脑缺血再灌注损伤,从而有助于脑缺血后组织修复和功能重建。虽然缬芎滴丸促血管新生的具体作用机制还不清楚,但实验结果在血管新生方面证明了缬芎滴丸对脑缺血再灌注损伤的保护作用,与前期的研究结果相一致,为后续研究缬芎滴丸的药效和机制奠定了良好的基础,对于新药开发具有非常重要的意义。
| [1] | Meretoja A, Tatlisumak T. Thrombolytic therapy in acute ischemic stroke-basic concepts[J]. Curr Vasc Pharmacol , 2006, 4 :31–44. DOI:10.2174/157016106775203108 |
| [2] | Qi J, Li F. Mechanism and treatment of cerebral ischemia reperfusion injury[J]. Stroke Nervous Dis (卒中与神经疾病) , 2015, 22 :120–122. |
| [3] | Kitagawa K. Brain protection against cerebral ischemia[J]. Rinsho Shinkeigaku , 2013, 53 :1169–1171. DOI:10.5692/clinicalneurol.53.1169 |
| [4] | Xue CK, Jiang YZ, Yang J, et al. Valeriana on cardiovascular system of animal role[J]. Chin West Med (中西医结合杂 志) , 1988, 8 :8–12. |
| [5] | Yin YG, Zhu QH, Wang CY. Research progress of valerian[J]. Her Med (药学进展) , 2006, 25 :230–231. |
| [6] | Qu W, Peng RX, Yang J, et al. Protective effect of Valrian-Ligustrazine Co Pellet on acute cerebral ischemia in rats[J]. Med J Wuhan Univ (武汉大学学报(医学版)) , 2004, 25 :141–143. |
| [7] | Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke , 1989, 20 :84–91. DOI:10.1161/01.STR.20.1.84 |
| [8] | Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke , 1989, 20 :84–91. DOI:10.1161/01.STR.20.1.84 |
| [9] | Bederson JB, Pitts LH, Tsuji M, et al. Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination[J]. Stroke , 1986, 17 :472–476. DOI:10.1161/01.STR.17.3.472 |
| [10] | Bederson JB, Pitts LH, Germano SM, et al. Evaluation of 2,3,5-triphenyltetrazolium chloride as a stain for detection and quantification of experimental cerebral infarction in rats[J]. Stroke , 1986, 17 :1304–1308. DOI:10.1161/01.STR.17.6.1304 |
| [11] | LO EH. Experimental models, neurovascular mechanisms and translational issues in stroke research[J]. Br J Pharm , 2008, 153 :S396–S405. |
| [12] | Wang W, Sun FL, Ai HX, et al. The second Chinese Pharma-cological Society Tonic Pharmacology Specialized Committee Academia Symposium Proceedings (第二届中国药理学会补 益药药理专业委员会学术研讨会论文集) [C]. Chengde: Chinese Pharmacological Society, 2012: 28-29. |
| [13] | Gong CY, Lu B, Yang L, et al. Bibenzyl from dendrobium inhibits angiogenesis and its underlying mechanism[J]. Acta Pharm Sin (药学学报) , 2013, 48 :337–342. |
| [14] | Zhang YY, Wan HT, Lai LL, et al. The effect and mechanism of Yiqi Tongluo Jiedu capsule against cerebral ischemia reperfusion injury[J]. Acta Pharm Sin (药学学报) , 2012, 47 :1153–1158. |
| [15] | Chen RR, Guo H, Xu YT, et al. Research progress on pro- or anti-angiogenic effects of Chinese materia medica fomulas and their active components[J]. Chin Tradit Herbal Drugs (中草药) , 2013, 44 :3413–3422. |
| [16] | Duan L, Xiong XJ, Wang J. Activating blood circulation to remove stasis and therapeutic angiogenesis of coronary heart disease[J]. Chin J Integrat Tradit West Med (中国中西医结合杂志) , 2013, 33 :1561–1566. |
| [17] | Huang QJ, Li LX. Mechanism of cerebral angiogenesis after cerebral ischemia[J]. J Int Neurol Neurosurg (国际神经病 学神经外科学杂志) , 2014, 41 :134–137. |
| [18] | Eefsen RL, Engelholm L, Willemoe GL, et al. Microvessel density and endothelial cell proliferation levels in colorectal liver metastases from patients given neo-adjuvant cytotoxic chemotherapy and bevacizumab[J]. Int J Cancer , 2016, 138 :1777–1784. DOI:10.1002/ijc.29904 |
| [19] | Chang LP, Wei C, Jia ZH, et al. Effects of Tongxinluo on angiogenesis and the volume of blood perfusion in ischemic stroke rats[J]. Chin J Integrat Tradit West Med (中国中西医结合杂志) , 2012, 32 :1667–1670. |
 2016, Vol. 51
2016, Vol. 51


