据WHO的2015年统计数据显示,全球有1.3亿~1.5亿的丙肝病毒 (hepatitis C virus,HCV) 感染者,每年死于丙型肝炎病毒相关疾病的患者大约有50万人[1]。到目前为止还没有像乙肝疫苗一样有效并能够在人群中广泛应用的HCV疫苗。因此,抗病毒药物研发在HCV感染性疾病的防控中担负着重要的作用。HCV基因组编码3种结构蛋白 (core、E1和E2) 和7种非结构 (non-structural,NS) 蛋白 (P7、NS2、3、4A、4B、5A和5B),这些蛋白在HCV的复制和传播过程中发挥了重要作用,因此都有可能成为直接抗病毒药物 (direct antiviral agents,DAAs) 的潜在靶点。2011年上市的HCV NS3/4A蛋白酶抑制剂telaprevir和boceprevir显著提高了HCV基因1型患者的持续病毒学应答水平(sustained virologic response,SVR),开启了以HCV复制相关蛋白或酶 为靶点的直接抗病毒药物的研发新时代。截止2016年2月FDA共批准了11个直接抗病毒药物用于HCV感染治疗,其中有5个HCV NS3/4A抑制剂、2个NS5B抑制剂和4个NS5A抑制剂。不同基因型 (genotype,GT) HCV的致病力和对DAAs的应答率存在明显不同,现有的DAAs多数仅对HCV GT-1型可以获得较高的持续病毒学应答,同时,耐药屏障低仍然是多数DAAs难以克服的问题。因此,对广泛基因型的HCV具有快速清除能力,而且耐药屏障高的药物是目前HCV治疗的理想药物。
HCV NS5A蛋白由447个氨基酸组成,结构中包括3个结构域 (domain 1、2和3)。结构域1包括一个锌结合基序和一个N端两性螺旋,NS5A与内质网膜的结合依赖这个两性螺旋结构,因此这部分区域直接影响HCV基因组的复制; 而结构域2和3则对RNA复制和病毒颗粒的组装环节发挥重要作用[2]。而且,有研究显示NS5A可能在HCV干扰宿主细 胞内信号和免疫逃逸方面有促进作用,可能是导致干扰素治疗应答低的原因之一[3]。虽然HCV NS5A抑制剂对HCV复制抑制活性的具体机制还不清楚,但是近几年随着daclatasvir (BMS-790052) 的发现,HCV NS5A抑制剂研究吸引了更多的关注,并且凸显出这类药物抗病毒活性强、起效快、对广泛HCV基因型均有效的特点[4, 5]。从2013年到现在3年多的时间里,有4个HCV NS5A抑制剂被FDA批准上市,还有多个处于临床阶段的NS5A抑制剂研究结果令人期待。本文将主要从药物化学的角度对2010年以来HCV NS5A抑制剂的研究进展进行综述。
1 Daclatasvir的发现与应用 1.1 筛选模型为了得到新颖作用机制的特异性HCV抑制剂,Bristol-Myers Squibb公司的研究人员先后采用HCV复制子细胞模型、黄病毒属的牛腹泻病毒的复制子和感染细胞模型,通过高通量筛选发现HCV专属抑制剂[6]; 同时,测定这些化合物对其他病毒 (如HIV-1、疱疹病毒、流感病毒和肠道病毒等) 的抑制活性,再次确证其对HCV抑制作用的特异性; 然后,利用NS3蛋白酶、NS3解旋酶和NS5B聚合酶生化模型测定,排除了这些HCV抑制剂对上述已知靶点的作用; 最后结合耐药变异位点 (NS5A蛋白的Y93H变异) 和对多种细胞的毒性测定,初步确定低毒性的亚胺噻唑啉酮化合物BMS-858 (2) 可能是新颖HCV NS5A抑制剂苗头化合物。化合物2对HCV GT-1b复制子细胞抑制活性的EC50值为0.57 μmol·L-1,细胞毒性CC50 > 50 μmol·L-1 [7]。
1.2 结构优化为了提高化合物2的抗病毒活性,对其进行第 一轮的结构改造首先得到两个化合物 (3和4),HCV抑制活性相比2均得到近百倍的提高。但是,后来 针对化合物3的研究发现其在活性测定介质中不稳定,会经过游离基反应生成一对噻唑啉酮二聚体化合物5,这对稳定的二聚体均具有明显的HCV抑制活性 (5a和5b的EC50分别为43和0.6 nmol·L-1)。对这个噻唑琳酮二聚体进行结构简化并结合化合 物3中脯氨酸的特征合成得到活性显著提高的乙烯二苯类化合物6 (GT-1b EC50 = 0.086 nmol·L-1),在 6结构两翼末端引入含氮的碱性取代基帽子后,获 得了对HCV GT-1a的抑制活性显著提高的化合物 7,再对结构中易断裂的酰胺片段进行减毒优化得到EC50达到皮摩尔水平的双咪唑联苯化合物8,最 后,为了提高口服生物利用度,对吡咯烷的N-取代端进行降低分子量改造才产生了第一个对基因1~5型HCV均表现出显著抑制活性 (EC50 = 9~146 pmol·L-1) 的HCV NS5A抑制剂BMS-790052,即daclatasvir (DSV,1)[8-10]。DSV分别于2014和2015年被欧盟和美国FDA批准上市,成为了第一个HCV NS5A抑制剂药物 (图 1)。
1.3 靶点确证通过耐药表型测序分析,研究人员发现BMS- 790052诱导耐药均发生在NS5A蛋白的前100个氨
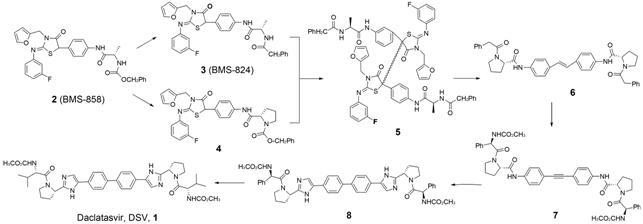
|
Figure 1 Discovery of daclatasvir |
基酸上,如L31、Y93、M28和Q54等氨基酸残基。而且,对HCV NS5A的domain 1晶体结构分析显示,这些变异位点均位于NS5A蛋白二聚体的交接面上[11]。因此,初步推测该类化合物作用于二聚体的分界面,通过干扰NS5A蛋白二聚体的形成发挥作用,这也 为这类化合物对称结构的重要性找到了理论依据。 鉴于HCV NS5A是一个酶活性未知的功能蛋白,为了验证靶点的推测,研究人员采用化学遗传学的方法,通过设计合成二苯乙烯化合物的小分子探针,利用生物素标记捕获了靶蛋白NS5A,从而确定了DSV的作用靶点[7, 12]。
1.4 临床应用DSV目前在临床的主要治疗方案是与asunaprevir或sofosbuvir联合应用来提高患者的持续病毒学应 答率和避免耐药发生。临床研究显示: DSV联合asunaprevir用于HCV基因1b的患者24周后,无论是初治患者、接收过干扰素治疗的患者或是伴肝硬化患者,均有超过80% 的患者获得了持续病毒学应答,且不良反应率低[13]。但DSV联合asunaprevir用于治疗HCV基因1a型患者48周的研究中发现带有HCV NS3耐药变异的毒株消除比较快,但是含有NS5A 耐药变异的毒株难消除,这说明一旦HCV NS5A出现耐药变异后可能导致再治疗的难度加大[14]。DSV联合sofosbuvir用于GT-3型HCV患者的 Ⅲ 期临床试验显示,90% 的初治患者和86% 经治患者在12周即获得了SVR12[15]。这与市场已有的sofosbuvir与ribavirin联合治疗24周用于GT-3型HCV患者的全口服给药方案相比,治疗周期缩短了一半。DSV联合sofosbuvir治疗HCV GT-3感染已经在2015年被FDA批准,并可用于伴有代偿性肝硬化的丙肝患者。
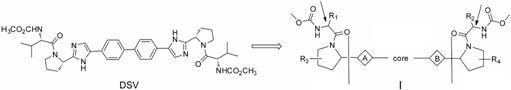
2 DSV类似物的研究自DSV的化合物专利公开以来,出现了大量HCV NS5A抑制剂的专利申请和研究报道,但这些抑制剂多数具有与DSV类似的药效团特征,即一对带有甲氧酰缬氨酸帽子的吡咯烷分别通过酰胺、咪唑或苯并咪唑连接在一个轴心基团两端的结构骨架[16]。多数研究旨在通过更为精致的结构优化来获得更具优势的泛基因型HCV抑制剂。在这里,将与DSV含有类似药效团特征的化合物结构概括为通式Ⅰ,并将其分为3个部分: 中心结构区 (包括core和A、B两个连接片段) 和两个翼端结构 (由取代的吡咯环形成的两侧对称或不对称结构)。依据这个通式,以DSV作为对照,根据结构变化的区域,将本文的DSV类似物归于以下3类进行分别论述。
2.1 中心结构区改变的化合物文献[17]报道采用MOE软件,对现有的多个HCV NS5A抑制剂结构进行能量最小化处理后,经过分析研究发现: 较为适宜的分子主体长度为19 ± 2 Å。该文献的分子主体是指通式Ⅰ中的两个箭头所示中间部分,考虑到所有DSV类似物中两翼端的四氢吡咯部分对于长度的贡献几乎都是相同的,因此,中心结构区的改变会明显影响分子主体长度,而针对该区域的结构优化也因此需要确保适合的长度。事实上,大量HCV NS5A抑制剂研究在单独或同时改变core及A、B两个片段时都会顾及最后形成的中心区整体长度。而且,通过分析不同中心结构的变化,可以为中心区结构的对称性与药效的关系找到一定的规律。因此,以下将对两翼与DSV相同,但在中心结构区具有明显改变的化合物进行分别阐述,并对中心结构区整体变化产生的药效影响进行综合分析。
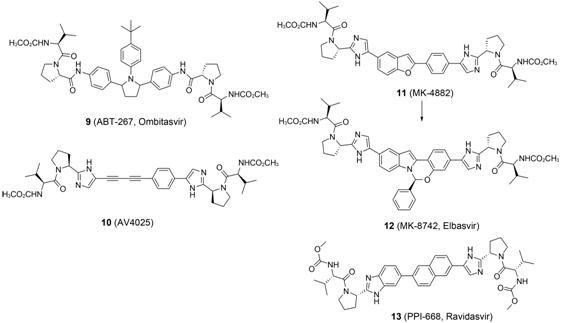
2.1.1 OmbitasvirAbbVie公司的ombitasvir (ABT- 267,9) 的结构特点在于引入了与整个分子形状呈正交角度的反式-2,5-二苯基-N-(4-叔丁基) 苯基吡咯烷,吡咯烷上的两个手性中心为2S,5S构型时抗病毒活性更强。可能是为了保证适宜的中心区长度,它的A、B片段沿用了DSV研发早期化合物6和7所保持的 酰胺形式,两翼与DSV完全相同。研究证实其对GT-1~5型HCV都显示出比DSV更强的体外抑制活性 (EC50 = 1.7~19.3 pmol·L-1),对GT-6a型HCV复制也具有明显的抑制活性(EC50 = 366 pmol·L-1),并且口服给药在人体内半衰期长达约30 h,适合单次给药[18]。Ombitasvir联合paritaprevir和ritonavir的临床Ⅱ期试验表明,GT-4型HCV感染者对此三联疗法的持续病毒学应答率为90.9%,而加入ribavirin的四联疗法的持续病毒学应答率更是高达100%[19]。2014年12月复方制剂ViekiraPak (ombitasvir/paritaprevir/ritonavir与dasabuvir的组合包装) 被FDA批准上市,并且可用于伴有肝硬化的患者。
|
|
AllaChem公司研发的AV4025 (10) 与DSV的不同体现在使用了二乙炔苯基结构,其他部分与DSV相同。其相比DSV具有更小的分子量,显示出了更适宜的靶点结合特性和较好的药代动力学性质。文献对两翼分别含有的两个手性中心构型进行了对比研究,发现4个手性中心均为S构型时具有最佳的活性,改变任一个构型都能使活性显著下降。这个特点也可以在其他DSV类似物的构型中得到确证。AV4025对GT-1a、1b、4a的EC50值分别为59、3.4和6.5 pmol·L-1,抗病毒活性优势不显著,但在动物实验中表现出较好的口服生物利用度,并且毒性低 (小鼠体内LD50大于2 000 mg·kg-1)[17]。AV4025对GT-1b型HCV感染者的Ⅰ/Ⅱ期临床试验结果乐观,安全性和耐受性良好,没有严重的不良反应发生,40 mg的剂量即可引起HCV RNA水平平均降低约3.35个Log10单位[20],但未见到后续研究公布。
2.1.3 ElbasvirElbasvir (MK-8742,12) 是Merck公司在MK-4882 (11) 的基础上进行优化得到的。MK-4882与DSV的不同之处在于其用苯并呋喃替换了联苯的其中一个苯环,动物实验显示MK-4882虽然消除病毒速度快,但是给药后很快出现的耐药基因Q30R和L31M/L导致药物也快速失效。通过将苯并呋喃与苯基进行桥连成环,进一步增加刚性,并在环上引入苯基取代得到MK-8742。由于分子疏水性增加,导致MK-8742的生物利用度 (9%~35%) 与同类化合物DSV、AV4025相比表现平凡,但MK-8742对GT1~4型HCV都有很好的抑制效果,与已经上市的DSV和lediprasvir相比,对多种耐药毒株的活性也表现更佳[21]。
Elbasvir与Merck公司的HCV NS3A抑制剂grazoprevir (MK-5172) 组成的复方单片,每日一次口服给药12周用于治疗HCV基因1、4和6型感染者的临床试验中,94.4% 的1a型感染者、95.5% 的1b型感染者、96.4% 的4型感染者都获得了持续病毒学应答[22]。这一复方单片于2016年1月被FDA批准上市用于HCV基因1和4型慢性感染的治疗,这为GT-4型HCV感染治疗的迫切需求提供了有效方法。
2.1.4 RavidasvirRavidasvir (PPI-668,13) 是由Presidio Pharmaceuticals公司开发的NS5A抑制剂,PPI-668的结构变化较小,仅将联苯骈合成了萘环,同时用苯并咪唑替换了A片段的咪唑环,保持了适宜的中心结构区长度,同时也增加了中心区的刚性。
PPI-668在临床试验中表现出较高的耐受性和适宜的药代动力学性质,而且单药给药治疗GT-1患者的临床试验表明: 给药5天,病人的HCV RNA降低了3.54~3.75个Log10单位[23]。PPI-668对HCV GT-1a、1b和3a感染者的研究也得到了类似的结果,表明其对广泛HCV基因型有效。在PPI-668与faldaprevir和deleobuvir联合治疗GT-1a患者的Ⅱ期临床试验 中,95% 的患者获得了持续病毒学应答(SVR4),并且100% 的患者获得了持续病毒学应答 (SVR8)[24]。目前,PPI-668联合sofosbuvir治疗GT-4型丙肝的 Ⅲ 期临床试验 (NCT02371408) 正在进行中。
2.2 仅在两翼结构区改变的GSK2336805GSK2336805 (JNJ56914845,14) 与DSV的唯一不同之处是在一侧翼端的吡咯烷上引入了氧杂螺环结构,并且研究发现在吡咯烷上引入螺环结构有利于提高化合物对HCV GT-1a的抑制活性。体外研究显示,14对GT-1a、1b、4a、5a和6a的抑制活性均很强,同时,对GT-1b型HCV的L31V和Y93H耐药变异毒株亦保持良好的抑制活性[25, 26]。Ⅰ期的临床试验表明,无论单药还是重复给药仅可以使HCV RNA水平下降2~3个Log10单位[27]。
GSK-2336805联合干扰素、ribavirin和telaprevir治疗轻度基因1型HCV患者的Ⅱ期临床试验 (NCT01648140) 已经开始,但没有后期的结果披露[28]。
2.3 中心结构区和两翼均有改变的NS5A抑制剂对中心结构区和两翼均有改变的改造策略在更多的NS5A抑制剂中得到体现,从ledipasvir (15) 发现过程可以反映出研究该类结构抑制剂的优化规律: ① 选择合适的区域,通过成环策略限制联苯基的旋转自由度,增加其刚性,从而改善对广泛基因型的抗病毒活性。而且,只要结构长度适宜,仍然能保持对GT-1b的强效抑制活性,这一构效特征已经被处于临床阶段的很多NS5A抑制剂研究得到验证[29]; ② 通过对两个翼端结构进行结构修饰可能会带来对GT-1a及耐药变异毒株抑制活性的增加,也会带来药物半衰期的延长等药代动力学性质改变。
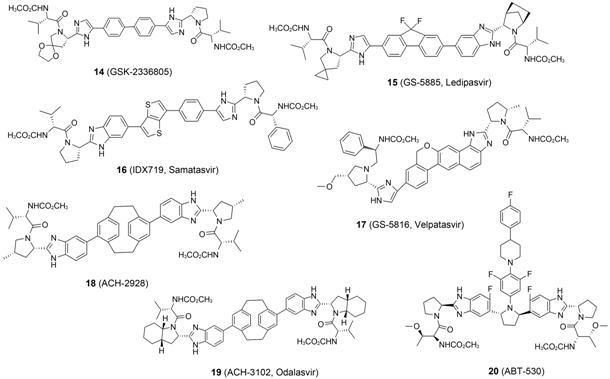
2.3.1 LedipasvirGliead公司的ledipasvir (GS-5885,15) 的结构特点在于: 首先引入二氟亚甲基将联苯的空间结构加以限制,形成刚性更强的三环结构; 同时,设计了不对称的A、B两个片段 (咪唑和苯并咪唑),从而实现了对GT-1a和1b都具有pmol·L-1浓度的抑制活性; 通过在两翼的吡咯烷上分别引入螺环或桥环,延长了化合物的半衰期,使得健康志愿者体内的血浆半衰期达到37~45 h[30]。实现了在药效和药代性质方面的双重改善。
在GS-5885联合sofosbuvir治疗对经典三联疗 法无效的GT-1型患者的 Ⅲ 期临床试验中,在接受 12周后,94% 的患者获得了持续病毒学应答,而在24周的疗程后,获得SVR的比例更是高达99%。同时还观察到该二联疗法与加入利巴韦林的三联方案疗效没有显著差别,并且没有因不良反应终止试验的病例报道[31]。含有GS-5885与sofosbuvir的复方单片Harvoni于2014年10月被FDA批准上市,成为第一个被批准不需要干扰素或利巴韦林的DAAs联合治疗方案。
2.3.2 SamatasvirSamatasvir(IDX719,16) 是Idenix公司旨在克服DSV对HCV GT-2和3型治疗效果稍弱的缺陷而设计研发的HCV NS5A抑制剂。IDX719的结构特征在于将DSV的二苯中插入了二噻吩骈合环结构,同时采用在一侧的连接片段 (A) 将咪唑与苯骈合的缩短策略,弥补了二噻吩骈合结构造成的核心区域略有延长。需要指出的是,与大部分DSV类似物采用两翼手性均为S构型的甲氧酰缬氨酸帽子不同,16采用S构型的甲氧酰缬氨酸和R构型的 甲氧酰苯基甘氨酸相结合的两翼结构。甲氧酰苯基甘氨酸帽子结构曾出现于DSV发现过程 (化合物7、8) 中,但是为了降低分子量,改善口服吸收性质,将含有苯基的帽子结构优化成了DSV中的异丙基取代[6]。而samatasvir则保留了一侧甲氧酰苯基甘氨酸帽子,同样获得了较好的药效表现和药代特征,samatasvir对基因1~5型HCV的体外抑制活性均很强,EC50值在2~24 pmol·L-1内,并且选择性指数大于5×107 [32]。这可能要归于分子整体性质的均衡表现。
Idenix公司开展了IDX719单独用药3天治疗 轻度GT-1~4型HCV感染的Ⅰ期临床试验,3天后GT-1、3和4型的HCV感染患者病毒水平均下降了3~4个Log10单位,并且不良反应较小,停药后没有观察到病毒反跳,但是对于带有NS5A蛋白M31基因突变的GT-2型感染患者没有显示出明显效果,说明该类患者存在明显的交叉耐药问题[33]。IDX719也开展了联合其他DAAs的临床试验,但结果未披露。
2.3.3 VelpatasvirVelpatasvir (GS-5816,17) 是Gilead公司的第二代NS5A抑制剂。Velpatasvir与elbasvir的结构相似,都是通过烷氧链形成骈合六元环增加刚性,并且在两翼部分引入了和samatasvir相同的不对称帽子 (甲氧酰缬氨酸和甲氧酰苯基甘氨酸); 同时,在两翼吡咯环上分别引入甲基和甲氧甲基进一步增加了两翼不对称性。这样的改变使得17具有了泛基因型抗病毒活性,其对GT1~6 HCV均有很好的抑制效果 (EC50 = 7~59 pmol·L-1) 和较低的细胞毒性 (CC50 > 44 mmol·L-1),选择性指数几乎高达109。而且,相比第一代NS5A抑制剂,velpatasvir在对耐药变异毒株和GT-2型 (2a和2b) 毒株均显示出更强的抑制效果[34]。
在velpatasvir联合sofosbuvir治疗GT1-6的 Ⅲ 期临床试验中,98% 的患者获得了持续性病毒应答 (SVR12),而且对于难治性丙肝和伴有肝硬化的丙肝患者也显示出显著效果[35, 36]。2015年10月Glead公司将日服一次的sofosbuvir/velpatasvir复方单片用于治疗GT1~6的丙肝患者的临床应用向FDA提出新药申请,并于2016年6月被FDA批准上市。
|
ACH-2928 (18) 是Achillion Pharmaceuticals公司早期开发的品种,其将DSV中联苯结构用二乙撑结构固定提高了刚性,并在两翼部分的吡咯烷上也增加了间位的甲基取代。在抗病毒活性方面,18与DSV相当,但其半衰期长,口服吸收好,药代性质更优[37]。在18的结构基础上,Achillion的研究人员在两翼部分的吡咯烷上引入桥环结构,找到了更为优秀的第二代NS5A抑制剂odalasvir (ACH-3102,19),这一结构改造显著提高了对GT-1a的抑制活性,并且提高了对耐药变异毒株的抑制活性。19的Ⅰ期临床数据表明: 单剂量用于GT-1a感染者时,血浆HCV RNA水平降低了约3到4个Log10,同时耐受性良好[38]。在odalasvir联合sofosbuvir治 疗GT-1型HCV患者的Ⅱ期临床试验中,在经过6周治疗后100% 的患者获得了持续病毒学应答 (SVR12),有效地缩短了治疗周期,未来Achillion拟进行治疗周期为4周的odalasvir联合sofosbuvir治疗方案 探索[39]。
2.3.5 ABT-530ABT-530 (20) 是AbbVie公司继ABT-267之后研发的第二代NS5A抑制剂,其保留了与ABT-267相同的顺式2,5-二苯基吡咯烷骨架,但 是吡咯烷的N-1位苯基上连接了吸电性和极性都明显增强的取代基,同时吡咯烷两端的苯环在C-1位都引入了F取代,相对固定了核心结构的构象,同样起到了增加刚性的作用,而且A、B两个片段采用减毒的电子等排策略,将酰胺进行成环优化形成苯并咪唑的结构。不同于以往的DSV类似物,ABT-530在 两翼的帽子端用苏氨酸代替了缬氨酸,是对该类抑制剂结构修饰一个新变化。ABT-530对HCV各基因亚型 (GT-1a、1b、2a、2b、3a、4a、5a和6a) 的体外抑制活性有了进一步的提高 (EC50 < 5 pmol·L-1),同时对现有的多种HCV NS5A抑制剂耐药变异毒 株的抑制活性也在低皮摩尔水平[40, 41]。ABT-530和NS3/4A蛋白激酶抑制剂ABT-493联合应用的Ⅱ期临床试验结果表明,经过12周的治疗,HCV GT-1、GT-2和GT-3型感染者的持续病毒学应答率(SVR12) 分别达到了98%~100%、96%~100% 和83%~94%。而对于无肝硬化的HCV GT-1a型慢性感染患者,经过8周的治疗有97% 的患者获得了持续性病毒应答 (SVR12)[42-44]。
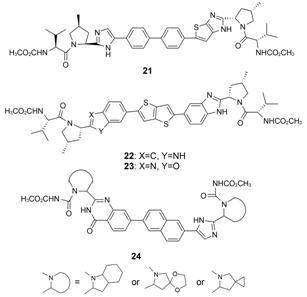
2.3.6 处于临床前研究阶段的DSV类似物Vertex公司的研究人员也打破DSV分子的C2轴对称结构,先合成了一系列中心结构区B片段的咪唑被其电子等排体噻吩并咪唑基团替换的不对称结构类似物。研究[45]发现化合物21对HCV具有皮摩尔浓度的体外抑制活性 (对GT-1a和1b的EC50分别是8和17 pmol·L-1),研究也考察了该化合物在动物体内药代动力学性质,但无论是半衰期还是生物利用度均没有显示出明显优势。需要指出的是,这一系列化合物在两翼部分的吡咯烷上也增加了间位的甲基取代,但是较早的文献[46]中并没有表明这一变化对该类结构药效的影响,在后续研究和文章中才系统证实了在两翼的吡咯烷间位引入甲基可以提高对HCV GT-1a的抑制活性的结论,并且明确了甲基连接碳的手性优势构型为S型; 同时,Henderson等[47]借鉴了samatasvir结构中的二噻吩骈合环结构,并用多种骈合芳杂环等排体对A、B两个片段分别进行替换,设计合成并证实了多个新型HCV NS5A抑制剂,如化合物22和23均对GT-1a和1b显示出皮摩尔浓度级的抑制活性,但遗憾的是,后来的研究显示这类化合物的口服生物利用度较低 (F < 10%)。
Vandyck等[48]还设计合成了一系列核心结构与PPI-668相同,但A片段为喹唑啉酮结构的HCV NS5A抑制剂 (24),并申请了专利保护。这类化合物的另一个结构特点是在两翼的吡咯烷上引入了螺环或桥环。但文献仅报道了化合物对HCV GT-1a和GT-1b的活性,而且活性强度相比现在的上市品种没有显示出明显优势。
|
除了DSV及其类似物,其他新颖结构类型的HCV NS5A抑制剂鲜有报道,而且多数缺乏系统的机制确证,因此,这里只做简单概述。
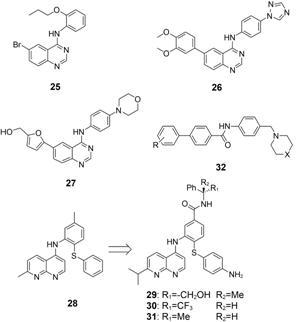
3.1 N-取代氨基喹唑啉基于蛋白激酶的ATP模拟物设计理念,Mathews等[49]意外发现作用于NS5A蛋白的HCV抑制剂先 导物25,对其进行结构优化发现了26,其对HCV GT-1a和GT-1b抑制活性的EC50分别为550和270 nmol·L-1。对同类化合物27进一步的作用机制研究发现,该类化合物通过抑制PI4KⅢα酶进而调节PI4P的细胞水平以达到抑制HCV目的。虽然26进入到临床研究,但由于口服给药后低血浆暴露量缺陷无法得到改善,导致其于2009年被终止研究[50]。
3.2 N-取代氨基萘啶AbbVie公司的研究人员在亚基因组复制子的研究中发现化合物28具有抗HCV活性,经过机制研究发现其作用靶点是NS5A蛋白 (未公开)。DeGoey等[51]在28的基础上进行构效关系研究,发现化合物29、30和31对GT-1型HCV具有较强的抑制活性 (纳摩尔浓度级),经过进一步的药代动力学测试,确定化合物29 (A-972338) 为治疗HCV感染的候选物,并拟进行大猩猩体内药代动力学研究,但未见后续研究结果的报道。
|
ARROW公司在早期就证实了N-苯基联苯甲酰胺类化合物32的HCV抑制活性,在机制不明的情况下,经过多轮的结构优化,将活性提高了上百倍 (EC50为数10 pmol·L-1),并且证实了这类化合物抑制HCV GT-1a的研究潜力,对这类化合物申请了多项专利保护,但未见后续的研究报道[52-54]。只是Merck公司的HCV NS5A抑制剂MK-4882似乎是在这类化合物的研究基础上发现的[55]。
4 结语相比其他机制的HCV抑制剂,HCV NS5A抑制剂的优势很明显,如抗病毒活性更强、清除病毒快速、具有对多种基因型HCV的抑制活性,而且不易产生药物相互作用。但是NS5A抑制剂的问题也很 明显,如结构类型多样性差可能导致容易发生交叉耐药; DSV及其类似物的分子量大,药代性质欠佳; 手性中心多导致药物经济学问题明显; 而且,HCV NS5A本身没有酶催化活性,具体作用机制却并不清楚,也限制了药物研发的进度。更严峻的问题是,直接抗病毒药物的耐药问题无法避免,HCV NS5A抑制剂也不例外。因此,单一的直接抗病毒剂很难治愈HCV感染而不出现耐药,对于难治性HCV感染更是面临很大挑战。因此,目前HCV治疗药物研究并不完美,距离在全球范围清除HCV感染还有很长的路要走,不同作用机制的HCV抑制剂联合才是最理想的治疗方案。HCV NS5A抑制剂已经越来越多的被 发现并成为HCV鸡尾酒疗法的重要组成之一,相信随着机制研究的深入,应该会有更具优势的HCV NS5A抑制剂被发现,为慢性HCV感染甚至难治性HCV感染患者提供更安全有效的治疗选择。
| [1] | http://www.who.int/mediacentre/factsheets/fs164/en/. |
| [2] | Lambert SM, Langley DR, Garnett JA, et al. The crystal structure of NS5A domain 1 from genotype 1a reveals new clues to the mechanism of action for dimeric HCV inhibitors[J]. Protein Sci , 2014, 23 :723–734. DOI:10.1002/pro.v23.6 |
| [3] | Polyak SJ, Khabar KS, Paschal DM, et al. Hepatitis C virus nonstructural 5A protein induces interleukin-8, leading to partial inhibition of the interferon-induced antiviral response[J]. J Virol , 2001, 75 :6095–6106. DOI:10.1128/JVI.75.13.6095-6106.2001 |
| [4] | Janardhan SV, Reau NS. Should NS5A inhibitors serve as the scaffold for all-oral anti-HCV combination therapies?[J]. Hepat Med , 2015 :711–720. |
| [5] | Liu D, Ji J, Ndongwe TP, et al. Fast hepatitis C virus RNA elimination and NS5A redistribution by NS5A inhibitors studied by a multiplex assay approach[J]. Antimicrob Agents Chemother , 2015, 59 :3482–3492. DOI:10.1128/AAC.00223-15 |
| [6] | O'Boyle DR 2nd, Nower PT, Lemm JA, et al. Development of a cell-based high-throughput specificity screen using a hepatitis C virus-bovine viral diarrhea virus dual replicon assay[J]. Antimicrob Agents Chemother , 2005, 49 :1346–1353. DOI:10.1128/AAC.49.4.1346-1353.2005 |
| [7] | Gao M, Nettles RE, Belema M, et al. Chemical genetics strategy identifies an HCV NS5A inhibitor with a potent clinical effect[J]. Nature , 2010, 465 :96–100. DOI:10.1038/nature08960 |
| [8] | Belema M, Lopez OD, Bender JA, et al. Discovery and development of hepatitis C virus NS5A replication complex inhibitors[J]. J Med Chem , 2014, 57 :1643–1672. DOI:10.1021/jm401793m |
| [9] | Belema M, Nguyen VN, Bachand C, et al. Hepatitis C virus NS5A replication complex inhibitors: the discovery of daclatasvir[J]. J Med Chem , 2014, 57 :2013–2032. DOI:10.1021/jm401836p |
| [10] | Belema M, Meanwell NA. Discovery of daclatasvir, a pan-genotypic hepatitis C virus NS5A[J]. J Med Chem , 2014, 57 :5057–5071. DOI:10.1021/jm500335h |
| [11] | Love RA, Brodsky O, Hickey MJ, et al. Crystal structure of a novel dimeric form of NS5A domain I protein from hepatitis C virus[J]. J Virol , 2009, 83 :4395–4403. DOI:10.1128/JVI.02352-08 |
| [12] | O'Boyle li DR, Sun JH, Nower PT, et al. Characterizations of HCV NS5A replication complex inhibitors[J]. Virology , 2013, 444 :343–354. DOI:10.1016/j.virol.2013.06.032 |
| [13] | Kumada H, Suzuki Y, Ikeda K, et al. Daclatasvir plus asunaprevir for chronic HCV genotype 1b infection[J]. Hematology , 2014, 59 :2083–2091. |
| [14] | Aghemo A, De Francesco R. Daclatasvir: a team player rather than a prima donna in the treatment of hepatitis C[J]. Gut , 2015, 64 :6860–6862. |
| [15] | Nelson DR, Cooper JN, Lalezari JP, et al. All-oral 12-week treatment with daclatasvir plus sofosbuvir in patients with hepatitis C virus genotype 3 infection: ALLY-3 Phase III Study[J]. Hematology , 2015, 61 :1127–1135. |
| [16] | Bachand C, Belema M, Deon DH, et al. Hepatitis C virus inhibitors: WO 2008021928 [P]. 2007-8-9. |
| [17] | Ivachtchenko AV, Mitkin OD, Yamanushkin PM, et al. Discovery of novel highly potent hepatitis C virus NS5A inhibitor (AV4025)[J]. J Med Chem , 2014, 57 :7716–7730. DOI:10.1021/jm500951r |
| [18] | Degoey DA, Randolph JT, Liu D, et al. Discovery of ABT-267, a pan-genotypic inhibitor of HCV NS5A[J]. J Med Chem , 2014, 57 :2047–2057. DOI:10.1021/jm401398x |
| [19] | Hézode C, Asselah T, Reddy KR, et al. Ombitasvir plus paritaprevir plus ritonavir with or without ribavirin in treatment-naive and treatment-experienced patients with genotype 4 chronic hepatitis C virus infection (PEARL-I): a randomised, open-label trial[J]. Lancet , 2015, 385 :2502–2509. DOI:10.1016/S0140-6736(15)60159-3 |
| [20] | http://allachem.com/allachem-llc-completes-phase-ibiia-clinical-study-with-av4025-an-hcv-ns5a-inhibitor/. |
| [21] | Coburn CA, Meinke PT, Chang W, et al. Discovery of MK-8742: an HCV NS5A inhibitor with broad genotype activity[J]. ChemMedChem , 2013, 8 :1930–1940. DOI:10.1002/cmdc.v8.12 |
| [22] | Rockstroh JK, Nelson M, Katlama C, et al. Efficacy and safety of grazoprevir (MK-5172) and elbasvir (MK-8742) in patients with hepatitis C virus and HIV co-infection (C-EDGE CO-INFECTION): a non-randomised, open-label trial[J]. Lancet Hiv , 2015, 2 :319–327. DOI:10.1016/S2352-3018(15)00114-9 |
| [23] | Lalezari JP, Farrell GC, Shah PS, et al. PPI-668, a potent new pan-genotypic HCV NS5A inhibitor: Phase 1 efficacy and safety[J]. Hematology , 2012, 56 (Suppl 1) :1065A–1066A. |
| [24] | Lalezari J, Holland L, Glutzer E, et al. Rapid and consistent virologic responses in a phase 2 trial of a new all-oral combination of faldaprevir, deleobuvir and PPI-668, with and without ribavirin, in patients with HCV genotype-1a infection[J]. Hematology , 2013, 58 (Suppl 1) :1389A. |
| [25] | Kazmierski WM, Maynard A, Duan MS, et al. Novel spiroketal pyrrolidine GSK2336805 potently inhibits key hepatitis C virus genotype 1b mutants: from lead to clinical compound[J]. J Med Chem , 2014, 57 :2058–2073. DOI:10.1021/jm4013104 |
| [26] | Bechtel J, Crosby R, Wang A, et al. In vitro profiling of GSK2336805, a potent and selective inhibitor of HCV NS5A[J]. J Hepatol , 2011, 54 (Suppl 1) :S307–S308. |
| [27] | Wilfret DA, Walker J, Adkison KK, et al. Safety, tolerability, pharmacokinetics, and antiviral activity of GSK2336805, an inhibitor of hepatitis C virus (HCV) NS5A, in healthy subjects and subjects chronically infected with HCV genotype 1[J]. Antimicrob Agents Chemother , 2013, 57 :5037–5044. DOI:10.1128/AAC.00910-13 |
| [28] | http://clinicaltrials.gov/ct2/show/NCT01648140. |
| [29] | Link JO, Taylor JG, Xu L, et al. Discovery of ledipasvir (GS-5885): a potent, once-daily oral NS5A inhibitor for the treatment of hepatitis c virus infection[J]. J Med Chem , 2014, 57 :2033–2046. DOI:10.1021/jm401499g |
| [30] | Afdhal N, Reddy KR, Nelson DR, et al. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection[J]. N Engl J Med , 2014, 370 :1483–1493. DOI:10.1056/NEJMoa1316366 |
| [31] | Bilello JP, Lallos LB, McCarville JF, et al. In vitro activity and resistance profile of samatasvir, a novel NS5A replication inhibitor of hepatitis C virus[J]. Antimicrob Agents Chemother , 2014, 58 :4431–4442. DOI:10.1128/AAC.02777-13 |
| [32] | Vince B, Hill JM, Lawitz EJ, et al. A randomized, double-blind, multiple-dose study of the pan-genotypic NS5A inhibitor samatasvir in patientsinfected with hepatitis C virus genotype 1, 2, 3 or 4[J]. J Hepatol , 2014, 60 :920–927. DOI:10.1016/j.jhep.2014.01.003 |
| [33] | Cheng G, Yu M, Peng B, et al. GS-5816, a second-generation HCV NS5A inhibitor with potent antiviral activity, broad genotypic coverage, and a high resistance barrier[J]. J Hepatol , 2013, 58 (Suppl 1) :S484–S485. |
| [34] | Foster GR, Afdhal N, Roberts SK, et al. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 infection[J]. N Engl J Med , 2015, 373 :2608–2617. DOI:10.1056/NEJMoa1512612 |
| [35] | Feld JJ, Jacobson IM, Hézode C, et al. Sofosbuvir and velpatasvir for HCV genotype 1, 2, 4, 5, and 6 infection[J]. N Engl J Med , 2015, 373 :2599–2607. DOI:10.1056/NEJMoa1512610 |
| [36] | Curry MP, O'Leary JG, Bzowej N, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis[J]. N Engl J Med , 2015, 373 :2618–2628. DOI:10.1056/NEJMoa1512614 |
| [37] | Huang M, Yang G, Patel D, et al. ACH-2928: a novel high potent HCV NS5A inhibitor with favorable preclinical characteristics[J]. J Hepatol , 2013, 54 :S479. |
| [38] | Muir A, Hill J, Lawitz E, et al. ACH-3102, a second generation NS5A inhibitor, demonstrates potent antiviral activity in patients with genotype 1a HCV infection despite the presence of baseline NS5A-resistant variants[J]. J Hepatol , 2013, 58 :S360. |
| [39] | Gane E, Schwabe C, Mader M, et al. Sustained virologic response after ACH-3102 and sofosbuvir treatment for 8 or 6 weeks: a phase 2 "Proxy" study[J]. J Hepatol , 2013, 58 (Suppl 1) :S266. |
| [40] | Teresa NG, Pilot-Matias TJ, Krishnan P, et al. Methods for treating hepatitis C: WO 2014047039 [P]. 2014-03-07. |
| [41] | Teresa NG, Krishnan P, Kati W, et al. ABT-530, an HCV NS5A inhibitor with potent pangenotypic activity and high genetic barrier to resistance. 21st Annual Conference on Retroviruses and Opportunistic Infections (CROI) [C]. Boston, Massachusetts, United States, March 3-6, 2014. http://www.natap.org/2014/CROI/croi_11.htm |
| [42] | Poordad F, Felizarta F, Asatryan A, et al. 98%-100% SVR4 in HCV genotype 1 non-cirrhotic treatment-naive or pegylated interferon/ribavirin null responders with the combination of the next generation NS3/4A protease inhibitor ABT-493 and NS5A inhibitor ABT-530 (SURVEYOR-1)[J]. Hematology , 2015, 62 (Suppl 1) :228A–229A. |
| [43] | Kwo PY, Bennett M, Wang S, et al. High SVR4 rates achieved with the next generation NS3/4A protease inhibitor ABT-493 and NS5A inhibitor ABT-530 in non-cirrhotic treatment-naive and treatment-experienced patients with HCV genotype 3 infection (SURVEYOR-2)[J]. Hematology , 2015, 65 (Suppl 1) :337A–338A. |
| [44] | Wyles D, LSulkowski MS, Wang S, et al. Inhibitor ABT-530 in non-cirrhotic treatment-naive and treatment-experienced patients with HCV genotype 2 infection (SURVEYOR-2)[J]. Hematology , 2015, 65 (Suppl 1) :339A–340A. |
| [45] | Giroux S, Xu J, Reddy TJ, et al. Discovery of thienoimidazole-based HCV NS5A genotype 1a and 1b inhibitors[J]. ACS Med Chem Lett , 2013, 5 :240–243. |
| [46] | Henderson JA, Bilimoria D, Bubenik M, et al. Benzimidazole-containing HCV NS5A inhibitors: effect of 4-substituted pyrrolidines in balancing genotype 1a and 1b potency[J]. Bioorg Med Chem Lett , 2015, 25 :944–947. DOI:10.1016/j.bmcl.2014.12.045 |
| [47] | Henderson JA, Bilimoria D, Bubenik M, et al. Synthesis and evaluation of NS5A inhibitors containing diverse heteroaromatic cores[J]. Bioorg Med Chem Lett , 2015, 25 :948–951. DOI:10.1016/j.bmcl.2014.12.042 |
| [48] | Koen V, Raboisson PJMB. Quinazolinone derivatives as HCV inhibitors: WO 2013098320 A1 [P]. 2013-07-04. |
| [49] | Bianco A, Reghellin V, Donnici L, et al. Metabolism of phosphatidylinositol 4-kinase IIIa-dependent PI4P is subverted by HCV and is targeted by a 4-anilino quinazoline with antiviral activity[J]. PLoS Pathog , 2012, 8 :e1002576. DOI:10.1371/journal.ppat.1002576 |
| [50] | Makonen B, Lopez OD, Bender JA, et al. Discovery and development of hepatitis C virus NS5A replication complex inhibitors[J]. J Med Chem , 2014, 57 :1643–1672. DOI:10.1021/jm401793m |
| [51] | Degoey DA, Betebenner DA, Grampovnik DJ, et al. Discovery of pyrido[J]. Bioorg Med Chem Lett , 2013, 23 :3627–3630. DOI:10.1016/j.bmcl.2013.04.009 |
| [52] | Wheelhouse CJ, Thomas AJF, Bushnell, et al. Biphenyl derivatives and their use in treating hepatitis C: WO 2007031791 [P]. 2006-9-18. |
| [53] | Carter MC, Cockerill S, Flack SS, et al. Heterocylic derivatives and their use in treating hepatitis C: WO 2009034390 [P]. 2008-9-12. |
| [54] | Carter MC, Mathews N. Novel biphenyl compounds useful for the treatment of hepatitis C: WO 2010094977 [P]. 2010-2-22. |
| [55] | Conte I, Giuliano C, Ercolani C, et al. Synthesis and SAR of piperazinyl-N-phenylbenzamides as inhibitors of hepatitis C virus RNA replication in cell culture[J]. Bioorg Med Chem Lett , 2009, 19 :1779–1783. DOI:10.1016/j.bmcl.2009.01.066 |
 2016, Vol. 51
2016, Vol. 51


