2. 天津药物研究院, 释药技术与药代动力学国家重点实验室, 天津 300193 ;
3. 贵州省中国科学院天然产物化学重点实验室, 贵州 贵阳 550002
2. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China ;
3. The Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences, Guiyang 550002, China
药物在体内的吸收、分布、代谢和排泄与药物的跨膜转运密切相关,介导药物跨膜转运的药物转运体在体内广泛分布[1]。一些水溶性、荷电性或与营养物质类似的药物可通过转运体介导的转运机制进行跨膜转运[2, 3],而组织和器官上转运体的存在决定某些药物靶向部位及非靶部位的分布程度[4],因此,阐明体内动态过程的药物转运体,对解析药物的有效性、安全性和毒性具有非常重要的意义。美国食品和药品管理局在2012年公布的指南中详细阐述了新药研发中基于药物转运体的研究内容,并规范了相关转运体的评价标准[5]。
具有自主知识产权的抗乙肝候选新药替芬泰 (研究中曾用名: Y101) 是从抗乙肝病毒苗药马蹄金 (Dichondra repens Forst.) 的主要活性成分马蹄金素设计和合成的苯丙酸二肽衍生物,与以往抗乙肝 病毒药物相比,Y101具有新型化学骨架[6],并有良好的抗乙肝病毒作用,且无细胞毒作用,其抗病毒机制与核苷类似物不同,不易产生耐药性及停药反跳现象[7-10],具有良好开发前景。
前期的临床前药代动力学评价研究结果表明,灌胃给予大鼠Y101,出现生物利用度较低和较大的个体间差异,已有诸多文献[11-14]报道这些现象的发生均可能与外排转运体P-糖蛋白 (P-gp) 有关。另外,Y101在肝组织中的浓度远远大于其他组织和血浆,这可能与肝脏摄入型转运体有关联,因此有必要契合Y101在研究开发过程中的需要,对Y101在体内的转运过程进行研究。
人结肠腺癌细胞 (Caco-2),具有和小肠上皮细胞相似的形态和功能,可用于筛选药物肠道渗透性和预测药物口服吸收利用度。人多药耐药基因 (MDR1) 稳定转染马丁达比犬肾上皮细胞 (MDCK) 建立的专一过表达P-gp的细胞系,是用来筛选P-gp底物的权威模型[15]。HEK293-hOATP1B1和HEK293-hOATP2B1细胞模型是人有机阳离子转运多肽 (hOATP1B1和hOATP2B1) 稳定转染人胚肾细胞 (HEK293) 建立的细胞系。CHO-PEPT1细胞模型是人H+/寡肽共转运蛋白 (PEPT1) 稳定转染中国仓鼠卵巢细胞 (CHO) 建立的细胞系。上述几种非极性转染的细胞模型是目前体外转运体研究的主要细胞系。本研究应用Caco-2细胞和基因转染细胞模型MDCK-MDR1、HEK293- hOATP1B1、HEK293-hOATP2B1和CHO-PEPT1分别对外排转运体P-gp和摄取型转运体OATP1B1、OATP2B1和PEPT1进行初步研究,以期对大鼠体内研究出现的诸多现象进行合理解释,为Y101的进一步开发提供理论依据。
材料与方法药品与试剂 Y101由贵州省中国科学院天然产物化学重点实验室合成,批号20110302; 内标苯海拉明为中国食品药品检定研究院产品,批号0903091; 咖啡因为天津中安药业有限公司生产,批号TC2003200; 罗丹明123、Hank’s平衡盐溶液 (HBSS) 为Sigma公司出品; Dulbecco’s磷酸盐缓冲液 (DPBS)、胰蛋白酶 (0.25% Trypsin-EDTA)、胎牛血清 (FBS) 和细胞冻存液均为Gibco公司产品; 3H-硫酸雌酮 (3H-ES) 为中国同位素公司产品; 3H-甘氨酰肌氨酸 (3H-GlySar) 为美国ARC公司产品; 二甲基亚砜为天津市凯信化学工业有限公司产品; 高糖培养基 (DMEM) 为美国Hyclone公司产品。液相色谱-质谱所用有机溶剂均为色谱纯; 去离子水为北京中盛茂源科技发展有限公司纯水制备系统自制。
细胞株 Caco-2细胞由中国医学科学院基础医学细胞中心提供; MDCK-MDR1、MDCK-Wild细胞、HEK293-hOATP1B1、HEK293-hOATP2B1、HEK293- mock、CHO-PEPT1和CHO-mock细胞均由日本富士生物医药研究所提供。
仪器 Olympus-CKX41倒置显微镜为日本Olympus公司产品; 二氧化碳培养箱为美国Thermo公司产品; illcell ERS-2跨上皮电阻仪为美国Millipore公司产品; 12孔聚碳酸酯膜转运板为美国Corning公司产品; Tri-Carb 2910 TR放射性液体闪烁仪为PerkinElmer公司产品; ZHWY-上海智诚恒温振荡器为北京华威兴业科技有限公司产品; API 4000 QTRAP液相色谱-质谱仪 (LC-MS) 为美国Applied Bi osystems公司产品; Shimadzu 10A液相色谱-紫外仪 (HPLC-UV) 为日本Shimadzu公司产品。
细胞培养 细胞复苏后,将Caco-2、MDCK-MDR1细胞置于常规培养皿内,以DMEM为培养基 (含10% FBS),在37 ℃、5% CO2和相对湿度90% 的培养箱内培养,培养基隔日更换,Caco-2细胞培养4~5日,MDCK-MDR1细胞培养1~2日即达到融合。当细胞覆盖盘底80%~90% 时,用含EDTA的胰酶消化,并用新鲜培养基调整细胞密度至每毫升细胞数为2×105,接种于Transwell聚碳酸酯膜12孔板中,在细胞层顶端每孔加0.5 mL细胞悬液,基底端每孔加1.5 mL新鲜培养基。Caco-2细胞培养前两周每隔1日换液一次,以后每日换液,连续培养至21日,得到完全分化的细胞单层。MDCK-MDR1细胞连续培养6日即得到完全分化的细胞单层。
HEK293-hOATP1B1、HEK293-hOATP2B1和CHO- PEPT1细胞的培养过程基本同MDCK-MDR1细胞 的培养。将细胞从培养皿中消化下来,使用培养基调整HEK293-OATP1B1和HEK293-OATP2B1细胞数 至每毫升为1×105,CHO-PEPT1细胞数则调整至每毫升为2×105,随后接种于24孔板中,每孔接种1 mL,培养48 h后进行实验。整个过程需在严格无菌条件下操作。本实验所用HEK293-hOATP1B1和HEK293- hOATP2B1细胞系均为25代,CHO-PEPT1细胞为 20代。
单层细胞的跨膜电阻值跨膜电阻值 (TEER) 提供跨细胞单层的离子流电阻信息,与细胞间紧密连接的完整性相关。测定时首先将电极放入预热至37 ℃的HBSS中平衡; 移走培养板中的培养基,加入HBSS,在细胞顶端 (apical,AP) 侧每孔加0.5 mL,细胞基底面 (basolateral,BL) 侧每孔加1.5 mL,37 ℃培养箱内平衡20 min,洗去细胞表面的杂质; 移走HBSS,重新加入预热的HBSS,测定TEER; 用1个空白载体重复上述步骤以获得空白值,按照公式1计算TEER值。
| $\text{TEER}=\left( \text{测定电阻值}-\text{空白值} \right)\times \text{单层表面积}$ | (1) |
CHO-PEPT1细胞的功能验证 甘氨酰肌氨酸 (GlySar) 是转运体PEPT1的标准转运底物,通过比较CHO-PEPT1细胞和CHO-mock细胞对于3H-GlySar摄取能力的差异,评价CHO-PEPT1细胞的转运功能。3H-GlySar以DPBS缓冲液稀释至50 nmol·L-1。按上述细胞培养方法培养48 h后,吸去24孔板中的培养基,以37 ℃的DPBS缓冲液清洗一次后,加入37 ℃的DPBS缓冲液孵育10 min; 吸去缓冲液,加入3H-GlySar,给药体积为500 μL,孵育2 min,确保每孔给药时间的一致性,保证每孔给药时间误差不超过2 s。给药结束后,吸去含3H-GlySar的溶液,以 0 ℃预冷的DPBS缓冲液清洗3次,终止转运过程并除去细胞外3H-GlySar。每孔加入0.1 mol·L-1 NaOH 500 μL,吹打数次,将NaOH溶液转移至液闪瓶中,加入3 mL闪烁液,涡旋30 s混匀后,用放射性液闪仪进行测定。
HEK293-hOATP1B1、HEK293-hOATP2B1细胞的功能验证 硫酸雌酮 (ES) 是转运体OATP1B1和OATP2B1的标准转运底物,通过分别比较HEK293- hOATP1B1、HEK293-hOATP2B1和HEK293-mock细胞对于3H-ES摄取能力的差异,评价HEK293- hOATP1B1、HEK293-hOATP2B1细胞的转运功能。3H-ES以DPBS缓冲液稀释至50 nmol·L -1,其余实验步骤基本同CHO-PEPT1细胞的功能验证。
转运实验 实验目的: ① 检测咖啡因在Caco-2、MDCK-MDR1细胞单层AP→BL的转运,用于验证细胞单层完整性; ② 罗丹明123的AP→BL和BL→ AP方向的转运,用于验证Caco-2和MDCK-MDR1细胞的P-gp功能; ③ Y101的双向转运,用于考察Y101对P-gp的作用。配制含上述药物的HBSS,吸去Transwell小室的培养基,加入37 ℃预热的空白HBSS溶液,37 ℃平衡20 min,吸去空白HBSS溶液; AP→BL方向的转运实验是在AP端加入0.5 mL预热的含药的HBSS溶液,BL端加入1.5 mL空白HBSS溶液; 而BL→AP方向的转运实验是在AP端加入 0.5 mL空白HBSS溶液,BL端加入1.5 mL预热的 含药HBSS溶液; 37 ℃恒温振荡器培养1.5 h,振荡 器转速为80 r·min-1; 吸取BL端或AP端的转运液,LC-MS/MS法[16]测定转运液中的药物浓度。
数据处理与分析 Papp的大小反映了药物透过单层细胞的能力以及药物吸收的速度,见公式2[17]:
| ${{P}_{\text{app}}}=\frac{\text{d}Q}{\text{d}t\times A\times {{C}_{0}}}$ | (2) |
其中,dQ为药物在dt时间内透过的量 (单位为μmol·min-1),A为聚碳酯膜的表面积 (本实验中为1.13 cm2),C0为初始浓度 (单位为μmol·L-1),Papp的单位为cm·s-1。外排率 (efflux ratio,RE) 代表药物外排能力的大小,通过它可以预测药物在肠吸收是否存在外排机制。当所测药物的纯外排比率 ≥2时,表示该药物可能为P-gp的底物,需要做进一步研究[18]。对Caco-2细胞和MDCK-MDR1细胞外排率的计算 见公式3,每个数据点为平行3孔的平均值,用x± s表示,统计学处理采用t检验。
| $\text{Effluxratio}=\frac{{{P}_{\text{app}\left( \text{BL}-\text{AP} \right)}}}{{{P}_{\text{app}\left( \text{AP}-\text{BL} \right)}}}$ | (3) |
Y101 对 HEK293-hOATP1B1 和 HEK293- hOATP2B1的抑制作用 通过比较细胞在Y101存 在及不存在的情况下对3H-ES摄取能力的差异,研 究Y101对转运体OATP1B1和OATP2B1的抑制作用。实验步骤如下: ① HEK293-hOATP1B1、HEK293- hOATP2B1及HEK293-mock细胞消化后接种于24孔板中培养48 h; ② 用DPBS缓冲液配制浓度为600 μmol·L-1的Y101,并在其中添加3H-ES; ③ 吸去24孔板中的培养基,以37 ℃的DPBS缓冲液清洗一次,之后加入37 ℃的DPBS缓冲液孵育10 min,吸去缓冲液,分别给予含Y101和不含Y101的同浓度3H-ES,孵育2 min; ④ 给药结束后,吸去3H-ES溶液,以0 ℃预冷的DPBS缓冲液清洗3次,终止转运过程并洗去细胞外3H-ES。每孔加入0.1mol·L-1NaOH 500 μL以溶解细胞,吹打数次,将细胞裂解溶液转移至液闪瓶中,加入3 mL闪烁液,混匀后以放射性液闪仪进行测定。
Y101 对转运体 PEPT1 的抑制作用 通过比较细胞在Y101存在及不存在的情况下对3H-GlySar摄取能力的差异,研究Y101对转运体PEPT1的抑制作用。实验步骤如下: ① CHO-PEPT1及CHO-mock细胞消化后接种于24孔板培养48 h; ② 配制的DPBS缓冲液pH 6[19, 20],用该DPBS缓冲液配制浓度为 50 μmol·L-1的Y101,并在其中添加3H-GlySar; ③ 吸去24孔板中的培养基,以37 ℃的DPBS缓冲液清 洗一次,之后加入37 ℃的DPBS缓冲液孵育10 min; 吸去缓冲液,分别给予含Y101和不含Y101的同 浓度3H-GlySar,孵育2 min; ④ 给药结束后,吸去3H-GlySar溶液,以0 ℃预冷的DPBS缓冲液清洗3次,终止转运过程并洗去细胞外3H-GlySar。每孔加入0.1 mol·L-1 NaOH溶液500 μL以溶解细胞,吹打数次,将NaOH溶液转移至液闪瓶中,加入3 mL闪烁液,混匀后以放射性液闪仪进行测定。
基于LC-MS/MS测定的细胞摄取 为了考察Y101是否为PEPT1、OATP1B1和OATP2B1的底 物,采用LC-MS/MS测定CHO-PEPT1、HEK293- hOATP1B1和HEK293-hOATP2B1细胞给予不同浓度Y101后摄取入细胞内的含量。实验步骤如下: ①DPBS缓冲液配制系列浓度的Y101; ② CHO-PEPT1、HEK293-hOATP1B1、HEK293-hOATP2B1细胞消化后,接种于24孔板培养48 h; ③ 吸去24孔板中的培养基,以37 ℃的DPBS缓冲液清洗一次,之后加入37 ℃的DPBS缓冲液孵育2 min; ④ 吸去含药溶液,以0 ℃预冷的HBSS缓冲液清洗3次,终止转运过程并洗去细胞外Y101。每孔加入500 μL 0.1 mol·L-1 NaOH溶液以溶解细胞,吹打数次,将细胞裂解液进行LC-MS/MS测定[16],计算Y101在上述细胞的摄取量。
结果 1 细胞模型的建立和功能验证 1.1 Caco-2和MDCK-MDR1细胞 1.1.1 测定单层细胞的跨膜电阻值随着培养时间的增加,Caco-2细胞单层TEER值逐渐增加,至21天达到450 Ω·cm2左右; MDCK-MDR1细胞单层两侧之间的跨膜电阻先增加后减少,在培养4天后达到最大,6天时细胞形态分化完成,形成致密单层,TEER值为 242 ± 10 Ω·cm2,均大于150 Ω·cm2时,表明Caco-2和MDCK-MDR1的细胞单层致密性和完整性符合实验要求[21]。
1.1.2 细胞单层完整性采用咖啡因的转运实验,通过HPLC-UV法测定转运液中咖啡因的含量,考察Caco-2和MDCK-MDR1的细胞单层完整性。通过计算Papp验证Caco-2和MDCK-MDR1细胞单层的致 密性,结果表明咖啡因在Caco-2细胞单层AP→BL方向的Papp值为 (16.5 ± 2.01)×10-6 cm·s-1; 在MDCK- MDR1细胞单层AP→BL方向的Papp值为 (17.7 ± 0.41) × 10-6 cm·s-1,均小于49×10-6 cm·s-1,表明Caco-2和MDCK-MDR1的细胞单层致密性良好,符合实验要求。
1.1.3 细胞单层P-糖蛋白功能验证采用罗丹明123的转运实验,通过HPLC-UV法测定转运液中罗丹明123的含量,验证Caco-2和MDCK-MDR1的细胞中P-gp功能。本实验采用罗丹明123和维拉帕米验证MDCK-MDR1细胞系P-gp的外排能力,其中 罗丹明123是P-gp的底物,维拉帕米是P-gp的抑 制剂。罗丹明123以及加入维拉帕米后在Caco-2和MDCK-MDR1细胞单层中双向转运的Papp值见图 1。Caco-2细胞对10 μmol·L-1罗丹明123的外排率为4.77,MDCK-MDR1细胞的外排率为18.0; 在AP和BL侧空白HBSS中加入10 μmol·L-1维拉帕米后,Caco-2细胞中罗丹明123的外排率降为2.00,MDCK-MDR1细胞中外排率降为3.07,说明2种细胞中P-gp功能良好,且MDCK-MDR1细胞具有较Caco-2更强的外排能力。
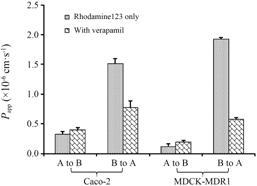
|
Figure 1 Effect of P-gp inhibitor verapamil on the transport of Rhodamine 123 across Caco-2 and MDCK-MDR1 cell monolayers. P-gp: P-glycoprotein; Caco-2: Human colon adenocarcinoma; MDCK: Mardin-Darby canine kidney; MDR1: Multidrug resistance; Papp: Apparent permeation coefficient. A: Apical side; B: Basolateral side. n = 3,x± s |
3H-GlySar给予mock细胞,GlySar摄入量液闪 响应平均值为225 dpm (n = 3),背景响应为43.1 dpm (n = 3),蛋白量采用Thermo公司的BCA蛋白试剂盒定量,CHO-PEPT1细胞系蛋白量为0.113 mg。CHO- PEPT1细胞与CHO-mock细胞相比,对3H-GlySar的摄取能力为CHO-mock细胞的35倍,表明CHO- PEPT1细胞的转运体功能良好,模型构建成功。
1.3 HEK293-hOATP1B1和HEK293-hOATP2B1 细胞3H-硫酸雌酮给予mock细胞,ES摄入量液闪响应平均值为829 dpm (n = 3),背景响应为17.33 dpm (n = 3),蛋白量采用Thermo公司的BCA蛋白试剂盒定量,HEK293-OATP1B1细胞系蛋白量为0.15 mg,HEK293-OATP2B1细胞系蛋白量为0.13 mg。HEK293- hOATP1B1、HEK293-hOATP2B1细胞与HEK293-mock细胞相比,对3H-ES的摄取能力分别为HEK293-mock细胞的16倍和7倍,表明HEK293-hOATP1B1和HEK293-hOATP2B1细胞的转运体功能良好,模型构建成功。
2 Y101对P-gp转运体的抑制作用Y101在Caco-2细胞模型中的Papp(AP-BL)为1.09× 10-6 cm·s-1,表明Y101在肠道内为中等吸收 (20%~70%)[22]。在Caco-2细胞模型中的外排率为4.31,加入P-gp抑制剂维拉帕米,则降为2.17,说明Y101在肠道内可能存在外排机制,Y101可能为P-gp底物。Y101在MDCK-MDR1细胞模型中测得Y101的外排率为22.1; 加入P-gp抑制剂维拉帕米,降为3.10。由于MDCK-MDR1细胞中仅有外排转运体P-gp,而Y101在MDCK-MDR1细胞模型中的外排率远远大于在Caco-2细胞模型中的外排率 (4.31),说明Y101的外排主要由P-gp介导。Y101在Caco-2和MDCK- MDR1两种细胞单层中双向转运的Papp值及外排率见表 1。
| Table 1 Papp values of bentysrepinine (Y101) by di-directional transport across Caco-2 and MDCK-MDR1 cells. Papp: Apparent permeation coefficient; AP: Apical; BL: Basolateral; RE: Efflux rate. n = 3,x± s. **P < 0.01 vs Y101 only |
Y101对HEK293-OATP1B1和HEK293-OATP2B1细胞的3H-ES摄取能力的抑制作用结果见表 2,结果显示Y101对OATP1B1和OATP2B1两种转运体可能有弱的抑制作用。Y101摄取进入HEK293-OATP1B1和HEK293-OATP2B1细胞的LC-MS/MS测定结果 见图 2,结果显示,Y101经OATP1B1和OATP2B1介导转运的量与对照组的比值小于3,且各浓度与摄取量不成线性关系,因此Y101可能不是OATP1B1和OATP2B1转运体的底物。
| Table 2 Cellular uptake of 3H-ES into HEK293-OATP1B1,HEK293-OATP2B1 cells in the absence and presence of Y101. 3H-ES: 3H-Estrone sulfate; HEK293: Human embryonic kidney 293; OATP1B1: Organic anion transporting polypeptide 1B1; OATP2B1: Organic anion transporting polypeptide 2B1 |
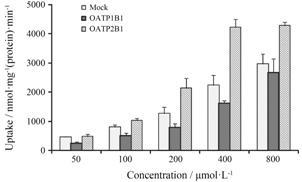
|
Figure 2 Cellular uptake of Y101 into HEK293-OATP1B1,HEK293-OATP2B1 and HEK293-mock cells. n = 3,x± s |
Y101对CHO-PEPT1细胞摄取3H-Glysar的抑 制作用结果见表 3,结果显示Y101对PEPT1转运体无抑制作用。Y101摄取进入CHO-PEPT1细胞的LC- MS/MS测定结果见图 3,结果显示Y101经PEPT1介导转运的量与对照组的比值小于3,且各浓度与摄取量不成线性关系,因此Y101可能不是PEPT1转运体 的底物。
| Table 3 Cellular uptake of 3H-Glysar into CHO-PEPT1 and CHO-mock cells in the absence and presence of Y101 |
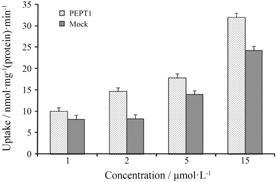
|
Figure 3 Cellular uptake of Y101 into CHO-PEPT1 and CHO- mock cells. CHO: Chinese hamster ovary; PEPT1: Peptide transporter1. n = 3,x± s |
应用转运体的体外研究方法评估转运体对药物作用的必要条件是转运蛋白需存在于一个活的细胞或膜系统中,因此成功构建表达转运体的细胞模型是所有体外转运体研究的基础。本研究采用Caco-2细胞模型以及非极性基因转染细胞模型MDCK- MDR1、HEK293-hOATP1B1、HEK293-hOATP2B1和CHO-PEPT1,评价Y101的被动扩散能力以及是否存在转运体介导的跨膜转运机制[23]。细胞模型的功能验证研究结果表明,上述细胞模型构建成功,能够应用于相关转运体的研究。
本研究采用同位素方法进行初期的筛选实验,发现Y101可能对OATP1B1和OATP2B1两种转运 体有抑制作用,进一步采用LC-MS/MS法对Y101 摄取进入HEK293-hOATP1B1和HEK293-hOATP2B1细胞内的含量进行测定,探讨Y101与OATP1B1和OATP2B1两种转运体的亲和性,由于Y101通过转运体OATP1B1和OATP2B1摄取进入细胞内的量与对 照组的比值小于3,且各浓度与摄取量不成线性关系,因此初步判断Y101可能不是OATP1B1和OATP2B1转运体的底物。
从化学结构上看,Y101是具有寡肽特征的苯丙酸二肽衍生物,预测寡肽转运体PEPT1可能是介导Y101肠道吸收机制,但研究结果表明Y101并非通过PEPT1介导转运,因此有必要继续探讨介导Y101摄取进入体内的转运机制。综合分析Y101的结构存在胺基的特点和SLC各转运体底物的特点,很可能存在由OCT或OCTN家族介导的有机阳离子的主动转运机制。为彻底阐明其与摄取转运体的亲和力,解析Y101在体内的动态过程,需在后续的实验进行深入研究。
如果一个候选化合物满足以下特征,包括相对分子质量大于400,N和O原子总和大于8,pKa大于 8的碱或pKa小于4的酸,其很有可能是P-gp的底物,此即判断P-gp可能底物的规则,称为“四规则”[24]。Y101的相对分子质量为489,pKa为8.77,符合“四规则”,虽然N和O原子的总和为4,但由于化合物的氢键受体数越多,被P-gp外排的可能性越大[25],因此不能排除Y101为P-gp底物的可能性。本实验在成功构建Caco-2和MDCK-MDR1两种细胞模型 的基础上,同时加入P-gp的特异性抑制剂维拉帕米,互补性地证明了Y101的外排主要由P-gp介导。
前期临床前药代动力学研究结果表明,Y101灌胃给药后的绝对生物利用度,大鼠为46.0%,而恒河猴仅为19.2%,且个体差异均较大。另外,Y101大鼠灌胃给药后,虽然在体内广泛分布,但脑组织中检测不到Y101 (上述数据未发表)。已有诸多文献[11-14]报道这些现象的发生均可能与外排转运体P-gp有关。由于大鼠、猴和犬与人相比,其P-gp功能没有明显差别[26],因此本文构建人源化细胞系,用来对大鼠和猴的体内结果进行比较分析。本研究表明Y101是P-gp的底物,P-gp介导的Y101外排成为Y101吸收的一道生物屏障,可能在细胞和分子水平上影响Y101在体内的吸收、分布、代谢和排泄过程,阻碍其在肠道的吸收,导致其在靶标的暴露减少,引起生物利用度的降低。这一结果不仅为Y101大鼠给药后生物利用度较低以及不能进入脑组织提供了有力的证据,其意义还在于临床用药时应关注与P-gp转运体底物类药物联合使用时出现不良反应的可能性,减少不良反应的发生。
| [1] | Yoshimichi S, Akira T. Transporter-mediated drug delivery:recent progress and experimental approaches[J]. Drug Discov Today , 2004, 9 :712–720. DOI:10.1016/S1359-6446(04)03198-8 |
| [2] | Tsuji A. Impact of transporter-mediated drug absorption,distribution,elimination and drug interactions in antimicrobial chemotherapy[J]. J Infect Chemother , 2006, 12 :241–250. DOI:10.1007/s10156-006-0478-3 |
| [3] | Ayrton A, Morgan P. Role of transport proteins in drug absorption,distribution and excretion[J]. Xenobiotica , 2001, 31 :469–497. DOI:10.1080/00498250110060969 |
| [4] | Kusuhara H, Sugiyama Y. Role of transporters in the tissueselective distribution and elimination of drugs:transporters in the liver,small intestine,brain and kidney[J]. J Control Release , 2002, 78 :43–54. DOI:10.1016/S0168-3659(01)00480-1 |
| [5] | U.S.Food and Drug Administration.Guidance for Industry:Drug Interaction Studies-study Design,Data Analysis,and Implications for Dosing and Labeling[S/OL].http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm292362.pdf,2012. |
| [6] | Xu BX, Huang ZM, Liu CX, et al. Synthesis and antihepatitis B virus activities of Matijing-Su derivatives[J]. Bioorg Med Chem , 2009, 17 :3118–3125. DOI:10.1016/j.bmc.2009.03.003 |
| [7] | Xu Y, Huang ZM, Xu BX, et al. Effect of phenylalanine dipeptide compounds 073 on duck hepatitis B virus[J]. Clin J New Drug Clin Rem (中国临床新药杂志) , 2010, 29 :217–220. |
| [8] | Xu Y, Huang ZM, Xu BX, et al. Effect of phenylalanine dipeptide compounds 073 on HBsAg and HBeAg of serection in cultured cell line 2.2.15[J]. Pharm J Chin PLA (解放军药学学报) , 2009, 25 :120–124. |
| [9] | Ma J, Xu BX, Huang ZM, et al. Protective effect of phenylalanine dipeptide compounds 190 on mouse models of CCl4 hepatic injury[J]. Pharm J Chin PLA (解放军药学学报) , 2009, 25 :383–386. |
| [10] | Meng FC, Xu WR, Li YZ, et al. In silico molecular docking study of repensine and bentysrepinine against HBV DNA polymerase[J]. Chin Herb Med , 2015, 25 :39–44. |
| [11] | Wada S, Kano T, Mita S, et al. The role of inter-segmental differences in P-glycoprotein expression and activity along the rat small intestine in causing the double-peak phenomenon of substrate plasma concentration[J]. Drug Metab Pharmacokinet , 2013, 28 :98–103. DOI:10.2133/dmpk.DMPK-12-RG-005 |
| [12] | Huisman MT, Smit JW, Wiltshire HR, et al. P-Glycoprotein limits oral availability,brain,and fetal penetration of saquinavir even with high doses of ritonavir[J]. Mol Pharmacol , 2001, 59 :806–813. |
| [13] | Wacher VJ, Silverman J, Zhang Y, et al. Role of P-glycoprotein and cytochrome P4503A in limiting oral absorption of peptides and peptidomimetics[J]. J Pharm Sci , 1998, 87 :1322–1330. DOI:10.1021/js980082d |
| [14] | Tan W, Chen H, Zhao J, et al. A study of intestinal absorption of bicyclol in rats:active efflux transport and metabolism as causes of its poor bioavailability[J]. J Pharm Pharm Sci , 2008, 11 :97–105. DOI:10.18433/J3B88V |
| [15] | Tang F, Horie K, Borchardt RT. Are MDCK cells transfected with the human MDR1 gene a good model of the human intestinal mucosa?[J]. Pharm Res , 2002, 19 :765–772. DOI:10.1023/A:1016140429238 |
| [16] | Fan H, Li R, Gu Y, et al. Quantitation of bentysrepinine (Y101) in rat plasma by liquid chromatography tandem mass spectrometry:application to pharmacokinetic study[J]. J Chromatogr B , 2012, 889-890 :103–109. DOI:10.1016/j.jchromb.2012.02.002 |
| [17] | Artursson P, Palm JE. Correlation between oral drug absorption in humans and apparent drug permeability coefficients in human intestinal epithelial (Caco-2) cells[J]. Biochem Biophys Res Commun , 1991, 175 :880–885. DOI:10.1016/0006-291X(91)91647-U |
| [18] | Giacomini KM, Huang SM, Tweedie DJ, et al. Membrane transporters in drug development[J]. Nat Rev Drug Discov , 2010, 9 :215–236. DOI:10.1038/nrd3028 |
| [19] | Fujisawa YTR, Nara T, Kamo N, et al. The extracellular pH dependency of transport activity by human oligopeptide transporter 1(hPEPT1) expressed stably in Chinese hamster ovary (CHO) cells:a reason for the bell-shaped activity versus pH[J]. Biol Pharm Bull , 2006, 29 :997–1005. DOI:10.1248/bpb.29.997 |
| [20] | Poirier A, Belli S, Funk C, et al. Role of the intestinal peptide transporter PEPT1 in oseltamivir absorption:in vitro and in vivo studies[J]. Drug Metab Dispos , 2012, 40 :1556–1565. DOI:10.1124/dmd.112.044990 |
| [21] | Irvine JD, Takahashi L, Lockhart K, et al. MDCK (MadinDarby canine kidney) cells:a tool for membrane permeability screening[J]. J Pharm Sci , 1999, 88 :28–33. DOI:10.1021/js9803205 |
| [22] | Yee S. In vitro permeability across Caco-2 cells (colonic) can predict in vivo (small intestinal) absorption in man-fact or myth[J]. Pharm Res , 1997, 14 :763–766. DOI:10.1023/A:1012102522787 |
| [23] | Hidalgo IJ, Raub TJ, Borchardt RT. Characterization of the human colon carcinoma cell line (Caco-2) as a model system for intestinal epithelial permeability[J]. Gastroenterol , 1989, 96 :736–749. DOI:10.1016/S0016-5085(89)80072-1 |
| [24] | Didziapetris R, Japertas P, Avdeef A, et al. Classification analysis of P-glycoprotein substrate specificity[J]. J Drug Ta rget , 2003, 11 :391–406. DOI:10.1080/10611860310001648248 |
| [25] | Borchardt RT, Kerns EH, Thakker DR, et al. Optimizing the "Drug-Like" Properties of Leads in Drug Discovery[M]. New York: Springer, 2006 . |
| [26] | Li M, Yuan H, Li N, et al. Identification of interspecies difference in efflux transporters of hepatocytes from dog,rat,monkey and human[J]. Eur J Pharm Sci , 2008, 35 :114–126. DOI:10.1016/j.ejps.2008.06.008 |
 2016, Vol. 51
2016, Vol. 51


