建设成为创新型国家是国家富强、民族复兴、人民幸福的前提与保障,2015年两会提出“大众创业,万众创新”的号召,是实现中国梦的桥梁。分析创新的内涵,大体可分为两类: 首创性创新和跟进性创新。
1.1 首创性创新首创性创新是具有原始性和引领性的发明创造。历史上的磺胺和青霉素的发明与发现,我国的抗疟药青蒿素、降胆固醇药物洛伐他汀、分子靶向药物伊马替尼都是划时代的首创药物。首创性药物有时具有革命性颠覆性品格,例如质子泵抑制剂奥美拉唑的问世使H2阻断剂“替丁”类药物黯然失色,退出了抗消化道溃疡的首选药物地位; 2013年上市的抗丙肝病毒聚合酶的索非布韦,由于疗效显著,对既往上市的药物应用几乎是颠覆性威胁。程序化细胞死亡蛋白1 (PD-1) 抑制剂nivolumab等开创了新的治疗领域,也是革命性的。
1.2 跟进性创新跟进性创新具有模仿性、适应性和集成的特征,是在首创的基础上模拟与再创造,由于“站在巨人的肩膀”上攀登而有时“青出于蓝而胜于蓝”。例如第五个上市的“他汀”阿托伐他汀创造的奇迹,以及普利、地平、沙坦、沙星、西林、康唑等类的跟进药物,不乏超越了各自的先驱。
2 跟进性创新药物的空间变小20世纪80年代是跟进性药物研发的黄金时代,以靶标为核心的研发模式初步形成,体外活性评价模型为研发者提供了便捷的手段。然而,当时的研发和审评部门对药物的安全性、有效性和成药性存在认识水平的限制 (包括专利覆盖范围),批准上市的首创药物存在某些不足和“短板”,为跟进药物的创制留下了改进的余地和空间。
21世纪以来,首创药物的研发策略、理念和模式臻于成熟和完善,靶标的可药性和药物的药理作用与成药性等得到比较充分的确认和优化,首创药物的优化保障了药理活性强度、选择性、安全性、药代和物化性质等没有明显的缺陷和“瑕疵”,以至于跟进药物的研制难以找到切入口,“me-better”成为虚设的愿望。由于疗效和安全性呈现平平的“me-too”药物得不到患者和市场的青睬,没有特色的跟进性药物不太受药监和支付部门的欢迎。此外,当今的专利申请的保护范围广泛而严谨,普通的电子等排和骨架迁越都在保护之列。像兰索拉唑与泮托拉唑只是奥美拉唑的基团简单变换而获得独立知识产权的年代已不复存在。
3 21世纪上市的跟进性新药锐减药品是一类特殊的商品,新药创制既期待市场的经济价值,也要保障医疗健康,人们对药品的需求与一般商品不同。创制的新药只有比现有者优胜,方能有临床价值和市场份额。Munos[1]分析了本世纪前13年 (2000~2012) 美国FDA批准上市的353个新分子实体 (NME,其中有机小分子229个),除去作用机制不明的占8%,其余329个NME涉及的作用机制 (或靶标) 190种,这样,针对每种靶标上市的新药平均不足两个 (1.7个),具体地讲,13年里125个靶标各上市1个新药,37个靶标各上市两个,图 1是各种作用机制 (或靶标) 与每种靶标的NME数的作图,药物作用的靶标频度显示出长尾曲线的特征。
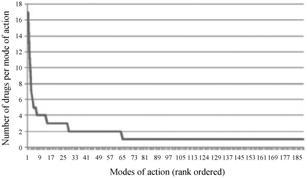
|
图 1 2000~2012年FDA批准的新分子实体作用靶标 (机制) 的频度分布 |
与20世纪相比,本世纪批准的跟进性新药数量明显减少,如表 1所示。业界已认识到,以往药企和研究所惯用的快速跟进策略 (fast follow strategy) 以为能够规避早期的靶标风险,其实,跟进的药物风险后置于临床和市场阶段,如若失败,投入-产出比更不划算,因而,现今侧重于首创性的研发。
| 表 1 2000~2012年和20世纪FDA批准的的药物新颖性比较[1] |
时下的药企创制新药已形成程式化和模式操作,项目的制定和实施按照决策层的既定方针办。当一个有希望的药物靶标出现,往往一窝蜂式的抢占高地,尽管互无模拟与借鉴,但研发思路大同小异,竞争的幸运者成为首创,后继药物成为了“跟随药物”。例如,研制钠-葡萄糖转运蛋白 (SGLT2) 抑制剂几乎都是以根皮苷 (1,phlorizin) 为先导物,研发策略皆为变O-糖苷为C-苷,降低分子柔性,消除易代谢的酚羟基等,以致上市的坎格列净 (2,canagliflozin,2013)、达格列净 (3,dapagliflozin,2014)、艾帕列净 (4,empagliflozin,2014) 结构类型相似,活性相近[2]。欧盟对列净类降糖药持消极态度。
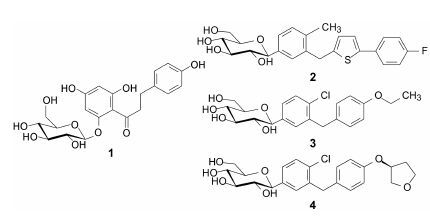
|
另一类降糖药二肽基肽酶 (DPP-4) 抑制剂“列汀”类药物也存在过饱和态势。
4.2 偶遇引发创新的激情在创新的框架下允许研发者的自由探索与选题,应是新形势下的另一种选择。西方称新药研发者为drug hunter (药物猎手),形象地比喻药物是研发者的猎物。偶遇激发创新的热情,导致创新药物作用机制的多样性和结构的千差万别 (比如分子量大到近千小到低于200的超小分子药物)。
2012年FDA批准的托法替尼[3] (5,tofacitinib) 就是一个范例。托法替尼是首创的以JAK-3为靶标的口服治疗类风湿性关节炎药物。项目的起源来自 于美国学术年会,美国国家卫生研究院 (NIH) 的Kawamura等[4]发现了免疫系统中起作用的一个激酶,命名为JAK-3激酶,但需要验证是否能够成为药物治疗的靶标; 参会的辉瑞化学家Changelian正拟研究新型免疫调节药物,偶遇新的靶标,激发了合作热情,辉瑞提供了探针化合物,NIH进行化学生物学的研究,在探索JAK-3的功能和药用价值的同时,发现苗头化合物,并向药物化学过渡,构成了自然的研发链[5]。苗头分子的确定,苗头向先导物的过渡,先导化合物的确定,先导物优化,各个阶段都围绕着提高活性强度、选择性、成药性 (物化性质、药代性质、安全性),彰显了化学生物学与药物化学的良好衔接。终于在2012年上市,在19年的研发历程中,反复对JAK-3靶标的功能进行了验证。图 2是托法替尼研发的化学生物学-药物化学过程。

|
图 2 托法替尼的结构演化历程 |
生物化学机制呈级联反应的各个环节是研发药物的靶标。HMG辅酶A还原酶是体内合成胆固醇的限速步骤酶,他汀类药物的成功在于从生化机制上降低了低密度胆固醇水平,减少了心肌梗死的发病率。其实胆固醇合成反应的其他节点也是潜在的靶标,只是在他汀药物的光环下是否有勇气挑战新的环节罢了。Esperion公司研制的降胆固醇药bempedoic acid (6,ETC-1002) 的II期临床获得良好效果,可降低LDL胆固醇30%,则是另辟蹊径的降胆固醇药。ETC-1002有着戏剧般的研发历程。Esperion公司创建者Roger Newton曾是Park Devis的化学家,阿托伐他汀的发明者。在被辉瑞收购后,开始研究新的降低LDL药物,设定的作用靶标是抑制ATP柠檬酸裂解酶 (ACL) 和激活AMP激活蛋白激酶 (AMPK),通过双重作用以调节脂质和糖代谢。研制出ETC-1002后,辉瑞几经交易,放弃了ETC-1002。Newton坚持研发,这两个酶的可药性较低,分子中含有两个羧基,但进入了Ⅲ 期临床试验。人们期待着新作用机制的降胆固醇药的成功[6-8]。
以丙肝病毒 (HCV) NS5B RNA聚合酶为靶标阻止HCV复制的抗HCV药物索非布韦 (7,sofosbuvir) 是2013年上市的重磅型药物,口服12~24周病毒应答率90%以上,近于治愈。在此之前上市的多为“匹韦”类蛋白酶抑制剂,疗程长,治愈率低。索非布韦上市第一年销售额过百亿美元,可称为革命性的首创药物。Pharmasset公司 (后并入Gilead科学公司) 针对抑制肝细胞的HCV颗粒的复制,为了提高抗病毒活性、具有组织特异性和靶酶的选择性,在构建化学结构中,研发者娴熟地处理了药效与药代、原药与前药、稳定性和靶向性的关系。结构设计路径凝集了药物化学和生物化学的理念和知识。概括地讲,以取代的胞苷 (8) 为初始核心结构,为避免氧化脱氨而失活,改构为取代的尿苷 (9),然而9不能发生一磷酸化,为此预构了5'-一磷酸化合物10,10预留出磷酸端基,以便在细胞内发生三磷酸化而致活,但10含有负电荷不利于过膜。为此,制成苯酯以掩蔽一个负电荷 (11),另一负电荷用于对天然氨基酸酰胺化 (12),磷酰胺键可被肝细胞中的核苷酸结合蛋白HINT1水解,因而提高了该前药的稳定性和特异性。游离羧基酯化成 为中性分子索非布韦 (7)。图 3是该设计过程的梗概历程。索非布韦作为前药,设计是成功的,其实该核苷的前药方法早在20年前就已由McGuigan提出,成为一个平台技术,在抗病毒和抗癌药物的研究中做过多方面探索,但幸运之神护佑了索非布韦[9]。
4.4 老药新用——既往药物的再定位20世纪80年代以前研制的药物多是以生理表型的变化进行评价的,大都没有对后来发展的靶标或作用机制做广泛的研究,药物的杂泛性 (promiscuity) 没有充分地发掘。靶向-脱靶作用 (targeting/off-targeting) 的转换对已有药物的再定位意义很大,无论是临床直接应用抑或结构稍加优化可得到事半功倍的效果。阿司匹林是最熟知的例子,20世纪70年代发现前列腺素及其功能,揭示了阿司匹林抑制COX酶阻断血小板聚集,因而成为广泛应用的预防栓塞和卒中的OTC药物,使这个古老的解热镇痛药逾百年而不衰,而且是难以代替和超越的me-only药。
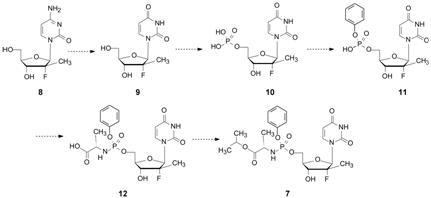
|
图 3 索非布韦化学结构的设计历程 |
曾经用于孕妇镇静的沙利度胺 (13,thalidomide) 因严重致畸撤市而声名狼藉,但临床发现对麻风性结节性红斑病可减轻症状,表现为免疫调节和抗炎作用,以及抗血管生成作用和抗肿瘤活性。后来证实是由于抑制了cereblon蛋白引起肢体畸形[10]。这样广泛且对疑难病症有潜在作用的“药物”,被长时间搁置,直到2013年改构为泊马度胺 (14,pomalidomide) 上市。虽然作用靶标仍然是cereblon蛋白,但没有致畸作用,表明致畸与抑制多发性骨髓瘤的作用可以分开[11]。2014年上市的阿普斯特 (15,apremilast) 是TNF-α和PDE4双重抑制剂[12]。
治疗中枢神经疾病的药物向来难以研发,最近引人注目的发现是氯胺酮 (16,ketamine) 的抗抑郁作用,氯胺酮曾是临床上广泛用于麻醉与镇痛的药物。研究表明它是NMDA受体拮抗剂,可诱发拟精神症状和认知损害,限制了其临床应用,况且更有K粉的坏名声。但研究发现氯胺酮诱发拟精神症状的机制于防治神经疾患具有重大意义,氯胺酮对严重抑郁症患者可以产生强大、快速且相对持久的抗抑郁作用[13]。S-构型的氯胺酮活性强于R,目前在进行临床抗抑郁研究。
抗类风湿性关节炎药物金葡芬 (17,aurothiogly-colanilide) 临床发现具有抗病毒和抗肿瘤作用,用于治疗单纯疱疹病毒引起的生殖器感染和癌症的联合化疗。
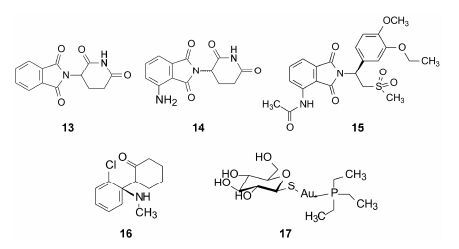
|
新有机合成反应、试剂和催化剂应用于复杂天然活性物质的研究,在全合成、简化物和结构修饰等方面有许多成功的范例,过去以表征化学结构和制备衍生物为主要任务的天然产物化学已延伸到化学合成领域。以下实例显示了天然产物合成化学在新药创制的地位。
4.5.1 艾日布林的全合成软海绵素B (18,hali-chondrin B) 最初是从日本海绵Halichondria okadai中分离得到,化学结构复杂,由聚醚与大环内酯组 成,相对分子质量为1 109.36,含有32个手性碳,具有很强的抗微管作用。Aicher等[14]研究其全合成,目标更集中于创制新型抗肿瘤药物。设定的目标是: ① 保持活性的基础上,去除冗余的片段,降低分子尺寸; ②提高大环内酯的化学稳定性; ③ 改善物化性质 (溶解性)。最终设计合成的艾日布林 (19,eribulin) 去除了聚醚部分; 将内酯基变换为亚甲基酮,增加了化学和代谢稳定性; 侧链中引入氨基,可与酸成盐增加了药物的溶解性。更重要的是,艾日布林实现了由简单有机原料经数10步反应组成的全合成,形成了规模的工业生产。于2012年FDA批准上市。
4.5.2 化学全合成的药物依沙匹隆2007年FDA批准BMS公司上市的依沙匹隆 (20,ixabepilone) 是由埃博霉素B (21,epothilone B) 改构而成,用作治疗晚期乳腺癌药物。埃博霉素B是粘杆菌Sorangium cellulosum的次级代谢产物,有类似于紫杉醇的抑制微管蛋白和抗有丝分裂作用。然而体内容易发生内酯键水解而失活。将内酯改换成内酰胺,即依沙匹隆,仍保持活性,提高了体内稳定性。

|
起初是用半合成方法,将埃博霉素B转化为依沙匹隆[15]。Harris等[16]完成了从简单的原料全合成依沙匹隆的合成路线,并实现了工业化生产。由于全合成路线的实现,还可改换用不同的原料合成新结构骨架的类似物。
4.5.3 全合成的含氟四环素从1948年发现金霉素 (22,aureocycline),迄今包括替加环素 (23,tigecycline) 在内的四环素类药物都是借助微生物发酵和半合成制取的。Sun等[17]设计并合成含氟四环素evaracycline (24),成为第一个完全由化学合成得到的四环素。后经Tetraphase公司研发,evaracyclin临床研究表明已达到III期临床的终末点要求,对耐药的革兰阴性菌引起的复杂腹腔感染,不劣于对照治疗组。
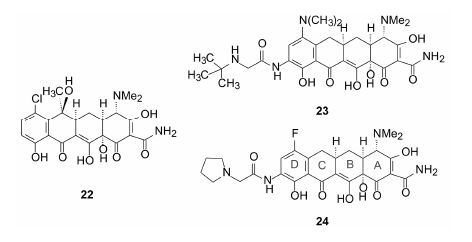
|
实现全合成的关键性步骤是C环的构建,这就要求在两个位点形成C-C连键时,保障高收率和立体选择性,并避免C环的芳构化。文献[17]方法的关键性突破是相继发生的迈克尔加成-狄克曼环加成反应,实现了C环的构建。evaracycline的全合成实现了工业化制备,各步反应以千克规模投料,总收率达70%以上。
5 跟进性药物的研制笔者曾在6年前撰文倡导研制跟进性新药,是在分析了我国的新药研究的状态和水平提出的[18]。然而,近几年来新药的研发格局发生了变化,首创性药物成为主导,跟进药物的空间变得狭小而艰难,药监和支付部门对待跟进药物的安全有效性严苛。在这种形势下,做跟进性的研究需要更加谨慎和风险的担当。化疗药物 (感染性疾病和癌症) 不断出现的耐药性,研发克服耐药的新一代药物要更有针对性,基于靶标结构的理性设计可降低盲目性。药物在组织器官中的分布,是药代ADME的盲区,难以预测,以靶标为核心的新药创制,例如抑制酪氨酸激酶的抗肿瘤药物创制,适应症往往只是被动接受。
| [1] | Munos B. A forensic analysis of drug targets from 2000 through 2012[J]. Clin Pharmacol Ther , 2013, 94 :407–411. DOI:10.1038/clpt.2013.126 |
| [2] | Guo ZR. Research and development process:from phlorizin to canagliflozin[J]. Acta Pharm Sin (药学学报) , 2015, 50 :633–634. |
| [3] | Flanagan ME, Blumenkopf TA, Brissette WH, et al. Discovery of CP-690,550:a potent and selective Janus kinase (JAK) inhibitor for the treatment of autoimmune diseases and organ transplant rejection[J]. J Med Chem , 2010, 53 :8468–8484. DOI:10.1021/jm1004286 |
| [4] | Kawamura M, McVicar DW, Johnston JA, et al. A molecular clong of L-Jak,a Hanus family protein-tyrosine kinase expressed in natural killer cells and activated leukocytes[J]. Proc Natl Acad Sci USA , 1994, 91 :6374–6378. DOI:10.1073/pnas.91.14.6374 |
| [5] | Changelian PS, Flanagan ME, Kent CR, et al. Prevention of organ allograft rejection by a specific Janus kinase 3 inhibitor[J]. Science , 2003, 302 :875–878. DOI:10.1126/science.1087061 |
| [6] | Filippov S, Pinkosky SL, Newton RS, et al. LDL-cholesterol reduction in patients with hypercholesterolemia by modulation of adenosine triphosphate-citrate lyase and adenosine monophosphate-activated protein kinase[J]. Curr Opin Lipid , 2014, 25 :309–315. DOI:10.1097/MOL.0000000000000091 |
| [7] | Mueller R, Yang J, Duan C, et al. Long hydrocarbon chain keto diols and diacids that favorably alter lipid disorders in vivo[J]. J Med Chem , 2014, 47 :6082–6099. |
| [8] | Bar-Tana J, Ben-Shoshan S, Blum J, et al. Synthesis and hypolipidemic and antidiabetogenic activities of β,β,β',β'-tetrasubstituted long-chain dioic acids[J]. J Med Chem , 1989, 32 :2072–2084. DOI:10.1021/jm00129a010 |
| [9] | Mehellou Y, Balzarini J, McGuigan C. Aryloxy phosphoramidate triesters:a technology for delivering monophosphorylated nucleosides and sugars into cells[J]. ChemMedChem , 2009, 4 :1779–1791. DOI:10.1002/cmdc.v4:11 |
| [10] | Ito T, Ando H, Suzuki T, et al. Identification of a primary target of thalidomide teratogenicity[J]. Science , 2010, 327 :1345–1349. DOI:10.1126/science.1177319 |
| [11] | Lu G, Middleton RE, Sun H, et al. The myeloma drug linalidomide prompts the cereblon-dependent destruction of ikaros proteins[J]. Science , 2014, 343 :305–309. DOI:10.1126/science.1244917 |
| [12] | Man HW, Schafer P, Wong LM, et al. Discovery of (S)-{2-[1-(3-ethoxy-4-methoxyphenyl)-2-methanesulfonylethyl]-1,3-dioxo-2,3-dihydro-1-isoindol-4-yl}acetamide (apremilast),a potent and orally active phosphodiesterase 4 and tumor necrosis factor-α inhibitor[J]. J Med Chem , 2009, 52 :1522–1524. DOI:10.1021/jm900210d |
| [13] | Engina E, Treit D, Dickson CT. Anxiolytic-and antidepressantlike properties of ketamine in behavioral and neurophysiological animal models[J]. Neuroscience , 2009, 161 :359–369. DOI:10.1016/j.neuroscience.2009.03.038 |
| [14] | Aicher TD, Buszek KR, Fang FG, et al. Total synthesis of halichondrin B and norhalichondrin B[J]. J Am Chem Soc , 1992, 114 :3162–3164. DOI:10.1021/ja00034a086 |
| [15] | Boezilleri RM, Zheng X, Schmidt RJ, et al. A novel application of a Pd (0)-catalyzed nucleophilic substitution reaction to the regio-and stereoselective synthesis of lactam analogues of the epothilone natural products[J]. J Am Chem Soc , 2000, 122 :8890–8897. DOI:10.1021/ja001899n |
| [16] | Harris CR, Kuduk SD, Danishefsky SJ, et al. Dianion equivalents corresponding to be polypropionate domain of epothilone B[J]. Tetrahedron Lett , 1999, 40 :2263–2266. DOI:10.1016/S0040-4039(99)00221-X |
| [17] | Sun CX, Wang Q, Brubaker JD, et al. A robust platform for the synthesis of new tetracycline antibiotics[J]. J Am Chem Soc , 2008, 130 :17913–17927. DOI:10.1021/ja806629e |
| [18] | Guo ZR. Innovation of follow-on drugs in drug discovery[J]. Chin New Drugs J (中国新药杂志) , 2009, 18 :784–796. |
 2016, Vol. 51
2016, Vol. 51


