Woodcock[1]认为高质量的药品是既没有污染又可以给患者提供可靠疗效的产品。按质量源于设计 (QbD) 理念,产品的质量不是检验出来的,而是通过设计赋予的; 对产品及其整个生产过程的认知是建立灵活监管方法的基础。目标产品的质量通常可 通过产品的关键质量属性 (CQAs) 进行评估。通过对产品CQAs的认知,确认生产过程中的关键原辅料属性 (CMAs) 和关键工艺参数 (CPPs),建立CMAs、CPPs和产品CQAs的关系,再通过对CMAs和CPPs的控制实现对产品CQAs的控制,并实现对生产工艺的不断优化,是QbD理念的核心[2]。
药物杂质谱 (impurity profile) 表征存在于药品中的所有已知杂质和未知杂质的种类和含量[3],其与药物生产的工艺路线、原辅料属性、工艺参数等密切相关。目前在仿制药注册、原料药产地变更、补充申请药品注册标准等方面已被予以了高度关注。在中 国食品药品检定研究院近年来组织的评价性抽验过程中,各承检单位对不同企业相同制剂的杂质谱均予以了高度关注。如能以杂质谱为指针,发现药品的CQAs,并通过探索性研究回溯到CMAs和CPPs,将有助于评价目前国产药品工艺设计和过程控制的合理性。
阿莫西林克拉维酸钾片为阿莫西林三水合物和克拉维酸钾按多种比例 (如2∶1、4∶1、7∶1和14∶1等) 组方的β-内酰胺类复方制剂,属于国家基本药物。在2014年评价性抽验中,获得17个厂家的152批阿莫西林克拉维酸钾片剂和分散片。本文以此为例,通过杂质谱分析,发现阿莫西林克拉维酸钾片剂的CQAs,进而探索其与生产过程相关的CMAs和CPPs之间的关系。
材料与方法 仪器真空烘箱: BINDER VD53; 热重分析仪: TA instruments Hi-Res TGA 2950; X射线衍射仪: D/MAX-2200,Rigaku,配RINT 2000 Series分析软件; 液相色谱仪: Waters 2996-2695,Empower2工作站; 水分活度仪: novasina LabMaster-aw; 统计分析软件: JMP11。
样品及试剂阿莫西林三水合物原料: 珠海联邦制药股份有限公司内蒙分公司,批号: 1402022068; 阿莫西林克拉维酸钾片剂: 共17个厂家的152批片剂及分散片。阿莫西林对照品、克拉维酸对照品和阿莫西林克拉维酸系统适用性对照品均来自中国食品药品检定研究院; 阿莫西林噻唑酸对照品、2',5'-二酮哌嗪-2 (R) 阿莫西林对照品、2',5'-二酮哌嗪-2 (S) 阿莫西林对照品、阿莫西林闭环二聚体对照品和阿莫西林闭环三聚体对照品,均由DSM Anti-Invectives B.V.公司提供。
乙腈:Sigma-Aldrich,色谱纯,磷酸二氢钾: 国药集团化学试剂有限公司。
HPLC法测定有关物质色谱柱: Agilent ZORBAX SB-C18 (4.6 mm × 250 mm,5 μm); 流动相: 流动相A: 0.01 mol·L−1 KH2PO4 (用2 mol·L−1 NaOH调节pH至6.0),流动相B: 0.01 mol·L−1 KH2PO4−CH3CN (20∶80); 流速: 1.0 mL·min−1; 检测器: 紫外PDA; 检测波长: 230 nm; 柱温: 30 ℃; 进样器温度: 4 ℃; 进样体积: 20 µL; 梯度洗脱 [0 min (98% A~2% B); 20 min (70% A~30% B); 22 min (98% A~2% B); 32 min (98% A~2% B)]。
LC-MS方法确认杂质结构采用柱切换HPLC- MS方法,色谱柱为Agilent C18 (150 mm × 4.6 mm,5 µm); 切换阀: 六通阀A和B; 切换用定量环体积: 500 µL; 流动相: C相: 含有0.5% 甲酸的水溶液; D 相: 乙腈−0.5% 甲酸溶液 (90∶10); 梯度洗脱 [0 min (100% C~0% B); 5.5 min (100% C~0% D); 25 min (0% C~100% D); 30 min (0% C~100% D)]。
MS参数: ESI离子源,二级质谱扫描,扫描范围: 10~1 600 Da; 气帘气: 20 L·h−1; 电离电压: +4 500 V; 离子源温度: 500.00 ℃; 吹扫气1: 60 L·h−1; 吹扫气2: 65 L·h−1; 碰撞诱导解离: 中等; 解簇电压: +65.0 V; 入口电压: +6.0 V; 碰撞电源: +62.00 V; 出口电压: +3.00 V。
真空干燥方法将阿莫西林三水合物原料置于真空烘箱中,温度为30 ℃,于不同时间点取样,测定其减失重量,直至恒重,得到含水量不同的样品。
热重分析法 (TGA)测定阿莫西林三水合物原料的结晶水 高解析模式,以5 ℃·min−1升温至60 ℃,敏感度为8.0。
水活度方法实验前采用水分活度仪配备的活度标准溶液对仪器进行六点校准。取样品约1.0 g,置于水分活度仪配备的样品盒中,将样品盒敞口置仪器样品仓中放置20 min,待平衡后开始测定。每个样品测定5次,取平均值。测定温度为25 ℃。
结果与讨论 1 杂质谱分析对152批阿莫西林克拉维酸钾片的HPLC-PDA杂质谱进行分析,其杂质谱见图 1。共发现13个含量大于0.1% 的杂质峰; 其中3、5、8、10号杂质峰为多数产品中的共有杂质,10号杂质峰为最大单一杂质。
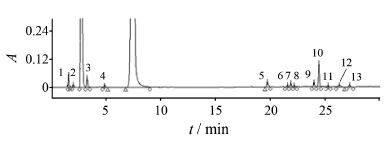
|
Figure 1 The chromatogram for the related substances of amoxicillin and clavulanate potassium tablet. Peaks 1−13: Impurites 1−13 |
采用杂质对照品结合二维色谱−质谱分析和文献[4]结果对诸杂质峰的结构进行归属 (欧洲药典8.0未收载的杂质结构见图 2)。杂质峰1为α苯甘氨酸; 杂质峰2和杂质峰3均为阿莫西林噻唑酸同分异构体。杂质2为S构型,杂质3为R构型。杂质峰5经过二维色谱分离,发现其为含2个杂质的共流出峰,分别称杂质5a和5b; 杂质5a为α苯甘氨酸和阿莫西林游离氨基发生亲核取代反应,形成的副产物,杂质5b为阿莫西林噻唑酸受热脱羧形成的5S-阿莫西林脱羧青霉噻唑酸。杂质峰6也为含杂质6a和杂质6b的共出峰; 杂质6a为阿莫西林开环二聚体,杂质6b为阿莫西林二聚体的脱羧产物。杂质7为2',5'-二酮哌嗪-2R-阿莫西林。杂质8为5R-阿莫西林脱羧青霉噻唑酸 (杂质5b的同分异构体)。杂质10为阿莫西林闭环二聚体; 杂质11为阿莫西林闭环三聚体。杂质峰4、9、12和13的结构也与阿莫西林有关,但目前无法准确归属; 其中杂质9和杂质13在样品的诸加速降解试验中均不增加,提示其为来自原料的工艺杂质。可见,阿莫西林克拉维酸钾片中的主要杂质均为阿莫西林相关杂质。
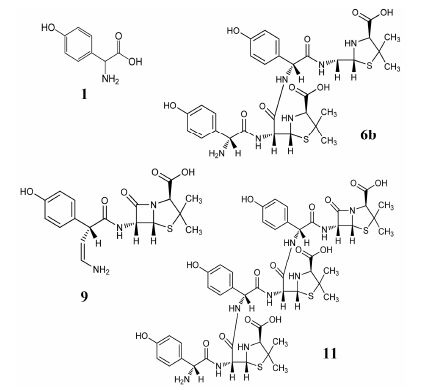
|
Figure 2 The structures of the impurities which were not included in EP8.0 of amoxicillin and clavulanate potassium tablet |
以杂质谱为指针,分析阿莫西林克拉维酸钾片的关键质量属性。大部分样品的杂质谱相似,阿莫西林闭环二聚体 (10号杂质) 的标准偏差最大,说明其在各企业样品中的含量差异最大。以13个杂质为指针,采用聚类方法对152批片剂进行分析,全部样品可分成5类: 其中第Ⅴ类样品 (59批,占总批数的39%) 中诸杂质的含量均较低,代表了理想的情况; 第Ⅳ类样品 (11批,占总批数的7%) 中除杂质10的含量较高外,杂质9、13的含量也相对较高,由于杂质9和13为工艺杂质,提示该类产品中使用的阿莫西林原料含杂质较多,而阿莫西林噻唑酸 (杂质3) 和阿莫 西林脱羧青霉噻唑酸 (杂质5和杂质8) 含量较高,提示工艺过程中伴随阿莫西林水解并受热脱羧情况; 第Ⅲ类样品 (11批,占总批数的7%) 中除杂质10的含量较高外,杂质3、8、9含量相对较高,同样提示阿莫西林原料质量不好,且工艺过程中伴随有阿莫西林水解和受热脱羧情况; 第Ⅱ类样品 (44批,占总批数的29%) 中只有杂质10含量较高; 第Ⅰ类样品 (27批,占总批数的18%) 中杂质10和杂质6含量相对较高,即后两类样品中二聚体的含量均较高 (图 3)。上述结果揭示,生产过程中首先要防止阿莫西林的聚合,其次是抑制阿莫西林的水解。

|
Figure 3 The statistical graphs of the impurities 1−13 contents of each type of the tablets (Ⅰ−Ⅴ represent the type numbers) |
将终产品的质量与生产中的质控关键点相关联。阿莫西林克拉维酸钾片剂生产工艺主要包括以下几个主要步骤: 首先是原辅料经过处理、称量后混合,将混粉进行干法制粒,在适宜的温湿度条件下过筛整粒,再将整理好的颗粒与辅料进一步混合,然后压片、包衣,最后终产品进行铝塑包装。阿莫西林三水合物是阿莫西林最稳定的晶体形态 [5, 6, 7],片剂中阿莫西林应以三水合物的形式存在[8]。TGA分析阿莫西林三水合物,在温度大于35 ℃时,随温度升高,阿莫西林三水合物逐步失去结晶水; 模拟干燥过程: 将阿莫西林三水合物原料30 ℃真空干燥,于不同时间点取样,分别测定样品的水分和杂质谱变化。结果可见,随干燥时间的增加,不仅样品的失水量增加,阿莫西林闭环二聚体的含量也逐渐增加 (由0.4% 增至4.0%),但其他杂质如阿莫西林噻唑酸等的含量基本不变 (图 4)。提示阿莫西林三水合物结晶水的丢失,导致晶体结构的改变,促进了闭环二聚体杂质的产生,使其成为片剂中的最大杂质。阿莫西林聚合物通常被认为与临床中的过敏反应密切相关[9, 10],因此产生过程中的过筛整粒 (干燥) 环节是其片剂生产的关键质控环节; 以闭环二聚体为指针可以监控该环节工艺参数的合理性。同时还提示保证阿莫西林三水合物在制剂干燥过程中不失水是生产中控制阿莫西林闭环二聚体产生的关键。

|
Figure 4 The chromatogram of related substance of amoxicillin with different crystal water contents. 1: Not dry; 2: Dry for 2.37 h,dehydration 3.85%; 3: Dry for 4.52 h,dehydration 6.61%; 4: Dry for 6.70 h,dehydration 10.40%; 5: Dry to constant weight,dehydration 12.64%. a: Penicilloic acid of amoxicillin; b: Cycle- closed dimer of amoxicillin |
吸附在固体表面的自由水更易参与药物降解反应。自由水的量可用水活度表征。对阿莫西林克拉维酸钾颗粒稳定性与其水分含量和水分活度相关性的研究表明,其稳定性主要与水分活度呈正相关[11]。分析水活度不同的片剂在加速实验中阿莫西林噻唑酸的变化率,提示样品中的水分活度是导致产生阿莫西林噻唑酸的关键因素。由于药品的水分活度与其制剂处方密切相关[12],因此阿莫西林克拉维酸钾片处方的合理性是储存中影响阿莫西林水解的关键。
结论片剂生产过程中原辅料的关键质量属性 (CMAs) 和关键工艺参数 (CPPs) 直接影响其CQAs。通常固体制剂的溶出特性和杂质谱被认为是CQAs的重要方面[2]。通过对阿莫西林克拉维酸钾片剂杂质谱的分析,确认杂质阿莫西林闭环二聚体和水解产物阿莫西林噻唑酸是与其CQAs密切相关杂质。生产中过筛整粒 (干燥) 环节不恰当的工艺参数可导致阿莫西林三水合物脱水,进而导致闭环二聚体明显增加; 而不合理的处方将使片剂中的活性水偏高,阿莫西林在储存期易水解产生阿莫西林噻唑酸。
以13个阿莫西林杂质为指针,通过聚类方法,阿莫西林克拉维酸钾片的杂质谱可分成5类 (图 3),
该结果可构成评价阿莫西林克拉维酸钾片仿制药品工艺优劣的模型。通过比较特定工艺仿制品杂质谱与模型中每类杂质谱的差异,可以初步判断生产工艺是否理想,为评价国产仿制药品的生产工艺和过程控制提供了新思路。
| [1] | Woodcock J. The concept of pharmaceutical quality[J]. Am Pharm Rev, 2004, 47:1-3. |
| [2] | ICH. ICH Harmonised Tripartite Guideline Pharmaceutical Development Q8(R2)[S/OL]. 2009[2015-12-17]. http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q8_R1/Step4/Q8_R2_Guideline.pdf. |
| [3] | Görög S. The importance and the challenges of impurity profiling in modern pharmaceutical analysis[J]. TrAC Trends Anal Chem, 2006, 25:755-757. |
| [4] | European Pharmacopoeia 8.0[R]. 2014,VolumeⅡ. |
| [5] | Gonçalves LR, Sousa R Jr, Fernandez-Lafuente R, et al. Enzymatic synthesis of amoxicillin:avoiding limitations of the mechanistic approach for reaction kinetics[J]. Biotechnol Bioeng, 2002, 80:622-631. |
| [6] | Dolezalova M, Kunteova B, Jobanek R. Determination of the purity of ampicillin by micellar electrokinetic chromatography and reversed phase liquid chromatography on a monolithic silica column[J]. J Sep Sci, 2004, 27:560-568. |
| [7] | Tung JC, Gonzales AJ, Sadowsky JD, et al. On the 1H NMR chemical shift assignments for ampicillin[J]. Magn Reson Chem, 2000, 38:126-128. |
| [8] | Boles MO, Girven RJ, Gane PAC. The structure of amoxycillin trihydrate and a comparison with the structures of ampicillin[J]. Acta Cryst, 1978, B34:461-466. |
| [9] | Jin SH, Hu CQ. Research progress on anaphylactic reaction of β-lactam antibiotics[J]. Chin J New Drugs (中国新药杂志), 1994, 3:38-41. |
| [10] | Hu CQ, Jin SH. The analysis technology progress on high molecular weight impurities in β-lactam antibiotics[J]. World Notes Antibiot (国外医药抗生素分册), 1996, 17:336-343. |
| [11] | Xue J, Zhu KX, Chong XM, et al. The influence of moisture on the stability of amoxicillin and clavulanate potassium granules[J]. Chin Pharm J (中国药学杂志) 2016, 51:13-19. |
| [12] | Kang Y. The Application of Water Activity and Near Infrared Spectroscopy in the Stability of Drugs Contained Clavulanate Potassium (水分活度与近红外光谱法在含克拉维酸钾药物稳定性研究中的应用)[D]. Nanjing:China Pharmaceutical University, 2006. |
 2016, Vol. 51
2016, Vol. 51


