2. 中国食品药品检定研究院, 北京 100050;
3. 中国医学科学院北京协和医院, 北京 100730
2. National Institutes for Food and Drug Control, Beijing 100050, China;
3. Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, Beijing 100730, China
缺血性脑血管疾病是一种高发病率、高致残率和高死亡率的神经系统疾病,严重危害着人类的健康,给个人、家庭和社会带来严重的负担[1]。然而至今尚未有完全治愈的理想药物,进一步深入地研究缺血损伤的发病机制,寻找新的治疗靶点和有效药物具有重要的意义。炎症反应作为缺血再灌注 (I/R) 损伤的重要机制之一受到越来越多的重视。其中肿瘤坏死因子α (tumor necrosis factor α,TNF-α) 和白细胞介素6 (interleukin-6,IL-6) 的分泌在缺血再灌注损伤中发挥关键作用[2]。尽管脑缺血再灌注损伤中炎症机制的研究已取得了长足的进步,但仍存在大量的不明机制,如调控炎症介质产生和释放的上游机制等。
有研究发现金属离子特别是二价的金属离子如锌离子和钙离子等可能参与的缺血损伤的发生发展[3]。随着研究的深入,研究者发现锌离子与钙离子相比,可能是介导缺血损伤的一种更为重要的离子[4, 5]。锌离子可能参与了脑缺血再灌注损伤的机制[6]。为了验证此假说,本研究采用大鼠大脑中动脉闭塞模型,借助锌离子的特异性螯合剂N-二硫氨基甲酸 (N,N- diethyldithiocarbamate,DEDTC),探讨锌离子在脑缺血损伤中的作用并对其机制进行初步研究。
材料与方法 实验动物SPF级雄性SD大鼠200只,体质量280~300 g。购自北京维通利华实验动物技术有限公司。许可证编号: SCXK (京) 2008-0001。饲养条件: 温度20~26 ℃,湿度40%~70%,术前禁食不禁水。
药品与试剂DEDTC (美国Sigma-Aldrich公 司),Newport Green锌离子荧光指示剂 (N7990,美国Invitrogen公司),OCT包埋剂 (日本樱花公司),2,3,5-氯化三苯基四氮唑 (TTC,北京华夏远洋科技有限公司),BCA蛋白定量试剂盒 (美国Thermo公司),裂解用Cocktail (美国Roche公司),ELISA试剂盒 (碧云天生物技术有限公司)。
仪器与设备手术显微镜 (德国Carl Zeiss公 司),温度调节仪 (美国Harvard Apparatus公司),冷冻切片机 (CM1900,德国Leica公司),正置荧光显微镜 (80i,日本NIKON公司),低温离心机 (德国Beckman公司),电动匀浆器 (DIAX900,德国Heidolph公司)。
实验分组及大脑中动脉模型的制备随机将大鼠分为假手术组、大脑中动脉闭塞 (middle cerebral artery occlusion,MCAO) 缺血再灌注6、12和24 h不同时间点组,DEDTC给药组 (造模前30 min腹腔注射10 mg·kg-1)。假手术组和MCAO组腹腔注射同等体积含10% DMSO的生理盐水。参考Longa等[7]建立的MCAO模型,大鼠称重后用5% 恩氟烷诱导麻醉,随后连接小动物呼吸机用2% 恩氟烷混合N2O:O2 (7:3) 维持麻醉。术中对肛温、平均动脉压及心率进行监测,维持上述各生理参数于正常范围。颈部中央切口,玻璃分针小心对血管进行分离,电凝结扎颈外动脉,随后用动脉夹夹闭颈总动脉和颈内动脉,于颈外动脉残端切口,小心插入线栓,经颈内动脉缓慢进入大脑中动脉,直至轻微阻力 (此时线栓插入深度约18 mm) 时停止。在颈内动脉根部打结固定避免线栓脱落。闭塞90 min后小心将线栓拔出,于缺血再灌注后6、12和24 h将动物麻醉断头处死,视为不同再灌时间点的动物模型。假手术组只做钝性分离,不进行插栓。
2,3,5-氯化三苯基四氮唑 (TTC) 染色于I/R 24 h后将动物处死,立即取脑放入特制模具中,于视交叉处切第一刀,由此向上切取2个层面,向后切取4个层面。将脑片放入1.5% TTC染液中,常温染色20 min,正常组织呈玫红色,梗死区脑组织呈白色。用Image J软件计算梗死面积。梗死体积 (R) % = 患侧脑片梗死体积总和/健侧脑片体积总和× 100%。
神经功能评分于大鼠I/R 24 h时用改良的Longa法对神经功能进行评分。评分标准为: 0分,无神经功能损害症状; 1分,对侧前肢不能伸展; 2分,对侧转圈; 3分,身体向对策倾倒; 4分,丧失意识,不能行走; 5分,死亡。
锌离子荧光染料Newport Green (NG)染色 I/R 6、12和24 h将动物处死并取脑。取纹状体部位进行连续冰冻切片,厚度为20 μm。将新鲜切片 (每组6片,连续切片,每切10张片子,取第11张,循环,共取6张) 放入10 μmol·L-1 NG-PBS (磷酸盐缓冲液) 溶液中,避光静置3 min。PBS冲洗3次,每次5 min。甘油封片后于荧光显微镜下进行观察。每张切片随机选取4个视野进行观察并拍照。借助NIS Element软件对NG以及荧光强度进行分析。平均荧光强度=总的荧光强度/NG阳性细胞数目。
ELISA法测定脑组织中TNF-α和IL-6的含量分别于I/R 6、12和24 h取材,将大鼠脑组织 匀浆经适当稀释后加入ELISA板中,37 ℃孵箱中反应90 min,洗板5次后加入生物素化的抗体工作液,37 ℃孵箱中反应60 min。洗板5次后加入酶结合物工作液,继续37 ℃孵箱中反应30 min,洗板,最后加入显色液,于450 nm波长下测定吸光值。用TNF-α和IL-6的标准品制备梯度浓度的工作液,测定标准曲线,计算样本中TNF-α和IL-6的浓度。每个标本均采用3个复孔。
Western blot方法检测p-Akt/Akt、N-NF-κB/ C-NF-κB及p-IκB/IκB蛋白表达于I/R 24 h后取材,梗死侧脑组织放于EP管内,加入裂解液500 μL匀浆后静置30 min,全程于冰上进行。BCA法进行蛋白定量,每组取50 μg加入上样缓冲液。SDS-PAGE凝胶电泳后,将蛋白通过电转的方法转至PVDF膜。5% 牛血清白蛋白 (BSA) 室温封闭2 h。加入适当比例稀释的一抗,4 ℃过夜。次日回收一抗,TBST洗膜3次,每次10 min。加入辣根过氧化物酶标记的二抗室温孵育2 h后TBST洗膜,ECL法显影拍照并借助Quantity One软件进行灰度分析。
统计学分析用SPSS16.0软件进行统计学分析。数据均以均数±标准差 (x±s) 表示。计量资料采用单因素方差分析,各时间点两两比较采用Post hoc方法,P < 0.05为差异有统计学意义。
结果 1 DEDTC对MCAO大鼠锌离子水平的影响如图 1所示,假手术组各时间点均少见NG阳性细胞,3个时间点的平均荧光强度分别为18.87 ± 4.73、19.41 ± 5.12和17.68 ± 3.93。MCAO模型组大鼠脑组织中可见NG阳性细胞的表达,平均荧光强度随灌注时间的增加而增加,分别为56.73 ± 9.08、86.27 ± 10.38和143.69 ± 18.65,较假手术组具有统计学意义 (P < 0.01)。腹腔注射DEDTC后,与模型组相比,各个时间点NG阳性细胞的平均荧光强度都降低 (26.40 ± 6.17、37.18 ± 5.99和68.65 ± 10.82),差异具有统计学意义 (P < 0.01)。
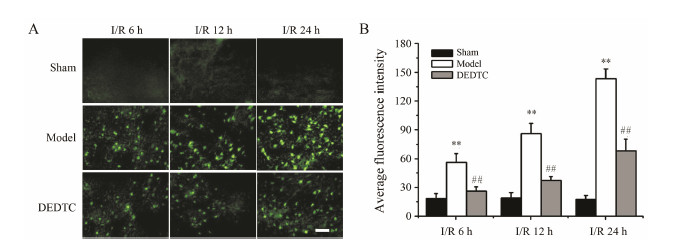 | Figure 1 Effect of N,N-diethyldithiocarbamate (DEDTC) on release of zinc induced by brain ischemia/reperfusion. A: Representative images of Newport Green (NG) staining; B: Quantification analysis of NG-positive cells. n = 6,± s. **P < 0.01 vs sham group; ##P < 0.01 vs model group. Scale bar,50 μm |
如图 2所示,假手术组大鼠各时间点均无脑梗死 (R = 0); 模型组大鼠I/R 24 h后脑梗死体积显著增加[R = (29.78 ± 4.18) %],与假手术组相比差异具有统计学意义 (P < 0.01)。给予DEDTC处理后,大鼠脑梗死体积显著减少 [R = (15.19 ± 6.18) %],较模型组具有统计学意义 (P < 0.01)。
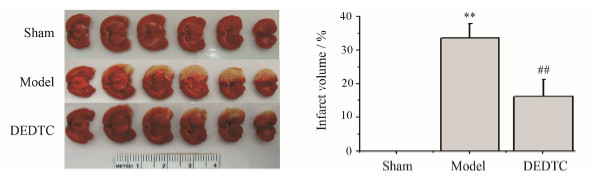 | Figure 2 Effect of DEDTC on infarct volume in rats with 24 h brain ischemia/reperfusion injury. n = 6,± s. **P < 0.01 vs sham group; ##P < 0.01 vs model group |
如图 3所示,MCAO组大鼠对外界刺激的反应能力和肢体活动情况变差,相应的神经功能评分增高,与假手术组相比具有统计学意义 (P < 0.01)。给予DEDTC后,在同一时间点对动物的神经功能检测发现,大鼠的反应性和肢体活动灵活状况与模型组相比具有显著的改善,差异具有统计学意义 (P < 0.01)。
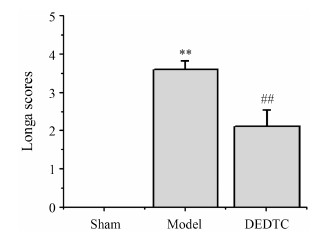 | Figure 3 Effect of DEDTC on neurological function in rats with 24 h brain ischemia/reperfusion injury. n = 6,± s. **P < 0.01 vs sham group; ##P < 0.01 vs model group |
缺血再灌注大鼠梗死侧脑组织中TNF-α的浓度在I/R 6 h已经出现明显的增加,并具有时间依赖性,各个时间点与假手术相比差异都具有统计学意义 (P < 0.01)。IL-6的浓度在I/R 6 h时也出现升高,但与假手术组相比无统计学意义。I/R 12 h后出现明显的增加,并具有时间依赖性,与假手术组各个时间点相比具有统计学意义 (P < 0.01)。给予DEDTC处理后,各给药组与相同时间点的模型组相比,TNF-α和IL-6的
浓度均有显著的下降,差异具有统计学意义 (P < 0.01)。见表 1。
|
|
Table 1 Effect of DEDTC on the release of TNF-α and IL-6 induced by brain ischemia/reperfusion injury (pg·mL-1). n = 6,± s. **P < 0.01 vs sham group; ##P < 0.01 vs model group |
借助Western blot的方法进行检测发现,缺血 再灌注损伤24 h后显著诱导丝氨酸/苏氨酸蛋白激酶 (serine/threonine kinase,Akt) 的磷酸化活化,p-Akt/ Akt的比值显著增加,较假手术组具有统计学意义 (P < 0.001)。相应的κB抑制分子 (inhibitor-kappa B,IκB) 的磷酸化降解 (p-IκB/IκB) 显著增加,以及核转录因子 (nuclear factor kappa B,NF-κB) 的入核 (N-NF-κB/C-NF-κB) 显著增加,与假手术组相比具有统计学意义 (P < 0.001)。给予DEDTC处理后,Akt的磷酸化活化、IκB的磷酸化降解以及NF-κB的入核都显著减少,与假手术组相比具有统计学意义 (P < 0.001),见图 4。
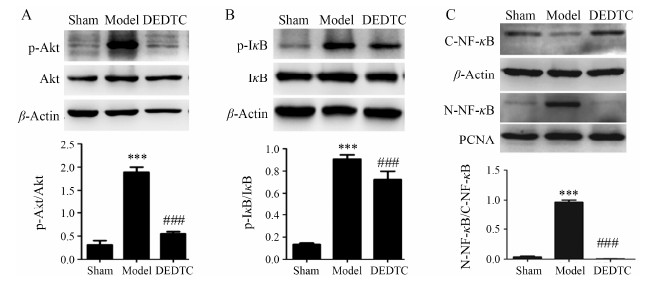 | Figure 4 Effect of DEDTC on the changes of Akt/NF-κB signaling pathway after brain ischemia/reperfusion injury. A: The expression of p-Akt/Akt; B: The expression of p-IκB/IκB; C: The expression of N-NF-κB/C-NF-κB. n = 3,± s. ***P < 0.001 vs sham group; ###P < 0.001 vs model group |
越来越多的研究发现在神经系统中,锌离子发挥了重要的作用。过量的锌离子具有细胞毒性可导致细胞的凋亡[8]。如在突触转运的过程中,锌离子被释放到突触间隙,进而通过门控通道进入到邻近的细胞内,这些过量的锌离子可能是导致大脑神经元出现延迟性神经元死亡的主要原因之一[9]。锌离子通过与N-甲基-D-天冬氨酸 (N-methyl-D-aspartic acid,NMDA) 受体结合,减少钙离子内流,抑制钙离子依赖的一氧化氮合酶 (nitric oxide synthase,NOS) 活性,减少NO的生成,最终有助于体外培养的海马神经元抵抗缺氧。体外实验发现,锌离子可以诱导培养神经元的线粒体肿胀,并通过激活蛋白激酶C (protein kinase C,PKC) 诱导NOS和活性氧自由基 (reactive oxygen species,ROS) 的生成释放[10]。此外,还有研究发现锌离子浓度的变化可以介导基质金属蛋白酶 (matrix metalloproteinases,MPPs) 活性的增加,从而诱导缺血再灌注损伤[11]。然而有关锌离子与缺血损伤之间的关系存在争议,其作用机制有待进一步研究。DEDTC是一种二硫代氨基甲酸盐,已有研究证实其为锌离子的特异性螯合剂[12]。此外NG是一种对游离的锌离子有特异性亲和力的荧光染料,对钙离子几乎没有影响。从本研究结果可以看到,随着缺血再灌注时间的增加,NG阳性细胞的表达也有了显著的增加,给予DEDTC后NG阳性细胞的表达则显著降低。DEDTC螯合锌离子后可以显著降低动物的梗死程度,改善动物的神经功能,提示抑制游离锌离子的过度增加可以对抗缺血再灌注带来的脑损伤。许多研究表明脑缺血再灌注损伤后,缺血区的神经元、星形胶质细胞以及小胶质细胞都可以释放大量的炎性因子,如TNF-α和IL-6,进而加重缺血再灌注损伤。本研究结果显示,给予DEDTC脑组织中炎性因子TNF-α和IL-6的浓度显著降低,提示游离锌离子的过度增加可能参与了缺血损伤后的炎症反应。
磷酸肌醇-3激酶 (phosphatidylinositol 3 kinase,PI3K)/Akt信号通路,可以通过调节基因的转录和 翻译、细胞的增殖和凋亡等参与细胞的生理病理过 程[13, 14, 15, 16]。近年来研究发现PI3K/Akt信号通路的活化与炎症反应的发生密切相关,磷酸化的Akt可以激活IκB激酶(IKK),引起IκB的磷酸化降解,最终激活NF-κB信号通路。活化的NF-κB入核进一步调节炎性因子的转录和表达,加重炎症反应[17]。从本研究结果可以看到,缺血损伤显著诱导PI3K/Akt/NF-κB信号通路的活化,而给予DEDTC后,该信号通路的活性得到显著的抑制。提示DEDTC对缺血再灌注大鼠的保护作用可能是通过抑制PI3K/Akt/NF-κB信号通路的活化,进而减少炎性因子的释放实现的。但缺血后的病理损伤机制十分复杂,各个级联损伤反应之间又存在着相互作用,因此并不能肯定锌离子与缺血损伤诱导的炎性反应之间具有直接的作用,如锌离子可能通过对自由基或者兴奋性氨基酸等的间接影响,从而调节炎性信号通路发挥作用。缺血后游离锌离子浓度的增加参与了缺血再灌注损伤,抑制锌离子浓度的增加可以通过干预炎性反应减轻脑组织的损害并改善脑功能,这为锌离子成为治疗脑缺血的新靶点,开发有效的锌离子螯合剂,提供了有力的理论基础和支持。
| [1] | Kinlay S. Changes in stroke epidemiology, prevention, and treatment[J]. Circulation, 2011, 124:e494-e496. |
| [2] | Cheng O, Ostrowski RP, Liu W, et al. Activation of liver X receptor reduces global ischemic brain injury by reduction of nuclear factor-κB[J]. Neuroscience, 2010, 166:1101-1109. |
| [3] | Tano JY, Gollasch M. Calcium-activated potassium channels in ischemia reperfusion:a brief update[J]. Front Physiol, 2014, 5:381. |
| [4] | Stork CJ, Li YV. Intracellular zinc elevation measured with a "calcium-specific" indicator during ischemia and reperfusion in rat hippocampus:a question on calcium overload[J]. J Neurosci, 2006, 26:10430-10437. |
| [5] | Stork CJ, Li YV. Rising zinc:a significant cause of ischemic neuronal death in the CA1 region of rat hippocampus[J]. J Cereb Blood Flow Metab, 2009, 29:1399-1408. |
| [6] | Alano CC, Garnier P, Ying W, et al. NAD+ depletion is necessary and sufficient for poly(ADP-ribose) polymerase-1-mediated neuronal death[J]. J Neurosci, 2010, 30:2967-2978. |
| [7] | Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20:84-91. |
| [8] | Colvin RA, Bush AI, Volitakis I, et al. Insights into Zn2+ homeostasis in neurons from experimental and modeling studies[J]. Am J Physiol Cell Physiol, 2008, 294:C726-C742. |
| [9] | Medvedeva YV, Lin B, Shuttlewworth CW, et al. Intracelluar Zn2+ accumulation contributes to synaptic failure, mitochondrial depolarization, and cell death in an acute slice oxygen glucose deprivation (OGD) model of ischemia[J]. J Neurosci, 2009, 29:1105-1114. |
| [10] | Aimo L, Cherr GN, Oteiza PI. Low extracellular zinc increases neuronal oxidant production through NADPH oxidase and nitric oxide synthase activation[J]. Free Radic Biol Med, 2010, 48:1577-1587 |
| [11] | Piperi C, Papavassiliou AG. Molecular mechanisms regulating matrix metalloproteinases[J]. Curr Top Med Chem, 2012, 12:1095-1112. |
| [12] | Siesjö BK. Pathophysiology and treatment of focal cerebral ischemia. Part Ⅱ:mechanisms of damage and treatment[J]. J Neurosurg, 1992, 77:337-354. |
| [13] | Polivka J Jr, Janku F. Molecular targets for cancer therapy in the PI3K/AKT/mTOR pathway[J]. Pharmacol Ther, 2014, 142:164-175. |
| [14] | Faes S, Dormond O. PI3K and AKT:unfaithful partners in cancer[J]. Int J Mol Sci, 2015, 16:21138-21152. |
| [15] | Keane NA, Glavey SV, Krawczyk J, et al. AKT as a therapeutic target in multiple myeloma[J]. Expert Opin Ther Targets, 2014, 18:897-915. |
| [16] | Mabuchi S, Kuroda H, Takahashi R, et al. The PI3K/AKT/mTOR pathway as a therapeutic target in ovarian cancer[J]. Gynecol Oncol, 2015, 137:173-179. |
| [17] | Kolmus K, Tavernier J, Gerlo S. β2-Adrenergic receptors in immunity and inflammation:stressing NF-κB[J]. Brain Behav Immun, 2015, 45:297-310. |
 2016, Vol. 51
2016, Vol. 51


