2. 河北省药品检验研究院, 河北 石家庄 050011;
3. 石药集团中奇制药技术(石家)有限公司, 河北 石家庄 050041
2. Hebei Institute for Drug Control, Shijiazhuang 050011, China;
3. CSPC Zhongqi Pharmaceutical Technology(Shijiazhuang) Co. Ltd., Shijiazhuang 050041, China
八子补肾胶囊遵循中华传统养生文化,以唐朝著名药剂五子衍宗丸为基础,以菟丝子、枸杞子、五味子、蛇床子、金樱子、覆盆子、韭菜子、川楝子、淫羊藿、巴戟天、肉苁蓉、地黄、川牛膝、人参、鹿茸、海马等中药材为主要药味,以调肝理气、补肾温阳为主要功效,同时具有滋补强健、抗疲劳等作用[1, 2, 3]。
八子补肾胶囊成分复杂,质量较难控制,目前文献报道仅对八子补肾胶囊中单一成分蛇床子素进行质量控制[4, 5],不能较为全面地反映八子补肾胶囊的质量。本研究参考相关文献[6, 7],采用超高效液相色谱-质谱联用法对八子补肾胶囊中花椒毒素、异茴芹内酯、佛手柑内酯、欧前胡素、蛇床子素、异欧前胡素、五味子甲素、五味子醇甲、金丝桃苷、槲皮苷、木犀草素、山柰酚、异鼠李素和熊果酸等14种主要成分进行定性及定量分析,为更好地控制八子补肾胶囊的质量提供重要参考依据。
材料与方法 仪器美国Waters I-Class超高效液相色谱仪 (在线脱气机,二元高压泵,自动进样器); 美国Waters Xevo TQ-S三重四极杆质谱仪,StepWave™离子源。Multifuge X1R台式离心机 (美国Thermo Fisher公司); MS3型涡旋混合器 (德国IKA公司); AB265-S/ FACT型电子分析天平 (瑞士梅特勒公司)。
药品与试剂色谱纯乙腈 (德国Merck公司); 超纯水 (Milli-Q Reference Ultrapure Water System)。花椒毒素 (xanthotoxin,14012444) 购于上海同田生物科技有限公司 (纯度大于98%); 异茴芹内酯 (isopimpinelline,121023)、佛手柑内酯 (bergapten,120816) 购于四川维克奇生物科技有限公司 (纯度均大于98%); 欧前胡素 (imperatorin,110826- 201214)、蛇床子素 (osthole,110822-200407)、异欧前胡素 (isoimperatorin,110827-200407)、五味子甲素 (deoxyschizandrin,110764-201312)、五味子醇甲 (schisandrin,110857-201412)、金丝桃苷 (hyperoside,111521-201406)、槲皮苷 (quercitrin,111538-200504)、木犀草素 (luteolin,111520-200504)、山柰酚 (kaempferol,110861-201209)、异鼠李素(isorhamnetin,110860-201109)、熊果酸 (ursolic acid,110742-201421) 购于中国食品药品检定研究院 (纯度均大于98%)。八子补肾胶囊 (批号: 130201、131101、131201) 由石家庄以岭药业股份有限公司生产。
色谱条件采用Waters ACQUITY BEH C18色谱柱(50 mm × 2.1 mm,1.7 μm),流动相为A (乙腈) - B (0.1% 乙酸),采用梯度洗脱方式,梯度洗脱程序如下: 0~1.3 min,30%~50% A; 1.3~2.2 min,50%~80% A; 2.2~3.5 min,80% A等度洗脱; 3.5~4.0 min,80%~30% A; 4.0~5.0 min,30% A等度洗脱。每次进样前预平衡1 min。流速为0.3 mL·min-1。色谱柱后溶液无分流,全部进入离子源,分析时间5 min,进样量2 μL。
质谱条件电喷雾离子源 (ESI源) ,StepWave™离子源,离子源温度为150 ℃,毛细管电压为2.0 KV,离子源补偿电压50 V,脱溶剂气温度500 ℃,脱溶剂气流量800 L·h-1,锥孔气流量150 L·h-1,雾化气压力7.0 Bar,接口处加热,采用多反应监测模式 (MRM)。花椒毒素、异茴芹内酯、佛手柑内酯、欧前胡素、蛇床子素、异欧前胡素、五味子甲素、五味子醇甲等8种成分采用正离子模式检测; 金丝桃苷、槲皮苷、木犀草素、山柰酚、异鼠李素和熊果酸等6种成分采用负离子模式检测。监测各成分离子对,14个成分的解簇电压 (DP)、碰撞能量 (CE) 和二级主要裂解碎片见表 1。
|
|
Table 1 UPLC-ESI-MSn data of the fourteen components |
分别取花椒毒素、异茴芹内酯、佛手柑内酯、欧前胡素、蛇床子素、异欧前胡素、五味子甲素、五味子醇甲、金丝桃苷、槲皮苷、木犀草素、山柰酚、异鼠李素和熊果酸对照品适量,精密称定,分别加甲醇溶解并稀释制成各约0.2 mg·mL-1的对照品溶液。
样品溶液的制备取八子补肾胶囊20粒,倾出内容物,研细,混匀,取粉末约4.0 g,精密称定,置锥形瓶中,精密加入70% 乙醇80 mL,精密称定,超声 (功率: 100 W; 频率: 25 kHz) 处理60 min, 放冷,再精密称定,用70% 乙醇补充损失的重量,摇匀,离心,用0.2 μm滤膜滤过,续滤液作为供试品溶液。
方法学验证基质效应
精密称取已知含量的八子补肾胶囊 (批号: 130201) 内容物约4.0 g,共15份,分别精密加入一倍含量的高、中、低3个浓度水平的对照品溶液,每个浓度水平5份,作为A样,测得含量为A。未添加对照品溶液的已知含量的八子补肾胶囊为B样,测得含量为B。一倍含量的对照品溶液为C样,测得含量为C。以(A-B)/C×100% 计算基质效应。
线性关系分别量取花椒毒素、异茴芹内酯、佛手柑内酯、欧前胡素、蛇床子素、异欧前胡素、五味子甲素和五味子醇甲对照品溶液适量,加甲醇稀释制成质量浓度分别为0.2、0.5、1.0、2.0、5.0、10.0和20.0 ng·mL-1的混合对照品溶液,摇匀,作为正离子模式线性系列标准溶液。分别量取金丝桃苷、槲皮苷、木犀草素、山柰酚、异鼠李素和熊果酸对照品溶液适量,加甲醇稀释制成质量浓度分别为5、10、20、50、100、200和500 ng·mL-1的混合对照品溶液,摇匀,作为负离子模式线性系列标准溶液。分别精密量取正离子模式线性系列标准溶液和负离子模式线性系列标准溶液各2 μL,按上述方法对14种成分进行测定。以质量浓度为横坐标X (ng·mL-1),以峰面积为纵坐标Y,分别绘制标准曲线,进行线性回归,得回归方程,线性范围及相关系数。
回收率与精密度精密称取已知含量的八子补肾胶囊 (批号: 130201) 内容物约4.0 g,共9份,分别精密加入高、中、低3个浓度水平的对照品溶液,每个浓度水平3份,按上述方法制备供试品溶液并测定,计算回收率。取同一批八子补肾胶囊 (批号: 130201) 6份,每份精密称取内容物约4.0 g,按上述方法制备供试品溶液并测定,计算精密度。
含量测定取3批样品按上述方法配制样品溶液,负离子模式直接进样2 μL,正离子模式稀释40倍后进样2 μL,以峰面积计算14种成分的含量。
结果 1 方法学验证 1.1 方法专属性与基质效应由结果可见,14种成分分离良好,基质效应为98.5%~101.2%,基质成分不干扰14种成分的测定。见图 1。
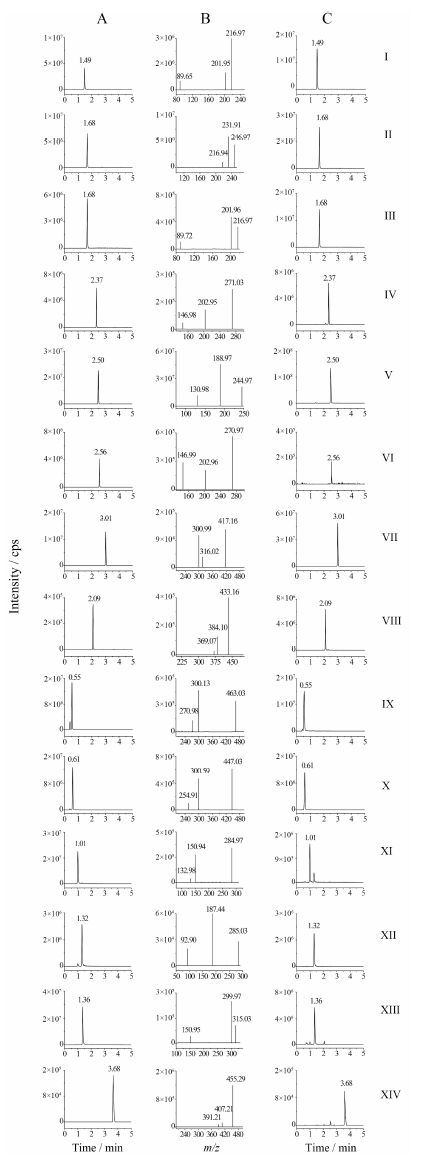
|
Figure 1 Representative extractions chromatograms (XIC) of MRM chromatograms of xanthotoxin (Ⅰ),isopimpinelline (Ⅱ),bergapten (Ⅲ),imperatorin (Ⅳ),osthole (Ⅴ),isoimperatorin (Ⅵ),deoxyschizandrin (Ⅶ),schisandrin (Ⅷ),hyperoside (Ⅸ),quercitrin (Ⅹ),luteolin (Ⅺ),kaempferol (Ⅻ),isorhamnetin (ⅩⅢ) and ursolic acid (ⅩⅣ) standards (A),product ion scan spectra (B) and sample (C) |
由结果可见,14种成分的线性关系良好,r2 ≥0.999 1,定量限为0.11~4.52 ng·mL-1。线性和定量限结果见表 2。
|
|
Table 2 Regression equations,correlation coefficients and linearity ranges of the fourteen components |
花椒毒素、异茴芹内酯、佛手柑内酯、欧前胡素、蛇床子素、异欧前胡素、五味子甲素、五味子醇甲、金丝桃苷、槲皮苷、木犀草素、山柰酚、异鼠李素和熊果酸的平均回收率分别为99.56%、99.47%、99.69%、101.2%、99.89%、100.2%、99.86%、101.2%、98.69%、101.1%、98.65%、99.75%、101.9% 和97.89%。RSD值分别为1.1%、0.9%、1.3%、1.1%、1.5%、1.4%、1.4%、0.8%、1.7%、1.7%、1.9%、1.5%、1.6% 和2.1%。结果表明该方法回收率良好。
八子补肾胶囊 (批号: 130201) 中花椒毒素、异茴芹内酯、佛手柑内酯、欧前胡素、蛇床子素、异欧前胡素、五味子甲素、五味子醇甲、金丝桃苷、槲皮苷、木犀草素、山柰酚、异鼠李素和熊果酸的平均含量 (n = 6) 分别为274.5、280.3、187.3、84.9、987.3、1.1、295.6,1073.0、191.1、6.0、7.0、92.4、23.1、87.6 μg·g-1; RSD值分别为0.8%、1.2%、1.5%、2.1%、0.8%、2.8%、0.5%、0.6%、1.7%、2.3%、2.5%、1.7%、1.8% 和1.9%,均符合规定。结果表明本方法精密度良好。
2 实际样品的检测3批样品中,14种待测组分的含量范围为1.1~ 1 103.3 μg·g-1,RSD值范围为0.3~2.9%。其中五味 子醇甲含量最高,异欧前胡素含量最低。各待测组分在3批样品中的含量基本一致,说明各批次制剂样品所用药材质量稳定,制剂工艺成熟。结果见表 3。
|
|
Table 3 Contents of the fourteen compounds in Bazibushen capsules (n = 6,μg·g-1) |
八子补肾胶囊由多味药材组成,其药效是多种化学成分产生的综合效果,进行定性和定量分析是控制复方制剂质量的主要方法。香豆素类、木脂素类和黄酮类成分是八子补肾胶囊处方组成中的标志化合物,不仅有较高的含量而且具有较强的明确的药理药效活性。因此,选择14种主要成分作为八子补肾胶囊的有效成分组进行质量控制。
八子补肾胶囊中的上述14种活性成分中,8种成分在正离子模式下的响应值高,另外6种成分在负离子模式下的响应值高,采用正负离子同时切换方式和多次切换监测模式方式,虽然方便,但两组化合物灵敏度均有大幅下降,故本实验采用正负离子分别测定的方法。
流动相的组成决定了分析物间的分离度和待测物的离子化程度,故流动相的选择对于UPLC-ESI- MS/MS法定量测定待测化合物十分关键。本实验对甲醇-水和乙腈-水两种流动相组成系统进行了考察,结果表明乙腈-水系统优于甲醇-水系统。为了提高各待测组分的分离度和检测灵敏度,先后考察了包括醋酸铵、甲酸、乙酸在内的流动相添加剂来选择最佳的流动相条件,结果表明,乙酸铵对各待测组分有一定的离子抑制作用; 甲酸条件下各待测组分的离子化效果也不理想; 在流动相中加入0.1% 乙酸可以改善各待测组分的峰形并提高各待测组分的灵敏度。故最终选择在流动相的水相中加入0.1% 乙酸,以提高各待测组分的离子化效率。另外由于等度洗脱分离能力差和消耗时间长的缺点,最后选用了梯度洗脱的方法。
关于提取溶剂和提取方法,实验过程中对不同浓度的甲醇溶液和乙醇溶液进行了比较,结果显示70% 乙醇溶液的提取率更高; 实验还对超声提取,振摇提取和加热回流提取方法进行了比较,结果显示超声的提取效率最高; 经对不同超声提取时间进行考察,60 min时各主要成分的含量不再增加,即能达到最高的提取率,因此将样品超声处理时间确定为60 min。
本实验建立的UPLC-ESI-MS/MS方法可在短时间内快速定量检测八子补肾胶囊中的14种主要药理药效成分,测定时,制剂中各化学成分不需完全的色谱分离,即可通过质谱的高选择性予以区别。14个待测化合物在5 min内实现了快速分离分析。本实验建立的超高效液相色谱-质谱联用法可为全面有效的控制八子补肾胶囊的质量提供重要参考依据。
| [1] | Xu HH, Zhang YF, Li XY, et al. Quality standard research of bazibushen capsule[J]. China Pharm (中国药业), 2011, 20:24-25. |
| [2] | Zhao SH, Han GR, Xu HH, et al. Determination of osthole in bazibushen capsule by fluorescence scanning method[J]. Chin Tradit Pat Med (中成药), 2005, 27:783-785. |
| [3] | Wang QR, Fang ZL, Zheng Y, et al. Chinese tonifying formula "Bazi Bushen capsules" benefits the performance of soccer players during preparation and competition period[J]. Chin J Sports Med (中国运动医学杂志), 2012, 31:1054-1058. |
| [4] | China Food and Drug Administration. National Drug Standards (国家药品标准), WS-5565(B-0565)-2014. |
| [5] | China Food and Drug Administration. National Drug Standards (国家药品标准), WS-5565(B-0565)-2002. |
| [6] | Chen Y, Chen CJ, Li J, et al. Determination of 10 mycotoxin contaminants in Panax notoginseng by ultra performance liquid chromatography-tandem mass spectrometry[J]. Acta Pharm Sin (药学学报), 2015, 50:81-85. |
| [7] | Liu J, Xu W, Li H, et al. Simultaneous determination of ten components in Radix Paeoniae Alba pieces by UPLC-MS/MS[J]. Chin J Pharm Anal (药物分析杂志), 2015, 35:635-643. |
 2016, Vol. 51
2016, Vol. 51


