红芪为豆科植物多序岩黄芪 (Hedysarum polybotrys Hand.-Mazz.) 的干燥根,具有升阳补气、固表止汗、利水消肿、生津养血、行滞通痹、脱毒排脓、敛疮生肌之功效[1]。红芪主要种植在甘肃省陇南地区,是甘肃省的道地药材,在甘肃省以红芪作为黄芪的代用品已有悠久历史。甘肃的红芪产量占全国的90%,文献[2]报道红芪在内蒙古、新疆、陕西等地亦有,但现在大多没有种植品。近年来国内外学者主要对红芪的化学成分和药理学活性做了深入研究,研究发现红芪药材含有丰富的黄酮类[3, 4]、皂苷类[5]、多糖[6]、氨基酸和微量元素[7]等成分。其药理活性主要有免疫调节、抗肿瘤、抗氧化、降血糖、抗肝纤维化等[8, 9]。然而有关红芪活性成分含量测定的文献[10, 11]报道较少,并且最多同时测定了5个黄酮类化合物[12, 13],鲜见用HPLC法测定红芪中腺苷、异甘草素和γ-氨基丁酸 (GABA) 成分的报道。为了提高红芪质量标准控制,本实验建立了HPLC法测定红芪中8个活性成分含量的方法。
中药是一个复杂的体系,其药效的发挥是多种因素相互作用的结果。中药化学成分是其药效物质基础的重要构成部分,其含量的高低在一定程度上体现了中药质量的优劣。然而其含量又与产地、气候及采收季节等因素密切相关。鉴于同种药材的遗传特性相似,本实验测定了甘肃24批红芪药材的指标成分含量,对其进行主成分分析从中提取出一些潜在的综合性指标,体现中药的整体性; 并通过聚类分析,寻找其产地规律性。
材料与方法 实验仪器Waters 2695型高效液相色谱仪; Waters 2996型二极管阵列检测器 (DAD); Alltech ELSD 2000型蒸发光散射检测器; Millennium 32色谱管理站; 717自动进样器; Sartorius BS224S型电子分析天平 (万分之一); Sartorius BP211D型电子分析天平 (十万分之一)。
试剂和药品对照品腺苷 (批号110879-200202) 购于中国食品药品检定研究院; 对照品芒柄花苷 (批号M-013-140730)、毛蕊异黄酮苷 (批号Ⅲ-020- 140730-2)、异甘草素 (批号Y-008-140801)、γ-氨基丁酸 (γ-aminobutyric acid,GABA; 批号101494560) 购于上海盛中医药化工有限公司; 对照品毛蕊异黄酮 (批号201102)、芒柄花素 (批号201011)、美迪紫檀素 (批号130120) 购于上海顺勃生物工程有限公司; 以上所有对照品均供含量测定用,纯度均大于98%。甲醇 (山东禹王) 和乙腈 (德国默克) 均为色谱纯; 水为高纯水; 其他试剂均为国产分析纯。
药材24批红芪药材 (编号S1-S24) 中22批药材为栽培品,采自甘肃省不同地区 (9批采自陇南宕昌县不同乡镇: S1、S2为宕昌县所产,S3为车拉乡,S4、S5为官亭镇,S6为哈达铺镇,S7、S8为将台乡,S9为南阳镇; S10采自陇南礼县; S11~S14分别采自武都市甘泉镇、米仓山、柏林镇和有子山; S15~S18采自陇西县文峰、碧岩、菜子和首阳镇,S19~S22为岷县所产); S23为采自甘肃的野生品。以上药材经兰州大学药学院马志刚教授鉴定均为多序岩黄芪的 (Hedysarum polybotrys Hand.-Mazz.) 干燥根。S24为红芪对照药材,购于中国食品药品检定研究院。
HPLC-DAD色谱条件迪马公司Diamonsil C18柱 (250 mm × 4.6 mm,5 μm); 迪马公司C18保护柱 (10 mm × 4.6 mm,5 μm); 流动相A为乙腈,B为水溶液; 流速1.0 mL·min-1; 柱温40 ℃; 进样量10 μL。 采用梯度洗脱程序: 0~30 min,5%~30% A; 30~ 65 min,30%~60% A。检测波长为204 nm (检测腺苷、毛蕊异黄酮苷、芒柄花苷、毛瑞异黄酮、异甘草素和芒柄花素) 和250 nm (检测美迪紫檀素)。
HPLC-ELSD色谱条件[14]迪马公司Diamonsil C18柱(250 mm × 4.6 mm,5 μm); 迪马公司C18保护柱 (10 mm × 4.6 mm,5 μm); 流动相为乙腈-水溶液 (1∶9) 等度洗脱,ELSD载气流速3.1 L·min-1; 漂移管温度110.5 ℃; 增益值为8; 进样量5 μL。
混合对照品储备液的制备 分别精密称取腺苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮、异甘草素、芒柄花素和美迪紫檀素对照品适量,置2 mL棕色量瓶中,加甲醇适量溶解并稀释至刻度制成每1 mL含腺苷0.30 mg、毛蕊异黄酮苷0.48 mg、芒柄花苷0.87 mg、毛蕊异黄酮0.22 mg、异甘草素0.27 mg、芒柄花素0.61 mg和美迪紫檀素0.65 mg的对照品贮备液。分别精密量取腺苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮、异甘草素、芒柄花素和美迪紫檀素对照品贮备液各1 mL于10 mL棕色量瓶中,加甲醇稀释至刻度 ,作为混合对照品溶液贮备液,备用。
GABA对照品溶液的制备精密称取GABA对照品24.97 mg于5 mL量瓶中,加甲醇适量,微热溶解,用甲醇定容至刻度,即为GABA对照品贮备液,备用。
供试品溶液I的制备[11]分别精密称取红芪粉末1.0 g,置250 mL圆底烧瓶中,加入甲醇50 mL,于电热恒温水浴锅中加热回流4 h,冷却,滤过,残渣用10 mL甲醇洗涤3次,合并滤液与洗涤液,减压回收甲醇至干,残渣加甲醇适量溶解,转移至10 mL量瓶中,定容至刻度,摇匀,溶液过0.45 μm滤膜,取续滤液即得供试品溶液Ⅰ。
供试品溶液Ⅱ的制备 精密吸取上述供试品溶液Ⅰ 500 μL于10 mL量瓶中,加甲醇稀释至刻度,摇匀,溶液过0.45 μm滤膜,取续滤液即得供试品溶液Ⅱ。 方法学考察 专属性分别吸取对照品溶液和供试品溶液适量,按上述色谱条件分别进样分析,比较对照品和供试品的色谱图。
线性关系考察分别精密吸取混合对照品贮备液0.02、0.04、0.2、0.4、1.0、2.0和4.0 mL,置于10 mL棕色量瓶中,加甲醇稀释至刻度,摇匀,即得系列对照品混标溶液。分别取10 μL,按HPLC-DAD色谱条件平行进样3次,以峰面积平均值A为纵坐 标,浓度C(μg·mL-1) 为横坐标,绘制标准曲线。
分别精密吸取GABA对照品母液0.1、0.2、0.5、1.0和2.0 mL,置于5 mL量瓶中,加甲醇稀释至刻度,摇匀,即得GABA系列对照品溶液。分别取5 μL,按HPLC-ELSD色谱条件平行进样3次,以平均峰面积A的对数值为纵坐标,浓度C (μg·mL-1) 的对数值为横坐标,绘制标准曲线。同法逐级稀释考察定量限 (信噪比为10)。
精密度精密吸取同一混合对照品溶液10 μL/ GABA对照品溶液5 μL,按上述色谱条件当日连续进样6次和连续进样3天,每天进样2次。记录各成分保留时间和色谱峰面积。分别计算RSD值,即为日内精密度和日间精密度。
重复性取同一批样品,按供试品制备方法,平行制备供试品溶液6份,分别进样分析。记录各成分的保留时间和色谱峰面积,计算RSD值。
稳定性取同一供试品溶液,室温下自然放置,分别于0、2、4、6、8、12和24 h进样分析,记录各成分峰面积,计算RSD值。
加样回收率取已知含量的同一批红芪药材6份,每份1.0 g,精密称定,分别加入混合对照品溶液1 mL (腺苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮、异甘草素、芒柄花素、美迪紫檀素和GABA的质量浓度分别为0.059、0.007、0.278、0.012、0.024、0.262、0.204和195.23 mg·mL-1),按供试品溶液制备方法,分别制备供试品溶液Ⅰ、Ⅱ并进样分析,计算8个成分的加样回收率。
样品含量测定分别取24批红芪药材1.0 g,按照供试品制备方法分别制备供试品溶液Ⅰ、Ⅱ,按色谱条件分别进入HPLC色谱系统分析,记录8个成分的保留时间和峰面积,采用外标法分别计算各成分的含量。
统计方法分析分别应用SPSS Statistics 19.0 软件进行主成分分析和聚类分析。
结果 1 方法学考察 1.1 方法专属性供试品HPLC色谱图中指标成分与其他成分的色谱峰均分离良好,且与对照品保留时间一致 (腺苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮、异甘草素、芒柄花素、美迪紫檀素及GABA对照品的保留时间分别为6.653、21.384、30.251、34.135、43.431、45.183、50.490和2.496 min),表明该方法具有良好的专属性。HPLC色谱图见图 1。
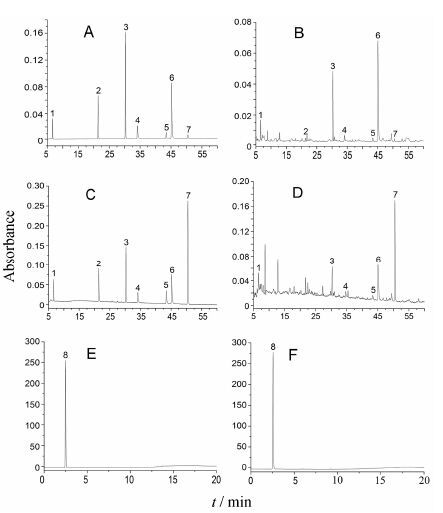
|
Figure 1 HPLC chromatograms of reference substances and samples. A: Reference substances by HPLC-DAD (250 nm); B: Samples by HPLC-DAD (250 nm); C: Reference substances by HPLC-DAD (204 nm); D: Samples by HPLC-DAD (204 nm); E: Reference substances by HPLC-ELSD; F: Samples by HPLC- ELSD. Peaks 1: Adenosine; 2: Calycosin-7-glucoside (Cal-7-Glu); 3: Ononin; 4: Calycosin; 5: Isoliquiritigenin; 6: Formononetin; 7: Medicarpin; 8: γ-Aminobutyric acid (GABA) |
结果如表 1所示,8个成分的r2均大于0.99,表明各成分在线性范围内线性良好。
|
|
Table 1 Regression equations of reference substances |
结果显示8个成分 (腺苷、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮、异甘草素、芒柄花素、美迪紫檀素及GABA) 峰面积的日内精密度分别为0.60%、0.36%、0.41%、0.28%、0.36%、0.23%、0.89%和1.09%; 日间精密度分别为0.76%、0.55%、0.68%、1.31%、0.70%、0.70%、0.50%和1.78%。精密度实验RSD均小于2%,表明仪器精密度良好。
1.4 重复性结果显示样品中8个成分的平均含量分别为58.22、7.13、268.71、12.09、23.97、259.92、202.25 μg·g-1和194.00 mg·g-1; RSD分别为0.64%、1.05%、0.89%、1.12%、0.47%、0.81%、0.43% 和1.05%,表明该方法重复性良好。
1.5 稳定性在室温下自然放置24 h,测得8个成分峰面积的RSD分别为1.13%、1.36%、0.58%、1.50%、1.39%、0.49%、0.36% 和1.07% (n = 7),表明供试品溶液在室温24 h内稳定。
1.6 加样回收率结果显示,8个成分的加样回收率分别为100.07%、98.66%、96.90%、99.96%、101.43%、103.45%、100.26% 和96.78%; RSD分别为0.64%、1.58%、0.99%、1.35%、0.68%、0.29%、0.43% 和1.61% (n = 6),表明所建立的方法的准确度良好。
2 红芪样品含量测定24批红芪药材含量测定结果见表 2。由测定结果可知红芪中GABA的含量最高 (最高达到307.53 mg·g-1),芒柄花苷、芒柄花素和美迪紫檀素次之 (最高达到353.81、278.44和493.94 μg·g-1),而毛蕊异黄酮苷、毛蕊异黄酮和异甘草素含量较低。
|
|
Table 2 The contents of the eight compounds in Radix Hedysari from different places in Gansu |
主成分分析结果表明前3个成分的特征根均大于1,且对方差的累积贡献率达到77.204%,故选定前3个主成分来概括样品信息,红芪中各组分对主成分的贡献大小见表 3。由表 3可知对主成分1贡献较大的是美迪紫檀素、芒柄花苷、毛蕊异黄酮和芒柄花素,对主成分2贡献较大的是毛蕊异黄酮苷、腺苷和异甘草素,对主成分3贡献最大的是GABA。根据各主成分的得分 (F1、F2、F3),以各主成分相应的方差贡献百分比为权重,对3个主成分进行线性组合,构造可以反映原样本信息的综合主成分得分,用F值表示 (即: F = 0.536 3 × F1 + 0.282 9 × F2 + 0.180 7 × F3)。对F值进行排序,结果见表 4。F值愈大说明红芪中各成分综合含量愈高,红芪质量愈好,由表 4可知S4的质量为最佳。
|
|
Table 3 Component score coefficient matrix. Component 1,2 and 3 represent the three common factors which were extracted from the whole samples. The value in the table above represented the correlation coefficient between the common factor and the original variables,and the greater absolute value showed that the relationship was more closely |
|
|
Table 4 Comprehensive principal component evaluation results. Comprehensive principal component score showed the comprehensive information of the original samples and the bigger numerical value might suggest the better quality of Radix Hedysari. Preferential order revealed the quality of the order of the 24 batches of Radix Hedysari |
为了考察红芪8个成分含量差异与产地之间的相互关系,应用SPSS软件对24批不同产地的红芪进行聚类分析[15]。应用K-Means聚类法快速聚类结果聚成两类,样品S2、S4、S5和S9聚成一类,其余20批样品聚成一类。这表明这4个样品质量较好,其余质量稍次。这也与主成分分析结果一致,这4个样品在综合主成分得分排序中分别为第3、1、4和第2。
应用Hierarchical聚类法进行系统聚类分析得到聚类谱系图,见图 2。聚类谱系中,将24批红芪样品分为两大类: 第4批自成一类,其余23批分为一类。
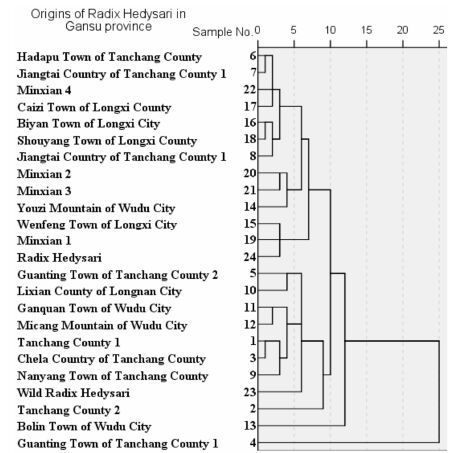
|
Figure 2 Hierarchical diagram of 24 batches of Radix Hedysari |
结合主成分分析,可以得出第4批样品质量最佳。其余23批样品又可分为3类,其中S5、S10、S11、S12、S1、S3、S9、S23、S2聚成一类,在综合主成分得分排序中分别为第4、7、8、11、5、6、2、9、3位,提示这一类红芪质量较好; 第13批样品自成一类,结合主成分分析,在综合主成分得分中排第10位; 其余13批样品分为一类,质量稍差,这也与主成分分析结果相一致,其在综合主成分得分排序中为第12~24位。结果发现除S4和S13外,基本按地域性聚成两类,陇南宕昌、礼县及武都等地区聚成一类,而陇西、岷县等地区聚成一组。该分组符合地域分布特征。然而武都、宕昌所产红芪除了大部分聚为一类外,仍有个别与陇西、岷县等地聚为一类,这也提示除产地外,红芪质量还可能与其生长年限、采收季节等因素有关。
讨论本研究对提取溶剂、提取方法、流动相、柱温、检测波长等条件进行了优化。结果发现甲醇作为提 取溶剂,采用回流提取4 h的方法提取效率高; 柱温40 ℃,以乙腈-水为流动相等度洗脱分离效果佳。在190~400 nm对样品进行全波长扫描,发现在波长250 nm处,各成分峰形较好,峰面积值大,分离度好。美迪紫檀素在204 nm处有最大吸收,在250 nm处吸收较弱,且比较ELSD和DAD检测结果,发现紫外检测的灵敏度更高。因此选择两个波长250 nm和204 nm分别作为检测波长进行测定。
本实验建立了HPLC-DAD测定红芪中腺苷和6个黄酮类成分含量的方法,并且首次运用HPLC- ELSD法测定了红芪中的GABA含量。建立的方法操作简便,方法灵敏度高,准确度、精密度和重复性好,可为多指标控制红芪质量提供实验基础。红芪中除含有较高的GABA外,芒柄花苷和芒柄花素和美迪紫檀素的含量也很高,这为阐述红芪的药效物质基础提供了新的思路。聚类分析和主成分分析结果基本一致,表明聚类分析可用于评估红芪指标成分含量与产地之间的相关性,对红芪的质量评价具有一定的可靠性和客观性。
| [1] | Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. Part 1. Beijing:China Medical Science Press, 2010:142. |
| [2] | Li GM, Wang WN, Hu MS. Studies on the pharmacognosy of Radix Hedysari[J]. Bull Chin Mater Med (中药通报), 1987, 12:5-9. |
| [3] | Hai LQ, Zhang QY, Liang H, et al. Studies on chemical constituents of Hedysarum polybotrys[J]. Acta Pharm Sin (药学学报), 2003, 38:592-595. |
| [4] | Zheng SS, Wu T, Wang ZT. Chemical constituents from the roots of Hedysarum polybotrys[J]. China J Chin Mater Med (中国中药杂志), 2011, 36:2350-2352. |
| [5] | Jia ZQ, Dong QX, Zhou XY. Comparison of total saponin content in the root, stem, leaf of Radix Hedysari[J]. Northwest Pharm J (西北药学杂志), 2001, 16:157. |
| [6] | Ma D, Feng SL, Zhao LG, et al. Purification of the Radix Hedysari polysaccharide and determination of its constitutions[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2008, 25:177-179. |
| [7] | Duan ZX, Sun LJ, Zheng HJ, et al. Determination of inorganic elements and amino acids in Hedysarum polybotrys Hand.-mass as well as its growing soils[J]. J Lanzhou Univ (兰州大学学报), 1990, 26:79-82. |
| [8] | Liu J, Hu X, Yang Q, et al. Comparison of the immunoregulatory function of different constituents in Radix Astragali and Radix Hedysari[J]. J Biomed Biotechnol, 2010, 2010:1-12. |
| [9] | Chen XY, Liu XY, Chen YL, et al. Spectrum-effect relationship on anti-hepatic fibrosis effect of Radix Hedysari[J]. Chin J Chromatogr (色谱), 2015, 33:413-418. |
| [10] | Hu FD, Feng SL, Zhao JX. Determination of formononetin and calycosin from Radix Hedysari by HPLC[J]. Chin Med Mat (中药材), 2003, 26:634-636. |
| [11] | Zhao DW, Wu X, Song PS, et al. Determination of four flavonoids in Radix Hedysari by HPLC[J]. China Pharm (中国药师), 2015, 18:44-46. |
| [12] | Zhao J, Yu QT, Li P, et al. Determination of nine active components in Radix Hedysari and Radix Astragali using capillary HPLC with diode array detection and MS detection[J]. J Sep Sci, 2008, 31:255-261. |
| [13] | Liu Y, Zhang XJ, Zhao YJ, et al. Comparative chemical analysis of Radix Astragali and Radix Hedysari by HPLC[J]. Nat Prod Res, 2012, 26:1935-1938. |
| [14] | Xu ZA, Zhang JZ, Zhao CS. Determination of γ-aminobutyric acid in food by HPLC-ELSD[J]. Chem Anal Meterage (化学分析计量), 2012, 21:49-51. |
| [15] | Dai XY, Sheng ZH, Hao YY, et al. Principal component analysis and clustering analysis of the trace elements in Rheum palmatum L. from different areas[J]. Chin J Tradit Chin Med Pharm (中华中医药杂志), 2012, 27:1445-1448. |
 2016, Vol. 51
2016, Vol. 51


