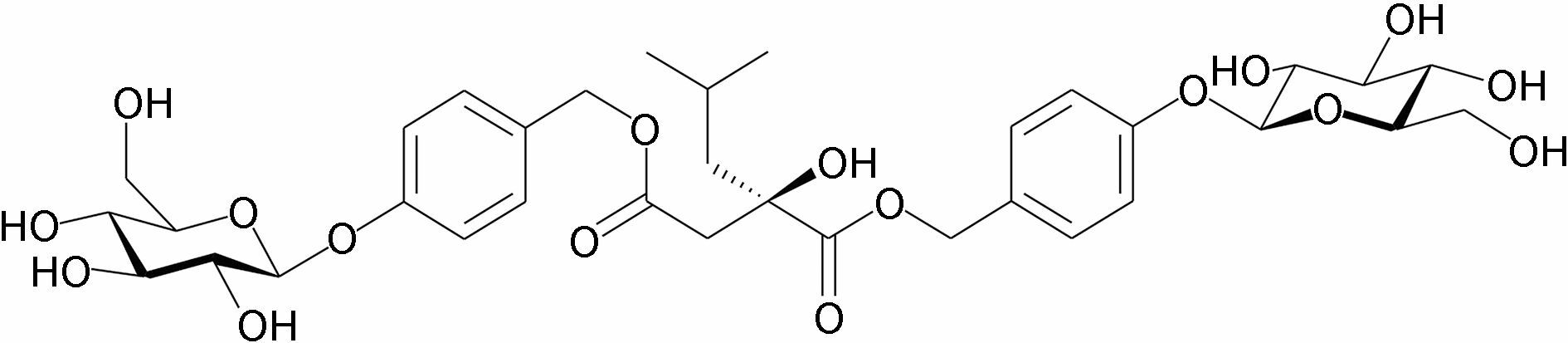
血管性痴呆 (vascular dementia,VaD) 是仅次于阿尔兹海默病(Alzheimer’s disease,AD) 的第二大常见痴呆病症。神经冲动在大脑的顺利传导可以使来自不同大脑区域的信息进行整合。神经环路结构与 功能的完整性是认知、运动和感觉等功能正常进行的必要条件。白质几乎占据了人类脑容量的一半,它由髓鞘化的轴突组成,轴突的总长度可达176 000 km[1]。轴突的数量、直径和髓鞘的厚度决定着白质的体积。轴突是神经元间连接的物质基础,负责细胞间的信息交流。髓鞘是包围在轴突外的多层致密膜结构,产生绝缘作用而加速神经冲动的传导。因此,白质在大脑功能性网络信息畅通中发挥着关键作用。影像学研究显示,在脑血管病和痴呆患者中经常可以检测到白质损伤,会导致运动能力受损、认知功能下降,这可能与损伤脑区间信号传递的速度和完整性有关[2,3]。目前,白质损伤的确切原因尚不明确,微血管疾病导致的慢性脑缺血是脑白质损伤的重要原因之一[4]。脑白质损伤的病理变化主要表现为脱髓鞘、轴突损伤和少突胶质细胞凋亡[5,6]。1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯 (militarine,图 1) 是从植物白及中分离出的一种丁二酸苄酯糖苷化合物,前期研究显示该类化合物可明显改善痴呆模型动物学习记忆障碍[7,8]。本研究采用慢性脑缺血大鼠模型,探讨militarine对学习记忆能力和白质是否具有保护作用。
|
Figure 1 The structure of militarine |
实验动物 Wistar雄性大鼠,体重300~400 g,购自斯贝福 (北京) 实验动物科技有限公司,许可证号: SCXK (京) 2011-0004。
实验材料Militarine (纯度≥95%,中国医学科学院药物研究所李帅教授提供); BCA蛋白浓度测定试剂盒 [威格拉斯生物技术 (北京) 有限公司]; RIPA裂解液 (上海碧云天生物技术有限公司); 5×loading buffer、ECL超敏发光液 (北京普利莱基因技术有限公司); MBP鼠单克隆抗体 (Millipore公司); GAPDH兔单克隆抗体和CNPase兔单克隆抗体 (Cell Signaling Technology公司); Alexa Fluor® 488标记驴抗兔抗体 (Life Technology公司); HRP标记羊抗鼠抗体 (EarthOx公司); Solvent Blue 38 (Sigma公司); 其他试剂均购自北京化工厂。
慢性脑缺血模型建立 大鼠禁食12 h,腹腔注射5% 水合氯醛 (350 mg·kg-1) 麻醉,将大鼠固定后,暴露颈部皮肤,用碘伏擦拭后正中划开,剥离肌肉,暴露双侧颈总动脉,用玻璃分针小心将颈总动脉与迷走神经分离,将颈总动脉以1号缝合线双次结扎。伤口涂抹青霉素后,用7号缝合线缝合伤口,并用碘伏擦拭。其中,假手术组 (sham) 仅分离双侧颈总动脉而不结扎。
动物分组与给药 大鼠分为sham组、慢性脑缺血组 (model组)、model+militarine (10和20 mg·kg-1·d-1) 组。动物术后24 h开始给药,militarine以生理盐水溶解,大鼠每日灌胃给药2次,间隔12 h,连续给予30天。Sham组和model组大鼠给予等量的生理盐水。
Morris水迷宫实验 在给药后第25天进行水迷宫实验。其中,前5天进行定位航行实验,第6天为空间探索实验。定位航行实验中,水迷宫装置直径1.5 m,平台位于水面下1.5 cm,水温 (20 ± 1) ℃。每只动物每天4个不同方位各训练一次,每次训练时间为120 s,动物找到平台后允许其停留15 s,如动物120 s内未发现平台,则实验人员帮助动物登上平台并允许其停留15 s。空间探索实验在最后一次定位航行实验后24 h进行,撤去平台,大鼠自由游泳,记录大鼠60 s内首次穿越原平台位置时间和穿越原平台的次数。
脑组织标本制作 Morris水迷宫实验结束后,大鼠腹腔注射10% 水合氯醛 (350 mg·kg-1) 麻醉。打开胸腔,充分暴露心脏,插入灌注针至主动脉,灌注生理盐水同时剪开右心耳,至无血液流出后,用4% 多聚甲醛磷酸盐缓冲液灌注固定。灌注结束后,将剥离的脑组织放入4% 多聚甲醛固定24 h。再将脑组织放入30% 蔗糖磷酸盐缓冲液脱水至其沉入底部。使用Optimum Cutting Temperate包埋脑组织,连续冠状冰冻切片 (片厚20 μm)。将脑片置于0.01 mol·L-1 PBS中,4 ℃保存。
牢固蓝 (luxol fast blue,LFB) 染色 将脑片裱于赖氨酸包被的玻片上,37 ℃烘干。将玻片依次浸入70% 和95% 乙醇各5 min后,转入盛有0.1% LFB染液的染缸,60 ℃水浴2 h。取出染缸,冷却至室温后,用95%乙醇和去离子水洗涤玻片。然后将玻片浸入0.05% 碳酸锂溶液和70%乙醇分化,各30 s,去离子水洗涤,至灰、白质具有鲜明对比。脑片经70%、80%、90% 和100% 乙醇脱水后,二甲苯透化,然后中性树胶封片,显微镜下观察。白质损伤程度参考Wakita等[9]评分标准: 正常计0分,神经纤维排列紊乱计1分,形成显著空泡计2分,有髓神经纤维丢失计3分。
Western blot 大鼠断头处死,冰上分离胼胝体,液氮速冻后加入RIPA裂解液超声破碎,以BCA法测定蛋白浓度,加入1/4体积5×loading buffer后95 ℃处理5 min,-40 ℃保存。蛋白上样量30 μg,分离胶 浓度12%,将蛋白转印至PVDF膜后以5% 脱脂奶封闭1 h,一抗 (MBP,1∶2 000; GAPDH,1∶5 000) 4 ℃孵育过夜,二抗室温孵育2 h,加入ECL发光液,显影。使用Quality one 4.6.2凝胶分析软件对蛋白条带进行灰度分析。目的蛋白相对光密度 = (OD18.5 kDa MBP + OD21.5 kDa MBP) / ODGAPDH。
免疫荧光技术脑片以0.01 mol·L-1 PBS洗涤,0.3% Triton X-100室温孵育30 min,5% BSA室温封闭1 h。一抗 (CNPase,1∶100) 4 ℃孵育脑片过夜后,室温平衡30 min,0.01 mol·L-1 PBS漂洗。荧光二抗室温孵育1 h,0.01 mol·L-1 PBS漂洗后封片,荧光显微镜下观察。
统计学分析数据用$\overline{x}$± s表示,采用SPSS17.0统计分析软件进行统计分析。数据组间比较采用单 因素方差分析 (one-way ANOVA) 结合post hoc Bonferroni test检验,组内比较采用Student’s t-test检验。以P < 0.05为具有统计学差异。
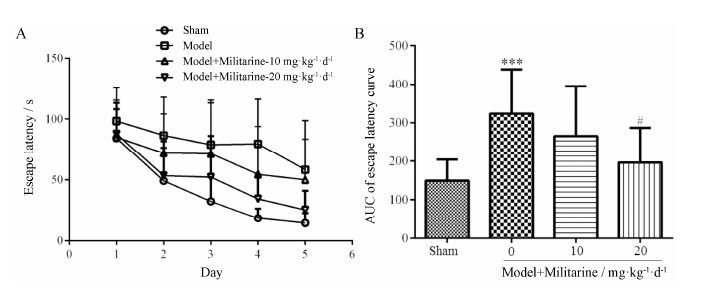
结果 1 Militarine对慢性脑缺血大鼠Morris水迷宫实验的影响 1.1 Militarine对慢性脑缺血大鼠定位航行实验的影响动物在术后给药第25天进行Morris水迷宫定位航行实验。在5天的连续训练过程中,各组大鼠逃避潜伏期逐渐缩短,model组大鼠逃避潜伏期最长,sham组及药物治疗组逃避潜伏期均低于model组 (图 2A)。Model组大鼠逃避潜伏期- 时间曲线下面积 (area under the curve,AUC) 明显高于sham组 (P < 0.001),给予20 mg·kg-1·d-1 militarine能显著降低慢性脑缺血大鼠AUC (P < 0.05) (图 2B)。
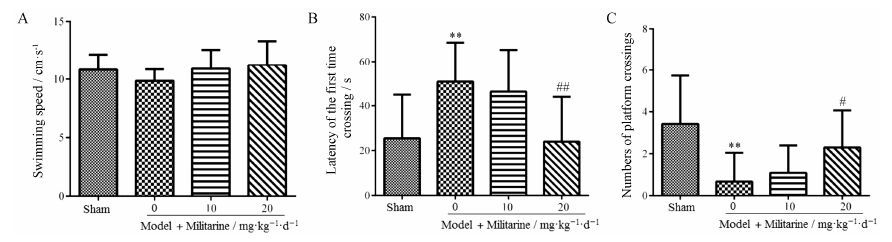
1.2 Militarine对慢性脑缺血大鼠探索实验的影响定位航行实验结束后24 h,撤去平台,记录大鼠60 s内首次穿越原平台位置时间和穿越原平台的次数。与sham组相比,model组大鼠首次穿越原平台位置时 间明显延长 (P < 0.01); 穿越原平台的次数明显减少 (P < 0.01)。而model+militarine (20 mg·kg-1·d-1) 治疗组大鼠首次穿越原平台位置时间显著缩短 (P < 0.01); 穿越原平台的次数明显增加 (P < 0.05)。各组动物游泳速度没有显著差异 (图 3)。
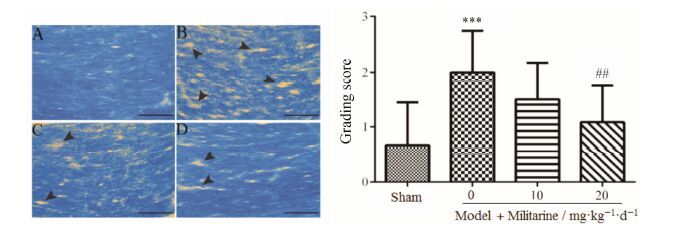
2 Militarine对慢性脑缺血大鼠胼胝体脑白质的影响LFB在乙醇溶液中可以将髓鞘染为蓝色。染色结果 (图 4) 显示,sham组大鼠胼胝体髓鞘致密,model组髓鞘变得稀疏,出现空洞,脱髓鞘现象明显。Model+militarine (20 mg·kg-1·d-1) 组大鼠胼胝体脑白质脱髓鞘现象得到显著改善 (P < 0.01)。
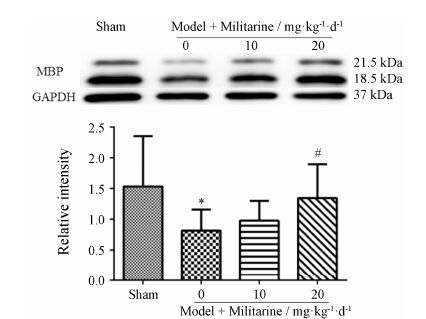
3 Militarine对慢性脑缺血大鼠胼胝体MBP的影响 18.5 kDaMBP位于少突胶质细胞胞浆侧细胞膜上,将细胞膜黏附起来形成髓鞘,21.5 kDa MBP对髓鞘化具有调节作用,可以增加髓鞘的稳定性[10]。Western blot结果显示 (图 5),慢性脑缺血后大鼠胼胝体部位MBP (18.5和21.5 kDa) 表达量明显低于sham组,给予militarine (20 mg·kg-1·d-1) 能显著逆转慢性脑缺血导致的MBP表达量下降。
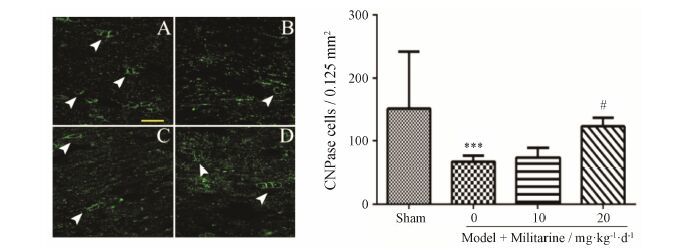
4 Militarine对慢性脑缺血大鼠胼胝体CNPase阳性细胞的影响CNPase是少突胶质细胞标志物之一。免疫组织荧光结果显示 (图 6),慢性脑缺血后大鼠胼胝体部位少突胶质细胞数量明显低于sham组 (P < 0.001),model+militarine (20 mg·kg-1·d-1) 组大鼠胼胝体部位少突胶质细胞数量显著增加 (P < 0.05)。
|
Figure 2 Effect of militarine on the escape latency (A) and the area under the curve (AUC) of escape latency (B) in the spatial acquisition trial by Morris water maze. n = 10-12,$\overline{x}$± s. **P < 0.001 vs sham; #P<0.05 vs model |
|
Figure 3 Effect of militarine on the average swimming speed (A),the latency time to cross the platform location (B),numbers of platform crossing (C) in the probe trial by Morris water maze. n = 10-12,$\overline{x}$± s. **P < 0.01 vs sham; #P < 0.05,##P < 0.01 vs model |
|
Figure 4 Photomicrographs of luxol fast blue (LFB) staining of the experimental rat corpus callosum. The vacuoles (arrows) are visible in corpus callosum. Sham (A),model (B) and model+militarine (10 and 20 mg·kg-1·d-1) (C and D) rats at 30 days after operation. n = 4,$\overline{x}$± s. ***P < 0.001 vs sham; ##P < 0.01 vs model. Scale bar: 50 μm |
|
Figure 5 Photographs of Western blot of myelin basic protein (MBP) in the experimental rat corpus callosum. n = 4,$\overline{x}$± s. P < 0.05 vs sham; #P < 0.05 vs model |
慢性脑缺血与认知功能障碍密切相关。大鼠永久性双侧颈总动脉结扎导致的慢性脑缺血模型是模拟人血管性认知障碍的常用模型。该模型术后可使脑血流量明显下降,持续达3个月之久,并出现认知障碍及大脑病理改变[11]。本实验通过Morris水迷宫实验评价militarine对慢性脑缺血大鼠认知功能的影响,结果显示,20 mg·kg-1·d-1 militarine能显著改善慢性脑缺血导致的学习记忆能力损伤。
|
Figure 6 Photographs of immunohistochemical staining for 2',3'-cyclic-nucleotide 3'-phosphodiesterase (CNPase)-positive oligodendrocytes (green) in the experimental rat corpus callosum. Sham (A),model (B) and model+militarine (10 and 20 mg·kg-1·d-1) (C and D) rats at 30 days after operation. n = 4,$\overline{x}$± s. ***P < 0.001 vs sham; #P < 0.05 vs model. Scale bar: 50 μm |
脑白质主要由髓鞘包围的神经轴突组成,控制神经元间信号传递,协调脑区间的运作。深部白质位于不同供血网络远端分水岭区域,这导致其在脑缺血时极易受到损伤[12]。髓鞘是包裹在轴突外起绝缘作用的一种脂蛋白膜,其独特的高脂低水成分和分段结构使信号能够使用较低的能量进行高速精确的传导[13]。脱髓鞘是缺血性脑白质病变的病理特征之一。LFB是一种常用的髓鞘染色剂,髓鞘被染成蓝色,可以用来观察髓鞘的改变。通过LFB染色发现,慢性脑缺血后,胼胝体部位髓鞘稀疏,出现空泡样病变[6]。MBP是中枢神经系统 (central nervous system,CNS) 髓鞘的主要蛋白之一,占蛋白总量的30%。它位于胞浆侧的细胞膜上,是目前发现的唯一一种CNS髓鞘化需要的结构性蛋白。慢性脑缺血导致白质受损后,MBP表达量下降[14]。本研究发现经20 mg·kg-1·d-1 militarine治疗后,胼胝体部位髓鞘稀疏和空泡样病变得到了明显的改善,MBP表达量明显上调。这说明militarine对缺血导致的脑白质损伤具有保护作用。
CNS髓鞘由少突胶质细胞形成。少突胶质细胞极易受到缺血缺氧的损伤,缺血时少突胶质细胞损伤导致的脱髓鞘是脑白质损伤的重要原因。CNPase是少突胶质细胞的标志物之一,免疫组织化学染色结果显示脑缺血后,CNPase表达明显降低,少突胶质细胞数量明显减少。给予20 mg·kg-1·d-1 militarine后,这一现象明显改善。大脑少突胶质细胞是室管膜下区的少突胶质前体细胞经迁移至灰质和白质分化形成[15]。研究发现,脑缺血后白质部位少突胶质前体细胞数量增加[16]。但受损的白质并没有再髓鞘化,其原因可能是增殖的少突胶质前体细胞没有分化为少突胶质细胞。因此,militarine是否可以促进少突胶质前体细胞的分化和 (或) 保护少突胶质细胞而减轻脑白质损伤,还需进一步的研究。
| [1] | Marner L, Nyengaard JR, Tang Y, et al. Marked loss of myelinated nerve fibers in the human brain with age[J]. J Comp Neurol, 2003, 462:144-152. |
| [2] | Bolandzadeh N, Davis JC, Tam R, et al. The association between cognitive function and white matter lesion location in older adults:a systematic review[J]. BMC Neurol, 2012, 12:126. |
| [3] | Chutinet A, Rost NS. White matter disease as a biomarker for long-term cerebrovascular disease and dementia[J]. Curr Treat Options Cardiovasc Med, 2014, 16:292. |
| [4] | Prins ND, Scheltens P. White matter hyperintensities, cognitive impairment and dementia:an update[J]. Nat Rev Neurol, 2015, 11:157-165. |
| [5] | Tomimoto H, Ihara M, Wakita H, et al. Chronic cerebral hypoperfusion induces white matter lesions and loss of oligodendroglia with DNA fragmentation in the rat[J]. Acta Neuropathol, 2003, 106:527-534. |
| [6] | Wakita H, Tomimoto H, Akiguchi I, et al. Axonal damage and demyelination in the white matter after chronic cerebral hypoperfusion in the rat[J]. Brain Res, 2002, 924:63-70. |
| [7] | Li M, Wang YF, Ma B, et al. Effect and mechanism of Coeloglossum viride var. bracteatum extract on scopolamineinduced deficits of learning and memory behavior of rodents[J]. Acta Pharm Sin (药学学报), 2009, 44:468-472. |
| [8] | Ma B, Li M, Nong H, et al. Protective effects of extract of Coeloglossum viride var. bracteatum on ischemia-induced neuronal death and cognitive impairment in rats[J]. Behav Pharmacol, 2008, 19:325-333. |
| [9] | Wakita H, Tomimoto H, Akiguchi I, et al. Glial activation and white matter changes in the rat brain induced by chronic cerebral hypoperfusion:an immunohistochemical study[J]. Acta Neuropathol, 1994, 87:484-492. |
| [10] | Harauz G, Boggs JM. Myelin management by the 18.5-kDa and 21.5-kDa classic myelin basic protein isoforms[J]. J Neurochem, 2013, 125:334-361. |
| [11] | Farkas E, Luiten PG, Bari F. Permanent, bilateral common carotid artery occlusion in the rat:a model for chronic cerebral hypoperfusion-related neurodegenerative diseases[J]. Brain Res Rev, 2007, 54:162-180. |
| [12] | Iadecola C. The pathobiology of vascular dementia[J]. Neuron, 2013, 80:844-866. |
| [13] | Baumann N, Pham-Dinh D. Biology of oligodendrocyte and myelin in the mammalian central nervous system[J]. Physiol Rev, 2001, 81:871-927. |
| [14] | Chida Y, Kokubo Y, Sato S, et al. The alterations of oligodendrocyte, myelin in corpus callosum, and cognitive dysfunction following chronic cerebral ischemia in rats[J]. Brain Res, 2011, 1414:22-31. |
| [15] | Dewar D, Underhill SM, Goldberg MP. Oligodendrocytes and ischemic brain injury[J]. J Cereb Blood Flow Metab, 2003, 23:263-274. |
| [16] | Miyamoto N, Tanaka R, Shimura H, et al. Phosphodiesterase III inhibition promotes differentiation and survival of oligodendrocyte progenitors and enhances regeneration of ischemic white matter lesions in the adult mammalian brain[J]. J Cereb Blood Flow Metab, 2010, 30:299-310. |
 2016, Vol. 51
2016, Vol. 51


