阿尔茨海默病 (Alzheimer’s disease,AD) 是老年痴呆中最常见的类型,AD患者约占老年性痴呆患者总数的60%~80%。AD在病理上以中枢神经细胞外老年斑 (senile plaques,SP)、细胞内神经纤维缠结 (neurofibrillary tangle,NFT) 和广泛神经元缺失 (neuronal loss) 为主要特征[1]。阿尔茨海默病在内的老年痴呆症是人类目前所面临的最大的全球公共卫生挑战之一,全世界患者已达3 500万多人次,预计到2030年将会翻一番,到2050年,将超过这个数字的3倍[2]。
然而,目前临床治疗AD的药物仅有乙酰胆碱酯酶抑制剂 (多奈哌齐、艾斯能、加兰他敏、石杉碱甲) 和N-甲基-D-天门冬氨酸受体拮抗剂 (美金刚) 两种类型,其临床治疗效果并不理想。因此,对AD这一多因素复杂性疾病,企图通过作用于单一靶点实现疾病治疗极为困难。近年来,随着对网络药理学和多向药理学的认识,研究者逐渐改变单靶点药物治疗的思路,设计可作用于多个抗AD 靶点的单一化学小分子,即“多靶点导向的活性配体”(multitarget- directed ligands,MTDLs)[3]。
随着越来越多的天然产物成功地通过FDA认证而上市,中药 (traditional Chinese medicines,TCMs) 作为天然产物的重要组成部分,在现代药物研发中受到了越来越多的关注和重视。据统计,从1981年到2010年间,有大约34% 新药来源于天然产物[4]。中药方剂中使用多味草药配伍而成,含有大量的化学物质,使得药物可以通过与疾病相关的多个靶点产生药效作用[5]。因此,在分子水平上,中药方剂用于治疗疾病的机制与网络药理学或多向药理学是相通的。
通过生物学实验手段来确定小分子与蛋白相互作用不仅耗时耗力,且任务艰巨。相比之下,计算模拟方法是一种更为方便快捷的方式。前人的研究表明,分子对接、药效团及机器学习建模的方法不仅可从中草药中寻找到指定靶点的潜在先导化合物,还可以用于确证特定中草 药化合物的潜在靶向蛋白[6, 7, 8, 9, 10, 11]。
千百年来,前人应用中草药在治疗疾病的实践中积累了阿尔茨海默病或老年痴呆症的治疗方法。中草药中的多种有效成分通过与疾病相关的多个靶点产生相互作用来提高AD患者的学习记忆能力。但是,对中药复方中所含的有效成分如何调控阿尔茨海默病的网络机制依然知之甚少。本文通过AD相关靶点、方剂和单体的收集,利用已建立的AD多靶点预测平台,预测其中的有效成分及其作用靶点,并构建了化合物-靶点网络、靶点-靶点网络及靶点-疾病网络来解释中药方剂的多种有效成分的协同作用机制。
材料与方法阿尔茨海默病相关靶点的收集 由于AD的病理机制复杂,涉及多种学说,如β淀粉样蛋白 (amyloid protein β,Aβ) 学说、胆碱能学说、Tau 蛋白磷酸化学说和氧化应激学说等。因此,AD相关的靶点众多。通过收集公开的靶点资源数据库药物靶点数据库 (http://pharmdata.ncmi.cn/drugtarget/) 以及治疗靶点数据库 (Therapeutic Target Database,TTD)[12],筛选出具有相应活性配体、进入临床I期的AD相关的作用靶点共25个。根据AD作用机制,对这些靶点进行了分类,见表 1。
|
|
Table 1 Classification of targets in terms of AD pathogenesis. AChE: Acetylcholinesterase; BuChE: Butyrylcholinesterase; α4 nAChR: α4-Nicotinic acetylcholine receptor; α7nAChR: α7- Nicotinic acetylcholine receptor; Muscarnic M1: Muscarinic acetylcholine receptor M1; AMPA 1: Glutamate receptor ionotropic AMPA1 receptor; AMPA2: Glutamate receptor ionotropic AMPA2 receptor; GABA A: Gamma-aminobuyrict acid A receptor; GABA B: Gamma-aminobuyrict acid B receptor; NMDA: Glutamate receptor; APP: Amyloid beta A4 precursor binding protein; BACE1: Beta-secretase; GSK3β: Glycogen synthase kinase 3 beta; CDK5: Cyclin-dependent kinase 5; COMT: Catechol O-methyltransferase; MAO B: Monoamine oxidase B; PDE4A: Phosphodiesterase type 4A; PDE4B: Phosphodiesterase type 4B; 5HT1A: 5-Hydroxytryptamine 1A; 5HT3A: 5-Hydroxytryptamine 3A; 5HT4: 5-Hydroxytryptamine 4; 5HT6: 5-Hydroxytryptamine 6 |
方剂和单体收集 中药用于防治疾病的基本形式是中药复方,即定量的若干种特定中草药植物的混合物。中药复方中含有大量的化学物质,这可能与疾病相关的多个靶点产生相互作用。通过在方剂现代应用数据库,以“阿尔茨海默病”或“老年痴呆”为关键词进行查询,收集治疗阿尔茨海默病中药方剂,并提取出现频率≥5次的中草药进行后续的研究。这些中草药植物中所含化合物从本课题组构建的最新版中国天然产物数据库及TCM-Database@Taiwan数据库中收集[13]。
化学空间及类药性分析中药方剂中使用多味草药配伍而成,含有大量的化学物质,而且结构具有多样性,因此通过计算化合物的两个常见物化性质描述符分子质量 (MW) 与脂水分配系数 (ALogP) 来考察其化学空间分布特征。然后,运用类药性“五规则”[14]对中药中的化合物进行过滤,以便进一步分析有效成分的作用靶点。
靶点预测模型建立本实验室方坚松等[10]使用两种不同的分子指纹描述符 (ECFP6和MACCS) 与两种不同的建模方法 [朴素贝叶斯 (naive Bayesian,NB) 及递归分割 (recursive partitioning,RP)] 构建了100个针对25个抗AD重要靶点的二分类理论预测模型,每个靶点具有4个二分类模型可预测化合物 针对该靶点的活性,包括NB_ECFP6、NB_MACCS、RP_ECFP6和RP_MACCS,并通过训练集5倍交叉验证与测试集验证证明了这些模型具有较高的预测精度。该模型首次运用机器学习方法 (朴素贝叶斯及递归分割) 构建针对多因素复杂性疾病AD的靶点预测系统,并将其成功运用于发现多个多靶点抗AD先导化合物。基于已构建的抗AD重要靶点的理论预测模型,对中药复方化合物的作用靶点进行了预测。如果一个化合物被特定靶点的4个分类模型中至少3个预测为阳性作用,定义该化合物可作用于此靶点。
然后,使用Cytoscape 3.2.1构建化合物-靶点相互作用网络,并使用Network Analyzer分析网络特征。为了研究化合物可能作用的生物学通路及靶点之间的相互关系,通过注释、可视化和整合发现的数据库 (Database for Annotation,Visualization and Integrated Discovery,DAVID)[15]及基因/蛋白质相互作用数据库 (Search Tool for the Retrieval of Interacting Genes/ Proteins,STRING)[16]进行GO (gene ontology) 生物通路富集及建立靶点之间相互作用关系。此外,从药物靶点数据库检索靶点相关疾病,并结合DAVID数据库对Gene Disease Database富集结果,构建了靶点-疾病相互作用网络,从而预测抗AD中药及其他适 应征。
血脑屏障透过性预测血脑屏障 (blood brain barrier,BBB) 是一个介于血液-脑/脊髓之间的通透性较低的、有选择性通过能力的动态界面[17]。血脑屏障的低通透性给中枢神经疾病的治疗和药物的研发带来了严峻的挑战。因此,评价药物的血脑屏障透过性对开发治疗阿尔茨海默病药物具有重要意义。使用Discovery Studio 4.1中的ADMET模块对86个活性化合物进行血脑屏障透过性预测,从而获得血脑屏障透过性良好的多靶点化合物。
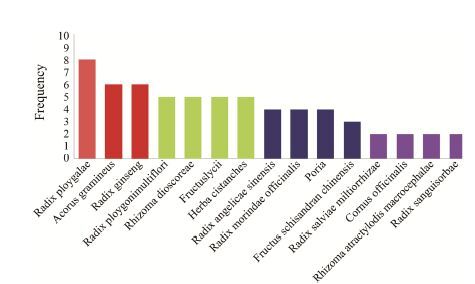
结果 1 用于治疗阿尔茨海默病的中药复方有效成分收集及分析通过在方剂现代应用数据库中检索,共查到13 种治疗阿尔茨海默病中药方剂,即补肾益智方、养寿丹、益智灵、还少丹、补肾益智方、调心方、益肾化瘀降浊汤、理脾阴正方、地黄饮子、生脉饮、智脑胶囊、脑忆清胶囊和七福饮加味。这些方剂共包含50多种中草药植物,其中提取出现频率≥5次的中草 药进行后续的研究 (图 1)。它们分别是远志 (radix ploygalae)、菖蒲 (acorus gramineus)、人参 (radix ginseng)、何首乌 (radix polygonimultiflori)、山药 (rhizoma dioscoreae)、枸杞子 (fructuslycii) 和肉苁蓉 (herba cistanches)。从本课题组构建的最新版的中国天然产物数据库以及TCM-Database@Taiwan数据库中获得507个无结构重复的化合物。
|
Figure 1 Frequency of herbs in the Chinese medicinal formulae |
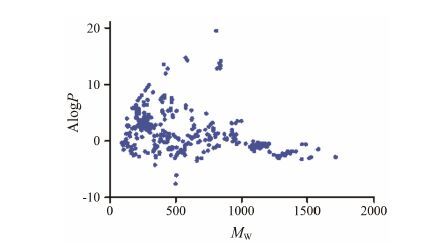
通过计算化合物的两个常见物化性质描述符MW与ALogP来考察中药中化合物化学空间分布特征。结果如图 2所示,化合物MW均在100~1 800,AlogP值在 -10~20,表明中药复方中化合物具有空间分布和多样性。经过类药性预测 (图 3) 后,发现243个化合物有较好的类药性质,并对这些化合物的作用靶点进行预测。
|
Figure 2 Diversity distribution of constituents of herbs in the Chinese medicinal formulae. Chemical space was defined by molecular weight (MW) as X-axis,and ALogP as Y-axis |
|
Figure 3 Drug-likeness distribution of constituents of herbs in the Chinese medicinal formulae |
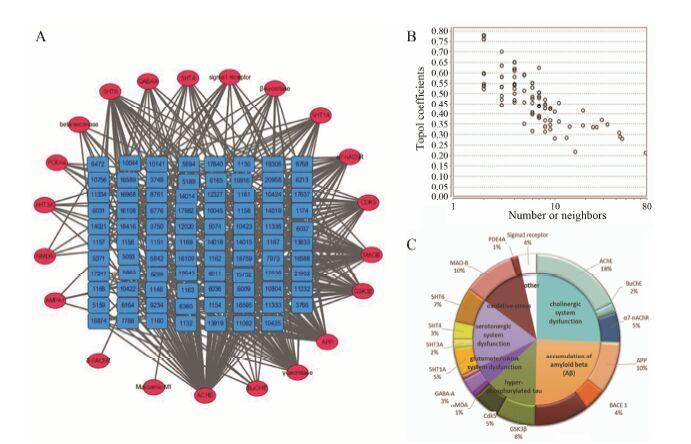
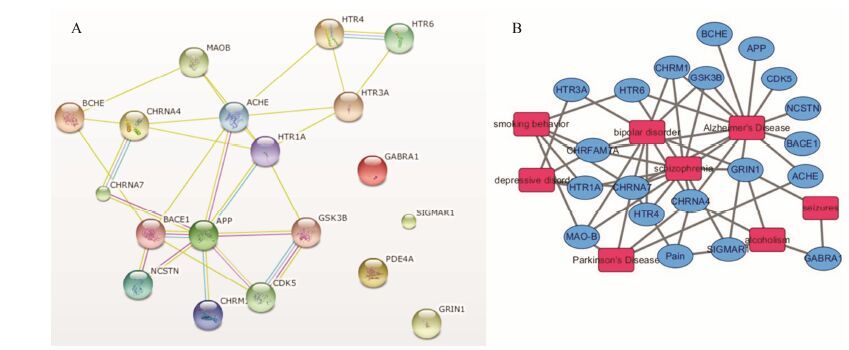
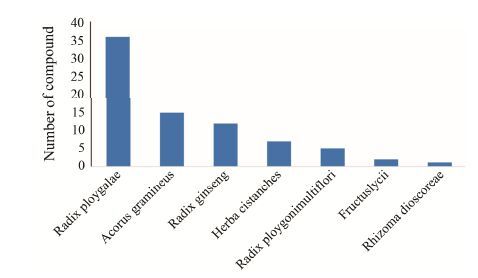
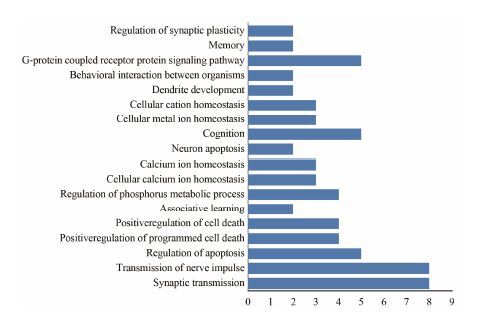
基于已构建的100个覆盖25个抗AD重要靶点的理论预测模型,对507个中药方剂中化合物的作用靶点进行了预测。结果显示,中药方剂中有86个化合物可作用于AD的相关靶点,且大部分有效成分可作用于多个AD相关靶点。预测结果显示 (图 4),抗AD中药复方的化合物主要作用于胆碱能系统和Aβ 产生与聚集过程,从靶点-靶点作用网络 (图 5A) 可以看出乙酰胆碱酯酶与β-淀粉样前体蛋白为高纬度的节点 (hub)。通过网络拓扑特征分析发现,化合物相邻节点数与拓扑相关系数成正比,高网度化合物之间具有较强的相关性,进一步分析结构发现,去甲哈尔满 (β-咔唑啉)、氧杂蒽酮、黄酮、α-细辛醚和色酮等结构片段出现频率很高。从靶点-疾病的作用网络 (图 5B) 可以看出这些化合物不仅可以治疗AD,而且还可以用于治疗帕金森症、精神疾病、抑郁症和癫痫症等。统计方剂中的中药所包含有效化合物的数目 (图 6) 发现,远志中包含的有效成分最多,其次是菖蒲、人参。该结果与图 1结果一致。GO生物学通路富集分析结果 (图 7) 显示,中药所包含有效化合物主要作用通路为突触传导与突触可塑性、神经冲动传导、细胞凋亡调控、磷酸化途径和Ca离子信号传导途径等。这些结果说明,中药方剂中化合物通过作用于多个靶点及多个代谢通路发挥协同作用。
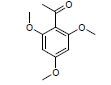
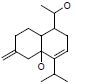
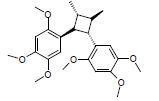
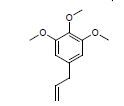
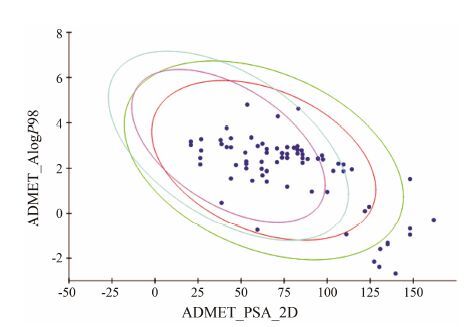
4 血脑屏障透过性预测药物的良好血脑屏障透过性是开发治疗阿尔茨海默病药物的前提。使用Discovery Studio 4.1中的ADMET模块对86个活性化合物进行血脑屏障透过性预测 (图 8),结果发现36个化合物有较好的血脑屏障透过性,表 2列举了7个具有结构代表性的多靶点活性化合物,并且经TCMsp[18]和Drugbank数据库[19]检索这7个化合物的作用靶点,发现预测结果涵盖大部分作用靶点,说明了预测结果的可靠性。
|
Figure 4 The result of prediction of potential inhibitors of herbs in the Chinese medicinal formulae. A: Constituents-target network for potential inhibitors of herbs in the Chinese medicinal formulae (number of nodes = 108,clustering coefficient = 0.0,network centralization = 0.675,network heterogeneity = 1.321). B: Analysis of topological coefficients of constituents-target network. C: Target distribution of potential inhibitors of herbs in the Chinese medic inal formulae |
|
Figure 5 Analysis of target-target interaction by STRING (Search Tool for the Retrieval of Interacting Genes/Proteins) (A) and the relationship of target and disease (B) |
|
Figure 6 The number of potential inhibitors of herbs in the Chinese medicinal formulae |
|
Figure 7 The enrichment of GO biology pathway of potential inhibitors in the Chinese medicinal formulae by DAVID (Database for Annotation Visualization and Integrated Discovery) |
|
Figure 8 Prediction of blood-brain penetration of potential inhibitors in the Chinese medicinal formulae |
中草药在几千年的历史长河中对中国人民的医疗保健起着十分重要的作用。与西药明确的治疗疾病的机制相比,中药治疗疾病的机制仍然很不清晰[5]。因此,为了更好地促进中草药的发展和现代化,从分子水平来解释中药复方治疗疾病的机制是亟需解决的问题。“君、臣、佐、使”历来被强调为“制方之要”[20],从图 1与图 4中可见,中药在方剂中的使用频率和中药中有效化合物数目成正相关,这从分子水平证明了组方中中药配伍的科学性。
虽然AD病理特征已经得到认识,但其复杂的病理机制并不明确,其中胆碱能系统、Aβ假说及tau蛋白磷酸化假说一直是研究的重点。图 4表明,抗AD中药复方的化合物主要作用于胆碱能系统和Aβ产生与聚集过程,其次是tau蛋白磷酸化途径及5-HT系统。这说明中药方剂治疗机制与AD病理机制相吻合。此外,代谢通路富集结果表明,抗AD中药复方的化合物主要影响突触功能、神经冲动传导、Ca离子通路、蛋白磷酸化以及神经元凋亡通路,从而提高认知及学习记忆能力。所以,抗AD中药化合物通过多个靶点及多条代谢通路发挥协同作用,而且经靶点-疾病网络分析,这些中药化合物对帕金森疾病、抑郁症和癫痫症等中枢神经疾病也具有一定作用。
|
|
Table 2 The typical examples of multi-target constituents with good blood-brain penetration |
从靶点-靶点作用网络可以看出,AD相关的大部分靶点之间具有紧密联系,其中乙酰胆碱酯酶与β-淀粉样前体蛋白是该网络的调控中心。乙酰胆碱酯酶抑制剂是当前临床治疗AD最为有效的药物。目前,上市的治疗AD药物也主要是胆碱酯酶抑制剂[21],如多奈哌齐、加兰他敏和艾斯能等。但现有的抗AD药物只能延缓疾病的进展,不能完全治愈疾病。而且,近年来针对Aβ假说开发的药物,虽然已经达到抑制Aβ聚集及降低Aβ的水平, 但并没有改善AD的表 现[22, 23, 24]。因此,在多靶点化合物设计时,研究者不仅要考虑保留乙酰胆碱酯酶靶点及β-淀粉样前体蛋白靶点,还需在此基础上寻找具有药理协同作用的其他靶点[25, 26]。例如,以茚酮为基础结构设计的抑制胆
碱酯酶及抗氧化和Aβ聚集的药物[25],改造2,4-双取代嘧啶结构获得抗胆碱酯酶和Aβ聚集的药物[26],合成苯甲酰胺衍生物获得抑制胆碱酯酶[27]、Aβ聚集及β内分泌酶的药物等[28]。本文列举的7个多靶点化合物具有良好的血脑屏障透过性,可进一步优化以提高对靶点的作用强度。
综上所述,本研究以抗AD中药方剂为研究对 象,运用机器学习模型分析了中药方剂中所含有效成分的作用靶点及通路,并构建了化合物-靶点,靶点-靶点及靶点-疾病的相互网络,来解释中药方剂的多种有效成分的协同作用机制。本文建立了中药方剂的网络药理学的研究思路,为中医药的研究和发展提供新的思路和方法。
| [1] | Anand R, Gill KD, Mahdi AA. Therapeutics of Alzheimer's disease:past, present and future[J]. Neuropharmacology, 2014, 76:27-50. |
| [2] | Kumar A, Singh A, Ekavali, et al. A review on Alzheimer's disease pathophysiology and its management:an update[J]. Pharmacol Rep, 2015, 67:195-203. |
| [3] | Cavalli A, Bolognesi ML, Minarini A, et al. Multi-targetdirected ligands to combat neurodegenerative diseases[J]. J Med Chem, 2008, 51:347-372. |
| [4] | Newman DJ, Cragg GM. Natural products as sources of new drugs over the 30 years from 1981 to 2010[J]. J Nat Prod, 2012, 75:311-335. |
| [5] | Tian S, Li Y, Li D, et al. Modeling compound-target interaction network of traditional Chinese medicines for type II diabetes mellitus:insight for polypharmacology and drug design[J]. J Chem Inf Model, 2013, 53:1787-1803. |
| [6] | Chen X, Ung CY, Chen YZ. Can an in silico drug-target search method be used to probe potential mechanisms of medicinal plant ingredients?[J]. Nat Prod Rep, 2003, 20:432-444. |
| [7] | Ehrman TM, Barlow DJ, Hylands PJ. In silico search for multi-target anti-inflammatories in Chinese herbs and formulas[J]. Bioorg Med Chem, 2010, 18:2204-2218. |
| [8] | Harvey AL, Clark RL, Mackay SP, et al. Current strategies for drug discovery through natural products[J]. Expert Opin Drug Dis, 2010, 5:559-568. |
| [9] | Schuster D, Wolber G. Identification of bioactive natural products by pharmacophore-based virtual screening[J]. Curr Pharm Design, 2010, 16:1666-1681. |
| [10] | Chen KC, Chang KW, Chen HY, et al. Traditional Chinese medicine, a solution for reducing dual stroke risk factors at once?[J]. Mol BioSyst, 2011, 7:2711-2719. |
| [11] | Fang JS, Li Y, Liu R, et al. Discovery of multi-target-directed ligands against Alzheimer's disease through systematic prediction of chemical-protein interactions[J]. J Chem Inf Model, 2015, 55:149-164. |
| [12] | Pang XC, Liu AL, Du GH. Review on the application of drug target database[J]. Chin Pharm J (中国药学杂志), 2014, 49:1969-1972. |
| [13] | Chen CY. TCM Database@Taiwan:the world 's largest traditional Chinese medicine database for drug screening in silico[J]. PLoS One, 2011, 6:e15939. |
| [14] | Lipinski CA, Lombardo F, Dominy BW, et al. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings[J]. Adv Drug Deliv Rev, 1997, 23:3-25. |
| [15] | Dennis Jr G, Sherman BT, Hosack DA, et al. DAVID:Database for Annotation, Visualization, and Integrated Discovery[J]. Genome Biol, 2003, 4:R60. |
| [16] | von Mering C, Huynen M, Jaeggi D, et al. STRING:a database of predicted functional associations between proteins[J]. Nucleic Acids Res, 2003, 31:258-261. |
| [17] | Chow BW, Gu C. The molecular constituents of the bloodbrain barrier[J]. Trends Neurosci, 2015, 38:598-608. |
| [18] | Ru JL, Li P, Wang JN, et al. TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6:13. |
| [19] | Wishart DS, Knox C, Guo AC, et al. DrugBank:a knowledgebase for drugs, drug actions and drug targets[J]. Nucleic Acids Res, 2008, 36:D901-D906. |
| [20] | Chen CY. Weighted equation and rules:a novel concept for evaluating protein-ligand interaction[J]. J Biomol Struct Dyn, 2009, 27:271-282. |
| [21] | Melnikova I. Therapies for Alzheimer's disease[J]. Nat Rev Drug Discov, 2007, 6:341-342. |
| [22] | Armstrong RA. A critical analysis of the ‘amyloid cascade hypothesis’[J]. Folia Neuropathol, 2014, 52:211-225. |
| [23] | Faux NG, Ritchie CW, Gunn A, et al. PBT2 rapidly improves cognition in Alzheimer's disease:additional phase II analyses[J]. J Alzheimers Dis, 2010, 20:509-516. |
| [24] | Wisniewski T, Konietzko U. Amyloid-β immunisation for Alzheimer's disease[J]. Lancet Neurol, 2008, 7:805-811. |
| [25] | Huang L, Miao H, Sun Y, et al. Discovery of indanone derivatives as multi-target-directed ligands against Alzheimer's disease[J]. Eur J Med Chem, 2014, 87:429-439. |
| [26] | Mohamed T, Zhao X, Habib LK, et al. Design, synthesis and structure-activity relationship (SAR) studies of 2,4-disubstituted pyrimidine derivatives:dual activity as cholinesterase and Aβ-aggregation inhibitors[J]. Bioorg Med Chem, 2011, 19:2269-2281. |
| [27] | Peng DY, Sun Q, Zhu XL, et al. Design, synthesis, and bioevaluation of benzamides:novel acetylcholinesterase inhibitors with multi-functions on butylcholinesterase, Aβ aggregation, and β-secretase[J]. Bioorg Med Chem, 2012, 20:6739-6750. |
| [28] | Huang WH, Tang L, Shi Y, et al. Searching for the multitarget-directed ligands against Alzheimer's disease:discovery of quinoxaline-based hybrid compounds with AChE, H3R and BACE 1 inhibitory activities[J]. Bioorg Med Chem, 2014, 19:7158-7167. |
 2016, Vol. 51
2016, Vol. 51