在过去的10年里,化学疗法在肿瘤治疗中具有非常重要的作用,同时也受到人们的广泛关注。但是传统抗肿瘤药物仍然具有很多局限性,例如它们无法区分正常组织与肿瘤组织,使得治疗效率非常低,更甚者还会引起致命的不良反应。同时,多药耐药性也是肿瘤治疗所面临的巨大挑战,由于肿瘤细胞中过表达的P-糖蛋白会将治疗药物不断地从细胞质中泵出,导致治疗效果大幅度降低[1]。因此,提高选择性、克服多药耐药性成为抗肿瘤药物研发的关键。靶向药物递送系统,能够将抗肿瘤药物特异性地传递到肿瘤组织, 并且能够降低正常组织对抗肿瘤药物的摄取,可以降低其不良反应、提高临床治疗效果。目前靶向药物递送系统种类繁多[2, 3],有些已用于临床治疗中。将靶向配体,如多肽、抗体、叶酸或生物素,与靶向药物传递系统共价连接后,能有效地被肿瘤细胞上过表达的受体识别,进一步提高其靶向效率[4]。然而,在正常组织中也有相同的受体表达,它们同样能识别该靶向配体,只是识别水平较低,这使得其靶向效率及治疗效果受到明显的限制。
肿瘤组织与正常组织最大的区别在于,前者细胞外环境偏酸性[5]。近年来,以肿瘤组织的酸性微环境为靶点的抗肿瘤药物得到较快发展。由于肿瘤组织细胞代谢快、供氧不足等原因,细胞通过糖酵解提供能量产生大量乳酸,但肿瘤血管异常又不能及时清除,最终导致肿瘤组织微环境的pH值为5.7~7.2,明显低于正常组织的pH 7.4[6]。酸性微环境是提高抗肿瘤药物选择性的一个非常有效的靶点。刺激-响应型药物传递系统,一旦暴露于肿瘤微环境或受到外部刺激时,发生化学或物理变化,其靶向递送及控制释放功能就会突显出来。这些刺激因素主要包括温度、光照[7]、磁场、氧化还原电势、pH、酶和特异性生物活性分子。由于在不同的组织和细胞区室间的pH值差别很大,因此pH响应策略得到了最为广泛的应用[8]。
本文概述了近年来以肿瘤酸性微环境为靶点设计的5种类型pH敏感性多肽类药物递送系统的研究进展及应用前景。
1 pH敏感性多肽药物递送系统的发展状况根据pH响应机制、多肽种类及载体材料的不同,可以将pH敏感性多肽药物递送系统分为5种类型: pH响应性细胞穿膜肽介导的药物递送系统; pH响应性多肽自组装药物释放系统; pH依赖性电荷反转药物传递系统; pH敏感性寡肽介导的药物递送系统; pH敏感型载体材料与细胞穿膜肽共修饰纳米粒。
1.1 pH响应性细胞穿膜肽介导的药物递送系统细胞穿膜肽 (cell-penetrating peptides,CPPs) 是一种由10~30个氨基酸残基组成的阳离子短肽。细胞穿膜肽能介导多种物质进入细胞,如DNA、蛋白质、抗体、显像剂、纳米粒和脂质体等[9]。将CPPs与传统的抗肿瘤药物 (如紫杉醇、喜树碱和鬼臼毒素等) 共价连接后,能明显提高这些药物的抗肿瘤活性,同时也增强了这些药物的水溶性、组织渗透力及在肿瘤组织中的分布[10]。然而,由于细胞穿膜肽的选择性较差、正电荷多而引起的体内系统毒性、稳定性差等问题,使其在体内的应用受到了限制。因此,研究者想出了很多策略以提高细胞穿膜肽的肿瘤靶向性[11],如将肿瘤特异性靶向配体与细胞穿膜肽结合[12],或制成肿瘤靶向配体与细胞穿膜肽共修饰纳米粒[13]和脂质体[14]。
1.1.1 pH响应性细胞穿膜肽抗肿瘤药物分子很难通过细胞膜脂质双分子层进入到细胞内,CPPs能克服此缺点,携带各种治疗物质直接进入到细胞内而不滞留于溶酶体中[15]。但是,由于CPPs缺乏肿瘤特异性使其应用受到了限制,人们试图寻找到某些适宜的靶向策略,即在CPPs到达肿瘤组织之前设法屏蔽其结构域,当CPPs到达肿瘤组织后完全去屏蔽,从而规避非特异性摄取,以提高CPPs在肿瘤治疗方面的应用。
Transportan是由神经甘丙肽的12个功能性氨基酸和黄蜂毒素通过赖氨酸连接而成的细胞穿膜肽,它通过能量非依赖通路穿过细胞膜,能激活Na+、K+-ATPase,导致溶酶体裂解,增加了药物的生物利用度[16]。但Transportan的选择性差,Soomets等[17]设计合成了一系列Transportan的类似物 (TP7~TP15)。其中,TP10具有显著的膜转位能力,它是由21个氨基酸残基组成的细胞穿膜肽,能将多种物质运送至细胞内,如寡核苷酸、核酸肽、蛋白质及其他多肽类物质[18]。
本课题组前期研究中,对TP10进行了一系列的修饰改造,结果发现TP10-5 (TK) 是TP10类似物中最有前景的一个[19]。因为肿瘤细胞表面所带的负电荷多于正常细胞,所以TP10和TK通过静电引力会优先与肿瘤细胞结合,随之进入细胞内。但是相比之下,仍然有大量多肽分子进入正常细胞产生毒性作用。在整个渗透进程中,多肽与细胞膜之间的静电吸引作用最为关键,因此削弱两者之间的静电引力就会降低多肽的细胞内摄作用,从而降低其细胞毒性。组氨酸的pKa ≈ 6.5,含组氨酸的多肽在pH ≤6.5时 会发生质子化而带正电荷,而在pH 7.4时大部分不带电荷。为了克服TK特异性低、毒性大的缺点,以TK[AGYLLGKINLKKLAKL(Aib)KKIL-NH2]为模板,将序列中的所有赖氨酸替换为组氨酸,合成了一种新型的具有pH选择性且低毒性的细胞穿膜肽TH [AGYLLGHINLHHLAHL(Aib)HHIL-NH2][19]。研究发现,与母肽TK相比,在pH 7.4条件下,TH细胞毒性及穿膜活性明显降低; 当pH 6.0时,TH的细胞毒性、穿膜活性与pH 7.4时相比显著增强。然而,母肽TK的活性在不同pH条件下并没有明显差别。这些结果均证明,TH在正常生理条件下不能被激活,但在肿瘤酸性环境中能够被激活。这种酸激活细胞穿膜肽能选择性地携带小分子药物、纳米颗粒、胶束、聚合物、寡核苷酸、蛋白质或荧光标记物分子进入肿瘤细胞,以满足各种应用需要。
1.1.2 pH响应性细胞穿膜肽修饰的脂质体近年 来,纳米药物已经成为治疗恶性疾病的研究热点[20]。实体瘤的渗透和滞留效应(enhanced permeability andretention effect,EPR effect),使得脂质体能有效地累积于肿瘤组织,降低游离药物的毒性,从而引起了人们的广泛关注[21]。人们常采用可裂解的聚乙二醇(polyethylene glycol,PEG) 对CPPs进行修饰,制成纳米载体,以降低传统CPPs的非特异性渗透。由于肿瘤微环境呈弱酸性,增强CPPs肿瘤特异性的有效手段是对其进行修饰改造,使之具有pH响应性[22]。
由TP10衍生而来的TH具有非常显著的pH敏感性,并且TH与喜树碱 (camptothecine,CPT) 的共轭物TH-CPT能优先进入酸性环境中的细胞[19]。基于以上研究,Zhang等[23]将TH引入到脂质体中,设计合成了一种pH响应性细胞穿膜肽修饰的脂质体TH- Lip。由于TH具有pH 敏感性,在血液循环及正常组织中,TH的穿膜活性被掩蔽; 当TH-Lip到达肿瘤组织,TH序列中的组氨酸质子化,使得TH-Lip表面电荷由负转为正,TH的穿膜活性被激活,使肿瘤细胞对TH-Lip的摄取增加。体外研究发现,包载紫杉醇 (paclitaxel,PTX) 的脂质体PTX-TH-Lip能有效地抑制肿瘤细胞生长,诱导细胞凋亡,且具有pH依赖性。体内研究表明,TH-Lip保留了脂质体的长循环特性,使其到达肿瘤组织后尽可能多地被肿瘤细胞摄取,从而避免了其他组织 (如肝脏、脾脏和肾脏等) 对TH-Lip的非特异性摄取。
TH-Lip为研发pH响应性细胞穿膜肽修饰的药物传递系统提供了一个全新的视角,绕开正常组织或器官,直接到达肿瘤组织发挥抗肿瘤作用。
虽然TH-Lip表现出非常显著的pH敏感性,却 不能主动靶向至特定的肿瘤位点。靶向配体肽c (RGDfK) 是整合素ανβ3的有效配体[24, 25],由于整合素ανβ3高表达于B16F10细胞、成胶质细胞瘤及肺癌细胞表面,因此Shi等[26]将RGDfK通过酯键连接到酸激活细胞穿膜肽TH的C末端,合成了新的肽链TR [c(RGDfK)-AGYLLGHINLHHLAHL(Aib)HHIL-NH2],使TR不仅能够特异性识别肿瘤细胞表面过表达的整合素ανβ3,而且具有pH响应性细胞穿膜活性。将TR修饰到脂质体表面,得到一种新型的pH 响应性脂质体TR-Lip。体外研究结果表明,TR-Lip保持了有效的pH响应性,并且呈现出与整合素ανβ3很强的亲和力。与TH-Lip相比,TR-Lip的优势在于它能主动靶向整合素ανβ3过表达的细胞。在pH 6.5条件下,将PTX包载于脂质体中形成的PTX-TR-Lip抑制B16F10细胞活性比PTX-TH-Lip更强。该课题组以注射B16F10细胞的荷瘤小鼠为模型,研究了TR-Lip生物分布及PTX-TR-Lip体内抗肿瘤活性。结果发现,TR-Lip能大量聚积于肿瘤组织; 与对照组相比,PTX-TR-Lip能显著抑制肿瘤组织的生长,其肿瘤抑制率也高于PTX-TH-Lip组。更有趣的是,PTX-TR-Lip组的荷瘤小鼠存活率最高,这可能与PTX-TR-Lip高效地抗肿瘤活性有关。
总之,由于TR-Lip具有pH响应性,又能主动靶向至特定的肿瘤位点,进而可以大幅度地降低全身性毒性。然而TR-Lip也存在不足之处,虽然它的抗肿瘤活性得到了提高,但pH敏感性与TH-Lip相比略有降低。如果能克服此缺点,将其研发成为疏水性抗肿瘤药物的长循环载体将具有明显的优势。此外,Jiang等[27]用pH响应性细胞穿膜肽R6H4 (RRRRRR HHHH-NH2) 和透明质酸 (hyaluronic acid,HA) 共修饰得到一种双功能靶向脂质体HA-R6H4-L,也表现出很好的pH响应性肿瘤靶向功能。
1.2 pH响应性多肽自组装药物释放系统自组装多肽及其衍生物由于其很好的生物相容性、化学多样性及生物识别能力,受到了极大的关注。近年来,利用pH、温度、光照、酶和化学物质等外部条件刺激来调节多肽及其衍生物的自组装,使其广泛运用于各个方面,如组织工程、药物递送、伤口愈合及抑制剂的筛选等。在这些外部条件中,pH的应用最为广泛,特别是在药物控制释放方面。因此,将pH响应性智能药物载体用于抗肿瘤药物的靶向递送具有潜在可能性。
Liang等[28]基于多肽自组装系统,设计出一种pH敏感型两亲性多肽分子 (VVVVVVKKGRGDS) 作为抗肿瘤药物的载体。该多肽分子亲水端头部为KKGRGDS序列,其中两个赖氨酸残基能提供pH响应能力,并入RGD序列赋予两亲性多肽分子肿瘤靶向功能; 疏水端尾部为VVVVVV序列,这6个缬氨酸残基具有疏水性侧链,能提供疏水性相互作用以促进两亲性多肽分子的聚集和自组装。在中性或碱性介质中,这种两亲性多肽分子通过氢键及疏水相互作用自组装成球形胶束,若改变介质的pH使其变为酸性环境,两个赖氨酸残基离子化,静电排斥作用会阻止两亲性多肽分子自组装,导致胶束解离。将阿霉素 (doxorubicin,DOX) 包封于两亲性多肽分子形成的自组装胶束中,研究了pH的改变对药物释放的影响。结果发现,在中性介质中 (pH 7.0) DOX的释放持久,而在酸性介质中 (pH 5.0) DOX释放迅速。当这种包封了DOX的自组装胶束与HeLa细胞及COS7细胞共孵育时,由于HeLa细胞表面有过表达的RGD受体(如ανβ3,ανβ5)[29]使该胶束能有效利用RGD序列的肿瘤靶向功能,绕开COS7细胞,将DOX靶向输送至HeLa细胞,从而达到特异性杀死肿瘤细胞的目的。值得注意的是,这种两亲性多肽分子表现出的细胞毒性很低。
因此,将这种pH 响应性自组装药物释放系统作为抗肿瘤药物的载体,不仅靶向性好、安全性高,而且能够实现控制释放,具有很好的临床应用前景。
1.3 pH依赖性电荷反转药物传递系统近年来,pH依赖性电荷反转药物传递系统在控制释放及靶向传递药物方面展现了极大的优越性。这种pH依赖性电荷反转药物传递系统一旦受到外部pH的刺激,自身所带的负电荷会转化为正电荷,从而发挥其相应作用。值得注意的是,纳米粒表面所带的电荷在细胞内化及血液稳定性中扮演着重要角色。这种电荷反转纳米粒在中性条件下 (如在血液中) 能够保持最初所带的负电荷,从而抑制其与血清蛋白及正常组织的非特异性结合; 一旦到达肿瘤组织或核内体就会迅速反转为正电荷形式,促进肿瘤组织对电荷反转纳米粒的摄取,实现控制释放。
Han等[30]运用pH依赖性电荷反转策略,设计合成了一种新型的pH敏感性电荷反转聚合多肽纳米粒PPDTS[PLLeu-PLL(DMA)-Tat(SA)]。这种纳米粒能将抗肿瘤药物靶向输送至肿瘤组织,由于肿瘤组织具有微酸性细胞外环境 (pH ≈ 6.5),并且肿瘤细胞中的核内体也呈弱酸性 (pH ≈ 5.0),因此该纳米粒通过对肿瘤组织微酸性环境的逐级响应,提高了肿瘤细胞对抗肿瘤药物的细胞摄取。这种pH敏感性电荷反转聚合多肽纳米粒的基本结构为聚L-赖氨酸-聚-L-亮氨酸二嵌段共聚物 (PLLeu-PLL),将所有赖氨酸上的-NH2用2,3-二甲基马来酸酐酰胺化后形成β-羧酰胺,使得该聚合多肽自组装成带负电荷的纳米粒。通过链接反应将聚合多肽与细胞核靶向肽Tat共价连接在一起,然后用琥珀酰氯将Tat上的两个赖氨酸和一个谷氨酸残基酰胺化,掩蔽了其所带的正电荷及细胞穿膜功能,这样就抑制了Tat的非特异性细胞摄取。这种pH敏感性电荷反转聚合多肽纳米粒的响应机制 为: 当PPDTS到达微酸性的肿瘤组织,β-羧酰胺就 会水解,使得纳米粒由负电荷转化为正电荷,然后迅速被肿瘤细胞内化。当纳米粒被内化进入到更酸性的核内体中时,Tat琥珀酰胺进一步水解,使得Tat靶向细胞核的功能被激活,导致纳米粒更多地进入细胞核。该课题组将抗肿瘤药物DOX包封于纳米粒中,形成PPDTS/DOX,当该微粒到达细胞核后,DOX就会被释放,累积于细胞核,发挥抗肿瘤作用。
这种pH依赖性电荷反转药物传递系统的优点 是: 有助于同时实现肿瘤靶向摄取和抗肿瘤药物的细胞核递送。为抗肿瘤药物的靶向递送研究提供了 新思路。
1.4 pH敏感性寡肽介导的药物递送系统 1.4.1 pH响应性寡肽自组装纳米粒肿瘤组织微环境最显著的标志之一就是失调的pH值。利用这一特点设计出一种具有特异性及敏感性的成像探针靶向作用于肿瘤微环境。大多数pH敏感性纳米粒都是由长链聚合而成的,对于pH的刺激响应慢。智能pH响应性纳米粒,最大的优势在于对pH的变化能快速应答。如果纳米粒的反应时间过长,就会重新进入血液循环,导致其靶向肿瘤的效率降低[31]。Zhao等[32]设计了一种基于寡肽自组装的仿生纳米结构 —— pH敏感肽KS5-DEAP2分别与荧光染料A488、荧光猝灭剂BHQ-5共价连接后自组装形成的杂合肽纳米粒,只要微环境pH发生轻微改变 (由7.4变为6.8),这种纳米粒就能快速地从自组装期 (荧光猝灭) 切换至解离期 (有荧光)。该课题组利用肿瘤异种移植小鼠模型,通过瘤内注射的方式,研究了寡肽自组装纳米粒的体内肿瘤成像。结果显示,注射1.5 h内,随着时间的推移,瘤内的荧光逐渐增强; 1.5 h后,肿瘤内的荧光强度逐渐降低。说明一旦该探针遇到酸性的肿瘤微环境就会迅速并完全解离,从而产生更强的荧光信号。有趣的是,与不易解离的多肽组装体相比,这种pH响应性寡肽自组装纳米粒在肿瘤内的荧光信号强度消退速度更快。这就意味着,自组装纳米粒的解离组分一旦被代谢为小分子物质,就会通过自由扩散从机体内清除。此外,研究发现荧光染料主要定位于细胞膜水平。
由于这种pH响应性自组装寡肽纳米粒对肿瘤酸性微环境的灵敏度高,且能及时从机体内清除,若将其作为诊断肿瘤的荧光探针应用于临床,具有一定的准确性和安全性。
1.4.2 pH敏感性寡肽与细胞穿膜肽的重组体MAP(KLALKLALKALKAALKLA) 是一种两亲性CPPs,能通过胞吞作用携带多种生物活性分子进入细胞内,但是作为药物载体又缺乏特异性。组氨酸-谷氨酸 (histidine-glutamic acid,HE) 共聚物是一种pH高 度敏感性序列,为了阻止MAP非特异性摄取,Zaro 等[33]运用生物技术手段将寡肽HE与细胞穿膜肽MAP融合在一起,得到一种重组体HE-MAP,并被谷胱甘肽-S-转移酶 (glutathione-S-transferase,GST) 表达为融合蛋白GST-HE-MAP。在该研究中,GST一方面作为标记物用于蛋白的纯化,另一方面作为货物蛋白用于研究重组体HE-MAP的物质传递功能是否具有pH依赖性。结果显示,在pH ≤ 6.8时,GST- HE-MAP能与HeLa细胞高度结合并被细胞内化; 当pH > 7时,GST-HE-MAP与HeLa细胞的结合及内化明显降低,说明HE赋予了该融合蛋白高度的pH敏感性。这主要是由于组氨酸 (pKa ≈ 6.5) 在pH 7.4时不带电荷,而带负电荷的谷氨酸 (pK a ≈ 4) 与带正电荷的赖氨酸 (pKa ≈ 10) 或精氨酸 (pKa ≈ 12) 通过静电相互作用可以屏蔽MAP上的正电荷。一旦重组体HE-MAP暴露于微酸性环境,组氨酸发生质子化而带正电荷,导致谷氨酸残基与MAP上的阳离子残基之间的静电相互作用被解除,从而使MAP的细胞穿膜活性被激活。
基于上述研究,Fei等[34]又将寡肽HE重复序列(HE)10与MAP融合,探究了融合蛋白GST-(HE)10- MAP在荷瘤小鼠体内的分布情况。结果证实,在正常生理条件下 (HE)10能够掩蔽MAP的穿膜活性,导致GST-(HE)10-MAP选择性地分布在微酸性的肿瘤位点。
(HE)n重复序列与CPPs融合得到的重组体 (HE)n- CPPs,若改变 (HE)n重复序列的长度,是否能够调节CPPs所带的正电荷数目,从而使得CPPs的穿膜活性发生不同程度的改变。基于这个假设,Sun等[35]将寡肽序列 (HE)n (n = 8,10,12) 分别与阳离子细胞穿膜肽YG(RG)6、YGR6G6连接,形成六种结构不同的重组体 [(HE)8-YG(RG)6、(HE)10-YG(RG)6、(HE)12-YG(RG)6、(HE)8-YGR6G6、(HE)10-YGR6G6和 (HE)12-YGR6G6],并考察了这6种重组体与HeLa细胞的表面结合及细胞摄取是否具有pH敏感性。结果显示,(HE)10-YGR6G6的pH敏感性最高。通过实验数据对比发现,重组体的pH敏感性与它们的二级结构及 (HE)n重复序列的长度有关; 也与CPPs 中精氨酸的排列顺序有关。
根据现有的文献报道,可以推测若将这种pH敏感性重组体 (HE)n-CPPs作为传统抗肿瘤药物的载体,不仅能克服CPPs选择性差、正电荷多等缺点,又能提高传统抗肿瘤药物的水溶性、组织渗透能力及在肿瘤组织的分布。此外,也可以将荧光探针与这种pH敏感性重组体 (HE)n-CPPs连接,应用于肿瘤诊断。因此,pH敏感性寡肽与细胞穿膜肽的重组体在抗肿瘤药物靶向递送,特别是在大分子疗法方面具有一定的应用前景。
1.4.3 pH敏感性寡肽与细胞穿膜肽共修饰聚合物胶束为了抑制机体对抗肿瘤药物的非特异性摄取,同时提高聚乙二醇-聚乳酸 (poly(ethylene glycol)- poly(D,L-lactide),PEG-PLA) 聚合物胶束的物理稳定性以及肿瘤靶向性,Quahab等[36]用pH敏感性寡肽 (HE)5与细胞穿膜肽 (RG)5对PEG-PLA聚合物胶束进行共修饰,将 (HE)5、(RG)5分别连接到PEG-PLA的聚乙二醇末端,使得组装后多肽分子位于胶束表面 (PHPO)。同时,将抗肿瘤药多烯紫杉醇 (docetaxel,DTX) 包封于聚合物胶束PHPO中,制成载药聚合物胶束DTX-PHPO。研究发现,DTX-PHPO的体外释放及细胞摄取具有明显的pH依赖性。这主要归功于寡肽 (HE)5的pH敏感性[33, 34]。在pH 7.4时,胶束表面的 (HE)5通过静电相互作用屏蔽了 (RG)5的穿膜活性; 一旦该胶束进入肿瘤酸性微环境,(RG)5发生去屏蔽,其穿膜活性被激活,介导胶束进入肿瘤细胞,释放出药物分子,进而杀伤肿瘤细胞。
这种pH敏感性寡肽与细胞穿膜肽共修饰聚合 物胶束明显改善了DTX水溶性差的缺点。与大多数纳米药物载体相似,该聚合物胶束也可以被动靶向至肿瘤部位。又因其具有pH响应性,当到达肿瘤组织后,能携带更多的难溶性药物大分子进入肿瘤细胞。但是,若想使这类载体有更好的发展前景,pH敏感性寡肽和细胞穿膜肽的选择至关重要,因为它们之间的静电相互作用会直接影响到这类聚合物胶束能否进入到正常组织和器官而引起系统性毒性作用。
1.5 pH敏感型载体材料与细胞穿膜肽共修饰纳米粒大多数靶向作用于肿瘤组织的pH敏感性多肽类药物递送系统,主要通过对肽链的修饰改造,使其在微酸性肿瘤细胞外环境中具有pH响应能力。而将pH敏感型的载体材料与细胞穿膜肽结合,应用于肿瘤靶向型pH敏感性多肽类药物递送系统的文献报道并不多见。
1.5.1 细胞穿膜肽与pH敏感型PEG共修饰脂质体为了延长脂质体在体内的循环时间,改善其生物相容性,常见的方法是用PEG对脂质体进行修饰[37]。但是,PEG化后的脂质体,其亲水性表层会阻碍脂质体与细胞之间的相互作用,导致脂质体不能及时与细胞结合并内化,大大降低了药物递送效率。Zhang等[38]巧妙地用pH敏感型PEG (PEG5K-Hz-PE) 和细胞穿膜肽R8 (RRRRRRRR-NH2) 对脂质进行共修饰得到一种既有长循环特性,又有pH响应性的脂质体Cl-Lip。在血液循环中该pH敏感型PEG保持稳定,可以屏蔽R8的穿膜活性。当脂质体通过EPR效应靶向至肿瘤部位后,在肿瘤组织酸性微环境的诱导下,连接PEG的化学键水解断裂,使得该pH敏感型PEG断裂脱离脂质体表面,R8去屏蔽化,介导脂质体进入到肿瘤细胞内。
该pH敏感型PEG与细胞穿膜肽共修饰脂质体,为肿瘤靶向型pH敏感性多肽类药物递送系统的设计提供了一个很好的思路。可以进一步将各种类型的细胞穿膜肽 (如酸激活穿膜肽、具有主动靶向功能的细胞穿膜肽、裂解肽与细胞穿膜肽的重组体) 运用于此类共修饰脂质体,再将传统抗肿瘤药物包封于其中,发挥多重、灵敏、高效的肿瘤靶向及抗肿瘤作用。
1.5.2 细胞穿膜肽修饰的pH敏感性胶束聚合物胶束作为靶向药物递送载体,因其在体内稳定性高、生物相容性好和载药量大等优点,受到了广泛关注[39]。Sethuraman等[40]研究发现聚合磺胺甲氧嘧啶[poly (methacryloyl sulfadimethoxine),PSD],在pH 7.4时带负电荷,而当pH低于7.0时带正电荷,因此,在正常生理条件下PSD能有效地屏蔽CPPs所带的正电荷。Tat (YGRKKRRQRRR-NH2) 是经典的细胞穿膜肽,具有极强的细胞穿透力且能直接作用于细胞核。基于以上研究,Cheng等[41]利用pH敏感性的硬脂酰磺胺甲氧嘧啶 (stearyl sulfadiazine,SA-SD)、细胞穿膜肽Tat和mPEG2000-DOPE修饰的聚乙二醇化磷脂,制备得到包载DOX的聚合物胶束。由于硬脂酰磺胺甲氧嘧啶具有pH敏感性,在pH 7.4条件下,带负电荷的SA-SD通过静电相互作用将Tat隐蔽在聚合物胶束内,使其穿膜活性受到抑制; 当pH < 7.0时,SA-SD所带电荷由负转为正,静电相互作用被解除,使得Tat从胶束内核解离,暴露于胶束表面,介导载药胶束进入肿瘤细胞,从而选择性地杀伤肿瘤细胞 (图 1)。
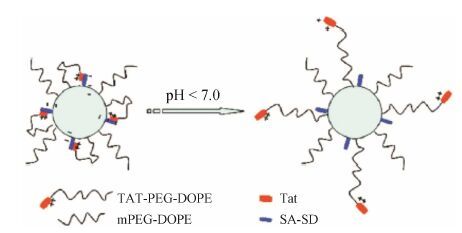
|
Figure 1 Schematic model of the proposed drug delivery system[41] |
这种pH敏感性聚合物胶束的最大优点是,充分利用了载体材料的pH敏感特型与细胞穿膜肽的穿膜活性。特别是在正常生理条件下,CPPs被隐藏在聚合物胶束内部,只有PEG链暴露在胶束表面,使得该药物载体具有长循环的特性。而当其到达肿瘤部位后,在肿瘤酸性微环境的诱导下,聚合物胶束发生去屏蔽,使得CPPs的穿膜活性被激活,进而将所载抗肿瘤药物靶向递送至肿瘤细胞内。若能将特异性识别肿瘤细胞的单克隆抗体或配体与CPPs连接,进一步制成具有主动靶向功能的pH敏感性聚合物胶束,由于实体瘤的EPR效应,使得该pH敏感性聚合物胶束不仅能够被动靶向累积于肿瘤组织,而且能够主动靶向并介导抗肿瘤药物进入肿瘤细胞,可能会大大降低系统性毒性。
2 展望肿瘤靶向型pH敏感性多肽类药物递送系统的 优点是: 正常生理条件下掩蔽了多肽分子所带的正电荷,减弱了与细胞膜的结合能力,从而有效地降低了药物对正常细胞的毒性。然而,当到达肿瘤组织 后,在酸性微环境的刺激下其活性被激活,促使抗癌药物进入肿瘤细胞,发挥显著的抗肿瘤或肿瘤定位作用。
pH响应策略为抗肿瘤药物的靶向递送提供了新的思路和方法。但是,肿瘤靶向型pH敏感性多肽类药物递送系统仍然存在一些问题需要解决: 血液中的稳定性、对环境pH的灵敏度、靶向肿瘤效率以及在肿瘤部位的累积等。因此,在今后的研究中,需要对该药物递送系统进行一定的修饰改造,如肽链特定位点氨基的酰胺化、引入高度特异性肿瘤靶向配体、增强组氨酸在微酸性条件下的质子化能力或制成长循环纳米粒等。使其在正常生理条件下,最大程度减少对正常组织和器官的毒副作用。而当其随着血液循环到达肿瘤部位后,能快速响应,有效地释放出抗肿瘤药物或自身的抗肿瘤活性被激活,从而达到特异性治疗肿瘤的目的。随着科学技术的不断发展,相信这些问题会得到解决,使得肿瘤靶向型pH敏感性多肽类药物早日应用于临床。
| [1] | Chari RVJ. Targeted cancer therapy:conferring specificity to cytotoxic drugs[J]. Acc Chem Res, 2008, 41:98-107. |
| [2] | Böhme D, Beck-Sickinger AG. Drug delivery and release systems for targeted tumor therapy[J]. J Pept Sci, 2015, 21:186-200. |
| [3] | Ying M, Chen GY, Lu WY. Recent advances and strategies in tumor vasculature targeted nano-drug delivery systems[J]. Curr Pharm Design, 2015, 21:3066-3075. |
| [4] | Li Y, Gao GH, Lee DS. Stimulus-sensitive polymeric nanoparticles and their applications as drug and gene carriers[J]. Adv Healthc Mater, 2013, 2:388-417. |
| [5] | Gerweck LE, Seetharaman K. Cellular pH gradient in tumor versus normal tissue:potential exploitation for the treatment of cancer[J]. Cancer Res, 1996, 56:1194-1198. |
| [6] | Webb BA, Chimenti M, Jacobson MP, et al. Dysregulated pH:a perfect storm for cancer progression[J]. Nat Rev Cancer, 2011, 11:671-677. |
| [7] | Wang RN, Ding Y, Zhou JP. Advances in research of photosensitizer anti-tumor target delivery systems based on photodynamic therapy[J]. Chin J New Drugs (中国新药杂志), 2014, 23:1897-1903. |
| [8] | Peng CM, Shen J, Lu WY. Environment-responsive drug delivery systems for targeted cancer therapy[J]. J Chin Pharm Sci, 2015, 24:5-14. |
| [9] | Huang YZ, Jiang YF, Wang HY, et al. Curb challenges of the "Trojan Horse" approach:smart strategies in achieving effective yet safe cell-penetrating peptide-based drug delivery[J]. Adv Drug Deliv Rev, 2013, 65:1299-1315. |
| [10] | Fonseca SB, Pereira MP, Kelley SO. Recent advances in the use of cell-penetrating peptides for medical and biological applications[J]. Adv Drug Deliv Rev, 2009, 61:953-964. |
| [11] | Shi WJ, Bi LW, Xu RA. Tumor-targeting carrier equipped with cell-penetrating peptides[J]. Chin J Cancer Biother (中国肿瘤生物治疗杂志), 2010, 17:104-108. |
| [12] | Li K, Lv XX, Hua F, et al. Targeting acute myeloid leukemia with a proapoptotic peptide conjugated to a toll-like receptor 2-mediated cell-penetrating peptide[J]. Int J Cancer, 2014, 134:692-702. |
| [13] | Li Y, Wen G, Wang D, et al. A complementary strategy for enhancement of nanoparticle intracellular uptake[J]. Pharm Res, 2014, 31:2054-2064. |
| [14] | Liu YR, Ji M, Wong MK, et al. Enhanced therapeutic efficacy of iRGD-conjugated crosslinked multilayer liposomes for drug delivery[J]. Biomed Res Int, 2013, 2013:378380. |
| [15] | Vivès E, Schmidt J, Pèlegrin A. Cell-penetrating and celltargeting peptides in drug delivery[J]. Biochim Biophys Acta, 2008, 1786:126-138. |
| [16] | Pooga M, Hällbrink M, Zorko M, et al. Cell penetration by transportan[J]. FASEB J, 1998, 12:67-77. |
| [17] | Soomets U, Lindgren M, Gallet X, et al. Deletion analogues of transportan[J]. Biochim Biophys Acta, 2000, 1467:165-176. |
| [18] | El-Andaloussi S, Järver P, Johansson HJ, et al. Cargodependent cytotoxicity and delivery efficacy of cell-penetrating peptides:a comparative study[J]. Biochem J, 2007, 407:285-292. |
| [19] | Zhang W, Song JJ, Zhang BZ, et al. Design of acid-activated cell penetrating peptide for delivery of active molecules into cancer cells[J]. Bioconjug Chem, 2011, 22:1410-1415. |
| [20] | Wang M, Thanou M. Targeting nanoparticles to cancer[J]. Pharmacol Res, 2010, 62:90-99. |
| [21] | Elbayoumi TA, Torchilin VP. Tumor-specific anti-nucleosome antibody improves therapeutic efficacy of doxorubicin-loaded long-circulating liposomes against primary and metastatic tumor in mice[J]. Mol Pharm, 2009, 6:246-254. |
| [22] | Makovitzki A, Fink A, Shai Y. Suppression of human solid tumor growth in mice by intratumor and systemic inoculation of histidine-rich and pH-dependent host defense-like lytic peptides[J]. Cancer Res, 2009, 69:3458-3463. |
| [23] | Zhang QY, Tang J, Fu L, et al. A pH-responsive α-helical cell penetrating peptide-mediated liposomal delivery system[J]. Biomaterials, 2013, 34:7980-7993. |
| [24] | Song WT, Tang ZH, Zhang DW, et al. Anti-tumor efficacy of c(RGDfK)-decorated polypeptide-based micelles co-loaded with docetaxel and cisplatin[J]. Biomaterials, 2014, 35:3005-3014. |
| [25] | Xu J, Liu C, Xu YN, et al. Mechanism of cellular uptake and transport mediated by integrin receptor targeting trimethyl chitosan nanoparticles[J]. Acta Pharm Sin (药学学报), 2015, 50:893-898. |
| [26] | Shi KR, Li JP, Gao ZL, et al. A pH-responsive cell-penetrating peptide-modified liposomes with active recognizing of integrin αvβ3 for the treatment of melanoma[J]. J Control Release, 2015, 217:138-150. |
| [27] | Jiang TY, Zhang ZH, Zhang YL, et al. Dual-functional liposomes based on pH-responsive cell-penetrating peptide and hyaluronic acid for tumor-targeted anticancer drug delivery[J]. Biomaterials, 2012, 33:9246-9258. |
| [28] | Liang J, Wu WL, Xu XD, et al. pH Responsive micelle selfassembled from a new amphiphilic peptide as anti-tumor drug carrier[J]. Colloid Surface B, 2014, 114:398-403. |
| [29] | Giancotti FG, Ruoslahti E. Integrin signaling[J]. Science, 1999, 285:1028-1032. |
| [30] | Han SS, Li ZY, Zhu JY, et al. Dual-pH sensitive chargereversal polypeptide micelles for tumor-triggered targeting uptake and nuclear drug delivery[J]. Small, 2015, 11:2543-2554. |
| [31] | Gao WW, Chan JM, Farokhzad OC. pH-Responsive nanoparticles for drug delivery[J]. Mol Pharm, 2010, 7:1913-1920. |
| [32] | Zhao Y, Ji TJ, Wang H, et al. Self-assembled peptide nanoparticles as tumor microenvironment activatable probes for tumor targeting and imaging[J]. J Control Release, 2014, 177:11-19. |
| [33] | Zaro JL, Fei L, Shen WC. Recombinant peptide constructs for targeted cell penetrating peptide-mediated delivery[J]. J Control Release, 2012, 158:357-361. |
| [34] | Fei LK, Yap LP, Conti PS, et al. Tumor targeting of a cell penetrating peptide by fusing with a pH-sensitive histidineglutamate co-oligopeptide[J]. Biomaterials, 2014, 35:4082-4087. |
| [35] | Sun CM, Shen WC, Tu JS, et al. Interaction between cellpenetrating peptides and acid-sensitive anionic oligopeptides as a model for the design of targeted drug carriers[J]. Mol Pharm, 2014, 11:1583-1590. |
| [36] | Quahab A, Cheraga N, Onoja V, et al. Novel pH-sensitive charge-reversal cell penetrating peptide conjugated PEG-PLA micelles for docetaxel delivery:in vitro study[J]. Int J Pharm, 2014, 466:233-245. |
| [37] | Crawford J. Clinical uses of pegylated pharmaceuticals in oncology[J]. Cancer Treat Rev, 2002, 28:7-11. |
| [38] | Zhang L, Wang Y, Gao HL. The construction of cell-penetrating peptide R8 and pH sensitive cleavable polyethylene glycols co-modified liposomes[J]. Acta Pharm Sin (药学学报), 2015, 50:760-766. |
| [39] | Wang Y, Zhu DD, Zhou J, et al. Mesoscopic simulation studies on the formation mechanism of drug loaded polymeric micelles[J]. Colloid Surface B, 2015, 136:536-544. |
| [40] | Sethuraman VA, Bae YH. TAT peptide-based micelle system for potential active targeting of anti-cancer agents to acidic solid tumors[J]. J Control Release, 2007, 118:216-224. |
| [41] | Cheng W, Jin MJ, Gao ZG, et al. Preparation and in vitro evaluation of pH-sensitive TAT peptide conjugated micelles[J]. Acta Pharm Sin (药学学报), 2011, 46:599-604. |
 2016, Vol. 51
2016, Vol. 51


