癌症已成为引起人类死亡的主要疾病,据估计到2050年癌症患者将会是现在的两倍[1]。然而,由于大部分上市抗肿瘤药物疏水性强、水溶性差、生物利用度低、体内循环时间短、快速清除以及全身毒副 作用等限制了其临床应用[2, 3]。基于胶束的纳米技术在医疗上的应用最早由瑞士苏黎世的Speiser提出,1976年他开发了固体化胶束,称作“nanoparts”[4],之后近40年里一直被用作药物递送载体。
聚合物药物结合物胶束 (polymer-drug conjugated micelles,PDCM) 作为一种有效的抗肿瘤药物载体,能够装载疏水性抗肿瘤药物并靶向递送至肿瘤部位,减少在其他部位蓄积,并保护药物在生物介质中不被灭活,从而提高治疗效果[5]。此外,聚合物药物结合物胶束制备过程相对简单,也可以用含有多种功能基团的聚合物来制备。例如,连接靶向基团叶酸[6]、抗体[7]和肽类[8]等或制备成环境敏感型聚合物药物结合物胶束。因此,聚合物药物结合物胶束一直是人们研究的热点。本文首先将对聚合物药物结合物胶束进行详细介绍,然后重点综述各种多功能化修饰的聚合物药物结合物胶束在抗肿瘤药物递送方面的应用。
1 PDCM概况 1.1 PDCM的由来及发展1975年Ringsdorf首先提出了“聚合物前药”的概念[9],将聚合物与药物通过共价键化学连接形成聚合物前药,进入体内后释放出药物发挥治疗作用。第一个聚合物药物结合物在1994年进入了临床试验阶段,它是由聚N-(2-羟丙基) 甲基丙烯酰胺 (PHPMA)-多柔比星 (DOX) 组成的聚合物药物结合物 (PK1)[10],这是聚合物药物结合物发展的一个转折点。随后,对聚合物药物结合物进行了大量的研究,许多聚合物蛋白及聚合物药物结合物进入研究阶段及临床应用阶段[11]。表 1对进 入临床试验阶段的聚合物药物结合物进行了总结。
|
|
Table 1 Polymer-drug conjugates in clinical development. PEG: Polyethylene glycol; SN38: 7-Ethyl-10-hydroxy-campothecin; DTX: Docetaxel; PHPMA: Poly-N-(2-hydroxypropyl) methacrylamide; DOX: Doxorubicin; HPMA: N-(2-hydroxypropyl) methacrylamide; PTX: Paclitaxel; CPT: Camptothecin; DACH: Diaminocyclohexane |
聚合物药物结合物胶束是由聚合物与药物形成的两亲性聚合物药物结合物,并在临界聚集浓度 (critical aggregation concentration,CAC) 以上时自组装形成的纳米级给药系统,常见的类型包括药物与聚合物组成的A-B型和A-C-B型,A代表亲水性聚合物,B代表疏水性药物,C代表疏水性聚合物[3]。当疏水性药物本身含有的活性基团可以直接连接在亲水性聚合物上,并且两者的分子量比例适当,连接后形成的两亲性分子能自组装形成A-B型; 然而,当疏水性药物含有的活性基团无法直接连接在亲水性聚合物上或两者分子量相差较大时,需要将药物连接到疏水性聚合物上作为疏水嵌段,再连接亲水性聚合物形成A-C-B型,这两种类型的聚合物药物结合物胶束的形成过程见图 1。此外,也可以用两亲性的嵌段聚合物 (如普朗尼克类) 作为载体与药物形成聚合物药物结合物胶束。
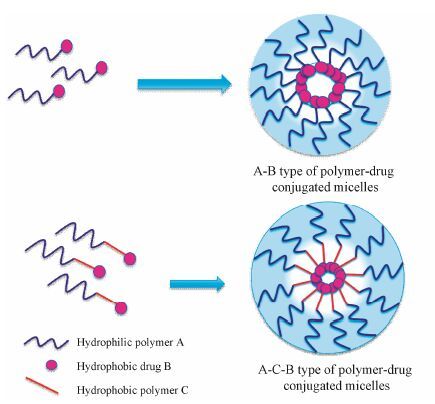
|
Figure 1 Two types of formation process of polymer-drug conjugated micelles |
聚合物药物结合物胶束一般由疏水性内核和亲水性外壳组成,其中疏水核心可以作为疏水性药物的装载空间,亲水性的外壳由亲水材料组成,作为胶束核心和外部环境之间的保护分界面,外壳不但能通过空间结构稳定胶束体系,而且可以控制所装载的药物释放[12]。为了连接药物,聚合物必须具有功能基团如羟基、氨基、羰基或羧基等,同样,药物中也应含有相应的活性基团以实现与聚合物的连接。连接聚合物和药物的连接物或连接键的性质也非常重要,可以利用这些连接物或连接键制备环境敏感型聚合物药物结合物胶束来控制药物在靶部位的释放[13]。
1.3 PDCM常用的载体材料常用的合成亲水材料有聚乙二醇 (PEG)、聚乙烯吡咯烷酮 (PVP)、聚丙 烯酸 (PAA) 和聚谷氨酸 (PGA),聚谷氨酸修饰后含有两个羧基的聚合物 (PGG) 等,天然的亲水材料有透明质酸 (HA)、硫酸软骨素 (CS)、肝素和白蛋白 等。常用的疏水性材料主要是聚酯类,包括聚乳酸 (PLA)、聚羟基乙酸 (PGA)、聚乳酸-羟基乙酸共聚物 (PLGA) 和聚己内酯 (PCL) 等,这些疏水材料均已通过美国FDA批准可以应用于临床[14]。
1.4 PDCM作为药物载体的优势在纳米药物递送系统中,聚合物药物结合物胶束由于具有潜在的多功能性,因此有其独特的优势,主要表现在: ① 能增加疏水性药物溶解度[15]; ② 物理化学性质稳定,具有较高的适应性和良好的抗稀释能力[12]; ③ 通过实体瘤的高通透性和滞留性(enhanced permeability and retention,EPR) 效应具有被动靶向作用,从而可以改善药物的生物分布而减小全身毒性[16]; ④ 与物理包封的胶束体系相比,聚合物药物结合物胶束可以同时物理包封和化学连接药物,从而提高载药量,增强治疗效果[17]; ⑤ 结构灵活,可以通过各种多功能化修饰实现药物的高效递送。
1.5 PDCM常见的制备方法制备聚合物药物结合物胶束首先是通过化学反应合成两亲性的聚合物药物结合物,这也是较关键的步骤; 然后再通过直接制备法或间接制备法形成胶束,这主要依赖于聚合物和所连接的药物性质[18]。聚合物与药物间通常经化学反应形成环境敏感的连接键,主要包括酯键、酰胺键、腙键和二硫键等,也可以用具有环境敏感性的连接物连接药物与聚合物,如聚丙烯酸、甲基丙烯酸类、聚胺类、聚氨基酸、壳聚糖、海藻酸钠、胱胺和半胱氨酸等,这些环境敏感化学键或连接物可以在体内控制药物在靶部位释放。聚合物药物结合物合 成后可通过1H核磁共振法 (1H NMR)、13 C核磁共 振法 (13C NMR)、质谱分析法 (MS) 和红外分光光 度法(IR) 等确证目标化合物是否已成功合成。直接形成胶束的方法包括聚合物药物结合物形成的两亲性分子在水性介质中直接溶解后形成胶束; 间接法依赖于与水互溶的有机溶剂的使用,这种有机溶剂可同时溶解聚合物和药物,并且能通过蒸发或透析除去[3]。
2 PDCM的物理化学性质 2.1 PDCM的粒径及其分布、zeta电位和形态粒径是影响纳米粒性质最重要的因素之一,一般认为纳米粒的粒径在10~200 nm内较为合理,合适的粒径范围能延长纳米粒在体内的循环时间。据报道,纳米粒粒径小于10 nm时迅速外渗或被肾清除; 大于200 nm时能够造成在肝、脾的聚集[19]。聚合物药物结合物形成的胶束粒径一般在10~100 nm之间,因此在体内可以有较长的滞留时间。粒径和zeta电位是与聚合物药物结合物胶束的物理稳定性和体内的代谢动力学相关的两个重要参数,评价粒径的一个重要参数是多分散系数 (polydispersity index,PDI),其数值在0~1之间,一般PDI通常在0.1~0.5之间,越小表示纳米粒越均匀,在0.1以下则非常均匀。在水溶液中zeta电位的绝对值在30 mV以上时比较稳定。纳米粒的形态对于体内的生物分布和细胞摄取至关重要,聚合物药物结合物形成的纳米粒一般是球形的,可以测定纳米粒形态的方法有多种,主要包括透射电子显微镜 (transmission electron microscopy,TEM)、扫描电子显微镜 (scanning electronic microscopy,SEM)、原子力学显微镜 (atomic force microscope,AFM) 和X射线小角散射 (small-angle X-ray scattering,SAXS) 等[14]。
2.2 PDCM的稳定性聚合物药物结合物胶束的稳定性包括物理稳定性 (胶束聚集或分解为单聚体) 和化学稳定性 (聚合物药物结合物的分解) 两个方面。当聚合物药物结合物的浓度在CAC以上时可以形成胶束。而血液中的血浆蛋白和脂蛋白可能会与聚合物药物结合物胶束相互作用[20],导致胶束提前降解或提前释放出药物。而且,在水性介质中,胶束与其单聚体之间存在着平衡,当胶束给药系统注射进入血液后,胶束浓度可能会被稀释到CAC以下,这就可能导致胶束分解为单聚体。聚合物药物结合物胶束分解为单聚体后,药物仍然连接在大分子聚合物载体上,仍然可以通过药物与聚合物之间刺激敏感的连接物或连接键来控制药物在靶部位的释放,这是聚合物药物结合物胶束的优势之一。为了保证聚合物药物结合物胶束的稳定性,必须减少胶束被网状内皮系统清除及控制胶束的粒径和表面特性来维持足够的血液浓度,具体包括: ① 胶束大于肾小球滤过阈值 (水溶性聚合物的分子质量大约为50 kDa); ② 胶束粒径应小于200 nm; ③ 亲水性聚合物链应具有生物相容性,减少被网状内皮系统的清除[12]。
3 PDCM的几种常见类型 3.1 单载药的PDCM临床应用的抗肿瘤药物大部分都是疏水性的、水溶性差和生物利用度较低,从而影响治疗效果,聚合物药物结合物胶束为疏水性抗肿瘤药物的递送提供了一种有效方法。通过共价键化学连接抗肿瘤药物与聚合物形成单载药的聚合物药物结合物胶束,这是聚合物药物结合物胶束较为常见的类型[21]。
Sarika等[22]制备了A-B型阿拉伯胶-姜黄素聚合物药物结合物胶束,阿拉伯胶是一种水溶性很好的多聚糖,能增加疏水性抗肿瘤化合物姜黄素的溶解性和稳定性。阿拉伯胶-姜黄素结合物能在水性介质中自组装形成球体纳米胶束,粒径为 (270 ± 5) nm,实验发现,这种A-B型的聚合物药物结合物胶束在HepG2细胞中比在MCF-7细胞中显示出更强的抗肿瘤活性,并且由于阿拉伯胶中半乳糖具有靶向作用,此结合物胶束在HepG2细胞中显示出更强的积聚与毒性作用。Cao等[23]合成了A-C-B型的聚乙二醇-聚乳酸-姜黄素 (PEG-PLA-Cur) 类磷脂聚合物药物结合物胶束。PEG作为亲水外壳,PLA为疏水性聚合物,它与抗肿瘤化合物Cur一起作为疏水内核,PLA与Cur之间通过pH敏感腙键连接,形成的胶束呈球形,表面带负电荷,载药量为4%,此结合物胶束在体内循环中显示出良好的稳定性,当到达肿瘤组织时,酸性微环境促使pH敏感腙键降解,快速释放出Cur,大大提高了药物递送效率。
3.2 双载药的PDCM化疗药物的联合应用可以产生协同效应,增强治疗效果,而且由于两种药物作用机制不同,可以减小剂量、降低毒性,聚合物药物结合物胶束可以实现两种抗肿瘤药物的共载[24]。常用的两药共载方式有两种: ① 选用一种合适的聚合物作为药物载体,这种载体可以同时通过共价键化学连接两种抗肿瘤药物; ② 选用一种合适的聚合物,先化学连接一种抗肿瘤药物形成聚合物药物结合物,然后物理包封另一种抗肿瘤药物形成两药共载的聚合物药物结合物胶束。
Camacho等[25]选用HA为载体材料,分别通过 共价键连接喜树碱 (CPT) 和多柔比星 (DOX),形成CPT-HA-DOX,递送这两种抗肿瘤药物,由于CPT和DOX潜在的协同抗肿瘤作用,在小鼠T41模型中两种药物仅需要较低剂量即能显著地减小肿瘤的体积,并且在正常器官中未见明显毒性。Chen等[26]制备了两药共载的普朗尼克类聚合物药物结合物混合胶束F127/P105-DOX-PTX,先将P105与DOX化学连接,再与F127形成混合胶束,然后物理包封PTX。结果显示,形成的纳米粒呈均匀的球形,粒径为22 nm,两药共载率为11.31%。F127/P105-DOX-PTX与单一药物剂型相比,显示出更高的细胞摄取率,更强的细胞生长抑制作用和促细胞凋亡作用。体内生物分布研究结果显示,F127/P105-DOX-PTX能显著增加药物在肿瘤组织中的积聚和药物在血液中的循环时间,并且发现F127/P105-DOX-PTX在心脏部位的积聚比游离药物少,说明F127/P105-DOX-PTX可以降低对心脏的毒性。
3.3 基因与药物共载的PDCM基因治疗 (gene therapy) 是指将外源正常基因导入靶细胞,以纠正或补偿因基因缺陷和异常引起的疾病,以达到治疗目的。也就是将外源基因通过基因转移技术将其插入患者的适当受体细胞中,使外源基因制造的产物能治疗某种疾病。肿瘤的发生通常是因为体内某个或某些基因的异常表达,基因治疗在恶性肿瘤的治疗中显示出良好的治疗效果,为肿瘤的治疗提供了一种新的思路。常用的治疗基因有质粒DNA (pDNA) 和小干扰RNA (siRNA) 等。聚合物药物结合物胶束可以作为一种有效的载体装载基因或共载基因与药物进行肿瘤治疗[27]。
Liu等[28]应用siRNA-磷脂与阳离子脂类和二硬脂酰磷脂酰乙醇胺 (DSPE)-聚乙二醇 (PEG2000) 围绕PLGA形成了siRNA-磷脂包覆的纳米粒 (siRNA- PCNPs),它可以递送siRNAs和疏水性抗肿瘤药物,静脉注射含DOX的siRNA-PCNPs (siPlk1-PCNPs/ ; DOX),显示出高效抑制肿瘤生长作用,结果表明,siRNA-PCNPs可以作为一种安全有效的基因和抗肿瘤药物的递送载体。
4 PDCM的多功能化修饰 如何将抗肿瘤药物高效靶向递送到实体肿瘤中仍然是肿瘤研究面临的重要问题。为了获得理想的药物代谢动力学,药物载体必须能阻止药物在非靶向组织中释放并且不与其相互作用,环境敏感型的药物载体可以有效达到这个目标,因为载体可以通过对周围环境条件或人体自身的信号作出响应,从而改变它们的物理化学性质来控制药物的释放速率和与细胞的相互作用[29, 30]。表 2列举了一些多功能化修饰的聚合物药物结合物[
|
|
Table 2 Overview of various multi-functional modification of polymer-drug conjugated micelles. HA: Hyaluronic acid; CP: Conjugated polypeptide; SS: Disulfide bond; CSO: Chitosan oligosaccharide; SA: Stearic acid; PEOz: Poly(2-ethyl-2-oxazoline); hyd: Hydrazone; MMP2: Matrix metalloproteinase 2; ppTAT: Penetrating peptide; CPP: Cell penetrating peptide; FA: Folate; P123: Pluronic P123; Apt: Aptamer; MTX: Methotrexate |
将靶向配体连接到纳米粒表面可以获得主动靶向的纳米药物递送系统,这些靶向配体包括抗体及其衍生物、转铁蛋白、各种肽类、小分子 (叶酸等)、适配体 (单链寡核苷酸等) 或一些特定糖类片段等,这些配体可以与特定的受体结合,而这些受体在靶部位是唯一的或高度表达的[38, 39],而且配体也可以克服体内的各种生理屏障。因此可以据此制备受体介导的主动靶向聚合物药物结合物胶束。配体不但可以使药物有效到达靶部位,而且能通过受体介导的内吞作用增强药物的细胞摄取[40]。
Li等[35]制备了叶酸主动靶向的普朗尼克P123聚合物药物结合物胶束FA-P123-PTX/PTX,同时物理包封和化学连接PTX,所形成的胶束呈球体,载药量高达 (18.08 ± 0.64) %。细胞摄取研究结果显示,叶酸能促进胶束内化进入叶酸受体阳性细胞。与已上市剂型紫杉醇 (Taxol) 相比,叶酸靶向的FA-P123-PTX/ PTX胶束在叶酸受体阳性肿瘤细胞中显示出更强的抗肿瘤活性及更高的安全性。这些结果说明,两种载药方式的FA-P123-PTX/PTX胶束在主动靶向递送抗肿瘤药物方面显示出较大的应用潜力。
4.2 pH敏感的PDCM研究发现,人体的病理部位 (如肿瘤组织、梗死或炎症部位) 的pH比正常组织要低,这是因为组织缺氧导致糖酵解增加和大量细胞死亡,核内体和细胞质中的pH通常也较低[30]。肿瘤部位细胞外的pH是微酸性 (pH 6.5~7.2),然而血液和正常组织中的pH值大约是7.4。核内体的pH在5.0~6.5,溶酶体的pH更低,大概在4.5~5.0之间。pH敏感的聚合物药物结合物胶束能靶向肿瘤部位或肿瘤细胞中的细胞器。可以用两种方式来制备pH敏感的聚合物药物结合物胶束: ① 使用具有酸碱性基团的pH敏感聚合物材料如羧酸类或有机胺类,它们在不同pH环境中具有可逆的质子化与非质子化作用,从而显示出pH敏感性; ② 药物与聚合物之间形成酸性敏感的化学键。常用的pH敏感材料有: 聚 (L-组氨酸) (PLH)、聚丙烯酸 (PAA) 和聚甲基丙烯酸 (PMAA) 等,药物与聚合物之间通常使用pH敏感的酰胺键、酯键和腙键等连接[41]。
Li等[33]制备了基于聚 (2-乙基-2-噁唑啉) (PEOz) - DOX (PEOz-hyd-DOX) 的结合物,将DOX通过pH敏感的腙键连接到PEOz上合成的PEOz-hyd-DOX可以自组装形成胶束,进一步物理包封DOX。结果显示,DOX在pH 5.0时比pH 7.4时释放更快,这种pH依赖的释放行为有助于DOX从酸性的核内体或溶酶体快速扩散进入细胞核内,与游离的DOX相比,这种pH敏感的胶束能持续增强抗肿瘤效果并且减少不良反应,是DOX的一种安全有效递送载体。
4.3 氧化还原敏感的PDCM很多肿瘤细胞中谷胱甘肽等还原性物质的浓度比正常细胞高至少4倍,细胞质内谷胱甘肽的浓度比细胞外环境和血液中高100~1 000倍,根据正常组织与肿瘤组织之间、细胞内外环境之间还原电位不同,可以制备氧化还原敏感的聚合物药物结合物胶束。亲水性的外壳和疏水性的内核之间通常用二硫化物来连接,形成的二硫键在正常生理条件下很稳定,但是在细胞质内高浓度的谷胱甘肽等还原条件下二硫键能通过氧化还原反应降解成游离的硫醇释放出药物[42]。
Lv等[31]制备了含有二硫键和酯键的递送PTX 的还原和pH双敏感聚合物药物结合物P(L-SS-PTX),体外细胞毒性研究显示,与不敏感的P(L-PTX) 胶束相比,还原和pH双敏感P(L-SS-PTX) 胶束在多种 肿瘤细胞中显示出更强的细胞毒性; 体内研究结果也表明,P(L-SS-PTX) 胶束与游离的PTX和不敏感P(L-PTX) 胶束相比,在荷瘤小鼠模型实验中显示出更好的抗肿瘤活性。这种双敏感的前药设计为抗肿 瘤药物递送提供了一种有效方法。
5 总结与展望近年来,聚合物药物结合物胶束作为一种有效的递送载体已经取得了很大进展,但仍然有很多问题没有解决。聚合物药物结合物胶束可以增加疏水性药物的溶解度、延长体内循环时间、增强药物治疗效果和减小全身毒性。然而,如何使聚合物药物结合物胶束通过各种生理屏障高效地递送到靶部位并在靶部位释放药物,如何确定聚合物药物结合物胶束在体内的药动学过程,载体材料如何从体内消除,如何保证聚合物药物结合物胶束在体内生理条件下的稳定性等问题仍然需要进一步研究与探索。随着药剂 学及各种相关学科的发展,各种新材料、新技术不断出现,聚合物药物结合物胶束作为一种理想的药物递送体系将在临床的应用更加广泛。
| [1] | Cabral H, Kataoka K. Progress of drug-loaded polymeric micelles into clinical studies[J]. J Control Release, 2014, 190:465-476. |
| [2] | Davis ME, Chen ZG, Shin DM. Nanoparticle therapeutics:an emerging treatment modality for cancer[J]. Nat Rev Drug Discov, 2008, 7:771-782. |
| [3] | Sosnik A, Raskin MM. Polymeric micelles in mucosal drug delivery:challenges towards clinical translation[J]. Biotechnol Adv, 2015, 33:1380-1392. |
| [4] | Eetezadi S, Ekdawi SN, Allen C. The challenges facing block copolymer micelles for cancer therapy:in vivo barriers and clinical translation[J]. Adv Drug Deliv Rev, 2015, 91:7-22. |
| [5] | Tran PH, Tran TD, Vo TV. Polymer conjugate-based nanomaterials for drug delivery[J]. J Nanosci Nanotechnol, 2014, 14:815-827. |
| [6] | Wu D, Zheng Y, Hu X, et al. Anti-tumor activity of folate targeted biodegradable polymer-paclitaxel conjugate micelles on EMT-6 breast cancer model[J]. Mater Sci Eng C Mater Biol Appl, 2015, 53:68-75. |
| [7] | Ahn J, Miura Y, Yamada N, et al. Antibody fragmentconjugated polymeric micelles incorporating platinum drugs for targeted therapy of pancreatic cancer[J]. Biomaterials, 2015, 39:23-30. |
| [8] | Liu F, Li M, Liu C, et al. Tumor-specific delivery and therapy by double-targeted DTX-CMCS-PEG-NGR conjugates[J]. Pharm Res, 2014, 31:475-488. |
| [9] | Ringsdorf H. Structure and properties of pharmacologically active polymers[J]. J Polym Sci Polym Symp, 1975, 51:135-153. |
| [10] | Vasey PA, Kaye SB, Morrison R, et al. Phase I clinical and pharmacokinetic study of PK1[N-(2-hydroxypropyl) methacrylamide copolymer doxorubicin]:first member of a new class of chemotherapeutic agents-drug-polymer conjugates[J]. Clin Cancer Res, 1999, 5:83-94. |
| [11] | Giang I, Boland EL, Poon GMK. Prodrug applications for targeted cancer therapy[J]. AAPS J, 2014, 16:899-913. |
| [12] | Sakai-Kato K, Nishiyama N, Kozaki M, et al. General considerations regarding the in vitro and in vivo properties of block copolymer micelle products and their evaluation[J]. J Control Release, 2015, 210:76-83. |
| [13] | Tu Y, Zhu L. Enhancing cancer targeting and anticancer activity by a stimulus-sensitive multifunctional polymer-drug conjugate[J]. J Control Release, 2015, 212:94-102. |
| [14] | Liu ZH, Wang YT, Zhang N. Micelle-like nanoassemblies based on polymer-drug conjugates as an emerging platform for drug delivery[J]. Exp Opin Drug Deliv, 2012, 9:805-822. |
| [15] | Su Y, Hu Y, Du Y, et al. Redox-responsive polymer-drug conjugates based on doxorubicin and chitosan oligosaccharideg-stearic acid for cancer therapy[J]. Mol Pharm, 2015, 12:1193-1202. |
| [16] | Yu Q, Wei Z, Shi J, et al. Polymer-doxorubicin conjugate micelles based on poly(ethylene glycol) and poly(n-(2-hydroxy propyl) methacrylamide):effect of negative charge and molecular weight on biodistribution and blood clearance[J]. Biomacromolecules, 2015, 16:2645-2655. |
| [17] | Liu Z, Wang Y, Zhang J, et al. Pluronic P123-docetaxel conjugate micelles:synthesis, characterization, and antitumor activity[J]. J Biomed Nanotechnol, 2013, 9:2007-2016. |
| [18] | Gaucher G, Dufresne MH, Sant VP, et al. Block copolymer micelles:preparation, characterization and application in drug delivery[J]. J Control Release, 2005, 109:169-188. |
| [19] | Moghimi SM, Hedeman H, Muir IS, et al. An investigation of the filtration capacity and the fate of large filtered stericallystabilized microspheres in rat spleen[J]. Biochim Biophys Acta, 1993, 1157:233-240. |
| [20] | Li YP, Budamagunta MS, Luo JT, et al. Probing of the assembly structure and dynamics within nanoparticles during interaction with blood proteins[J]. ACS Nano, 2012, 6:9485-9495. |
| [21] | Sarika PR, James NR, Nishna N, et al. Galactosylated pullulancurcumin conjugate micelles for site specific anticancer activity to hepatocarcinoma cells[J]. Colloid Surface B, 2015, 133:347-355. |
| [22] | Sarika PR, James NR, Kumar PRA, et al. Gum arabiccurcumin conjugate micelles with enhanced loading for curcumin delivery to hepatocarcinoma cells[J]. Carbohyd Polym, 2015, 134:167-174. |
| [23] | Cao Y, Gao M, Chen C, et al. Phospholipid-like amphiphilic polymer conjugate micelles for on-demand intracellular curcumin delivery[J]. J Control Release, 2015, 213:e131. |
| [24] | Thipparaboina R, Chavan RB, Kumar D, et al. Micellar carriers for the delivery of multiple therapeutic agents[J]. Colloid Surface B, 2015, 135:291-308. |
| [25] | Camacho KM, Kumar S, Menegatti S, et al. Synergistic antitumor activity of camptothecin-doxorubicin combinations and their conjugates with hyaluronic acid[J]. J Control Release, 2015, 210:198-207. |
| [26] | Chen Y, Zhang W, Huang Y, et al. Pluronic-based functional polymeric mixed micelles for co-delivery of doxorubicin and paclitaxel to multidrug resistant tumor[J]. Int J Pharm, 2015, 488:44-58. |
| [27] | Tsouris V, Joo MK, Kim SH, et al. Nano carriers that enable co-delivery of chemotherapy and RNAi agents for treatment of drug-resistant cancers[J]. Biotechnol Adv, 2014, 32:1037-1050. |
| [28] | Liu H, Li Y, Mozhi A, et al. siRNA-phospholipid conjugates for gene and drug delivery in cancer treatment[J]. Biomaterials, 2014, 35:6519-6533. |
| [29] | Akimoto J, Nakayama M, Okano T. Temperature-responsive polymeric micelles for optimizing drug targeting to solid tumors[J]. J Control Release, 2014, 193:2-8. |
| [30] | Torchilin VP. Multifunctional, stimuli-sensitive nanoparticulate systems for drug delivery[J]. Nat Rev Drug Discov, 2014, 13:813-827. |
| [31] | Lv S, Tang Z, Zhang D, et al. Well-defined polymer-drug conjugate engineered with redox and pH-sensitive release mechanism for efficient delivery of paclitaxel[J]. J Control Release, 2014, 194:220-227. |
| [32] | Mastria EM, Chen M, McDaniel JR, et al. Doxorubicinconjugated polypeptide nanoparticles inhibit metastasis in two murine models of carcinoma[J]. J Control Release, 2015, 208:52-58. |
| [33] | Li J, Zhou Y, Li C, et al. Poly(2-ethyl-2-oxazoline)-doxorubicin conjugate-based dual endosomal pH-sensitive micelles with enhanced antitumor efficacy[J]. Bioconjugate Chem, 2015, 26:110-119. |
| [34] | Tian R, Wang H, Niu R, et al. Drug delivery with nanospherical supramolecular cell penetrating peptide-taxol conjugates containing a high drug loading[J]. J Colloid Interf Sci, 2015, 453:15-20. |
| [35] | Li M, Liu Y, Feng L, et al. Polymeric complex micelles with double drug-loading strategies for folate-mediated paclitaxel delivery[J]. Colloid Surface B, 2015, 131:191-201. |
| [36] | Zhao N, Pei SN, Qi J, et al. Oligonucleotide aptamer-drug conjugates for targeted therapy of acute myeloid leukemia[J]. Biomaterials, 2015, 67:42-51. |
| [37] | Li Y, Xiao K, Zhu W, et al. Stimuli-responsive cross-linked micelles for on-demand drug delivery against cancers[J]. Adv Drug Deliv Rev, 2014, 66:58-73. |
| [38] | Trapani G, Denora N, Trapani A, et al. Recent advances in ligand targeted therapy[J]. J Drug Target, 2012, 20:1-22. |
| [39] | Toporkiewicz M, Meissner J, Matusewicz L, et al. Toward a magic or imaginary bullet? Ligands for drug targeting to cancer cells:principles, hopes, and challenges[J]. Int J Nanomedicine, 2015, 10:1399-1414. |
| [40] | Xu HY, Ma HF, Yang PM, et al. Targeted polymer-drug conjugates:current progress and future perspective[J]. Colloid Surface B, 2015, 136:729-734. |
| [41] | Liu Z, Zhang N. pH-Sensitive polymeric micelles for programmable drug and gene delivery[J]. Curr Pharm Design, 2012, 18:3442-3451. |
| [42] | Cui C, Yu P, Wu M, et al. Reduction-sensitive micelles with sheddable PEG shells self-assembled from a Y-shaped amphiphilic polymer for intracellular doxorubicine release[J]. Colloid Surface B, 2015, 129:137-145. |
 2016, Vol. 51
2016, Vol. 51


