壳聚糖 (chitosan,Ch) 又称脱乙酰甲壳素,是由自然界广泛存在的几丁质 (chitin) 经脱乙酰作用得到。这种天然高分子具有生物兼容性、安全性和微生物降解性等优良性能[1, 2]。壳聚糖经羧甲基化反应后得到羧甲基壳聚糖 (carboxymethyl chitosan,CMCh),是一种水溶性壳聚糖衍生物,其性质稳定、无毒和无抗原性,是良好的药物载体材料[3]。本研究利用羧甲基壳聚糖pH敏感性特性[4, 5, 6],通过疏水性软脂酸修饰形成羧甲基壳聚糖-软脂酸自组装胶束 (carboxymethyl chitosan-palmitic acid,CMCh-PA),并依据肿瘤组织偏酸性的微环境特点,使载药胶束在肿瘤部位产生定位释放,实现其物理化学靶向性; cRGD多肽是精氨酸、甘氨酸及天冬氨酸组成的环状多肽,其存在于多种细胞外基质中,能与肿瘤新生血管内皮细胞高度表达的整合素αβ受体结合,有效促进肿瘤细胞对生物材料的黏附[7]。同时,以紫杉醇 (PTX) 作模型药物,以软脂酸-羧甲基壳聚糖聚合物作载体材料,利用cRGD靶向性修饰实现对肿瘤部位的主动靶向作用,制备紫杉醇聚合物靶向胶束PTX-cRGD-CMCh-PA,并对该药物递送系统的理化性质、释药规律和体内外靶向性等方面进行综合评价。
材料与方法 仪器Unity Inova 400超导核磁共振谱仪 (美国瓦瑞安公司); HPP 5001激光粒度分析仪 (英国Malvern公司); 1260 Infinity型高效液相色谱仪 (美国安捷伦公司); 超声波细胞粉碎机 (上海之信仪器有限公司); Bio Tek酶标仪 (美国伯腾仪器有限公司); TCS-SP2共聚焦激光扫描显微镜 (德国Leica公司); 活细胞工作站 (型号Cell’R,Olympus公司); 小动物近红外荧光成像系统 (IVIS Lumina II); LG-5真空冷冻干燥冻干机 (上海机械工艺研究所); 透析袋 (MW = 3 500 Da和MW = 8 000 Da,进口分装)。
药品和试剂紫杉醇 (纯度> 99%,美仑生物有限公司); 壳聚糖 (MW = 8~10 kDa,江苏南通兴成生物制品厂,脱乙酰度85%); 1-(3-二甲氨基丙基)-3-乙基碳二亚胺·盐酸盐 (EDC·HCl,上海延长生化科技发展有限公司); N-羟基丁二酰亚胺 (NHS,上海共价化学科技有限公司); Taxol (实验室自制,乙醇和聚氧乙烯蓖麻油按照1∶1比例); Tween 80 (国药集团化学试剂有限公司); 芘 (Alfa Assar公司); RPMI-1640培养基 (Thermo Fisher Scientific公司); 小牛血清 (北京索莱宝科技有限公司); 胰蛋白酶 (Beyotime公司); 二甲亚砜 (DMSO)、香豆素-6、Hoechst33258 (Sigma公司); 噻唑蓝 (MTT,北京索莱宝科技有限公司); Lyso-Traker-Red溶酶体红色荧光探针 (碧云天公司); Luc-A549 (杭州贺临生物科技有限公司); 乙腈和甲醇均为色谱纯,其他的试剂均为AR级。
动物BALB/c裸鼠,SPF级,体重18~22 g,由苏州大学实验动物中心提供 (实验动物使用许可证号: SYXK (苏) 2007-0035)。
载体cRGD-CMCh-PA的制备羧甲基壳聚糖 (CMCh) 的合成 精密称取壳聚糖 (MW = 8 000~10 000 Da) 10.0 g,与NaOH 20.0 g共同加入到装有80% 异丙醇溶液100 mL中,室温溶胀24 h。将氯乙酸15.0 g溶于20 mL异丙醇中,缓慢滴入上述溶液中,50 ℃继续反应4 h,加入70% 乙醇适量,3 000 r·min-1离心15 min,收集沉淀物,乙醇洗涤3次,真空干燥,即得[8]。
CMCh-PA的合成 将软脂酸 (PA) 0.200 g溶于50 mL干燥的CH2Cl2,缓慢加入EDC·HCl 0.320 g和NHS 0.180 g,40 ℃反应2 h。旋转蒸发除去CH2Cl2得到活化的PA-NHS。将CMCh-PA 0.25 g溶于30 mL水中,逐滴加入活化的软脂酸甲醇溶液中,在80 ℃下反应5 h。冷却至室温,继续搅拌12 h,循环去离子水透析72 h,冷冻干燥,即得CMCh-PA[9]。
cRGD-CMCh-PA的合成 精密称取CMCh-PA 30 mg,溶于20 mL pH 8.0 PBS中形成溶液。加入EDC·HCl 6 mg,在25 ℃下反应30 min,加入NHS 6 mg继续反应2 h。之后将整个反应体系置于4 ℃环境中,加入cRGD 5 mg反应24 h。将反应后的产物置于透析袋 (MW = 3 500) 中透析72 h,冷冻干燥得到cRGD-CMCh-PA[10]。
红外和核磁分析取一定量的Ch、CMCh和CMCh- PA采用FT-IR进行红外表征[11]。用CF3COOD/D2O (9∶1) 1.0 mL溶解壳聚糖,将CMCh、CMCh-PA、cRGD- CMCh-PA分别溶于1.0 mL D2O,通过400 MHz 1H NMR测得4个样品的核磁谱图[12]。
PTX-cRGD-CMCh-PA的制备采用薄膜分散法制备载药胶束。量取一定体积的1.0 mg·mL-1紫杉醇-甲醇溶液,加入一定量cRGD-CMCh-PA,45 ℃下旋转蒸发挥去溶剂形成药物和紫杉醇薄膜。向整个体系中加入适量的蒸馏水并用0.45 μm微孔滤膜过滤除去聚合物的聚集体和游离的药物,即得载药胶束。
包封率和载药量的测定将甲醇0.9 mL加入 0.1 mL载药胶束中,使胶束破乳,置超速冷冻离心机中,控制温度4 ℃,16000 r·min-1下离心45 min; 另取载药胶束,超速冷冻离心处理。分别取上清液20 μL,采用HPLC法测定胶束总药物浓度和未包载的游离药物浓度[13]。根据式 (1) 和式(2) 计算得到载药胶束 (PTX-cRGD-CMCh-PA) 的包封率 (encapsulation efficiency,EE) 与载药量 (loaded amount,LD)。色谱条件: 色谱柱为ODS2-C18; 流动相: 乙腈-水(70∶30,v/v); 检测波长: 227 nm; 流速: 1.0 mL·min-1; 柱温: 25 ℃; 进样量: 20 μL。

以pH 5.3和pH 7.4 PBS作为复溶介质,采用薄膜分散法制得载药胶束PTX-cRGD- CMCh-PA,并用相应酸度的PBS缓冲溶液稀释至一定倍数,以激光粒度仪测定粒径及zeta电位值。以pH 5.3和pH 7.4 PBS缓冲溶液作为水化介质制得一定体积的1.0 mg·mL-1载药胶束,滴加1~2滴在碳支持膜上,自然晾干后通过透射电子显微镜 (TEM) 观察不同酸度条件下载药胶束PTX-CMCh-PA的形态特征。采用芘荧光探针法[14],测定不同pH值下的CMC值。
体外药物释放分别精密吸取制得的载药胶束5.0 mL加到透析袋 (截留分子量 = 8 000 Da) 中,以50.0 mL不同pH值的PBS (pH 5.3或7.4) 作为释放介质 (加入0.5% Tween 80); (37 ± 1) ℃恒温振荡器中振荡,分别于不同时间点精密吸取透析外液1.0 mL,并补充等量恒温的相同释放介质。样品采用HPLC法测得相应紫杉醇浓度,并计算得到各对应时间点的累积释放百分率[15]。
细胞毒性实验取对数期A549细胞通过MTT法考察Taxol、CMCh-PA和cRGD-CMCh-PA载药胶束的细胞毒性。在96孔板中每孔加入100 μL试样,放入CO2恒温培养箱培养24 h。每孔加入5 mg·mL-1 MTT溶液20 μL,继续孵育3~4 h。吸去上层液体,用PBS溶液冲洗至少3次。每孔加入DMSO 100 μL,低速振荡15 min,在酶联免疫检测仪570 nm波长处测定各孔的吸光值[16]。
共聚焦激光显微镜定性观察载体在细胞内的分布采用薄膜分散法制备含50 μL香豆素-6 (Cou-6,浓度为10 μg·mL-1) 的载药胶束Cou-6-CMCh-PA和Cou-6-cRGD-CMCh-PA。将A549细胞放置在37 ℃、5% CO2培养箱培养24 h后,用pH 7.4 PBS等渗溶液清洗3次,以洗去细胞单分子层表面的杂质。分别加入Cou-6-CMCh-PA和Cou-6-cRGD-CMCh-PA两种胶束1 mL,分别孵育0.5、1和3 h。用Hoechst33258与Lyso-Tracker Red对细胞核和溶酶体进行染色。通过4%多聚甲醛固定15 min,PBS冲洗3次,共聚焦激光显微镜下观察摄入情况[17]。
活细胞工作站考察A549细胞对胶束的动态摄取过程将对数期生长的A549细胞用50 μL Hoechst33258染色10 min,PBS轻轻洗涤细胞3次,加入含有50 nmol·L-1 Lyso-Tracker Red的无血清培养基染色20 min。先将活细胞工作站系统预热至37 ℃,将培养基替换为含Cou-6-cRGD-CMCh-PA的无血清培养基后分别上机检测。调整各通道的曝光时间及透射光,优化荧光图像。两组检测时间为2 h,每隔15 s采集一次图像得到胶束的动态摄取图[18]。选取若干时间点摄取,分别随机选取胞浆中的ROI (region of interest),记录2 h内溶酶体和胶束荧光强度变化。
Luc-A549裸鼠肺癌皮下瘤模型和原位模型考察载药胶束的体内靶向性将Luc-A549裸鼠肺癌皮 下瘤模型和原位模型接种肿瘤4周后,分别选取裸鼠通过尾静脉分别注射0.2 mL CMCh-PA-DiR和cRGD- CMCh-PA-DiR胶束溶液,24 h后置于小动物近红外荧光成像系统 (IVIS Lumina II) 中扫描成像[19]。解剖取出心、肝、脾、肺、肾及肿瘤,置于荧光成像系统中观察其组织分布情况。
统计学处理实验数据以x± s表示,用SPSS19.0统计软件进行数据处理,各组间数据的比较采用one- way ANOA分析,两两间的比较采用SNK法分析。
结果 1 傅里叶变换红外光谱 (FT-IR) 分析各物质的红外图谱如图 1所示。CMCh图中,1 130 cm-1是醚键的C-O伸缩振动峰,表明合成了O-羧甲基壳聚糖。1 650~1 570 cm-1峰形变化不大,表明伯胺上反应较少。CMCh-PA图中,2 932~2 920 cm-1之间的吸收峰2 922 cm-1是软脂酸的C-H对称伸缩振动峰,表明PA接枝到了CMCh上。以上分析表明,CMCh-PA被成功合成。
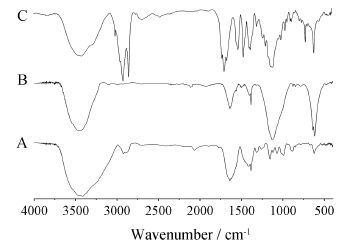
|
Figure 1 The FT-IR spectra of chitosan (Ch,A),carboxymethyl chitosan (CMCh,B) and carboxymethyl chitosan-palmitic acid (CMCh-PA,C) |
各样品的1H NMR谱图如图 2所示。在CMCh图中,δ 2.66为O-CH2-C=O中亚甲基氢的峰,表明羧甲 为软脂酸末端CH3质子峰,δ 1.52为软脂酸上与羰基基接枝到壳聚糖的C6-OH上; CMCh-PA图中,δ 0.79临近的CH2质子峰,表明软脂酸 (PA) 接枝到壳聚糖的C2-NH2上; δ 6.6和6.8为酪氨酸苯环上两对对位H的分裂峰,表明cRGD接枝到羧甲基壳聚糖-软脂酸 (CMCh-PA) 的羧基上。以上结果提示,cRGD-CMCh- PA已被成功合成。由1H NMR中峰面积之比与氢原子个数之间的关系,结合壳聚糖、羧甲基壳聚糖、软脂酸-羧甲基壳聚糖分子结构式,对1H NMR相应峰积分计算得到羧甲基取代度为45.0%。另外,通过酸碱滴定法进一步确定氨基羧甲基化程度为15.8%,壳聚糖的C6-OH羧甲基化程度为29.2%; 软脂酸-羧甲基壳聚糖分子CMCh-PA中,软脂酸的取代度为15.0%[20]。
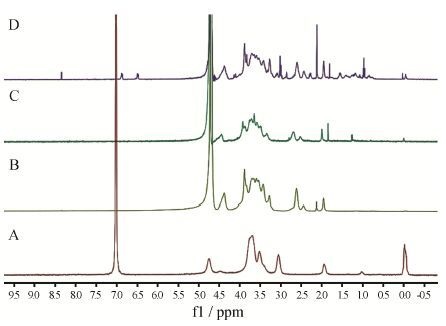
|
Figure 2 The 1H NMR spectra of Ch (A),CMCh (B),CMCh- PA (C) and cRGD-carboxymethyl chitosan-palmitic acid (cRGD- CMCh-PA,D) |
取PTX-cRGD-CMCh-PA载药胶束 (药载比 = 4 mg∶10 mg),cRGD-CMCh-PA载体材料质量浓度为 1 mg·mL-1,测得包封率为99.67%,载药量达到28.5%。
4 不同pH载药胶束的粒径和形态如图 3所示,在介质pH 7.4条件下PTX-cRGD- CMCh-PA粒子表面电位为 (26.3 ± 1.4) mV,粒径为 (162.9 ± 1.5) nm; pH 5.3时电位为 (32.3 ± 2.8) mV。与pH 7.4 PBS中粒径和电位情况相比,pH 5.3时粒径出现多峰现象,而zeta电位值较大,推测是由于O-羧甲基壳聚糖-软脂酸中软脂酸段含羧基和壳聚糖上残留的丰富氨基发生质子化作用所致; 羧基在高pH值下带负电,随着pH值降低,羧酸根负离子质子化不带电荷; 氨基在较高pH值时不带电荷,当pH值降低时,氨基会得到质子,转变为铵根阳离子,氨基端由疏水端变为亲水端。通过载药胶束上羧基和氨基质子化,电位随pH值下降而升高。载药胶束由于壳聚糖刚性结构上 部分基团亲水/疏水段转换而实现翻转,造成部分胶束解散成小颗粒或聚集成大粒子,从而出现多峰现象。
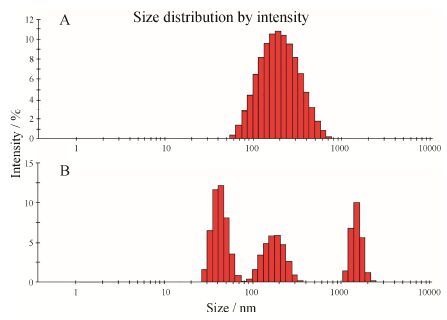
|
Figure 3 Particle size distributions of paclitaxel-loaded cRGD- carboxymethyl chitosan-palmitic acid (PTX-cRGD-CMCh-PA) micelles in phosphate buffered saline (PBS). A: pH 7.4; B: pH 5.3 |
电镜照片如图 4所示,正常载药胶束呈球状,大小比较均匀,边缘光滑,形态比较圆整,无药物结晶析出。在图 4a、4b中显示,大多数粒子的粒径为150 nm,比激光散射仪测定的结果162.9 nm略小,可能是因为溶剂效应所致。其原因为在激光散射仪测定载药胶束溶液时,胶束粒子处于水化介质中,而电镜测定时样品是在干燥状态,经滤纸吸附的干燥过程可能引起PTX-cRGD-CMCh-PA粒子表面由于水化层丢失造成塌陷或萎缩,外观表现为粒径收缩。与pH 7.4条件下相比,在pH 5.3 (图 4c) 的PBS缓冲溶液中载药胶束的形态明显不同,较多的胶束出现聚集或解散现象,仅有小部分胶束维持原来的圆整形态。胶束粒径小于200 nm,满足实体瘤部位的渗透滞留效应 (EPR) 的条件,可以利用肿瘤局部微环境实现被动靶向,有助于该药物递送系统实现药物在肿瘤组织的蓄积,发挥抗肿瘤效果。
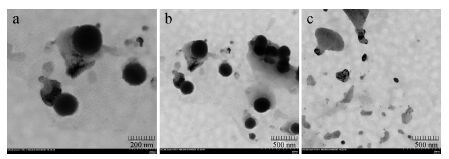
|
Figure 4 Morphology of PTX-cRGD-CMCh-PA in PBS. a: pH 7.4; b: Local; c: pH 5.3 |
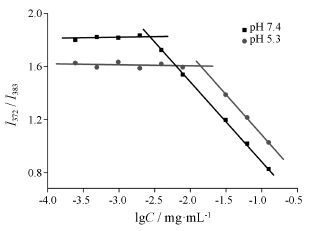
聚合物cRGD-CMCh-PA的CMC值即为I372/I383数据点的水平切线与突变曲线切线的交点对应的聚合物浓度值。如图 5所示,pH 7.4时,CMC = 2.72×10-3 mg·mL-1; pH 5.3时,CMC = 1.40×10-2 mg·mL-1。这表明: 在弱酸性条件下该载体不易形成胶束。这种特性有利于胶束在正常组织仍能维持稳定,但是在肿瘤组织中药物在该浓度下快速释放。
|
Figure 5 Plot of the intensity ratio I373/I384 from pyrene excitation spectra function of lgC at pH 7.4 and pH 5.3 |
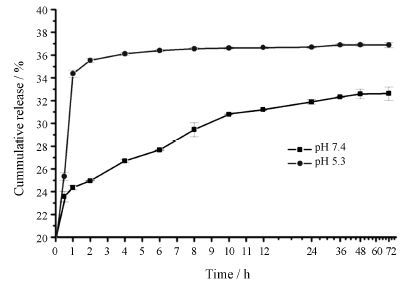
由图 6可知,相对于本身不具有pH敏感性紫杉醇而言,在pH 7.4条件下cRGD-CMCh-PA载药胶束中的药物在5 h时仅释放了24.95% 左右,说明该载药胶束具备明显的缓释作用,10 h后进入缓慢的释药阶段,药物浓度维持在基本恒定的水平。在pH 5.3时,PTX-cRGD-CMCh-PA在0.5 h后释放即达到25.36%,2 h后累积释放量为35.54%,说明在pH 5.3 PBS中,药物在前阶段时存在突释现象,3 h后的较长时间基本恒速释放,并保持较高的释放速度。用几种不同的释药模型对PTX-cRGD-CMCh-PA体外药物释放实验数据分别进行处理,结果见表 1。
|
Figure 6 Release behavior of PTX-cRGD-CMCh-PA micelles at 37 ℃ in different PBS (pH 5.3 and pH 7.4,n = 3) |
|
|
Table 1 Fitting equation of release curve for PTX-cRGD-CMCh-PA |
在pH 7.4条件下,PTX-cRGD-CMCh-PA累积释放量Q与时间t的相关系数较高的回归方程为Q = 2.866 t1/2 + 21.237,R2 = 0.984 1。提示载药胶束累积释放量Q与时间t的关系与Higuchi方程吻合,说明PTX- cRGD-CMCh-PA在正常体内环境中的释放具备骨架型释药模型的特征,具有缓释作用; 当pH 5.3时,PTX- cRGD-CMCh-PA累积释放量Q与时间t的相关系数 较高的回归方程为Q = 32.387 × (1 - exp(-(0.006 63 × (t + 153.542)) ^ 12.622)),R2 = 0.990,严格服从Weibull分布函数,说明该药物递送系统具有快速释药特性,有利于药物快速释药及疗效的发挥。
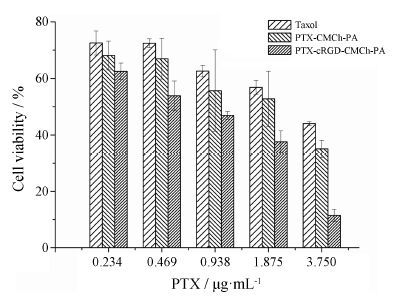
7 细胞毒性实验通过MTT法考察Taxol及不同浓度载药胶束对A549细胞的毒性,各组的质量浓度为: ① 3.75 μg·mL-1; ② 1.88 μg·mL-1; ③ 0.94 μg·mL-1; ④ 0.47 μg·mL-1; ⑤ 0.23 μg·mL-1。从图 7可知,Taxol及两种载药胶束对A549细胞毒性具有浓度依赖性,而两种载药胶束对细胞的抑制作用存在显著性差异,靶向载体材料包载紫杉醇制成PTX-cRGD-CMCh-PA胶束后,cRGD靶向修饰的载体IC50值最低。推测经过cRGD修饰后,载药胶束可显著提高A549细胞对药物的摄取量,且进入细胞内含体的胶束在弱酸性条件下迅速释放PTX,作用于微丝微管,导致A549细胞的分裂受阻,加剧其凋亡,从而显著提高化疗药物PTX的抗肿瘤效果,IC50明显降低。
|
Figure 7 Cytotoxicity of Taxol and two types of micelles on A549 |
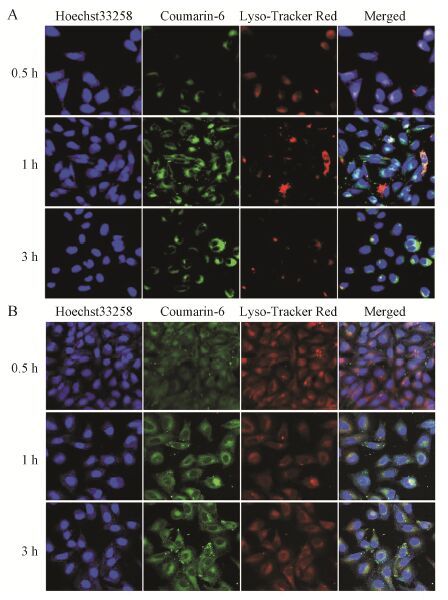
由图 8可知,0.5 h时胶束主要分布于细胞膜周 围,1 h开始进入细胞浆,且多数分布于酸性细胞器溶酶体中,说明有部分载体可能经过内吞途径进入细胞。2 h可见明显地溶酶体共定位情况。由此可见,肿瘤细胞对胶束摄取与时间呈现一定程度的依赖性。在相同时间间隔内,cRGD-CMCh-PA (图 8A) 较未接靶头的CMCh-PA (图 8B) 有更为明显的细胞摄取,提示胶束通过EPR效应和cRGD介导的主动靶向肿瘤细胞,更有利于药物摄取。
|
Figure 8 Distribution of CMCh-PA (A) and cRGD-CMCh-PA (B) micelles under confocal microscopy |
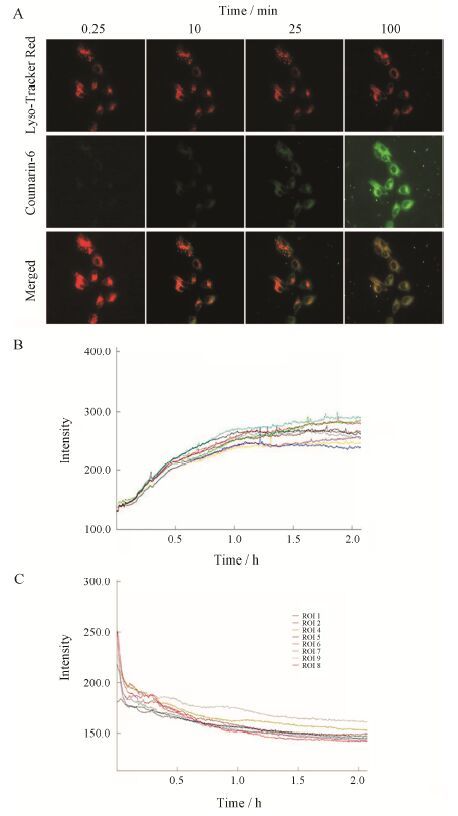
由图 9A随机截取的0.25、10、25和100 min时的活细胞工作站摄取图可以看出,随着时间延长,摄取量不断增高。由图 9B可知,cRGD-CMCh-PA给药后可迅速被A549细胞摄取,至0.5 h时细胞内可见较强烈的绿色荧光,1 h基本稳定。从图 9C可知,溶酶体红荧光强度在1 h后基本不变,cRGD-CMCh-PA摄取量随时间延长而增加,与前文共聚焦激光显微镜定性摄取结果相一致。
|
Figure 9 Cellular uptake by A549 observed using living cell station. A: Uptake images of coumarin (Cou-6)-labeled cRGD- CMCh-PA within 0.25,10,25 and 100 min. B: Kinetics of Cou-6 intensity from cytoplasmic ROIs (regions of interest) in A549 cells. C: Kinetics of Lyso-Tracker Red intensity from cytoplasmic ROIs in A549 cells |
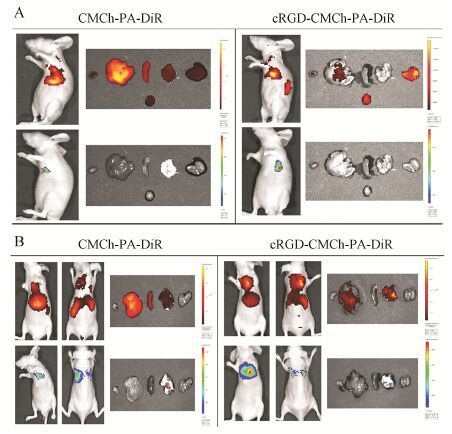
如图 10所示,Luc-A549裸鼠肺癌皮下瘤模型和原位模型中,无cRGD的CMCh-PA-DiR胶束在心、肝、脾、肺、肾及肿瘤组织均有分布,肝中分布较多; 而接枝cRGD的cRGD-CMCh-PA-DiR胶束在肿瘤组织及肾分布较多,在心、肝、脾和肺分布较少,表明cRGD-CMCh-PA-DiR胶束对裸鼠肿瘤组织有较好的靶向性。
|
Figure 10 Tissue distributions of micelles after 24 h,administration-subcutaneous tumor (A) and administration-orthotopic tumor (B) |
聚合物胶束作为疏水性药物和基因、多肽等生物大分子药物的载体,其聚合物胶束疏水性内核能有效增溶脂溶性药物,亲水性外壳能够使得胶束溶于水相中。通过采用生物可降解的壳聚糖制备药物递送系统的载体材料,对材料进行pH敏感性、热敏和温敏等修饰,从而实现药物的靶向递送效果。
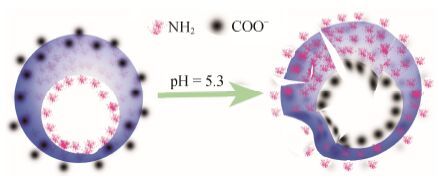
本文合成的新型药物递送系统cRGD-羧甲基壳聚糖-软脂酸聚合物,将其包载紫杉醇得到一种pH敏感型胶束,载药胶束具有较好的载药量和包封率,体外释放实验显示该载体具有pH敏感释药特点。综合分析不同pH值释放介质中载药胶束体外释放实验、粒径、电位、形态及CMC值,结合羧甲基壳聚糖-软脂酸的化学结构特点,推断该新型载体cRGD- CMCh-PA的pH响应性机制为: cRGD-CMCh-PA上存在羧基和氨基可以质子化,酸性环境中载体cRGD- CMCh-PA的氨基和羧基发生“质子化”,疏水的氨基质子化生成铵根离子变得亲水,亲水的羧基离子质子化生成羧基变得疏水 (图 11); 由于cRGD-CMCh- PA载体母核壳聚糖存在刚性结构,当壳聚糖上氨基发生疏水/亲水转换且羧甲基壳聚糖上的羧基在酸性环境下由于得到质子变得疏水时,cRGD-CMCh-PA实现亲水端和疏水端的急剧翻转,造成部分胶束解散成小颗粒或聚集成大粒子,出现多峰现象,在TEM中表现为胶束聚集或解聚的现象,这与粒径分布情况相吻合。
|
Figure 11 Inversion of hydrophilic block and hydrophobic block of the drug carrier |
体内外实验均证实,cRGD-CMCh-PA作为药物递送系统具有肿瘤组织特异靶向性,可作为疏水性药物的理想载体和高效的靶向递药系统。本研究为敏感性药物递送系统cRGD-CMCh-PA后续研究提供科学依据,对寻找pH敏感性载药胶束新材料提供一定的借鉴。
| [1] | Jayakumar R, Menon D, Manzoor K, et al. Biomedical applications of chitin and chitosan based nanomaterials-a short review[J]. Carbohydr Polym, 2010, 82:227-232. |
| [2] | Azuma K, Osaki T, Minami S, et al. Anticancer and antiinflammatory properties of chitin and chitosan oligosaccharides[J]. J Funct Biomater, 2015, 6:33-49. |
| [3] | Jiang Z, Han B, Hui L, et al. Preparation and anti-tumor metastasis of carboxymethyl chitosan[J]. Carbohydr Polym, 2015, 125:53-60. |
| [4] | Nam JP, Park SC, Kim TH, et al. Encapsulation of paclitaxel into lauric acid-O-carboxymethyl chitosan-transferrin micelles for hydrophobic drug delivery and site-specific targeted delivery[J]. Int J Pharm, 2013, 457:124-135. |
| [5] | Guo H, Zhang D, Li C, et al. Self-assembled nanoparticles based on galactosylated O-carboxymethyl chitosan-graftstearic acid conjugates for delivery of doxorubicin[J]. Int J Pharm, 2013, 458:31-38. |
| [6] | Du H, Yang X, Pang X, et al. The synthesis, self-assembling, and biocompatibility of a novel O-carboxymethyl chitosan cholate decorated with glycyrrhetinic acid[J]. Carbohydr Polym, 2014, 111:753-761. |
| [7] | Jin ZH, Josserand V, Foillard S, et al. In vivo optical imaging of integrin αv-β3 in mice using multivalent or monovalent cRGD targeting vectors[J]. Mol Cancer, 2007, 6:41. |
| [8] | Chen XG, Park HJ. Chemical characteristics of O-carboxymethyl chitosans related to the preparation conditions[J]. Carbohydr Polym, 2003, 53:355-359. |
| [9] | Hsiue GH, Wang CH, Lo CL, et al. Environmental-sensitive micelles based on poly (2-ethyl-2-oxazoline)-b-poly (L-lactide) diblock copolymer for application in drug delivery[J]. Int J Pharm, 2006, 317:69-75. |
| [10] | Hansson A, Hashom N, Falson F, et al. In vitro evaluation of an RGD-functionalized chitosan derivative for enhanced cell adhesion[J]. Carbohydr Polym, 2012, 90:1494-1500. |
| [11] | Murinov KY, Kuramshina AR, Khisamutdinov RA, et al. IR study on chitosan oxidation with sodium chlorite[J]. Russ J Gen Chem, 2010, 80:23-26. |
| [12] | Yao Z, Zhang C, Ping Q, et al. A series of novel chitosan derivatives:synthesis, characterization and micellar solubilization of paclitaxel[J]. Carbohydr Polym, 2007, 68:781-792. |
| [13] | Huo MR, Zhou JP, Wei Y, et al. Preparation of paclitaxelloaded chitosan polymeric micelles and influence of surface charges on their tissue biodistribution in mice[J]. Acta Pharm Sin (药学学报), 2006, 41:867-872. |
| [14] | Kalyanasundaram K, Thomas JK. Environmental effects on vibronic band intensities in pyrene monomer fluorescence and their application in studies of micellar systems[J]. J Am Chem Soc, 1977, 99:2039-2044. |
| [15] | Liu Q, Yang X, Xu H, et al. Novel nanomicelles originating from hydroxyethyl starch-g-polylactide and their release behavior of docetaxel modulated by the PLA chain length[J]. Eur Polym J, 2013, 49:3522-3529. |
| [16] | Nafee N, Schneider M, Svhaefer UF, et al. Relevance of the colloidal stability of chitosan/PLGA nanoparticles on their cytotoxicity profile[J]. Int J Pharm, 2009, 381:130-139. |
| [17] | Nakayama M, Chung JE, Miyazaki T, et al. Thermal modulation of intracellular drug distribution using thermoresponsive polymeric micelles[J]. React Funct Polym, 2007, 67:1398-1407. |
| [18] | Skommer J, Mcguinness D, Wlodkowic D. Self-adhesive microculture system for extended live cell imaging[J]. Biotech Histochem, 2011, 86:174-180. |
| [19] | Zhu QL, Zhou Y, Guan M, et al. Low-density lipoproteincoupled N-succinyl chitosan nanoparticles co-delivering siRNA and doxorubicin for hepatocyte-targeted therapy[J]. Biomaterials, 2014, 35:5965-5976. |
| [20] | Yuan ZQ, Li JZ, Liu Y, et al. Systemic delivery of micelles loading with paclitaxel using N-succinyl-palmitoyl-chitosan decorated with cRGDyK peptide to inhibit non-small-cell lung cancer[J]. Int J Pharm, 2015, 492:141-151. |
 2016, Vol. 51
2016, Vol. 51


