2. 中国医学科学院、北京协和医学院医药生物技术研究所, 北京 100050
2. Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
随着心脑血管疾病发病率逐年增高的势头,心脑血管疾病的研究已成为我国医学研究的热点领域。动脉粥样硬化 (atherosclerosis,AS) 是心脑血管疾病的主要病理基础,而脂质代谢紊乱尤其是胆固醇代谢紊乱又是AS发生的主要致病因素[1]。因此,研究脂代谢调节,特别是胆固醇代谢调控机制对于防治心脑血管疾病有积极的理论及实践意义。
胆固醇逆转运 (reverse cholesterol transport,RCT) 过程是指将胆固醇由外周组织转运回肝脏进行再循环或以胆汁酸的形式随粪便排出体外的过程。研究表明,促进RCT过程能使过量的胆固醇从肝外细胞 (尤其是泡沫化的巨噬细胞) 外流并运送到肝细胞进行代谢,从而减轻AS斑块或病灶[2]。ATP结合盒转运体A1 (ATP-binding cassette transporter A1,ABCA1) 是ATP结合盒转运体 (ABC) 超家族的成员之一。ABCA1能促进细胞内的胆固醇流出从而参与RCT,最终清除组织内过量的胆固醇[3]。ATP结合盒转运体G1 (ABCG1) 也是介导巨噬细胞胆固醇外流的主要分子之一[4]。ABCG1通常是以自身形成同源二聚体的形式来介导巨噬细胞中的胆固醇外排到高密度脂蛋白 (HDL),但并不会影响HDL水平[5, 6]。清道夫受体 (scavenger receptor class B type Ⅰ,SR-BI)是介导胆固醇逆转运的HDL受体,它不仅能促进胆固醇从外周细胞流出,又可以促进肝脏中胆固醇的选择性摄取[7]。人高密度脂蛋白受体被称为CLA-1 (CD36 and lysosomal integral membrane protein-Ⅱ analogous-1)[8]。过氧化物酶体增殖物激活受体 (peroxisome proliferator-activated receptors,PPARs) 属于非甾体类核受体超家族,有3个主要成员: PPARα、PPARγ和PPARβ/δ[9],是人类代谢性相关疾病防治药物的重要靶标。研究表明,PPARs两个重要的亚型PPARα和PPARγ配体激活剂不仅可以改善包括糖尿病在内的胰岛素抵抗综合征 (IR),而且还可以减缓AS的进程,其潜在机制可能是提高了ABCA1等基因的表达,增加了ABCA1等功能受体的量,最终引起巨噬细胞内胆固醇流出的增加[10]。因此,寻找能够上调ABCA1和SR-BI/CLA-1的小分子化合物有可能成为发现新型调节脂代谢药物的一种有效手段。
应用本实验室在前期工作中建立的人ABCA1[11]和CLA-1[12]表达上调剂筛选模型筛选获得了活性化合物E23869,并对该化合物进行了体外脂质代谢相关研究。结果表明化合物E23869能够激活核受体PPARα/PPARγ从而上调ABCA1和SR-BI的表达,具有较好的体外调节脂代谢的作用,为新型调血脂药物的开发奠定了重要的基础。
材料与方法 主要试剂RPMI 1640培养基、DMEM培养基购自美国Hyclone公司; 胎牛血清、小牛血清和培养3T3-L1细胞所用的DMEM培养基购自美国Gibco公司; 罗格列酮 (rosiglitazone,RGZ,CAS号: 122320- 73-4)、GW9662 (CAS号: 22978-25-2)、3-异丁基-1-甲基黄嘌呤 (isobutylmethylxanthine,IBMX,CAS号: 28822-58-4)、地塞米松 (CAS号: 50-02-2)、胰岛素、二甲基亚砜 (DMSO) 均购自美国Sigma公司; MK886 (ab141140) 购自英国Abcam公司; 荧光素酶检测试剂盒购自美国Promega公司; 荧光实时定量PCR试剂盒 (FastStart Universal SYBR Green Master,ROX) 购自瑞士Roche公司; Ox-LDL和HDL购自北京协生生物科技有限责任公司; 增强型HRP化学发光液购自美国Millipore公司; MTT (3-(4,5-dimethylthiazol- 2-yl)-2,5-diphenyltetrazolium bromide,0793) 购自美国Amresco公司; 筛选所用的化合物来自国家新药 (微生物) 筛选实验室,纯度 > 95%。
细胞株人肝癌细胞株HepG2细胞和小鼠单核巨噬细胞RAW264.7培养于含10% (v/v) 胎牛血清的DMEM培养基 (Hyclone) 中; 人正常肝细胞L02培养于含15% (v/v) 胎牛血清的DMEM培养基中; 小鼠胚胎成纤维细胞3T3-L1培养于10% (v/v) 小牛血清的DMEM培养基 (Gibco) 中。所有细胞都于5% CO2培养箱中37 ℃贴壁培养。所有细胞株均为国家新药 (微生物) 筛选实验室保存。
主要仪器2104-0010型酶标仪 (美国Perkin Elmer公司),Mx3000型实时定量PCR仪 (美国Agilent公司),Trans-Blot®semi-DRY Transfer Cell半干式膜转印仪和AL050123型PCR仪(美国Bio-Rad公司)。
化合物样品高通量筛选利用ABCA1p-LUC HepG2[11]或CLA-1p-LUC HepG2[12]细胞进行高通量筛选和活性化合物的EC50测定,方法同文献[11, 12, 13, 14]。
计算待测样品对荧光素酶活性的改变率,改变率 (%) = 加入待测化合物后的荧光素酶活性/加入空白对照样品 (DMSO) 后的荧光素酶活性 × 100。以待测样品的改变率≥150% 即视为初筛阳性,对初筛的阳性化合物进一步复筛,并观察其对细胞状态的影响。
MTT比色实验分别将人肝癌细胞HepG2、小鼠单核巨噬细胞RAW264.7、人正常肝细胞L02和小鼠胚胎成纤维细胞3T3-L1用含血清的生长培养基配成单细胞悬液,接种于96孔透明底板 (Costar) 中,待细胞融合度为50% 时换为无血清培养基稀释的系列浓度梯度化合物E23869,设空白对照,每孔200 μL,培养48 h后每孔加入5 mg·mL-1的MTT溶液20 μL,使其终质量浓度为0.5 mg·mL-1,37 ℃避光培养4 h后终止培养。弃上清液,每孔加入DMSO 150 μL,室温避光孵育15 min,用酶标仪读取各孔在560 nm波长下的光吸收值。
蛋白质免疫印迹法检测活性化合物对ABCA1等蛋白表达水平的影响将小鼠单核巨噬细胞RAW264.7和人正常肝细胞L02分别接种于6孔板细胞培养板 (Costar) 中,待细胞融合度达到90%后,加入含一定浓度化合物的无血清培养基。设立加药组E23869 (0.01、0.10、1.00和10.00 μmol·L-1) 和阴性对照组 (不加入待测样品),培养24 h后提取细胞中总蛋白,方法同文献[13, 14]。各蛋白抗体所使用的浓度如下: ABCA1 (1∶500,Novus); SR-BI (1∶2 000,Novus); ABCG1 (1∶2 000,Abcam); FAS (1∶2 000,Sigma); CD36 (cluster of differentiation 36,1∶500,Novus); β-Actin (1∶5 000,Sigma); 山羊抗兔二抗 (1∶2 000,ZSGB-BIO); 兔抗小鼠二抗 (1∶2 000,ZSGB-BIO)。化学发光法 (ECL,Millipore) 检测,Tanon 5200化学发光成像系统成像,以对照组作为内参对照,用各处理组的面积灰度值与对照组相比,从而定量分析蛋白表达水平的变化。
活性化合物对巨噬细胞泡沫化及细胞内总胆固醇的影响将小鼠单核巨噬细胞RAW264.7铺于24或96孔细胞培养板 (Costar) 中,待细胞融合度为90% 时,换为无血清DMEM培养基。设立空白对照组 (不加Ox-LDL和待测样品)、泡沫细胞组 (80 μg·mL-1 Ox-LD L) 和加药组 [80 μg·mL-1 Ox-LDL和E23869 (分别为0.01、0.10、1.00和10.00 μmol·L-1)]。加入终质量浓度为80 μg·mL-1 Ox-LDL到泡沫细胞组和加药组24 h后,加药组加入一定浓度的待测样品培养24 h进行油红染色或测定细胞内总胆固醇。对96孔板进行油红染色并拍照方法同文献[15]。对24孔板进行活性化合物对细胞内总胆固醇的测定。利用组织总胆固醇测定试剂盒 (北京普利莱基因技术有限公司) 测定细胞内总胆固醇的含量,用BCA试剂盒测定蛋白浓度,以每毫克蛋白浓度校正总胆固醇含量。
活性化合物对胆固醇外排实验的影响活性化合物对胆固醇外排实验方法同文献[15]。将小鼠单核巨噬细胞Raw264.7接种于黑色透明底96孔细胞培 养板(Costar) 中,待细胞融合度为90% 时,换为含0.2% (w/v) BSA的DMEM培养基,加入终浓度为 5 μmol·L-1的荧光标记的胆固醇22-NBD-cholesterol (Invitrogen) 孵育24 h。然后用PBS轻轻漂洗细胞2次,加入含一定浓度化合物的测定培养基 (DMEM加入0.2% BSA和0.1% DMSO),设立空白组 (不加胆固醇)、对照组 (胆固醇、无HDL)、加药组 [胆固醇、HDL和E23869(0.01、0.10、1.00和10.00 μmol·L-1)] 和阳性对照组 [胆固醇、HDL (终质量浓度50 μg·mL-1) 和10.00 μmol·L-1 9-顺式视黄酸 (9-cis-retinoic acid,9CRA,Sigma)]。孵育18 h后直接加入终质量浓度为50.00 μg·mL-1的HDL继续孵育6 h。
用酶标仪在其激发光为485 nm、发射光为535 nm时,分别测定并记录上清和细胞内荧光值[15]。胆固醇流出率的计算公式为: 胆固醇流出率 (%) = (上清荧光值-空白上清荧光值)/[(上清荧光值-空白上清荧光值)+ (细胞内荧光值-空白上清荧光值)]×100。
活性化合物对核受体的激动活性作用PPARα和PPARγ都是配体依赖的核受体。本实验室前期利用哺乳动物细胞单杂新技术建立了核受体PPARs的激动剂药物活性评价模型[16]。具体操作如下: 首先 将无血清DMEM培养基 (每孔25 μL) 和脂质体LipofectamineTM 2000 (每孔0.40 μL) 混匀,室温孵 育5 min; 将无血清DMEM培养基 (每孔25 μL) 和200 ng质粒DNA (报告质粒GAL4和表达质粒pBIND- PPARα/γ-LBD比例为10∶1) 混匀。然后将两者合并混匀,室温孵育20 min。人肝癌HepG2细胞接种于96孔板 (Costar) 中,待细胞长至 90% 融合度后,加入上述含脂质体和质粒的混合液 (每孔50 μL)。转染6 h后,换为无血清的DMEM培养基 (每孔200 μL),设置终浓度为0.1%DMSO的无血清培养基作为空白对照,然后加入不同浓度的化合物E23869和RGZ (10.00 μmol·L-1),加药24 h后,检测细胞中荧光素酶表达活性的变化。改变率大于150% 为阳性。并分析样品的浓度与荧光素酶活性的改变率之间的量效关系,通过Graphpad Prism 5.0软件拟合量效关系曲线并计算EC50。
活性化合物对ABCA1等蛋白表达的机制研究将RAW264.7和L02细胞分别铺于6孔板中,向其中同时加入E23869 (10.00 μmol·L-1)、PPARα拮抗剂MK886 (1.00 μmol·L-1) 或PPARγ拮抗剂GW9662 (10.00 μmol·L-1) 共同孵育24 h,然后提取细胞总蛋白,利用Western blotting法检测化合物对ABCA1等蛋白表达的影响,方法同前。
活性化合物对前脂肪细胞诱导分化的影响小鼠前脂肪细胞3T3-L1培养于10% (v/v) 小牛血清的DMEM培养基 (Gibco) 中,待细胞长到70%~80% 汇合度时,以每毫升4×105个细胞数接种于24孔培养板中。在扩展培养基中继续培养3天长至100% 汇合度时换液,在融合后的扩展培养基中继续培养48 h后,换为分化培养基,诱导培养至少48 h后,此时3T3-L1细胞已经被诱导,进入分化期。
其中,维持培养基为含10 μg·mL-1胰岛素及10%胎牛血清 (FBS) 的DMEM培养基: 90 mL DMEM培养基 + 280 μL重组人胰岛素 (100 U·mL-1) 注射液 + 10 mL FBS。分化培养基为含0.05 mmol·L-1 IBMX、1 μmol·L-1 dexamethasone、10 μg·mL-1胰岛素及10% FBS的DMEM培养基: 90 mL DMEM培养基 + 100 μL 50 mmol·L-1 IBMX母液 + 10 μL 10 mmol·L-1 dexamethasone母液 + 280 μL重组人胰岛素 (100 U·mL-1) 注射液 + FBS 10 mL。扩展培养基为10% (v/v) 小牛血清的DMEM培养基 (Gibco)。
将24孔板中刚诱导完的3T3-L1细胞换成新鲜的含一定浓度化合物的扩展培养基,设立加药组E23869 (0.10、1.00和10.00 μmol·L-1) 和阴性对照组 (不加入待测样品),继续培养7天,每2天换一次新鲜的加药培养基,第7天进行油红染色,染色方法同巨噬细胞泡沫化。同时,用异丙醇将各孔染色的油红洗出,在550 nm波长下进行定量检测,观察活性化合物对脂肪细胞分化和脂质蓄积的影响。按照细胞内甘油三酯测定试剂盒说明书 (北京普利莱基因技术有限公司) 测定3T3-L1细胞中的甘油三酯含量,前期处理细胞的方法同上,用BCA法进行蛋白定量,以每毫克蛋白浓度校正甘油三酯含量。
统计学分析实验数据以x± s表示,两组间比较采用方差分析及t检验。P < 0.05时被认为有显著性差异。
结果 1 活性化合物E23869在ABCA1和CLA-1表达上调剂筛选模型中的量效关系曲线用ABCA1-LUC HepG2和CLA-1p-LUC HepG2细胞对国家新药 (微生物) 筛选实验室化合物库的20 000个化合物进行高通量筛选,相对荧光强度增加50%以上的初筛阳性化合物进行复筛,阳性率约为0.30%。发现化合物E23869具有同时上调ABCA1 和CLA-1的活性,目前尚无其任何生物活性报道,该化合物的结构如图 1A,其对ABCA1和CLA-1的上调活性为目前发现的同系列化合物 (氮-(苯并噻唑- 2-基)-苯甲酰胺类) 中最好的。E23869分子式为C14H8F2N2OS,相对分子质量为290.29,淡黄色粉末,化学名为氮-(苯并噻唑-2-基)-2,5-二氟苯甲酰胺,英文名为N-(benzothiazol-2-yl)-2,5-difluorobenzamide。通过测定不同浓度的E23869在ABCA1[11]和CLA-1[12]表达上调剂模型中的荧光信号值,得到其在模型上的量效关系曲线 (图 1B和1C)。结果表明,E23869能够以剂量依赖的方式分别增加ABCA1-LUC HepG2和CLA-1p-LUC HepG2细胞荧光素酶活性。在ABCA1表达上调剂筛选模型中的EC50值为0.25 μmol·L-1,与对照组比较,最高上调活性为196% (图 1B); 在CLA-1表达上调剂筛选模型中的EC50值为0.66 μmol·L-1,与对照组比较,最高上调活性为198% (图 1C)。
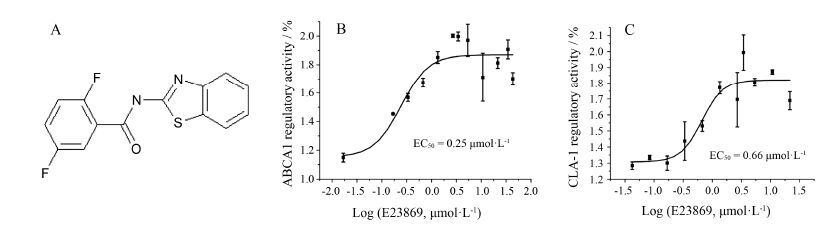
|
Figure 1 E23869 regulated ABCA1 and CLA-1 activities. A: Chemical structure of E23869; B: ABCA1 regulatory activity of E23869; C: CLA-1 regulatory activity of E23869. HepG2 cells were seeded in 96-well plates in 100 μL medium for 6 h,followed by substitution with medium containing different concentration of the positive compound. Twenty hours later,the cells were harvested for measurements of luciferase activity. n = 3,x± s |
DMSO能溶解细胞中的甲瓒,用酶联免疫检测仪在560 nm波长处测定其光吸收值,可间接反映活细胞数量。利用MTT比色法检测化合物E23869在0~100.00 μmol·L-1内对HepG2、Raw264.7、L02和3T3-L1细胞存活与生长的影响 (图 2A~D)。结果表明,在HepG2细胞中,E23869在0~100.00 μmol·L-1内均未表现出显著的细胞毒性; 在Raw264.7细胞和3T3-L1细胞中,E23869在50和100 μmol·L-1时表现出一定的细胞毒性; 而在L02细胞中E23869在6.25 μmol·L-1时表现出一定的细胞毒性。
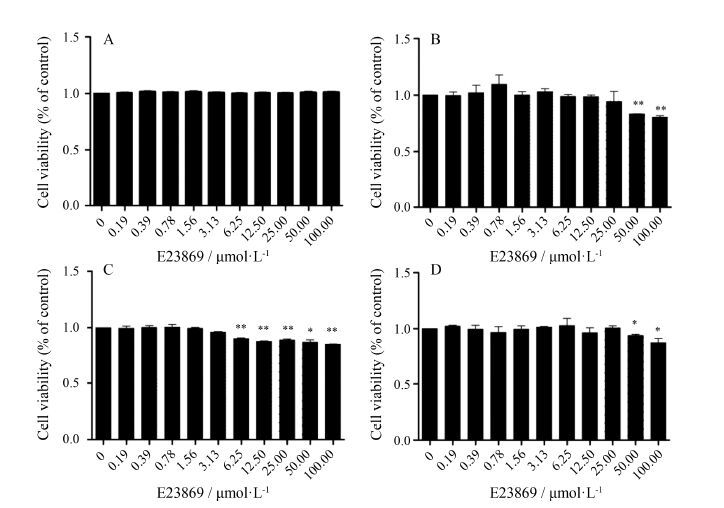
|
Figure 2 Effects of E23869 on cell viability. HepG2 cells (A),Raw264.7 cells (B),L02 cells (C) and 3T3-L1 cells (D) were treated with E23869 at the indicated concentrations. Cell viability was then assessed by MTT assay. n = 3,x± s. P < 0.05,**P < 0.01 vs control |
将E23869 (0.01、0.10、1.00和10.00 μmol·L-1) 分别处理RAW264.7和L02细胞24 h,利用Western blotting在RAW264.7和L02细胞中检测化合物E23869对靶蛋白 [ABCA1、SR-BI、ABCG1、CD36和脂肪酸合成酶 (fatty acid synthase,FAS)] 表达的影响。
Western blotting结果显示,与对照相比,E23869能够在蛋白水平显著增加RAW264.7细胞中ABCA1、SR-BI以及ABCG1的表达 (图 3A和3B),减少了CD36的表达; 在L02细胞中,0.10~10.00 μmol·L−1 E23869同样能够在蛋白水平上显著增加ABCA1、CLA-1以及ABCG1的表达 (图 3C和3D),在0.01、0.10和1.00 μmol·L-1浓度下减少了FAS的表达。
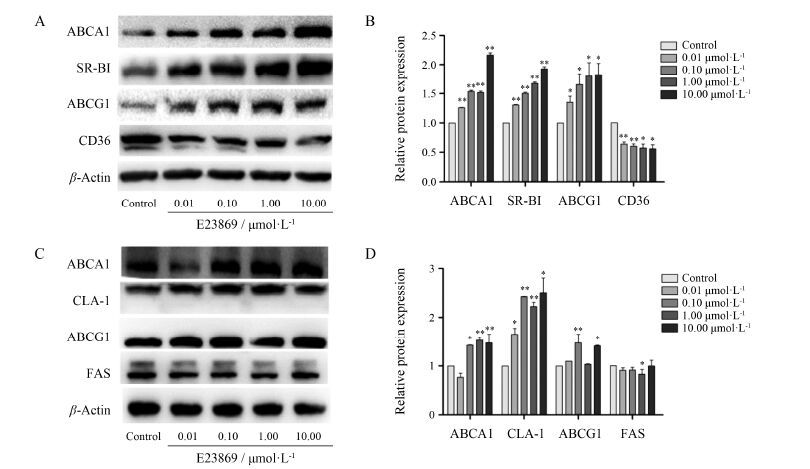
|
Figure 3 Effect of E23869 on ABCA1,SR-BI/CLA-1 and ABCG1 expressions. RAW264.7 cells (A,B) and L02 cells (C,D) were treated with or without E23869 (0.01,0.10,1.00 and 10.00 μmol·L-1 for each) for 24 h as described in the Materials and Methods,and the control groups were treated with DMSO (0.1%). Then the levels of ABCA1,SR-BI,ABCG1,CD36 and FAS proteins were determined by Western blotting. Induction factors were normalized against β-actin. n = 3,x± s. P < 0.05,**P < 0.01 vs control |
巨噬细胞大量吞噬变性的低密度脂蛋白Ox-LDL等,造成细胞内大量胆固醇以胆固醇酯的形式储存并蓄积,从而形成泡沫化细胞,这是AS等形成的重要原因。
巨噬细胞泡沫化实验结果显示,空白对照组没有红色脂滴形成 (图 4A,a),Ox-LDL对照组有明显的红色脂滴存在 (图 4A,b),各加药组细胞内出现的红色油状颗粒与Ox-LDL对照组相比有明显的减少,并且呈剂量依赖,E23869在10.00 μmol·L-1时脂质累积最少 (图 4A,c~f)。
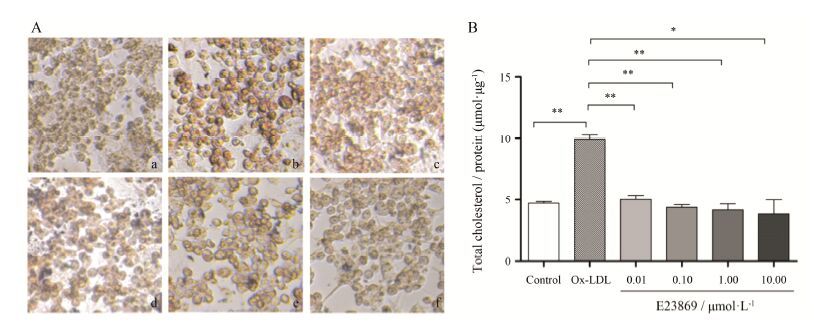
|
Figure 4 E23869 reduced lipids accumulation in RAW264.7 cells. RAW264.7 macrophages were co-incubated with E23869 (0.01,0.10,1.00 and 10.00 μmol·L-1) and Ox-LDL (80 μg·mL-1) for 24 h. After incubation,cells were fixed and stained with oil red O (ORO) (A),or total cholesterol was extracted and determined by the Cholesterol Assay Kit (B). a: Blank cells; b: Control (Ox-LDL only); c: Ox-LDL (80 μg·mL-1) + E23869 (0.01 μmol·L-1); d: Ox-LDL (80 μg·mL-1) + E23869 (0.10 μmol·L-1; e: Ox-LDL (80 μg·mL-1) + E23869 (1.00 μmol·L-1); f: Ox-LDL (80 μg·mL-1) + E23869 (10.00 μmol·L-1). The magnification of each panel is 200×. Total cholesterol content was measured as μg per 5×104 cells every 24 wells. n = 3,x± s. P < 0.05,**P < 0.01 vs Ox-LDL group |
油红染色指示的是细胞内包括胆固醇酯在内的所有中性脂质。因此,细胞内总胆固醇的量也是细胞泡沫化的一个主要特征。结果显示 (图 4B),各加药组细胞内的总胆固醇含量与Ox-LDL对照组相比有了明显的减少,并且呈剂量依赖性。总之,定性和定量研究结果均说明,化合物E23869能够减少脂质在巨噬细胞中蓄积,有效抑制了巨噬细胞泡沫化。
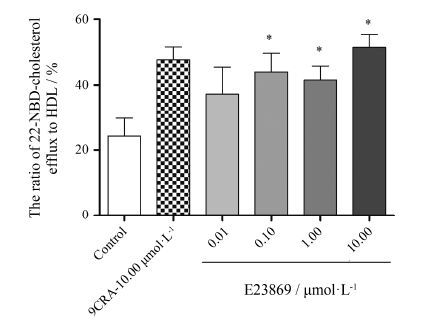
5 E23869增加RAW264.7细胞内的胆固醇流出从图 5可以看出,在不加E23869时胆固醇流出率约为23%; 在加入化合物E23869作用下,随着E23869浓度的增加,流出率也逐渐增加,与不加化合物组呈现显著差异; E23869在10.00 μmol·L-1时的胆固醇流出率最高,并优于阳性药9CRA,流出率最高约达到55%。说明E23869可以增加细胞内的胆固醇外排,对调节血脂有益。
|
Figure 5 E23869 induced cholesterol efflux to HDL in Raw264.7 macrophages. RAW264.7 macrophages were pre- incubated with 22-NBD-cholesterol for 24 h. Then,the cells were washed with PBS and incubated with E23869 (0,0.01,0.10,1.00 and 10.00 μmol·L-1) or 9CRA (10.00 μmol·L-1). After 18 h,50.00 μg·mL-1 HDL (final concentration) was added and incubated for 6 h at 37 ℃. The amount of cholesterol in the medium and cells were measured separately. n = 3,x± s. P < 0.05 vs control group |
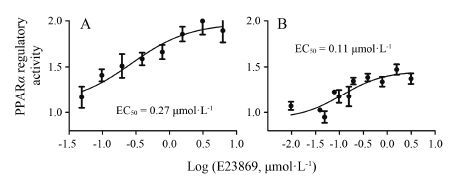
本实验室前期利用哺乳动物细胞单杂新技术建立了核受体PPARs的激动剂药物活性评价模型[16],现利用此模型评价化合物E23869对PPARα/PPARγ的激动活性。通过测定不同浓度化合物E23869的荧光信号值,得到该活性化合物的量效关系曲线 (图 6A和6B)。从结果可以看出,E23869以剂量依赖性方式激活PPARα/PPARγ介导的报告基因转录,最高激动活性分别为1.98倍和1.46倍,激动活性的EC50分别为0.27 μmol·L-1和0.11 μmol·L-1。
|
Figure 6 Dose-response curves for E23869 in log scale. A: PPARα activation by E23869 in a GAL4-PPARα-LBD reporter assay; B: PPARγ activation by E23869 in a GAL4-PPARγ-LBD reporter assay. HepG2 cells were transfected with GAL4-pGL4- luc reporter plasmid and pBIND-PPARα/γ-LBD expression plasmid using LipofectamineTM 2000 (Invitrogen) for 6 h. After transfection,cells were treated with DMSO and medium containing differernt concentration of compound E23869 for 24 h. Then the cells were harvested for measurements of luciferase activity |
通过核受体PPARα/PPARγ激动剂药物活性评价模型发现E23869在PPARα/PPARγ上有明显激活作用,为了进一步验证其机制,利用Western blotting法在RAW264.7和L02细胞中检测加入PPARα/PPARγ拮抗剂后化合物对靶蛋白 (ABCA1、SR-BI和ABCG1) 表达的影响。
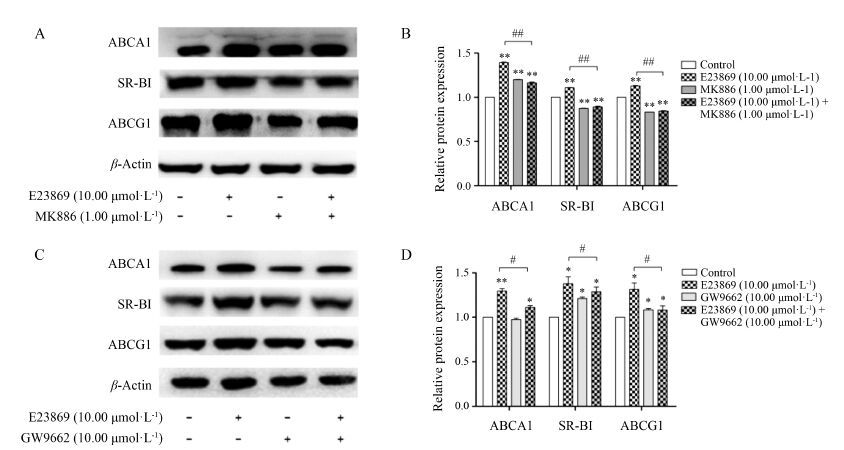
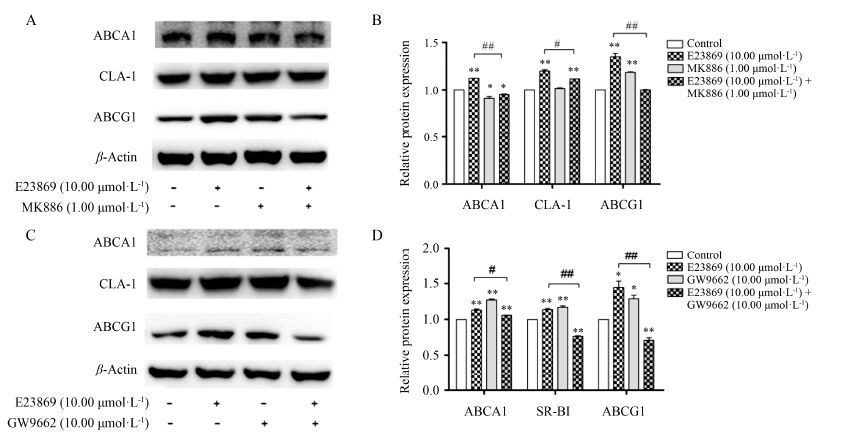
从图 7A和7B中可以看出,在RAW264.7细胞中,单独加入PPARα拮抗剂MK886对ABCA1、SR-BI和ABCG1的表达影响不大,但共同加入活性化合物E23869和PPARα拮抗剂MK886作用后,与单独加药组相比,ABCA1、SR-BI和ABCG1的蛋白水平有所下降。从图 7C和7D中可以看出,共同加入活性化合物E23869和PPARγ拮抗剂GW9662作用后,与单独加药组相比,ABCA1、SR-BI和ABCG1的蛋白水平也有所下降。从图 8中可以看出,在L02细胞中,共同加入活性化合物E23869和PPARα/γ拮抗剂作用后,与单独加药组相比,ABCA1、CLA-1和ABCG1的蛋白水平均有所下降。这些结果说明,E23869确实是通过PPARα/PPARγ通路来调控了ABCA1、SR-B1/CLA-1及ABCG1的蛋白表达水平。
|
Figure 7 Effects of PPARα/γ antagonist on activity of E23869 in RAW264.7 cells. RAW264.7 cells were incubated with or without E23869 (10.00 μmol·L-1),MK886 (1.00 μmol·L-1) (A) or GW9662 (10.00 μmol·L-1) (C) for 24 h,and then the levels of ABCA1,SR-BI and ABCG1 proteins were determined by Western blotting assays. A,C: The protein levels were analyzed by Western blotting. B,D: The protein levels were analyzed by grayscale scanning. n = 3,x± s. P < 0.05,**P < 0.01 vs control group; #P < 0.05,##P < 0.01 vs 10.00 μmol·L-1 E23869 |
|
Figure 8 Effects of PPARα/γ antagonist on activity of E23869 in L02 cells. L02 cells were incubated with or without E23869 (10.00 μmol·L-1),MK886 (1.00 μmol·L-1) (A) or GW9662 (10.00 μmol·L-1) (C) for 24 h,and then the levels of ABCA1,CLA-1 and ABCG1 proteins were determined by Western blotting assays. A,C: The protein levels were analyzed by Western blotting. B,D: The protein levels were analyzed by grayscale scanning. n = 3,x± s. P < 0.05,**P < 0.01 vs control group; #P < 0.05,##P < 0.01 vs 10.00 μmol·L-1E23869 |
如图 9A所示,诱导48 h后3T3-L1细胞在含10.00 μmol·L-1 RGZ的扩展培养基中可完全分化成为 成熟的脂肪细胞,油红染色后在镜下可以观察到脂滴内丰富的脂质蓄积,脂滴数几乎达到90%,并且脂滴很密集,说明10.00 μmol·L-1 RGZ能够加速3T3-L1细胞的分化成熟与脂滴内甘油三酯的累积。而同样 情况下,在0.10~10.00 μmol·L-1之间E23869加药 组则表现出较弱的脂肪生成作用,7天的含药培养脂滴数量不超过50%,脂滴大且分散,与RGZ组相比,E23869对3T3-L1细胞分化与脂肪生成的诱导作用 更弱。同时,用异丙醇将各孔染色的油红洗出后,在550 nm波长下进行定量检测,也能看到活性化合物显著减少了对脂肪细胞分化和脂质蓄积的诱导 (图 9B)。药物诱导的3T3-L1细胞内甘油三酯含量测定 表明 (图 9C),与10.00 μmol·L-1 RGZ组相比,在0.10和1.00 μmol·L-1两个浓度时,E23869对3T3-L1细胞中脂质生成显著减少,对甘油三酯的诱导生成作用也很弱; 但在10.00 μmol·L-1处E23869对3T3-L1 细胞中脂质生成及甘油三酯的诱导相比低浓度有 一定程度地增加,但与10.00 μmol·L-1 RGZ组相比,E23869对3T3-L1细胞的分化与脂肪生成的诱导作用较弱。
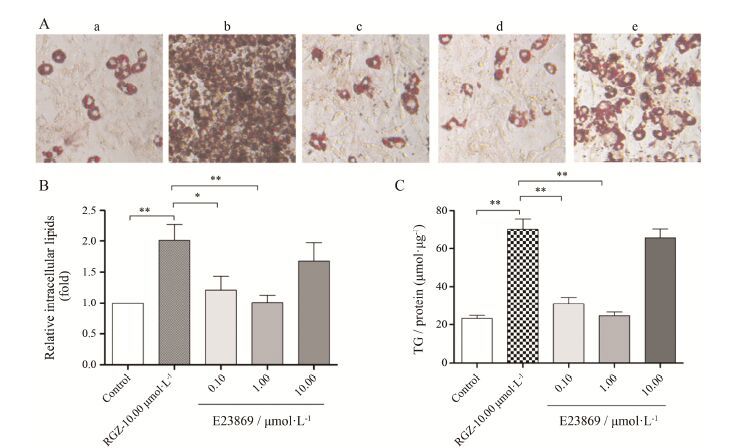
|
Figure 9 E23869 weakly promoted in vitro differentiation of mouse preadipocytes. 3T3-L1 preadipocytes were grown in plates and induced to differentiate into adipocytes. Rosiglitazone (RGZ,10.00 μmol·L-1) and E23869 (0.10,1.00 and 10.00 μmol·L-1) were added to the cultures throughout the experiment. A: Cells were fixed with 4% paraformaldehyde and stained with 0.5% ORO to detect lipid accumulation. Representative images of the five study groups were shown (200× magnification). a: Negative (insulin only); b: 10.00 μmol·L-1 RGZ; c: 0.10 μmol·L-1 E23869; d: 1.00 μmol·L-1 E23869; e: 10.00 μmol·L-1 E23869. B: After ORO staining,bound dye was solubilized and quantified spectrophotometrically at 550 nm. C: Differentiating 3T3-L1 adipocytes were cultured in expansion medium and stimulated with the indicated concentrations of E23869 or RGZ. After 6 days of stimulation,the cells were harvested to measure the intracellular triglyceride (TG) content. n = 3,x± s. P < 0.05,**P < 0.01 vs 10.00 μmol·L-1 RGZ |
ABCA1和SR-BI/CLA-1是参与RCT的关键蛋白,其表达量增高能够促进胆固醇的流出,调节脂代谢,降低AS的发病风险[13, 14]。本研究希望找到具有上调ABCA1和SR-BI/CLA-1的活性,并具有较好的体外调节脂代谢的新型小分子化合物并研究其作用机制。
利用实验室前期构建的人ABCA1和CLA-1表达上调剂筛选模型,发现具有上调ABCA1和CLA-1活性功能的化合物E23869,并对其进行体外初步活性及机制研究。体外分子实验结果表明,在RAW264.7和L02细胞中,活性化合物E23869均能在一定程度上调ABCA1、SR-BI/CLA-1和ABCG1的表达; 体外功能实验证实,E23869能有效地促进细胞内的胆固醇外排,并有效抑制巨噬细胞泡沫化; 这说明此活性化合物确实能够通过调节RCT关键蛋白ABCA1、SR-BI/CLA-1和ABCG1的表达,从而增加细胞内胆固醇外排,抑制巨噬细胞泡沫化,这将有利于RCT、调节血脂及抑制AS的发生。
ABCA1、SR-BI/CLA-1、ABCG1、CD36和FAS受核受体的调节。PPARα是调节肝脏线粒体、过氧化物酶体和微粒体中脂肪酸氧化相关基因的关键因子[17]。作为临床用药贝特类药物的药靶,被证明与体内脂代谢平衡密切相关,可调控编码脂质代谢、脂质运输有关功能蛋白的表达,在调节胆固醇和脂肪酸的代谢过程中起关键作用[18]。PPARα激动剂有降低胆固醇、降血脂等作用。PPARγ主要分布在白色和棕色脂肪,是噻唑烷酮类的作用靶位,控制脂肪的储存和释放,促进脂肪细胞基因表达,参与体内细胞增殖、分化、凋亡、免疫和代谢等人体几乎所有的生理过程,与人类许多疾病如心血管疾病、糖尿病、痴呆症和癌症都有密切的关系,几乎与AS所有病理过程有关,通过RCT调节巨噬细胞和血管内皮细胞中的脂质富集[19]。研究中作者发现活性化合物E23869具有激动PPARα和PPARγ的活性。在RAW264.7和L02细胞中,化合物E23869和PPARα/γ拮抗剂共同作用24 h后,与只加入E23869相比,ABCA1、SR-BI/CLA-1及ABCG1的蛋白水平均显著下降,说明E23869是通过激动PPARα/γ而上调ABCA1、SR-BI/CLA-1及ABCG1的表达。此外,通过测定活性化合物E23869对PPARδ的激动活性发现E23869不能激活PPARδ (数据未显示),并且对脂肪细胞的诱导生成作用较 弱,这说明该活性化合物可能符合PPARα/γ部分激动剂的特征。罗格列酮是TZD类的PPARγ激动剂,通过强效完全地激活PPARγ可显著增加胰岛素敏感性,改善T2DM患者的血糖控制,而这种强效完全的激活方式会诱导多组织非特异性基因的表达,从而引起一系列不期望的不良反应,包括体重增加、水肿、骨质疏松症、肝损伤、癌症和心脏衰竭等。E23869可能通过部分激活PPARα和PPARγ,减少不良反应的产生。
总之,本研究通过人ABCA1[11]和CLA-1[12]表达上调剂筛选模型筛选获得了活性化合物E23869,发现其能激动PPARα/γ从而上调ABCA1、SR-BI/CLA-1和ABCG1的表达,进而促进胆固醇外排,减少细胞内脂质的蓄积,在体外具有较好的调节脂质代谢活性。因此,认为化合物E23869对于新型调血脂药物的开发有着重要意义。
| [1] | Bosevski M. Peripheral arterial disease and diabetes[J]. Prilozi, 2012, 33:65-78. |
| [2] | Ohashi R, Mu H, Wang X, et al. Reverse cholesterol transport and cholesterol efflux in atherosclerosis[J]. QJM, 2005, 98:845-856. |
| [3] | Oram JF. HDL apolipoproteins and ABCA1 partners in the removal of excess cellular cholesterol[J]. Arterioscler Thromb Vasc Biol, 2003, 23:720-727. |
| [4] | Attie AD. ABCA1:at the nexus of cholesterol, HDL and atherosclerosis[J]. Trends Biochem Sci, 2007, 32:172-179. |
| [5] | Zhu Y, Qi C, Jain S, et al. Isolation and characterization of PBP, a protein that interacts with peroxisome proliferatoractivated receptor[J]. J Biol Chem, 1997, 272:25500-25506. |
| [6] | Hegele RA. Plasma lipoproteins:genetic influences and clinical implications[J]. Nat Rev Genet, 2009, 10:109-121. |
| [7] | Xu YN, Liu Q, Xu Y, et al. Rutaecarpine suppresses atherosclerosis in ApoE-/- mice through upregulating ABCA1 and SR-BI within RCT[J]. J Lipid Res, 2014, 55:1634-1647. |
| [8] | Calvo D, Vega MA. Identification, primary structure, and distribution of CLA-1, a novel member of the CD36/LIMPⅡ gene family[J]. J Biol Chem, 1993, 268:18929-18935. |
| [9] | Adegbate E, Adem A, Hasan MY, et al. Medicinal chemistry and actions of dual and pan PPAR modulators[J]. Open Med Chem J, 2011, 5:93-98. |
| [10] | Chawla A, Boisert WA, Lee CH, et al. A PPAR-LXRABCA1 pathway in macrophage is involved in cholesterol efflux and atherosclerosis[J]. Mol Cell, 2001, 7:161-171. |
| [11] | Gao J, Xu Y, Yang Y, et al. Identification of upregulators of human ATP-binding cassette transporter A1via high-throughput screening of a synthetic and natural compound library[J]. J Biomol Screen, 2008, 13:648-656. |
| [12] | Yang Y, Zhang Z, Jiang W, et al. Identification of novel human high-density lipoprotein receptor up-regulators using a cell-based high-throughput screening assay[J]. J Biomol Screen, 2007, 12:211-219. |
| [13] | Xu YN, Gao J, Xu Y, et al. Screening and identification of the upregulators of ATP-binding cassette transporter A1[J]. Acta Pharm Sin (药学学报), 2012, 47:446-451. |
| [14] | Xu Y, Xu YN, Wu YX, et al. Study of isolation, identification and biological activity of human high density lipoprotein receptor CLA-1 up-regulator 9179D[J]. Chin J Antibiot (中国抗生素杂志), 2012, 37:377-382. |
| [15] | Wang X, Liu C, Liu P, et al. The in vitro anti-atherosclerotic activity of compound E0869[J]. Acta Pharm Sin (药学学报), 2015, 50:440-446. |
| [16] | Zheng ZH. Development of a HTS and Activity Evaluation Platform for Metabolic Diseases Drugs Targeting Nuclear Receptors and Pharmacology Studies of Active Compounds (代谢性疾病相关核受体药物筛选、评价体系的建立及活性化合物的药理学研究)[D]. Beijing:Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, 2007. |
| [17] | Jones AB. Peroxisome proliferator-activated receptor (PPAR) modulators:diabetes and beyond[J]. Med Res Rev, 2001, 21:540-552. |
| [18] | Guan Y. Targeting peroxisome proliferator-activated recaptors (PPARs) in kidney and urologic disease[J]. Minerva Urol Nefrol, 2002, 54:65-79. |
| [19] | Shih CY, Chou TC. The antiplatelet activity of magnolol is mediated by PPAR-β/γ[J]. Biochem Pharmacol, 2012, 84:793-803. |
 2016, Vol. 51
2016, Vol. 51


