2. 大连医科大学, 辽宁大连 116044
2. Dalian Medical University, Dalian 116044, China
儿茶酚氧位甲基转移酶 (catechol O-methyltransferase,COMT,EC 2.1.1.6),是一类重要的II相代谢酶,COMT与S-腺苷甲硫氨酸 (SAM或AdoMet) 结合后,再与底物结合,将S-腺苷甲硫氨酸上的甲基转移至儿茶酚类底物的羟基上,形成羟基氧甲基化产物,如图 1所示[1]。COMT催化的底物均为儿茶酚类化合物,包括多巴胺、肾上腺素和去甲肾上腺素等内源性神经递质,以及黄酮儿茶酚、原儿茶醛、儿茶素、咖啡酸等食品化学成分,除此之外还有左旋多巴、瑞香素等具有儿茶酚结构的临床药物。细胞内 的COMT主要以游离型的COMT (soluble COMT,S-COMT) 和膜结合型的COMT (membrane-bound COMT,MB-COMT) 两种形式存在,两者的不同在于MB-COMT在N端增加了50个氨基酸。此外,COMT还存在很多不同的基因型和突变体[2]。
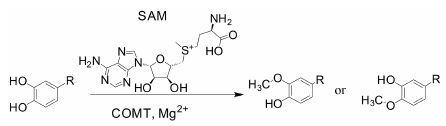
|
图 1 COMT酶催化底物示意图 |
Grossman等[3]应用原位杂交和细胞杂交技术,确定了人COMT基因位于22号染色体长臂1区1带2亚带。人COMT基因包含了6个外显子,其中外显子1和2不编码。COMT由一个基因两个不同启动子分别编码S-COMT和MB-COMT[4]。两种类型的COMT在人体不同器官和细胞中特异性转录[5,6]。
1.2 COMT的分布COMT分布于哺乳动物各个组织,并在各个组织中发挥着代谢儿茶酚胺神经传导物质、儿茶多酚类雌激素和外源化合物的作用[7,8]。COMT在人肝脏和肾脏中活性最高,其中S-COMT在肝脏中活性最高[9]。
肾脏中COMT活性与多巴胺局部代谢相关[7,8]。多巴胺在肾脏细胞中由左旋多巴合成[10]。多巴脱羧酶的量在肾小管上皮细胞中最多。多巴胺的运输是通过肾小管上皮细胞输送到其他肾脏细胞。多巴胺受体刺激可增加尿钠的排泄,因此其在体内钠盐平衡中发挥重要作用[11]。
其他外周组织也存在COMT,例如腺体、肌肉组织、脂肪组织及血细胞。此外还在小肠细胞、淋巴球细胞[12]、单核细胞、皮肤成纤维细胞和黑色素细胞发现有COMT活性[13]。
大脑中COMT的主要作用是代谢在突触传导之后未被神经元重吸收的儿茶酚胺。人大脑中COMT蛋白印迹数据显示,MB-COMT的数量占COMT总数的70%[5]。从不同的大脑区域得到的神经胶质细胞,通过细胞培养和聚集体培养,发现COMT的活性变化不大[13]。
由于S-COMT的翻译是通过COMT较长的mRNA序列,所以在大脑组织中S-COMT和MB-COMT的mRNA水平与COMT的蛋白含量无关。
1.3 COMT的功能及底物特异性Axelrod等[14]在1950年首先证明COMT是降解儿茶酚类化合物的代谢酶之一,能够将S-腺苷甲硫氨酸 (SAM) 的甲基转移到肾上腺素和其他儿茶酚类化合物的3位羟基上从而使其甲基化,此外COMT的活性依赖二价阳离子。COMT的催化机制为有序反应机制,如图 2所示,首先COMT先与辅酶SAM (AdoMet) 结合,随后结合二价阳离子Mg2+,最后与底物结合完成反应[15]。
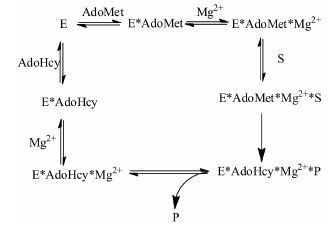
|
图 2 COMT反应机制[15] |
由于儿茶酚胺是重要的神经传导物质,涉及很多生物学功能,所以抑制COMT活性受到了研究人员的关注。COMT抑制剂可以用来控制内源性神经传导物质的水平。早期的COMT抑制剂 (通常称为“第一代”抑制剂) 能够通过抑制COMT延长内源性神经传导物质的生理学作用,但是,“第一代”抑制剂使多巴胺能神经元、肾上腺素能神经元和去甲 肾上腺素能神经元激活的效果相当有限。“第一代” COMT抑制剂的作用受到质疑,直到发现COMT能够代谢帕金森病治疗药物左旋多巴 (L-DOPA)。左旋多巴被认为是“人造的”可以用来控制大脑中神经递质水平的多巴胺的生物前体。尽管左旋多巴具有很好的治疗效果,但是它的缺点是体内的半衰期很短。COMT抑制剂能够抑制3-甲氧基左旋多巴在外周组织中的形成,从而延长左旋多巴的药效同时也减少了治疗剂量。在过去的30年,学术界和制药工业界致力于优化左旋多巴的疗效,COMT抑制剂的开发受到很大的关注。“第二代”抑制剂代替了“第一代”抑制剂,改善了药效。临床上帕金森病辅助治疗相关的COMT抑制剂,如图 3所示,有尼泰卡朋、恩他卡朋、托卡朋、内比卡朋和opicapone等[16, 17]。
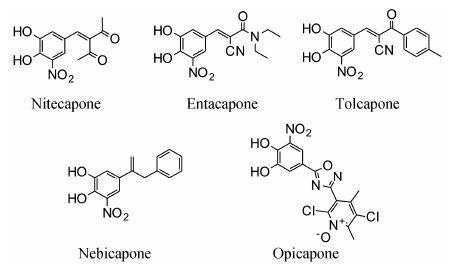
|
图 3 “第二代”COMT抑制剂 |
COMT基因具有多态性。不同个体的COMT活性之间会有差异,通过研究人体红细胞发现表现型活性低的个体呈现常染色体隐性遗传。只有1/3~1/4的人COMT表现型活性低,野生型 (WT) 的COMT表现出热不稳定性。COMT的单核苷酸突变 (SNP),如图 4所示,最常见的是在外显子4中G > A的非同义替换突变造成108位 (S-COMT)/158位 (MB-COMT) 缬氨酸突变为蛋氨酸。突变的位点不在催化区域,不影响酶的催化动力学。Val108/158Met的单核苷酸突变在白种人中是常见的,等位基因频率能够达到50%[18]。
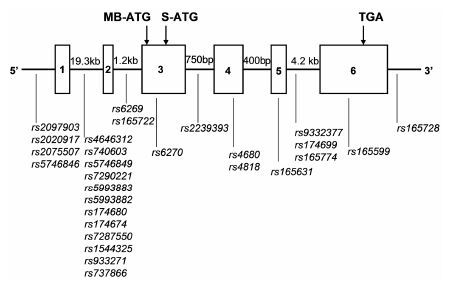
|
图 4 COMT基因突变位点 |
此外,还有很多其他多态性也已确定。COMT基因从外显子2到6重新排列。通过24个SNPs位点检测发现,除Val108/158Met外,另一个非同义替换的基因突变Ala52/102Thr,只在非裔美国女性中观察到。Saito等[19]分析了96位日本人的DNA,检测到34个SNPs位点。Ji等[20]发现白种人DNA重新排序后,在所有外显子1的一侧有1 kb的包含物,并检测到33个SNP位点。特别是位于P1启动子5' FR (-628; C > T; rs2020917) 和I1I1 (701; A > G; rs737865) 与患乳腺癌风险降低有关。
3 COMT与疾病的关系COMT的生理底物包括左旋多巴、儿茶酚胺 (多巴胺、去甲肾上腺素、肾上腺素),还有羟基代谢物、儿茶酚雌激素、抗坏血酸 (维生素C) 和黑色素的中间体二羟基吲哚。食物和药物中也含有很多COMT底物,例如三酚类和取代的儿茶酚、多巴酚丁胺、异丙肾上腺素、派瑞定、α-甲基多巴、苄丝肼、卡比多巴、二羟苯基丝氨酸、黄酮类和四羟基喹诺酮的二羟基衍生物。COMT的主要作用是清除具有生物活性和毒性的儿茶酚类化合物和其他羟基代谢产物。在怀孕早期,COMT能够通过激活由羟基化酶催化形成的芳烃羟基化物,从而保护胎盘、帮助胎盘发育[21]。同时COMT充当了血液和 其他组织之间的解毒屏障,避免有害的外源性物质进入组织 (如肠黏膜和大脑)。COMT也可能在肾脏和肠道中通过特有的或间接的方式调节多巴胺能神经元的作用,这种情况在大脑中也可能同时发生: COMT活性可能在大脑的各个部分调节多巴胺和去甲肾上腺素的生物活性,因此COMT与情绪和其他心理过程相关[22, 23]。
3.1 22q11.2微缺失症22q11.2微缺失是指人体22号染色体11.2区缺失,2000年统计数据显示大约每4 000个新生儿里就有1个22染色体11.2缺失综合征患者。22q11.2微缺失也成为了最常见的染色体中间缺失。在这个区域中大量的低拷贝重复区域使这个区域在减数分裂的时候特别容易被删除,并且值得注意的是在这个区域重复复制也是常见的。22q11.2微缺失症缺失的片段中含有编码COMT的基因。COMT的表达贯穿了整个中枢神经系统神经元细胞,在神经胶质中不表达,在神经元细胞中包括前额皮质中高表达[24]。
COMT调节多巴胺代谢的机制作用,可以从COMT基因敲除小鼠的结果得到一些启示。虽然COMT敲除后的小鼠的前额皮质内显示多巴胺基础水平是正常的,但是前额皮质细胞外间隙的多巴胺清除之后的再次诱发释放会慢50% 左右[25]。多巴胺补充与多巴胺刺激受体需要一个平衡的状态,COMT活性减少可能会延长多巴胺受体的状态活性,但对多巴胺补充活性的影响很小[24]。
前额皮质中多巴胺功能作用的前提是在思维过程中有稳定的多巴胺信号释放,只有稳定的多巴胺信号持续释放才会形成认知过程[26]。相反,多巴胺信号的状态不稳定,能够破坏已经形成的神经元的活性模式,形成新的模式,因此认知的过程更加灵活[24]。
由于在前额皮质中补充了过多的多巴胺信号,出现持续顽固的认知过程,出现这样的认知方式是精神分裂症和分裂情感障碍相关的标志之一[26]。在这点上,大多关注其与COMT多态性的作用,特别是158位残基改变活性; Val158是COMT活性最高的编码形式,然而Met158生成较低活性COMT的基因型。这些基因型在人体和转基因小鼠模型中都显示出对皮质多巴胺水平和认知表现的影响。尽管一些研究认为COMT的多态性会影响认知表现,但是另一些研究结论则相反,所以COMT多态性是否影响认知的影响还没有定论[27]。
3.2 COMT与乳腺癌乳腺癌是出现频率最高的癌症之一,也是世界范围内死亡率很高的癌症。乳腺癌的发生机制尚不明确。循环雌激素的暴露被认为是导致乳腺癌发生最主要的原因。由于雌激素的生物合成和代谢包含很多翻译和转录过程,这些过程中的某些基因可能有助于雌激素的水平和对乳腺癌治疗的敏感性。乳腺癌易感基因1 (BRCA1) 和乳腺癌易感基因2 (BRCA2) 的突变可能导致了乳腺癌遗传风险的增加。然而,乳腺癌的发生几率仅增加了5% ,说明低外显率的遗传因子可以解释大部分的疾病特点[28,29]。
17-β-雌二醇 (E1) 和雌素酮 (E2) 能够被CYP酶代谢,生成2-OH E2/E1和4-OH E2/E1。然后COMT通过转移S-腺苷甲硫氨酸上的甲基使2-OH E2/E1的2-OH和3-OH位点,4-OH E2/E1的4-OH位点的羟 基甲基化。E2和E1的儿茶酚代谢产物,特别是4-OH E2/E1可致癌。雌激素的相对活性是4-OH E2 > 2-OH E2 = E2。COMT通过羟基甲基化清除雌激素的活性。E2/E1的儿茶酚类代谢产物同时通过氧化还原循环生成醌类活性氧类物质 (ROS)。活性氧类物质能够造成DNA氧化损伤包括雌激素醌类 ,特别是4-OH E2/E1生成的醌类,产生具有腺嘌呤和鸟嘌呤脱嘌呤加合物[29]。
COMT在保护DNA损伤中扮演重要作用。在MCF-7细胞中,COMT抑制剂能够增加氧化DNA损伤的数量。在MCF-10F细胞中,COMT抑制剂能够使4-OH-醌雌激素脱嘌呤加合物的数量急剧上升。这些结果证明了COMT作为重要的二相代谢酶,具有抑制儿茶酚雌激素的活性和防止它们氧化代谢成遗传毒性的醌类代谢物的功能。此外,2-MeO E2通过抗血管形成和生长抑制作用发挥抗癌和保护心脏的作用。因此,COMT调节2-OH E2儿茶酚雌激素的羟基甲基化不仅是防止潜在的雌激素和遗传毒性作用,而且还可能生成具有保护作用的代谢产物[29]。
科学家提出低活性的COMT-L型可能增加患乳腺癌的风险,因为可能增加儿茶酚雌激素中间产 物的积累。过去10年,COMT Val158Met多态性对 乳腺癌发展的研究结果相互矛盾。不仅如此,两份荟萃分析研究得出了不同的结论。COMT Val158Met 多态性和乳腺癌患病的风险两者之间的关系并没有明确的结论[29]。Qin等[28]荟萃分析结果显示,COMT Val158Met多态性与乳腺癌患病风险无关。然而,对于这个结论有必要进行大样本标准无偏差的基因分析方法研究。此外,应同时分析基因与基因、基因与环境之间的相互作用。
3.3 COMT与阿尔茨海默症阿尔茨海默症 (AD) 又称老年痴呆,是一种起病隐匿的神经系统退行性疾病,全球每年因阿尔茨海默症带来的经济损失估计有6 040亿[30]。时空方向记忆的丢失和损坏是阿尔茨海默症最突出的临床特征。胆碱酯酶抑制剂 (ChIs) 治疗记忆障碍的广泛应用,是基于乙酰胆碱缺失的假设[31]。
识别阿尔茨海默症患者的一个明显表现是伴有认知障碍迅速加重和认知能力的迅速下降[31]。非典型抗精神病药物在12周内可以改善阿尔茨海默症相关的攻击性行为和精神错乱。然而,必须考虑严重的不良反应,包括锥体外系症状,加速认知能力下降、中风和死亡[32]。为了证实COMT与阿尔茨海默症治疗有关,研究人员提出假设: ① COMT的生物效应可能与AD病理生理学相关; ② COMT基因多态性与AD诊断和AD相关的表现相关; ③ COMT抑制剂的生物效应可能对AD治疗有效; ④ COMT抑制剂在动物和人体的研究中对认知的影响[30]。
阿尔茨海默症患者与COMT的生物学功能相 关。很多证据显示多巴胺的作用可能影响阿尔茨海默症[33]。如,阿尔茨海默症患者尿中多巴胺的水平比正常人低。阿尔茨海默症患者改变了依赖多巴胺机制,并且这种机制调整了长期类似抑郁的适应证。多巴胺和乙酰胆碱具有函数关系,并且在阿尔茨海默症患者大脑中多巴胺调节类胆碱皮质应激性[34]。从遗传学角度,多巴胺受体和多巴胺转运体在精神行为症状中有重要作用。作为抗阿尔茨海默症药物应用多巴胺D2受体的激动剂美金刚胺,表明多巴胺功能的重要性[35]。美金刚胺会增加小鼠前额皮质和纹状体多巴胺的释放及抑制黑质多巴胺神经元中ATP依赖的K+离子传导[36]。
除了儿茶酚神经递质之外,还有COMT生理学底物包括儿茶酚雌激素,是细胞色素P450调控的代谢17-β-雌二醇的产物[37]。研究发现在人体内实验中COMT rs4680多态性能够调节雌激素的水平,因此增加了雌激素依赖性的风险情况如乳腺癌、前列腺癌和骨质疏松症[38]。雌激素的代谢与AD病理学有很大的相关性。17β-雌二醇在不同的路径中使tau的碳酸化作用变弱,然而在海马体中长期的作用会增强依赖apoE的方法。雌激素增加β-淀粉样蛋白前体蛋白在细胞内的移动,并且在体外始终抑制β-淀粉样蛋白纤维的形成[39]。在AD患者β-淀粉样肽存在于线粒体中,能够加强活性氧的形成同时充当了破坏性分子和信号分子,导致神经元细胞的凋亡。然而,年轻女性的线粒体可以防止β-淀粉样蛋白的毒性,生成少量的活性氧,并且释放比男性更少的凋亡信号。随着女性年纪增长,这种作用连同雌激素的保护作用又逐渐消失。雌激素正调节脑啡肽酶的表达以此 来促进β-淀粉样酶的降解[40]。从基因上看,雌激素被作为AD治疗方案被提出。目前能够知道的是在绝经期左右可能有一个“关键时期”,这个时期雌激素作为处方治疗可能减少AD在晚年的发生风险[41]。这种影响可能对49岁以下的女性更重要。此外,雌激素作为处方之后可能会出现不良反应,特别是对于60~65岁的女性患者[42]。
一些个案研究报告指出AD,患者与非精神错乱的人相比血液中维他命B12更低并且同型半胱氨酸 的水平更高[43]。如今,依靠长期研究证明血清同型半胱氨酸升高是AD发生的危险因素。当确证AD后,高同型半胱氨酸血症与认知减退和抑郁症具有相关 性[44]。尤其是COMT基因对血浆同型半胱氨酸的水平有影响。具有等位基因Val的个体其同型半胱氨酸水平明显高于met/met纯合体的个体[45]。
3.4 COMT与帕金森病帕金森病是第2类常见的神经退行性疾病,影 响工业化国家大约0.3% 的人口,仅次于阿尔茨海默症[46]。通常帕金森病被定义为运动障碍症,像震颤、刚性、动作迟缓、姿势不稳定综合征[47]。然而,认知障碍也是其重要的临床症状[48]。所有的症状是由于黑质区域细胞死亡导致的多巴胺分泌蛋白活性的下降造成的。因此,多巴胺水平异常导致患者行动能力受到阻碍[49,50]。
尽管帕金森病的具体原因仍不清楚,但是帕金森病的病因可能是基因和环境因素导致[51]。研究显示,泛素羧基末端水解酶L1 (UCHL1)、突触核蛋白 (SNCA)、parkin (PARK2)、PTEN-induced putative kinase 1 (PINK1)、DJ-1 (PARK7) 和Leucine-rich repeat kinase 2 (LRRK2) 及Tau A0等位基因可能与帕金森病有关[50, 52]。
左旋多巴是帕金森疾病最有效的治疗药物,其代谢过程如图 5所示,但是在某些情况下其他的药 物,如单胺氧化酶B抑制剂、金刚烷胺、抗胆碱能药物和多巴胺激动剂能够避免左旋多巴相关的运动并发症。通过左旋多巴服用的剂量改变可能缓解运动 波动,或是通过与其他药物合用,如COMT抑制剂或多巴胺受体激动剂[53]。由于多巴胺转运体在皮质层区很少,事实上细胞外多巴胺水平产生的影响很小,COMT可能在多巴胺信号传导上起重要作用。研究显示COMT多态性对帕金森疾病的易感性没有影响[50]。
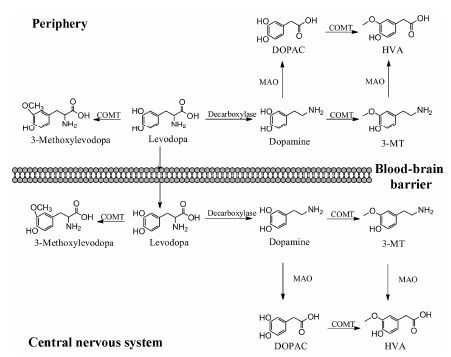
|
图 5 左旋多巴代谢过程 |
COMT的活性与疼痛相关的原因有两个,首先COMT是调节儿茶酚胺的酶之一,特别是在大脑区域和周边组织。此外儿茶酚胺在多个途径影响疼痛的感知。其次,化合物抑制COMT活性可能由于本身引起,例如可能抑制氧化应激[54,55,56,57]。
在人体大脑中,突触后神经元和神经胶质细胞有COMT,但是突触前多巴胺能神经元没有COMT。多巴胺需要转运才能够被这些神经细胞吸收。大脑纹状体中,多巴胺信号的终止主要依靠多巴胺转运蛋白[58]。相比之下,在多巴胺转运蛋白密度低的大脑区域,例如在脑前额皮质中,多巴胺是由COMT代谢并且由去甲肾上腺素转运体吸收从而调节多巴胺能神经传导。
COMT活性也可能由于大脑的故障或者损伤发 生改变。很多大脑损伤包括毒性、物理损伤、或是局部缺血的损伤部位已被证实其COMT的活性增强[59]。COMT活性增强的原因可能是因为COMT的激活和转移,包括小胶质细胞的损伤区域。大脑由于外部原因的损伤和局部缺血可导致疼痛[60]。疼痛也是很多神经退行性疾病的常见症状,例如帕金森病和多发性硬化。大脑损伤部位COMT活性增强和中枢性疼痛症状出现的原因尚不明确[61]。COMT缺失的动物表现出健康和正常运动技能的状态。然而,COMT缺失的小鼠出现很多特殊的变化,具有攻击性、焦虑行为、和对记忆储存能力和声音惊跳反应压力敏感性[62]。
在人痛觉研究中,COMT活性低与痛觉敏感增 强相关,并且COMT抑制剂在动物研究中能够使动物对热和机械性疼痛敏感。COMT活性低的单倍基因型,而不是单个单基因位点,与人体疼痛相关。在临床慢性疼痛中,COMT多态性的影响依赖于疼痛的类别。与其他慢性疼痛情况不同,COMT活性不会影响神经性和癌痛的疼痛敏感。荟萃分析的结果显示rs4680只与纤维肌痛或者慢性广泛疼痛显著相关,但是与偏头痛或者慢性肌肉骨骼疼痛情况无关。然而,COMT活性低可能增强阿片类物质阵痛和加剧不良反应,至少在很多癌痛中如此。在脊髓和大脑中的COMT水平降低甚至在某些情况下可能有镇痛作用,这一假说在神经病动物模型中硝替卡朋作为止痛剂得到支持[63]。
3.6 COMT与精神分裂症精神分裂症是一种严重的精神疾病,在男性和女性中都可能出现,发病率大约为1%。已经发现很多罹患精神分裂症风险相关的因素。一般来说,精神分裂症被认为是多因素导致的复杂病症[64, 65]。
几个连锁分析都证实COMT基因是精神分裂症的易感基因,同时另外两份荟萃分析也证实COMT与精神分裂症相关。患腭心面综合征的患者更容易患精神失常,特别是精神分裂症。如上文所述,COMT缺失使多巴胺等神经儿茶酚胺类化合物过多,导致出现持续顽固的认知过程,诊断出精神分裂的几率更大[13]。
COMT作为精神分裂症的候选基因引起关注是因为精神分裂症与多巴胺系统和前额皮质的功能紊乱有关。而COMT对多巴胺系统和前额皮质都具有很重要的作用。前额皮质层内多巴胺不足导致这一区域的认知工作异常。在临床中发现前额皮质层多巴胺的水平和记忆工作之间直接相关。D1受体信号缺失直接导致认知障碍。而且,记忆工作的缺失可以通过改善D1受体信号的刺激来治疗。这可能作为一个独特方式用于治疗精神分裂症患者的认知障碍[66]。
3.7 COMT与其他相关疾病 3.7.1 高同型半胱氨酸血症同型半胱氨酸是由S- adenosyl-homocysteine (SAH) 转换的,如果SAH大量积累,则COMT活性受到抑制,儿茶酚化合物的羟基甲基化和化合物的失活会减少。活性高的COMT会使用SAM的甲基作为供体生成SAH。SAH迅速转换成同型半胱氨酸后造成高同型半胱氨酸血症[67]。
3.7.2 先兆子痫先兆子痫和COMT的关系尚不明确,但已有研究[68]表明,当胎盘中的COMT活性变低或者COMT数量变少时会引起严重的先兆子痫。
4 总结与展望COMT作为人体二相代谢酶,其代谢的底物是外源或者内源的儿茶酚类化合物。通过代谢这些儿茶 酚类化合物,清除毒性化合物和代谢产物。与COMT相关的疾病主要是由于COMT活性变化引起的代谢产物增加或减少,使得代谢产物增加或者底物增加引起的毒性或者代谢调控紊乱。由于COMT具有代谢儿茶酚类化合物的作用,通过增加或抑制COMT活性,清除儿茶酚化合物及其产物的毒性或者使化合物代谢延缓,达到治疗病症的效果。目前还没有COMT激动剂的报道,COMT抑制剂作为帕金森病的辅助用药已经得到广泛的认证,并且左旋多巴在与COMT抑制剂和单胺氧化酶B (MAOB) 抑制剂合用时,能够延长和增强药效。并且有报道称COMT抑制剂可用于精神失常疾病,如精神分裂症的治疗,但是并没有足够的药理学数据支持COMT抑制剂用于精神疾病的临床治疗。
目前,文献报道COMT以及COMT代谢产物能够作为一些疾病的标志物,如嗜铬细胞瘤、情绪相关疾病[69,70]。另有文献[71]报道,检测尿液中的COMT能够作为罹患膀胱癌的标志物之一。由于COMT是管家基因[72],并且COMT是胞内蛋白,对COMT研究不仅仅在于抑制剂治疗神经性疾病的作用,除此之外COMT作为疾病标志物的研究也具有重要意义。
| [1] | Axelrod J, Senoh S,Witkop B. O-Methylation of catechol amines in vivo[J]. J Biol Chem, 1958, 233:697-701. |
| [2] | Axelrod J, Tomchick R. Enzymatic O-methylation of epinephrine and other catechols[J]. J Biol Chem, 1958, 233:702-705. |
| [3] | Grossman MH, Emanuel BS, Budarf ML. Chromosomal mapping of the human catechol-O-methyltransferase gene to 22q11.1→q11.2[J]. Genomics, 1992, 12:822-825. |
| [4] | Lundstrom K, Tenhunen J, Tilgmann C, et al. Cloning, expression and structure of catechol-O-methyltransferase[J]. Biochim Biophys Acta, 1995, 1251:1-10. |
| [5] | Tenhunen J, Ulmanen I. Production of rat soluble and membrane-bound catechol O-methyltransferase forms from bifunctional mRNAs[J]. Biochem J, 1993, 296(Pt 3):595-600. |
| [6] | Tenhunen J, Salminen M, Lundstrom K, et al. Genomic organization of the human catechol O-methyltransferase gene and its expression from two distinct promoters[J]. Eur J Biochem, 1994, 223:1049-1059. |
| [7] | Guldberg HC, Marsden CA. Catechol-O-methyl transferase:pharmacological aspects and physiological role[J]. Pharmacol Rev, 1975, 27:135-206. |
| [8] | Roth JA. Membrane-bound catechol-O-methyltransferase:a reevaluation of its role in the O-methylation of the catecholamine neurotransmitters[J]. Rev Physiol Biochem Pharmacol, 1992, 120:1-29. |
| [9] | Ellingson T, Duddempudi S, Greenberg BD, et al. Determination of differential activities of soluble and membrane-bound catechol-O-methyltransferase in tissues and erythrocytes[J]. J Chromatogr B Biomed Sci Appl, 1999, 729:347-353. |
| [10] | Soares-da-Silva P, Fernandes MH, Pinto-do OP. Cell inward transport of L-DOPA and 3-O-methyl-L-DOPA in rat renal tubules[J]. Br J Pharmacol, 1994, 112:611-615. |
| [11] | Hansell P, Odlind C, Mannisto PT. Different renal effects of two inhibitors of catechol-O-methylation in the rat:entacapone and CGP 28014[J]. Acta Physiol Scand, 1998, 162:489-494. |
| [12] | Bidart JM, Motte P, Assicot M, et al. Catechol-O-methyltransferase activity and aminergic binding sites distribution in human peripheral blood lymphocyte subpopulations[J]. Clin Immunol Immunopathol, 1983, 26:1-9. |
| [13] | Tunbridge EM, Harrison PJ, Weinberger DR. Catechol-Omethyltransferase, cognition, and psychosis:Val158Met and beyond[J]. Biol Psychiatry, 2006, 60:141-151. |
| [14] | Karhunen T, Tilgmann C, Ulmanen I, et al. Distribution of catechol-O-methyltransferase enzyme in rat tissues[J]. J Histochem Cytochem, 1994, 42:1079-1090. |
| [15] | Mannisto PT, Ulmanen I, Lundstrom K, et al. Characteristics of catechol O-methyl-transferase (COMT) and properties of selective COMT inhibitors[J]. Prog Drug Res, 1992, 39:291-350. |
| [16] | Lotta T, Vidgren J, Tilgmann C, et al. Kinetics of human soluble and membrane-bound catechol O-methyltransferase:a revised mechanism and description of the thermolabile variant of the enzyme[J]. Biochemistry, 1995, 34:4202-4210. |
| [17] | Kiss LE, Soares-da-Silva P. Medicinal chemistry of catechol O-methyltransferase (COMT) inhibitors and their therapeutic utility[J]. J Med Chem, 2014, 57:8692-8717. |
| [18] | Ehler A, Benz J, Schlatter D, et al. Mapping the conformational space accessible to catechol-O-methyltransferase[J]. Acta Crystallogr D Biol Crystallogr, 2014, 70:2163-2174. |
| [19] | Saito S, Iida A, Sekine A, et al. Identification of 197 genetic variations in six human methyltranferase genes in the Japanese population[J]. J Hum Genet, 2001, 46:529-537. |
| [20] | Ji J, Tsuk S, Salapatek AM, et al. The 25-kDa synaptosomeassociated protein (SNAP-25) binds and inhibits delayed rectifier potassium channels in secretory cells[J]. J Biol Chem, 2002, 277:20195-20204. |
| [21] | Ball P, Knuppen R. Catecholoestrogens (2-and 4-hydroxyoestrogens):chemistry, biogenesis, metabolism, occurrence and physiological significance[J]. Acta Endocrinol Suppl (Copenh), 1980, 232:1-127. |
| [22] | Mannisto PT, Kaakkola S. Catechol-O-methyltransferase (COMT):biochemistry, molecular biology, pharmacology, and clinical efficacy of the new selective COMT inhibitors[J]. Pharmacol Rev, 1999, 51:593-628. |
| [23] | Lee E, Cho S, Kim K, et al. An integrated approach to infer causal associations among gene expression, genotype variation, and disease[J]. Genomics, 2009, 94:269-277. |
| [24] | Drew LJ, Crabtree GW, Markx S, et al. The 22q11.2 microdeletion:fifteen years of insights into the genetic and neural complexity of psychiatric disorders[J]. Int J Dev Neurosci, 2011, 29:259-281. |
| [25] | Yavich L, Forsberg MM, Karayiorgou M, et al. Site-specific role of catechol-O-methyltransferase in dopamine overflow within prefrontal cortex and dorsal striatum[J]. J Neurosci, 2007, 27:10196-10209. |
| [26] | Dickinson D, Elvevag B. Genes, cognition and brain through a COMT lens[J]. Neuroscience, 2009, 164:72-87. |
| [27] | Meyer-Lindenberg A, Weinberger DR. Intermediate phenoltypes and genetic mechanisms of psychiatric disorders[J]. Nat Rev Neurosci, 2006, 7:818-827. |
| [28] | Qin X, Peng Q, Qin A, et al. Association of COMT Val158Met polymorphism and breast cancer risk:an updated meta-analysis[J]. Diagn Pathol, 2012, 7:136. |
| [29] | Cavalieri EL, Rogan EG. Unbalanced metabolism of endogenous estrogens in the etiology and prevention of human cancer[J]. J Steroid Biochem Mol Biol, 2011, 125:169-180. |
| [30] | Serretti A, Olgiati P. Catechol-O-methyltransferase and Alzheimer's disease:a review of biological and genetic findings[J]. CNS Neurol Disord Drug Targets, 2012, 11:299-305. |
| [31] | Birks J. Cholinesterase inhibitors for Alzheimer's disease[J].Cochrane Database Syst Rev, 2006, 25:CD005593. |
| [32] | Raina P, Santaguida P, Ismaila A, et al. Effectiveness of cholinesterase inhibitors and memantine for treating dementia:evidence review for a clinical practice guideline[J]. Ann Intern Med, 2008, 148:379-397. |
| [33] | Perez-Madrinan G, Cook SE, Saxton JA, et al. Alzheimer disease with psychosis:excess cognitive impairment is restricted to the misidentification subtype[J]. Am J Geriatr Psychiatry, 2004, 12:449-456. |
| [34] | Ballard C, Creese B, Corbett A, et al. Atypical antipsychotics for the treatment of behavioral and psychological symptoms in dementia, with a particular focus on longer term outcomes and mortality[J]. Expert Opin Drug Saf, 2011, 10:35-43. |
| [35] | Pritchard AL, Pritchard CW, Bentham P, et al. Investigation of the role of the dopamine transporter in susceptibility to behavioural and psychological symptoms of patients with probable Alzheimer's disease[J]. Dement Geriatr Cogn Disord, 2008, 26:257-260. |
| [36] | Seeman P, Caruso C, Lasaga M. Memantine agonist action at dopamine D2 High receptors[J]. Synapse, 2008, 62:149-153. |
| [37] | Giustizieri M, Cucchiaroni ML, Guatteo E, et al. Memantine inhibits ATP-dependent K+ conductances in dopamine neurons of the rat substantia nigra pars compacta[J]. J Pharmacol Exp Ther, 2007, 322:721-729. |
| [38] | Worda C, Sator MO, Schneeberger C, et al. Influence of the catechol-O-methyltransferase (COMT) codon 158 polymorphism on estrogen levels in women[J]. Hum Reprod, 2003, 18:262-266. |
| [39] | Morinaga A, Hirohata M, Ono K, et al. Estrogen has antiamyloidogenic effects on Alzheimer's β-amyloid fibrils in vitro[J]. Biochem Biophys Res Commun, 2007, 359:697-702. |
| [40] | Liang K, Yang L, Yin C, et al. Estrogen stimulates degradation of β-amyloid peptide by up-regulating neprilysin[J]. J Biol Chem, 2010, 285:935-942. |
| [41] | Porrello E, Monti MC, Sinforiani E, et al. Estrogen receptor α and APOEε4 polymorphisms interact to increase risk for sporadic AD in Italian females[J]. Eur J Neurol, 2006, 13:639-644. |
| [42] | Craig MC, Murphy DG. Estrogen therapy and Alzheimer's dementia[J]. Ann N Y Acad Sci, 2010, 1205:245-253. |
| [43] | McCaddon A, Davies G, Hudson P, et al. Total serum homocysteine in senile dementia of Alzheimer type[J]. Int J Geriatr Psychiatry, 1998, 13:235-239. |
| [44] | Chen CS, Chou MC, Yeh YC, et al. Plasma homocysteine levels and major depressive disorders in Alzheimer disease[J]. Am J Geriatr Psychiatry, 2010, 18:1045-1048. |
| [45] | Tunbridge EM, Harrison PJ, Warden DR, et al. Polymorphisms in the catechol-O-methyltransferase (COMT) gene influence plasma total homocysteine levels[J]. Am J Med Genet B Neuropsychiatr Genet, 2008, 147B:996-999. |
| [46] | de Lau LM, Breteler MM. Epidemiology of Parkinson's disease[J]. Lancet Neurol, 2006, 5:525-535. |
| [47] | Gibb WR, Lees AJ. The relevance of the Lewy body to the pathogenesis of idiopathic Parkinson's disease[J]. J Neurol Neurosurg Psychiatry, 1988, 51:745-752. |
| [48] | Foltynie T, Goldberg TE, Lewis SG, et al. Planning ability in Parkinson's disease is influenced by the COMT val158met polymorphism[J]. Mov Disord, 2004, 19:885-891. |
| [49] | Cheshire P, Bertram K, Ling H, et al. Influence of single nucleotide polymorphisms in COMT, MAO-A and BDNF genes on dyskinesias and levodopa use in Parkinson's disease[J]. Neurodegener Dis, 2014, 13:24-28. |
| [50] | Wang Y, Yang X. Association of catechol-O-methyltransferase polymorphism (Val108/158Met) with Parkinson's disease:a meta-analysis[J]. J Mot Behav, 2012, 44:365-372. |
| [51] | Maraganore DM, Lesnick TG, Elbaz A, et al. UCHL1 is a Parkinson's disease susceptibility gene[J]. Ann Neurol, 2004, 55:512-521. |
| [52] | Lesage S, Brice A. Parkinson's disease:from monogenic forms to genetic susceptibility factors[J]. Hum Mol Genet, 2009, 18:R48-59. |
| [53] | Connolly BS, Lang AE. Pharmacological treatment of Parkinson disease:a review[J]. JAMA, 2014, 311:1670-1683. |
| [54] | Kambur O, Mannisto PT. Catechol-O-methyltransferase and pain[J]. Int Rev Neurobiol, 2010, 95:227-279. |
| [55] | Kambur O, Mannisto PT, Viljakka K, et al. Stress-induced analgesia and morphine responses are changed in catechol-O-methyltransferase-deficient male mice[J]. Basic Clin Pharmacol Toxicol, 2008, 103:367-373. |
| [56] | Davis WM, Hatoum NS, Khalsa JH. Toxic interaction between narcotic analgesics and inhibitors of catechol-Omethyltransferase[J]. Toxicology, 1979, 14:217-227. |
| [57] | Kambur O, Talka R, Ansah OB, et al. Inhibitors of catechol-Omethyltransferase sensitize mice to pain[J]. Br J Pharmacol, 2010, 161:1553-1565. |
| [58] | Moron JA, Brockington A, Wise RA, et al. Dopamine uptake through the norepinephrine transporter in brain regions with low levels of the dopamine transporter:evidence from knockout mouse lines[J]. J Neurosci, 2002, 22:389-395. |
| [59] | Helkamaa T, Reenila I, Tuominen RK, et al. Increased catechol-O-methyltransferase activity and protein expression in OX-42-positive cells in the substantia nigra after lipopolysaccharide microinfusion[J]. Neurochem Int, 2007, 51:412-423. |
| [60] | Redell JB, Dash PK. Traumatic brain injury stimulates hippocampal catechol-O-methyl transferase expression in microglia[J]. Neurosci Lett, 2007, 413:36-41. |
| [61] | Tinazzi M, Del Vesco C, Defazio G, et al. Abnormal processing of the nociceptive input in Parkinson's disease:a study with CO2 laser evoked potentials[J]. Pain, 2008, 136:117-124. |
| [62] | Papaleo F, Crawley JN, Song J, et al. Genetic dissection of the role of catechol-O-methyltransferase in cognition and stress reactivity in mice[J]. J Neurosci, 2008, 28:8709-8723. |
| [63] | Tammimaki A, Mannisto PT. Catechol-O-methyltransferase gene polymorphism and chronic human pain:a systematic review and meta-analysis[J]. Pharmacogenet Genomics, 2012, 22:673-691. |
| [64] | Lang UE, Puls I, Muller DJ, et al. Molecular mechanisms of schizophrenia[J]. Cell Physiol Biochem, 2007, 20:687-702. |
| [65] | Meyer-Lindenberg A. Imaging genetics of schizophrenia[J]. Dialogues Clin Neurosci, 2010, 12:449-456. |
| [66] | Goldman-Rakic PS, Castner SA, Svensson TH, et al. Targeting the dopamine D1 receptor in schizophrenia:insights for cognitive dysfunction[J]. Psychopharmacology (Berl), 2004, 174:3-16. |
| [67] | Zoccolella S, Lamberti P, Iliceto G, et al. Plasma homocysteine levels in L-dopa-treated Parkinson's disease patients with cognitive dysfunctions[J]. Clin Chem Lab Med, 2005, 43:1107-1110. |
| [68] | Shenoy V, Kanasaki K, Kalluri R. Pre-eclampsia:connecting angiogenic and metabolic pathways[J]. Trends Endocrinol Metab, 2010, 21:529-536. |
| [69] | Eisenhofer G, Keiser H, Friberg P, et al. Plasma metanephrines are markers of pheochromocytoma produced by catechol-O-methyltransferase within tumors[J]. J Clin Endocrinol Metab, 1998, 83:2175-2185. |
| [70] | Kramer UM, Cunillera T, Camara E, et al. The impact of catechol-O-methyltransferase and dopamine D4 receptor genotypes on neurophysiological markers of performance monitoring[J]. J Neurosci, 2007, 27:14190-14198. |
| [71] | Iwaki H, Kageyama S, Isono T, et al. Diagnostic potential in bladder cancer of a panel of tumor markers (calreticulin, gamma-synuclein, and catechol-O-methyltransferase) identified by proteomic analysis[J]. Cancer Sci, 2004, 95:955-961. |
| [72] | Eisenberg E, Levanon EY. Human housekeeping genes, revisited[J]. Trends Genet, 2013, 29:569-574. |
 2016, Vol. 51
2016, Vol. 51


