2. 中国科学院上海药物研究所, 上海 201210;
3. 吉林大学生命科学学院, 吉林长春 130012
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201210, China;
3. School of Life Sciences, Jilin University, Changchun 130012, China
环糊精 (cyclodextrins,CDs) 是由吡喃葡萄糖通过1,4糖苷键连接而成的环状低聚物,天然的CDs是由6、7、8个吡喃葡萄糖单元组成,分别为α、β、γ-CD。CDs具有外亲水、内疏水和特殊空腔的结构特征,其分子内部空腔可以与多种客分子形成包合物,改善客分子的水溶性[1]、稳定性[2]和口感[3]等。“包合”即是CDs与客分子发生超分子作用,使客分子全部或部分进入CDs空腔内[4]。CDs因其毒副作用小、生物相容性好和生物降解性好的优点而广泛应用于制剂领域,基于CDs构筑的超分子 (supramolecule) 自组装体系得到广泛的研究[5,6,7]。与油类成分接触时,CDs可以在油/水界面与油分子自组装形成两亲性超分子,这种超分子具有表面活性作用,可以显著降低油/水界面张力[8]。CDs与油自组装形成的微粒分布在油滴表面,具有稳定乳剂的作用[9,10]。通常将固体微粒发挥稳定作用的乳剂称为皮克林乳(Pickering emulsions)。因此,CDs分子与油自组装介导的乳剂可被界定为一种Pickering乳。与表面活性剂稳定的乳剂相比,Pickering乳具有以下特点: ① 乳剂的稳定性受pH、盐和温度的影响较小,提高了乳剂的稳定性; ② 没有表面活性剂带来的环境污染及毒性问题; ③ 降低了乳剂的起泡性,具有较高的黏稠度。由于界面微粒膜的存 在,Pickering乳在载药、药物缓释[11,12]和模板法制备功能性材料[13]等药物制剂领域具有良好的应用前景。与其他植物油相比,中链甘油三酯 (medium chain triglyceride,MCT) 的氧化稳定性好,可以提高药物的稳定性和口感,是一种常用的食品添加剂[14]。本研究以MCT为油相,以α-CD为主要辅料制备Pickering乳,探讨α-CD/MCT/水体系Pickering乳的形成机制与乳剂稳定性。
材料与方法 材料与试剂α-CD (食品级,纯度100.1%,瓦克化学有限公司); MCT (药辅级,纯度99.8%,江西省吉水县康民本草药用油提炼厂); 去离子水、正己烷、冰醋酸、异丙醇、甲醇 (国药集团化学试剂有限公司)。其他化学试剂均为分析纯。
实验仪器T25可调高速分散机 (IKA); SL200KS静态界面张力仪 (Solon公司); D8 Advance X-射线衍射仪 (Bruker公司); S4800扫描电子显微镜、S-3400N冷冻扫描电镜 (Hitachi公司); Agilent 1260高效液相色谱仪 (安捷伦科技有限公司); Ni-U微分干涉显微镜、TS-100F倒置相差显微镜 (Nikon公司); MS 3000激光粒度分析仪 (Malvern公司); LVDV-III流变仪 (Brookfield公司); MICRO 21R离心机 (Thermo Scientific公司); DZF-6050真空干燥箱 (上海一恒科技有限公司)。
MCT乳剂的制备将处方量CDs溶解于70 ℃去离子水中,然后将溶液冷却至室温作为连续相。将MCT加入25 ℃的连续相中,使用可调高速分散机,以12 000 r·min−1转速将混合物乳化3 min (表 1)。
|
|
Table 1 Formulations design of Pickering emulsions prepared with medium chain triglyceride (MCT) and different cyclodextrins (CDs) |
采用SL200KS静态界面张力仪,悬滴法测定油/水界面张力 (图 1)。MCT/α-CD (18 mg·mL−1)/水和MCT/水的界面张力通过轴对称滴形分析法得出[15]。
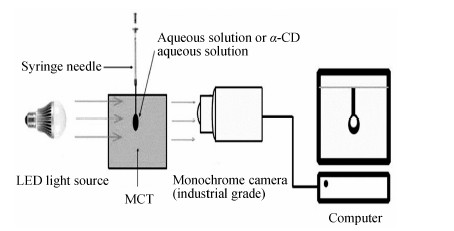 | Figure 1 Schematics of the set up for measuring the surface tension |
α-CD近饱和水溶液 (140 mg·mL−1) 200 mL中加入3% (w/v) MCT,使用可调高速分散机,以15 000 r·min−1转速将混合物均质5 min。将混合物离心 (10 000 r·min−1,10 min) 后弃上清液。获得的沉淀用石油醚洗涤3次,每次 20 mL,最后于真空干燥箱干燥 (40 ℃,12 h),即得MCT/α-CD固体微粒。
粉末X-射线衍射 (X-ray diffraction,XRD) 分析采用D8 Advance X-射线衍射仪对MCT/α-CD固体微粒进行分析。扫描类型为Locked Coupled; 扫描速度为0.1 s·step−1,数据点间隔为0.02°; 测试条件 为管电压40 kV,管电流40 mA,扫描角度 (2θ) 范围3°~40°。
MCT/α-CD固体微粒中MCT与α-CD质量比的测定将一定量MCT/α-CD固体微粒用正己烷配成合适的浓度后,超声30 min,水浴60 ℃加热30 min,循环超声加热各3次,运用高效液相色谱法 (high performance liquid chromatography,HPLC) 测定固 体微粒中α-CD和MCT的含量。采用HPLC-RID (refractive index detector) 测定α-CD的含量,HPLC- ELSD (evaporative light-scattering detector) 测定MCT的含量。α-CD测定色谱条件: 色谱柱为Apollo C18柱(150 mm × 4.6 mm,5 μm); 检测器: RID; 流动相: 甲醇−水(7∶93); 流速: 1.0 mL·min−1; 柱温: 40 ℃; 进样量: 50 μL。MCT测定色谱条件: 色谱柱为Luna Silica (2) 100 Å (150 mm × 4.6 mm,5 μm); 检测器: ELSD; 流动相: (正己烷−冰醋酸)−异丙醇 = (99.1∶0.1)∶0.8; 流速: 1.0 mL·min−1; 漂移管温度: 50 ℃; 进样量: 10 μL。
光学显微镜观察取乳剂适量置于载玻片上,采用TS-100F倒置相差显微镜观察乳滴形态; 采用Ni-U微分干涉显微镜 (differential interference microscopy,DIM) 观察乳滴表面形态。
电子显微镜观察取MCT/α-CD固体微粒适量置于样品台,制样后采用S4800扫描电子显微镜 (scanning electron microscope,SEM) 观察固体微粒形态。采用配备有PP2010冷冻传输系统附件 (Quorum) 的S-3400N冷冻扫描电镜 (Cryo-scanning electron microscope,Cryo-SEM) 对经冷冻切片后乳剂样品的乳滴横切面结构进行观察。
接触角 (θow) 测定固体微粒在油/水界面的接触角根据文献[16]的方法进行测定。将80 mg固体微粒压制成圆形片 (直径为1.0 cm,厚度为3.0 mm),放置于底面积为4.0 cm2的敞口透明玻璃容器底部。用注射器滴加4 μL去离子水到圆形片表面,再加入MCT溶液1.5 mL。记录水滴在圆形片的形态照片,运用Image Pro Plus 6.0软件分析水滴最终的平衡形状得出固体微粒的接触角[17]。
粒径分布取乳剂适量,采用MS 3000激光粒度分析仪在转速为2 000 r·min−1条件下同时测定乳滴和连续相中多余固体微粒的粒径及其分布。
黏度测定采用LVDV-III流变仪测定乳剂的黏度。在25 ℃下,选择18号转子,转速为50 r·min−1。每个样品平行测定3次,每次测定前样品需振摇均匀。
稳定性乳剂分层过程的快慢是评价乳剂稳定性的重要指标[18]。乳剂制备后立即取10 mL置于10 mL具塞量筒中。乳剂沉降后分为两层: 上层“乳层”和下层“水层”,沉降体积比 (H) 依据下列公式计算:
| $H = \frac{{{H_c}}}{{{H_e}}} $ | (1) |
Hc为沉降后乳层高度,He为沉降前全乳高度。记录30天内Hc的刻度值。
乳剂制备后,某些乳剂的沉降现象较快,沉降行为发生在几分钟内。因此,采用基于图像分析的沉降动力学表征方法自动监测了乳剂60 min内的沉降曲线。
结果与讨论 1 α-CD 和MCT在油/水界面的自组装当MCT滴加到CDs水溶液时,静置,α-CD/MCT/ 水体系肉眼即可观察到油/水界面生成了白色固体层,而β-CD/MCT/水和γ-CD/MCT/水体系均无明显此现象。乳化后,β-CD/MCT/水和γ-CD/MCT/水体系均有明显的多余油滴挂壁现象。因此α-CD/MCT/水体系乳化效果较好。分别测定α-CD水溶液 (18 mg·mL−1) 和水与MCT的界面张力。水与MCT的界面张力为 (8.751 ± 0.015) mN·m−1,当水中含α-CD时,油/水界面张力降低为 (6.128 ± 0.000) mN·m−1。天然的CDs没有表面活性[19]。CDs分子内部疏水性空腔与油分子形成主−客分子包合物的过程中,油分子与水相中的CDs可能在油/水界面自组装形成具有两亲性的类表面活性剂物质,导致油/水界面张力降低,从而稳定乳剂。
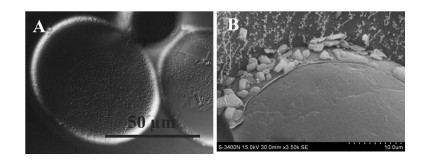
2 MCT/α-CD固体微粒的本质和微观形态MCT/α-CD固体微粒的结晶性通过XRD分析 (图 2) 可见,天然α-CD的部分结晶衍射峰被掩盖或消失,提示固体微粒是由α-CD与MCT发生部分包合作用形成。对固体微粒中α-CD与MCT的含量分别进行测定,结果表明固体微粒中α-CD与MCT的质量比为7∶1。经换算得到,固体微粒中两者的化学计量比为α-CD4.0MCT1。结果提示,每一个MCT分子可与多个α-CD分子进行自组装。自组装生成的两亲性超分子在油/水界面进一步聚集形成稳定Pickering乳的固体微粒。采用SEM观察可见,MCT/α-CD固体微粒 (图 3) 的形态呈“长棒状”,尺寸小于10 µm,与Mathapa等[20, 21]报道的α-CD/十四烷/水体系一致。
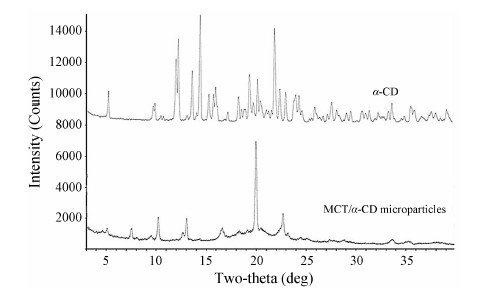 | Figure 2 Powder X-ray diffraction patterns of MCT/α-CD microparticles and α-CD |
 | Figure 3 SEM images of MCT/α-CD microparticles |
为了更直观地观察MCT/α-CD固体微粒在乳滴中的分布状况,分别使用DIM和Cryo-SEM对乳滴的表面和横切面进行观察。DIM显示(图 4A),乳滴表面凹凸不平、粗糙,提示乳滴表面可能存在固体微粒。采用Cryo-SEM进一步观察油/水界面的微观结构 (图 4B),MCT/α-CD固体微粒散在分布于乳滴表面形成微粒膜,并且尺寸与SEM的观察结果一致。
 | Figure 4 DIM image of the surface of emulsion droplet (NIKON *100,50 μm) (A),Cryo-SEM image of the distribution of MCT/α-CD microparticles at the oil/water interface (B) |
Mathapa等[20]的研究结果也证明,十四烷/β-CD Pickering乳体系的固体微粒主要分布于油滴表面,形成致密的微粒膜,维持油滴分散。采用α-CD、大豆油和水3种材料制备的新型自组装载药系统小珠 (beads)[22],是一种内部为油性结构、外部被两亲性超分子包裹的球体[23, 24]。稳定Pickering乳的固体微粒不必在油/水界面形成致密的微粒膜,但微粒必须在界面形成膜状结构才能形成Pickering乳[25, 26]。
4 MCT/α-CD固体微粒的润湿性与乳剂类型Pickering乳的类型由分布在油/水界面的固体微粒的润湿性决定[27,28]。θow < 90°的固体微粒倾向于稳定O/W型乳剂,而θow > 90°的固体微粒倾向于稳定W/O型乳剂。实验测得MCT/α-CD固体微粒θow为 (46.1 ± 3.4)°,小于90°,因此MCT乳剂的类型为O/W型Pickering乳。
5 MCT/α-CD固体微粒与乳剂的稳定性 5.1 粒径分布考察α-CD含量对MCT Pickering乳粒径的影响发现 (图 5),随着α-CD含量的增加,乳滴粒径呈下降趋势,乳滴粒径与吸附到乳滴表面的固体微粒量呈负相关[29,30]; 结果也显示连续相中存在部分未吸附的固体微粒 (尺寸与SEM,Cryo-SEM结果一致),且未吸附的固体微粒量随着α-CD含量升高而增加。因此,体系中α-CD的含量越高,油/水界面自组装生成的固体微粒量越多,利于油水界面张力的降低,形成乳滴的粒径越小。
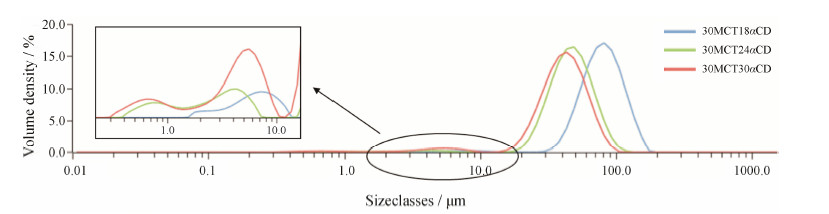 | Figure 5 Effects of α-CD content on the droplet size of MCT Pickering emulsions |
乳剂稳定性顺序 (图 6): 30MCT30αCD > 30MCT24αCD > 30MCT18αCD。根据Stokes定律,乳滴粒径越小,连续相黏度越大,乳剂越稳定。连续相中未吸附的固体微粒量越多,导致连续相黏度增加,进一步增加了Pickering乳的稳定性。实验测得乳剂黏度顺序为: 30MCT30αCD (6.58 mPa·s) > 30MCT24αCD (5.79 mPa·s) > 30MCT18αCD (5.71 mPa·s)。对室温放置12个月后的乳剂进行显微观察 (图 7),30MCT18αCD乳滴粒径明显变大,并有一定程度的破乳现象,在连续相中可以观察到明显固体微粒的存在; 而30MCT24αCD与30MCT30αCD处方乳滴形态保持完好,粒径无明显改变。乳滴表面吸附的固体微粒量越多,可以有效地阻止液滴之间相互靠近,减少了乳滴之间的聚集合并,从而提高了乳剂的稳定性; 连续相中部分未吸附的固体微粒在液滴空隙之间的存在会阻止液滴相互靠近和碰撞,在一定程度上也提高了乳剂的稳定性。
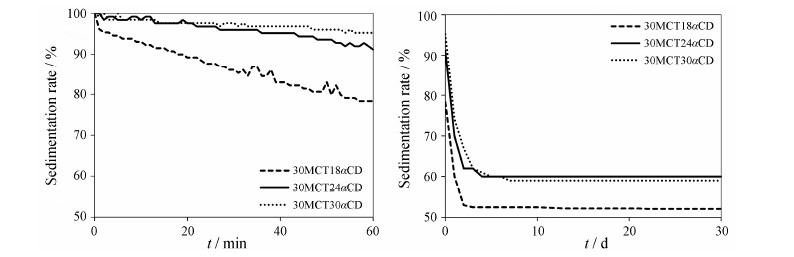 | Figure 6 Evaluation of the stability of MCT Pickering emulsions. Left: Automatic monitoring and quantitative characterization of sedimentation dynamics based on image profile analysis; Right: Observed by the naked eye |
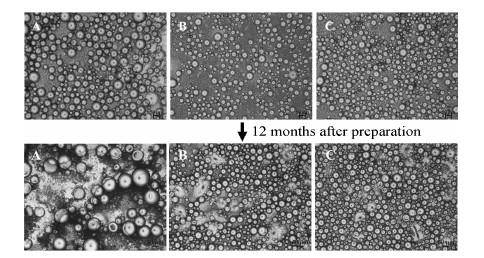 | Figure 7 Morphologies of MCT Pickering emulsions recorded by microscopy (NIKON *10,50 μm). A: 30MCT18αCD; B: 30MCT24αCD; C: 30MCT30αCD |
由MCT/α-CD分子自组装介导的Pickering乳的形成机制是: 在油/水界面,连续相中的α-CD分子与MCT自组装形成两亲性超分子,具有类似表面活性剂作用,可以降低油/水界面张力。在外力作用下,两亲性超分子自动聚集于油/水界面形成膜结构稳定乳剂。MCT/α-CD固体微粒θow小于90°,因此乳剂为O/W型Pickering乳。MCT/α-CD固体微粒与乳剂的稳定性关系是: 乳滴表面吸附的固体微粒越多,乳滴粒径越小,乳剂越稳定; 连续相中存在的多余固体微粒越多,连续相黏度越大,并在一定程度上阻止了液滴之间的聚集合并,使乳剂更稳定。
| [1] | Chen FW, Guo T, Li HY, et al. Preparation and characterization of dihydroartemisinin/hydroxypropyl-β-cyclodextrin inclusion complex[J]. Acta Pharm Sin (药学学报), 2012, 47:529-534. |
| [2] | Zeng J, Ren Y, Zhou CL, et al. Preparation and physicochemical characteristics of the complex of edaravone with hydroxypropyl-β-cyclodextrin[J]. Carbohydr Polym, 2011, 83:1101-1105. |
| [3] | Li X, Guo Z, Hao JB, et al. Synergetic taste masking of lipid coating and β-cyclodextrin inclusion[J]. Acta Pharm Sin (药学学报), 2014, 49:392-398. |
| [4] | Loftsson T, Duchêne D. Cyclodextrins and their pharmaceutical applications[J]. Int J Pharm, 2007, 329:1-11. |
| [5] | He YF, Fu P, Shen XH, et al. Cyclodextrin-based aggregates and characterization by microscopy[J]. Micron, 2008, 39:495-516. |
| [6] | Gao CZ, Zhang Y, Chen J, et al. Research progress of the drug delivery system of antitumor platinum drugs with macrocyclic compounds[J]. Acta Pharm Sin (药学学报), 2015, 50:650-657. |
| [7] | Guo M, Zhan MZ, Jiang YK. Investigation of properties of the resveratrol-β-cyclodextrin inclusion complex by drugprotein interaction spectra and molecular modeling[J]. Acta Pharm Sin (药学学报), 2014, 49:726-733. |
| [8] | Laza-Knoerr A, Huang N, Grossiord JL, et al. Interfacial rheology as a tool to study the potential of cyclodextrin polymers to stabilize oil-water interfaces[J]. J Incl Phenom Macrocycl Chem, 2011, 69:475-479. |
| [9] | Inoue M, Hashizaki K, Taguchi H, et al. Formation and characterization of emulsions using β-cyclodextrin as an emulsifier[J]. Chem Pharm Bull, 2008, 56:668-671. |
| [10] | Hashizaki K, Kageyama T, Inoue M, et al. Preparation and characterization of cycloalkanol/water emulsion using α-cyclodextrin as an emulsifier[J]. J Disper Sci Technol, 2009, 30:852-856. |
| [11] | Frelichowska J, Bolzinger MA, Pelletier J, et al. Topical delivery of lipophilic drugs from O/W Pickering emulsions[J]. Int J Pharm, 2009, 371:56-63. |
| [12] | Frelichowska J, Bolzinger MA, Valour JP, et al. Pickering W/O emulsions:drug release and topical delivery[J]. Int J Pharm, 2009, 368:7-15. |
| [13] | Mathapa BG, Paunov VN. Fabrication of novel cyclodextrinpolyallylamine hydrochloride co-polymeric microcapsules by templating oil-in-water emulsions[J]. Soft Matter, 2013, 9:4780-4788. |
| [14] | Bahal SM, Romansky JM, Alvarez FJ. Medium chain triglycerides as vehicle for palatable oral liquids[J]. Pharm Dev Technol, 2003, 8:111-115. |
| [15] | del Río OI, Neumann AW. Axisymmetric drop shape analysis:computational methods for the measurement of interfacial properties from the shape and dimensions of pendant and sessile drops[J]. J Colloid Interface Sci, 1997, 196:136-147. |
| [16] | Lan Q, Liu C, Yang F, et al. Synthesis of bilayer oleic acid-coated Fe3O4 nanoparticles and their application in pH-responsive Pickering emulsions[J]. J Colloid Interface Sci, 2007, 310:260-269. |
| [17] | Li X, Li HY, Xiao Q, et al. Two-way effects of surfactants on Pickering emulsions stabilized by the self-assembled microcrystals of α-cyclodextrin and oil[J]. Phys Chem Chem Phys, 2014, 16:14059-14069. |
| [18] | Kargar M, Fayazmanesh K, Alavi M, et al. Investigation into the potential ability of Pickering emulsions (food-grade particles) to enhance the oxidative stability of oil-in-water emulsions[J]. J Colloid Interface Sci, 2012, 366:209-215. |
| [19] | Saito Y, Watanabe K, Hashizaki K, et al. Determination of stability constants for alkanol/α-cyclodextrin inclusion complexes using the surface tension method[J]. J Incl Phenom Macrocycl Chem, 2000, 38:445-452. |
| [20] | Mathapa BG, Paunov VN. Cyclodextrin stabilised emulsions and cyclodextrinosomes[J]. Phys Chem Chem Phys, 2013, 15:17903-17914. |
| [21] | Mathapa BG, Paunov VN. Self-assembly of cyclodextrin-oil inclusion complexes at the oil-water interface:a route to surfactant-free emulsions[J]. J Mater Chem A, 2013, 1:10836-10846. |
| [22] | Liu C, Yi T. Research progress of self-assembled beads drug delivery system prepared from cyclodextrins and oils[J]. Acta Pharm Sin (药学学报), 2012, 47:1582-1586. |
| [23] | Bochot A, Trichard L, Le Bas G, et al. α-Cyclodextrin/oil beads:an innovative self-assembling system[J]. Int J Pharm, 2007, 339:121-129. |
| [24] | Hamoudi MC, Bourasset F, Domergue-Dupont V, et al. Formulations based on alpha cyclodextrin and soybean oil:an approach to modulate the oral release of lipophilic drugs[J]. J Control Release, 2012, 161:861-867. |
| [25] | Vignati E, Piazza R. Pickering emulsions:interfacial tension, colloidal layer morphology, and trapped-particle motion[J]. Langmuir, 2003, 19:6650-6656. |
| [26] | Hunter TN, Pugh RJ, Franks GV, et al. The role of particles in stabilising foams and emulsions[J]. Adv Colloid Interface Sci, 2008, 137:57-81. |
| [27] | Binks BP, Lumsdon SO. Influence of particle wettability on the type and stability of surfactant-free emulsions[J]. Langmuir, 2000, 16:8622-8631. |
| [28] | Binks BP, Clint JH. Solid wettability from surface energy components:relevance to pickering emulsions[J]. Langmuir, 2002, 18:1270-1273. |
| [29] | Hashizaki K, Kageyama T, Inoue M, et al. Study on preparation and formation mechanism of n-alkanol/water emulsion using α-cyclodextrin[J]. Chem Pharm Bull, 2007, 55:1620-1625. |
| [30] | Inoue M, Hashizaki K, Taguchi H, et al. Preparation and characterization of n-alkanol/water emulsion stabilized by cyclodextrin[J]. J Oleo Sci, 2009, 58:85-90. |
 2016, Vol. 51
2016, Vol. 51


