麦芽是禾本科植物大麦 (Hordeum vulgare L.) 的成熟果实经发芽干燥而成,广泛分布于我国各地,为营养价值较高的中药材。其味甘,性平,归脾,胃经,具有行气消食、健脾开胃、退乳消肿[1]等功效。最新药理研究表明,麦芽除有抗结肠炎[2]、助消化、回乳与催乳[3]等作用外,还能降血脂、护肝脏、抗真菌,在临床研究与应用中发挥着极其重要的作用。麦芽的生成是取净大麦先经清水浸泡后,每日淋水保持湿润,待胚芽长至2~3 mm时,取出晒干或低温 烘干。麦芽一般选择在低温且相对干燥的条件下进 行贮存,但贮存时间相对较长易导致麦芽吸收空气中的水分而变质。从其生长及贮存环境来看,麦芽极易污染真菌诱发霉变[4],进而产生黄曲霉毒素、赭曲霉毒素、伏马毒素等真菌毒素[5]。这些真菌毒素具有严重的致畸、致癌、致突变等毒副作用和较强的体内蓄积性[6, 7],不仅会影响麦芽的质量和安全性,也会严重危害人类健康。为此,《中国药典》(2010版) 规定麦芽等中药材中黄曲霉毒素总量不得超过10 μg·kg-1,黄曲霉毒素B1 (AFB1) 的含量不得超过5 μg·kg-1,但是,尚缺乏其他有害真菌毒素如赭曲霉毒素、伏马菌素等的含量限度标准。
鉴于麦芽的良好药用和食用价值及其真菌毒素高频发、强毒性、强致癌性的现状,建立准确可靠 的分析方法同时测定麦芽中多种真菌毒素的污染水平已经迫在眉睫。目前关于麦芽中真菌毒素的相关 检测报道极少,为此,本研究采用同位素内标法定 量,结合简单快速的超声提取的样品前处理方法,建立了基于正负切换的超高效液相色谱串联质谱法 (UPLC-MS/MS) 同时测定麦芽药材中11种真菌毒素的污染水平,为准确、灵敏、快速监测麦芽中真菌毒素污染状况,保证药材质量和安全性、有效性,提供了可靠的方法参考和数据支持。
材料与方法仪器 ACQUITY UPLC超高效液相色谱仪 (美国Waters公司),6500 QTRAP型串联四级杆-线性离子阱复合质谱仪 (美国AB SCIEX公司),配有电喷雾离子源 (ESI); 5415 R型冷冻高速离心机 (德国Eppendorf公司); MS105DU型半微量分析天平 (瑞士Mettler公司); MX-RL-Pro型旋转摇床混匀仪 (美国赛洛捷克公司)。
药品与试剂甲醇、乙腈为色谱纯 (德国默克公司); 乙酸铵、甲酸、乙酸为色谱纯 (纯度≥99.0%,美国Sigma公司); 实验室用水为超纯水 (德国默克密理博公司); 黄曲霉毒素B1 (AFB1,以甲醇为溶剂,5 μg·mL-1)、黄曲霉毒素B2 (AFB2,以甲醇为溶剂,4 μg·mL-1)、黄曲霉毒素G1 (AFG1,以甲醇为溶剂,4 μg·mL-1)、黄曲霉毒素G2 (AFG2,以甲醇为溶剂,4 μg·mL-1)、HT-2毒素(HT-2,以乙腈为溶剂,40 μg·mL-1)、T-2毒素(T-2,以乙腈为溶剂,10 μg·mL-1)、伏马毒素B1 (FB1,以乙腈/水50/50为溶剂,40 μg·mL-1)、伏马毒素B2 (FB2,以乙腈/水50/50为溶剂,40 μg·mL-1)、赭曲霉毒素A (OTA,以乙腈为溶剂,2 μg·mL-1)、脱氧雪腐镰刀菌烯醇 (DON,以乙腈为溶剂,100 μg·mL-1)、玉米赤霉烯酮 (ZEN,以乙腈为溶剂,40 μg·mL-1),以上11种毒素的对照 品原溶液购自新加坡Pribolab公司; 真菌毒素稳定 同位素内标溶液[13C17]-AFB1 (以乙腈为溶剂,0.05 μg·mL-1,为全13C标记) 和[13C18]-ZEN (以乙腈为溶剂,2.5 μg·mL-1,为全13C标记) 购自Sigma-Aldrich公司; 购买的麦芽药材分别产于河北、安徽、河南、黑龙江、广东等地。
对照品溶液的制备真菌毒素混合对照品溶液: 分别移取适量的11种真菌毒素标准对照品原液于5 mL量瓶中,用乙腈定容至刻度,配制成含黄曲霉毒素B1、G1为0.5 μg·mL-1,黄曲霉毒素B2、G2、T-2毒素、赭曲霉毒素A为0.2 μg·mL-1,脱氧雪腐镰刀菌烯醇为10 μg·mL-1,玉米赤霉烯酮、伏马毒素B1为2 μg·mL-1,HT-2毒素、伏马毒素B2为1 μg·mL-1的混合储备液,于-20 ℃避光保存。用麦芽空白基质溶液逐级稀释配制成不同浓度系列的基质添加混合对照品溶液。
真菌毒素同位素混合对照品溶液: 分别移取适量真菌毒素稳定同位素溶液于4 mL储液瓶中,用水稀释至2 mL配制成含[13C17]-AFB1为0.001 μg·mL-1,[13C18]-ZEN为0.01 μg·mL-1的稳定同位素混合标准溶液,充分混匀后于-20 ℃避光保存 (使用前恢复至室温并用涡旋混匀器充分混匀)。
样品制备取麦芽药材5.0 g(过2号筛),精密称定 (精确到0.001 g),置于50 mL离心管中,加入乙腈-水-乙酸 (80∶19∶1) 溶液25 mL,于旋转摇床混匀仪振荡提取1.5 h后,超声波提取30 min,提取后以12 000 r·min-1的转速高速离心10 min,准确 转移上清液1.0 mL于1.5 mL离心管中,旋涡混匀 后,离心(4 ℃,12 000 r·min-1) 10 min,吸取上清液过0.2 μm的聚四氟乙烯滤膜。吸取稳定同位素混合溶液5 μL于250 μL内插管中,再加100 μL滤液 (吸取前要涡旋混匀) ,涡旋混匀后供测定时使用。
色谱及质谱条件 色谱条件Phenomenex Kinetex C18色谱柱 (100 mm × 2.1 mm,2.6 μm); 流动相为2 mmol·L-1乙酸铵水溶液 (A相)-甲醇(含0.1% 甲酸,B相),梯度洗脱,0~2 min,25%~45% B; 2~10 min,45%~90% B; 10~12 min,90% B; 12~12.1 min,90%~25% B; 12.1~15 min,25% B; 流速0.3 mL·min-1; 柱温35 ℃; 进样量2 μL。
质谱条件离子源为电喷雾离子源 (ESI),扫描模式为多反应离子监测 (scheduled MRM) 正负切换同时扫描; 检测窗口时间范围为1 min; 碰撞气 (CAD) 为9 psi (1 psi ≈ 6.9 kPa); 雾化气 (Gas 1) 为60 Psi; 辅助加热气 (Gas 2) 为55 psi; 气帘气 (CUR) 为35 psi; 离子源温度 (TEM) 为550 ℃; 喷雾电压 (IS) 为+5.5 kV (positive)、-4.5 kV (negative)。保留时间、监测离子对 (m/z) 及相关参数见表 1。使用Analyst 1.6.2软件进行数据采集及处理。
|
|
Table 1 MRM transitions for 11 mycotoxins and 2 isotope internal standards. aRetention time; bPrecursor ion; cIon pair transition used for quantification, dIon pair transition used for identification. AFB1: Aflatoxin B1; AFB2: Aflatoxin B2; AFG1: Aflatoxin G1; AFG2: Aflatoxin G2; HT-2: HT-2 toxin; T-2: T-2 toxin; FB1: Fumonisin B1; FB2: Fumonisin B2; OTA: Ochratoxin A; DON: Deoxynivalenol; ZEN: Zearalenone |
分别取麦芽的阴性样品溶液和空白基质加标样品溶液在上述色谱-质谱条件下进行检测,11种真菌毒素及2种同位素的MRM定量离子图,如图 1所示。由分析结果可知,11种真菌毒素峰型较好且得到良好分离,阴性样品中未见被测峰所在保留时间的干扰峰,且空白基质加标样品的结果表明基质成分不干扰被测真菌毒素的检测。
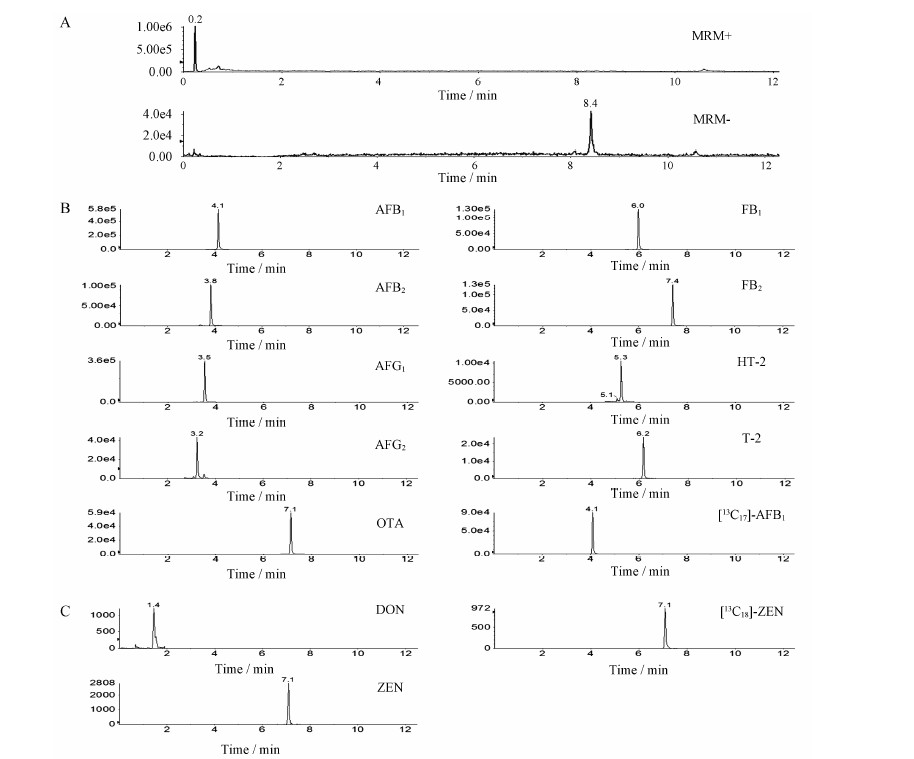 | Figure 1 MRM chromatograms of (A) blank malt samples, (B) fortified malt samples with the 11 mycotoxins scanned by positive MRM, and (C) fortified malt samples with the 11 mycotoxins scanned by negative MRM |
基质添加-稳定同位素标准校正曲线是选取不含真菌毒素的空白样品,按照样品制备中的预处理方法 (同样品制备方法) 准备空白基质溶液,随后添加不同浓度的混合对照品溶液及相同浓度的同位素混合溶液。标准校正曲线 以对照品溶液的峰面积与同位素内标的峰面积之比 (area ratio) 为纵坐标,进样浓度 (ng·mL-1) 为横坐标进行线性回归,线性方程、相关系数及线性范围见表 2。在最低添加浓度下,以大于3倍信噪比 (S/N) 得出11种真菌毒素的检出限、以大于10倍信噪比 (S/N) 得出11种真菌毒素的定量限,见表 2。
|
|
Table 2 Analytical parameters of the proposed UPLC-MS/MS method for 11 mycotoxins |
配制一定质量浓度的基质添加混合对照品溶液 (0.5 ng·mL-1 AFB1,0.2 ng·mL-1 AFB2,0.5 ng·mL-1 AFG1,0.2 ng·mL-1 AFG2,1.0 ng·mL-1 HT-2,0.2 ng·mL-1 T-2,2.0 ng·mL-1 FB1,1.0 ng·mL-1 FB2,0.2 ng·mL-1 OTA,10.0 ng·mL-1 DON,2.0 ng·mL-1 ZEN),同一天连续进样6次,记录峰面积,计算日内精密度。相同对照品溶液连续5天进样,记录峰面积,计算日间精密度。结果显示,日内精密度和日间精密度的RSD值都分别低于3.2%。
1.4 加样回收率在麦芽阴性样品中,分别添加低、中、高3个水平的11种真菌毒素的混合标准溶液,每个水平重复6次,按上述方法进行样品溶液的制 备并测定,计算各真菌毒素的回收率及相对标准偏差,结果表明,回收率为75%~117%,相对标准偏差为0.1%~8.0%,如表 3所示。
|
|
Table 3 Recoveries of 11 mycotoxins from fortified malt samples |
对市售的20批麦芽样品进行检测,结果显示有9批药材呈阳性,检出的真菌毒素有5种,2份样品检出黄曲霉毒素AFB1,含量分别为0.47和9.46 μg·kg-1; 2份样品检出T-2毒素,其中1份含量为1.76 μg·kg-1,另外1份含量低于LOQs; 4份样品均检出伏马霉素FB2,2份样品含量分别为0.89和1.47 μg·kg-1,另外 2份含量均低于LOQs; 2份样品检出赭曲霉毒素A,含量分别为1.14和1.42 μg·kg-1; 1份样品中检出脱 氧雪腐镰刀菌烯醇,含量低于LOQs。
讨论为了提高11种真菌毒素在正负离子多反应监测下的分离度及离子化效率,本研究分别比较了纯水、醋酸铵水溶液作为弱洗脱溶剂A相,纯甲醇、纯乙腈、含0.1% 甲酸甲醇及含0.1% 甲酸乙腈作为强洗脱溶剂B相。结果表明,纯水作为流动相A时离子化效率并不高,加入不同浓度的醋酸铵溶液对离子化效率及分离度有明显影响,但盐浓度太高会抑制离子化效率,因此选择2 mmol·L-1的醋酸铵水溶液作为流动相A。与乙腈相比,甲醇不仅大大改善了AFB2与AFG1、AFB1与FB1的分离度,同时真菌毒素的离子化效率也较高。由于伏马毒素含有羧基的特殊性,在酸性条件下才能将其从色谱柱上洗脱下来[8, 9],因此选择含0.1% 甲酸的甲醇溶液作为流动相B。
真菌毒素的极性范围较广,从极性最强的DON到疏水性较强的FB2,因此需采用梯度洗脱。在选择梯度条件时要考虑保留时间、分离度及基质干扰等综合因素。当初始有机溶剂含量较高时,各毒素的灵敏度增高,但极性化合物的保留时间过短,整体分离度也同时降低,当有机溶剂含量较低时,会出现弱极性化合物峰形展宽等现象,无法实现LC-MS/MS快速有效分离的目的。尝试不同梯度洗脱条件,最终选择25%甲醇作为初始浓度,90%甲醇为最高洗脱浓度,12 min完成11种真菌毒素的分离分析。
真菌毒素的理化性质、麦芽药材的复杂成分等是决定提取溶剂的主要因素,通常采用有机溶剂与水的混合液提取复杂基质中的真菌毒素。麦芽药材中含有大量的酶类及生物碱类[10],对所检测的真菌毒素有一定的干扰作用。将20 μL混标溶液添加到5 g样品中,分别考察80%甲醇、80%甲醇 (含1%乙酸)、80%乙腈、80%乙腈 (含1% 乙酸) 的提取效率。结果表明,80%乙腈 (含1%乙酸) 作为提取溶剂时提取效率最高且受麦芽基质的干扰较小,同时能满足真菌毒素的回收率。
目前对真菌毒素的净化方法中多采用固相萃取法、免疫亲和净化法、凝胶渗透净化法等。由于真菌毒素种类较多,采用上述几种方法不可避免会影响某些毒素提取效率。本方法采用对麦芽样品振荡提取后经两次离心过滤,直接对粗提取液进行进样分析,保证了真菌毒素不会因为前处理方法而受损失,保全了样品的真实性。
通过同位素内标校正,所有真菌毒素的回收率都在75%以上,消除了基质效应,保证了分析方法的可靠性和耐用性。为了校正样品前处理和离子化过程中的损失,在内标化合物的选择上要考虑同目标分析物的结构、理化性质尽可能相似,文献中报道有使用结构类似物如盐酸丁螺环酮[11]及zearalanone[12]作为真菌毒素定量分析时的内标物,但结构类似物的缺陷主要在于保留时间和离子化程度与待测分析物不同,从而限制了结构类似物对待测分析物因基质效应而产生的信号增强或抑制的校正能力[13]。本研究中使用AFB1的同位素[13C17]-AFB1作为正离子检测内标物,ZEN的同位素[13C18]-ZEN作为负离子检测内标物,同位素内标在其物理和化学性质与待测分析物基本一致,保证样品在制备、提取、进样以及质谱分析过程中产生的误差降到最低,分析方法更加可靠。
本方法的检测限 (LODs) 为0.05~30 μg·kg-1,远低于欧盟所规定的真菌毒素的最大允许残留量 (MRLs),为真菌毒素的测定提供高灵敏的分析方法,保证了麦芽用药的安全性。而实际麦芽所检出的真菌毒素种类除了药典规定的AF以外,还包括另外4种未在药典中做出相关规定的真菌毒素。同时,除脱氧雪腐镰刀菌烯醇的检测含量低于LOQ以外,其他4种毒素都出现含量高于欧盟所规定的真菌毒素的最大允许残留量(MRLs),这些真菌毒素的高毒性和高致癌性,对于麦芽的安全使用存在巨大的潜在危险。对实际样品的检测结果发现,在所测的20批药材中45% 的麦芽受到了真菌毒素的不同程度的污染,因此,迫切需要建立和规范麦芽及其他中药材中多种真菌毒素的检测方法及限量标准,改善我国中药材受真菌毒素的污染程度,提高中药材整体的质量,保证中药的用药安全。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. 2010 ed. Part I. Beijing: China Medical Science Press, 2010: 11. |
| [2] | Hanai H, Kanauchi O, Mitsuyama K, et al. Germinated barley food stuff prolongs remission in patients with ulcerative colitis [J]. Int J Mol Med, 2004, 13: 643-647. |
| [3] | Wang CF, Zhang SJ, Liu YZ. 213 cases of modified biochemical decoction for delectation [J]. J Sichuan Tradit Chin Med (四川中医), 2002, 20: 52. |
| [4] | Pitt JI, Marta H. Mycotoxin production in major crops as influenced by growing, harvesting, storage and processing, with emphasis on the achievement of food safety objectives [J]. Food Control, 2013, 32: 205-215. |
| [5] | Zhu QY, Suo LL, Hu MH. Simultaneous determination of 7 mycotoxins in wheat flour by ultra performance liquid chromatography-tandem mass spectrometry using isotope internal standard [J]. Mod Prev Med (现代预防医学), 2014, 41: 4362-4365, 4377. |
| [6] | Feng X, Kong WJ, Yang MH, et al. Latest advancement for detection methods of mycotoxins in traditional Chinese medicine [J]. World Sci Technol-Modern Tradit Chin Med Mater Med (世界科学技术), 2012, 14: 1944-1952. |
| [7] | Ashiq S, Hussain M, Ahmad B. Natural occurrence of mycotoxins in medicinal plants: a review [J]. Fungal Genet Biol, 2014, 66: 1-10. |
| [8] | Michael S, Franz B, Rudolf K, et al. Development and validation of a liquid chromatography/tandem mass spectrometric method for the determination of 39 mycotoxins in wheat and maize [J]. Rapid Commun Mass Spectrom, 2006, 20: 2649-2659. |
| [9] | Sulyok M, Krska R, Schuhmacher R. A liquid chromatography/tandem mass spectrometric multi-mycotoxin method for the quantification of 87 analytes and its application to semi-quantitative screening of moldy food samples [J]. Anal Bioanal Chem, 2007, 389: 1505-1523. |
| [10] | Hu XM, Zhang WK, Zhu QS, et al. Chinese Herbal Medicine (中华本草) [M]. Shanghai: Shanghai Science and Technology Press, 1999. |
| [11] | Kuang Y, Qiu F, Kong WJ, et al. Simultaneous quantification of mycotoxins and pesticide residues in ginseng with one-step extraction using ultra-high performance liquid chromatography- electrospray ionization tandem mass spectrometry [J]. J Chromatogr B, 2013, 939: 98-107. |
| [12] | Klötzel M, Lauber U, Humpf HU. A new solid phase extraction clean-up method for the determination of 12 type A and B trichothecenes in cereals and cereal-based food by LC-MS/MS [J]. Mol Nutr Food Res, 2006, 50: 261-269. |
| [13] | Jian W, Edom RW, Xu Y, et al. Potential bias and mitigations when using stable isotope labeled parent drug as internal standard for LC-MS/MS quantitation of metabolites [J]. J Chromatogr B, 2010, 878: 3267-3276. |
 2016, Vol. 51
2016, Vol. 51


