2. 南昌大学 第一附属医院GCP, 江西 南昌 330006;
3. 南昌大学 医学院临床药理研究所, 江西 南昌 330006
2. Department of GCP, The First Affiliated Hospital, Nanchang University, Nanchang 330006, China;
3. Institute of Clinical Pharmacology, College of Medicine, Nanchang University, Nanchang 330006, China
随着生活水平的提高,中国人群的生活方式和饮食结构都发生了巨大变化,心血管疾病的发病率呈现逐年上升的趋势,其中高脂血症早已成为一种全球性的高发病[1]。他汀类药物为HMG-GoA还原酶抑制剂,大量的临床资料表 明: 他汀类药物能明显降低血脂水平[2],临床应用非常广泛。同时,在我国临床上多采用具有调血脂与治疗心血管疾病作用的中草药如丹参、山楂、栀子、女贞子等联合他汀类药物以期达到更好的降脂作用以及治疗心血管疾病的作用[3, 4, 5]。中草药含有多种生物活性成分,也存在与多种类型的药物发生相互作用的可能,导致后者药动学的改变,甚至引发不同程度的不良反应[6]。因此,中草药与化学药物联合用药引起的药物相互作用应予以关注。
现代药动学研究表 明,转运蛋白在药物吸收、分布及消除中起重要作用,诸多药物通过转运体介导进入肠道、肝胆、血脑屏障等而起到相应的药理学作用[7, 8]。由于底物的重叠性,药物间对转运蛋白的转运存在竞争性,这是导致药物相互作用乃至不良反应发生的重要原因之一。
作为新一代的具有较强降脂疗效的他汀类药物,体内过程与有机阴离子转运多肽1B1 (organic anion transporting polypeptide 1B1,OATP1B1) 密切相关: 主要通过OATP1B1介导转运进入肝细胞而发挥降低胆固醇的药理作用,且研究表 明OATP1B1具有基因多态性,其基因突变显著影响他汀药物的药动学行为[9]。因此,本研究以丹参素中药组分和瑞舒伐他汀为例,探索丹参素对瑞舒他汀药物的药代动力学影响及机制。
材料与方法 实验动物与细胞健康SD雄性大鼠 (合格证 号: 0319602),体重200~235 g,南昌大学医学院实验动物中心提供; OATP1B1*5质粒 (pcDNA3.1(−) / Zeo: Invitrogen): 日本千叶大学赠送; 慢病毒表 达系统(由pGC-LV载体、pHelper 1.0载体和pHelper 2.0载体三质粒组成) 购于上海Genechem公司; HEK293T细胞: 中国医学科学院基础医学研究所。
主要试剂甲醇 (色谱纯)、无水乙酸乙酯 (分 析纯): Merck公司生产; 瑞舒伐他汀对照品 (T2): 浙江新东港药业有限公司提供 (含量: 99.5%; 批号: 20051101RS); 高糖DMEM培养基及非必需氨基酸: 美国Gibco公司; 胎牛血清 (fetal bovine serum,FBS): 杭州四季青公司; IV型胶原酶: 美国Gibco公司; 鼠抗EGFP单克隆抗体和羊抗鼠IgG: 美国Santa-Cruz公司; 质粒抽提Kit: QIAGEN公司; 凯基Braford蛋白含量检测试剂盒: 凯基生物。
主要仪器安捷伦Agilent-1260高效液相色谱仪; 上海飞鸽牌高速台式冷冻离心机 (GL-20G-Ⅱ); BP61S型电子天平: 德国Sartorius; 二氧化碳培养箱 (Heraeus Heracell 150): 德国贺利氏; CKX-41型倒置光学显微镜: 日本Olympus公司; PCR仪: 美国Applied Biosystems公司; 定量PCR仪: 美国BioRad公司; 荧光显微镜: 日本Olympus公司; 全波长酶标仪: 美国热电公司; 超低温冰箱 (MDF-382E): 日本三洋公司。
大鼠体内丹参素对瑞舒伐他汀药代动力学影响将雄性SD大鼠 (220 ± 15) g,分为对照组与瑞舒伐他汀合用丹参素组,每组6只,以瑞舒伐他汀100 mg·kg−1、丹参素46 mg·kg−1的剂量灌胃给药 (tid),两药合用时按先丹参素后瑞舒伐他汀的顺序相继灌胃,间隔15 min,在瑞舒伐他汀灌胃给药后0、0.5、1、1.5、3、5、8、10、12和24 h眼眶静脉采血约0.3 mL,血样置于加入肝素钠的试管中,离心处理后,血浆样品置于 −20 ℃冰箱冻存,应用LC-MS方法测定大鼠血浆中瑞舒伐他汀药物浓度; 通过DAS2.1软件对瑞舒伐他汀的血药浓度进行药代动力学分析,应用SPSS12.0对药代动力学参数进行统计分析。
丹参素对大鼠肝细胞摄取瑞舒伐他汀的影响采用原位胶原酶灌流法分离大鼠原代肝细胞; 探明瑞舒伐他汀与丹参素对大鼠原代肝细胞毒性作用基础上,探索大鼠原代肝细胞对瑞舒伐他汀的摄取特点,研究丹参素对大鼠原代肝细胞摄取瑞舒伐他汀的影响: DMEM培养基将肝细胞悬液稀释为每毫升1×106,加入到24孔培养板内,实验分为空白组、瑞舒伐他汀对照组以及瑞舒伐他汀合用系列浓度的丹参素组,加药后瑞舒伐他汀的药物终浓度为20 μmol·L−1,系列丹参素终浓度分别为20、40和80 μmol·L−1,加完药后置37 ℃的培养箱中分别孵肓40 s,缓慢吸弃含药的培养液,加入培养液洗涤4次后加入无菌水0.5 mL于 −80 ℃反复冻溶3次,样本经处理后用LC-MS测定。应用SPSS12.0进行统计分析。
丹参素对OATP1B1介导瑞舒伐他汀转运的影响分别构建OATP1B1*1a-GFP融合基因与OATP1B1*5- GFP融合基因的重组慢病毒表 达载体,建立稳定表 达OATP1B1*1a与OATP1B1*5的HEK293T细胞模型。探索丹参素对表 达OATP1B1*1a与OATP1B1*5的HEK293T细胞摄取瑞舒伐他汀的影响: 实验设计为空白组、瑞舒伐他汀组和系列浓度丹参素 (0.1、1与10 μmol·L−1) 合用瑞舒伐他汀组; 在细胞摄取实验中,瑞舒伐他汀的药物浓度是10 μmol·L−1,采用LC-MS测定HEK293T细胞样本。应用SPSS12.0进行统计分析。
结果 1 大鼠体内丹参素对瑞舒伐他汀药代动力学影响运用SPSS12.0软件对两组药代参数进行统计 分析,大鼠体内丹参素可明显影响瑞舒伐他汀的药代动力学特征,峰浓度值 (Cmax) 与药时曲线下面积 (AUC) 明显增大 (P < 0.05),而清除速率 (CLz/F) 显著降低 (P < 0.05) (图 1)。与单用瑞舒伐他汀组比较,合用丹参素后瑞舒伐他汀药代动力学参数Cmax、AUC0−t、AUC0−∞ 参数值分别增加约123%、194% 和195%,而CLz/F值降低了60%。其他药代参数tmax、t1/2差异不显著 (表 1)。
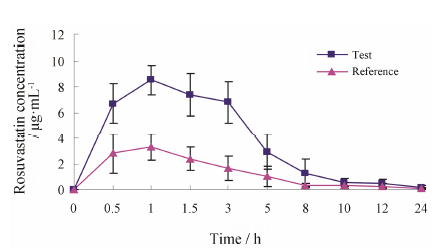 | Figure 1 Mean plasma concentration-time profiles of rosuvastatin following an oral administration of rosuvastatin (100 mg·kg−1) to rats in the presence and the absence of Danshensu (46 mg·kg−1). Filled triangles rosuvastatin alone; filled Diamonds pretreatment with 46 mg·kg−1 of Danshensu. n = 6, x±s |
| Table 1 Pharmacokinetic parameters of rosuvastatin after an oral administration of Danshensu (46 mg·kg−1) to rats. n = 6, x±s. Dss: Danshensu; ROS: Rosuvastatin; Dss+ROS: Coadministration with Danshensu |
利用大鼠获取的原代肝细胞呈条索状或圆块状,细胞透亮、边界清楚、胞质丰富,泡浆内有许多小颗粒,可见空泡,细胞核中等大小,圆形或椭圆形,核多偏位,可见双核甚至多核,以单核多见。随着细胞培养时间延长,细胞贴壁、伸展、变薄,体积明显变大,部分细胞呈多边形展开,有些细胞呈岛状连接,见图 2。利用大鼠原代肝细胞模型,研究发现20、40和80 μmol·L−1丹参素对肝细胞摄取瑞舒伐他汀均有抑制作用,并使摄取分别减少了3.13%、41.15% 与74.62%; 40和80 μmol·L−1丹参素对肝细胞摄取瑞舒伐他汀有明显的抑制作用,此时肝细胞摄取量与对照组间差异具有统计学意义,而浓度为20 μmol·L−1时抑制作用不显著,见图 3; 随着丹参素浓度增加,对肝细胞摄取瑞舒伐他汀抑制作用也增强,计算得出抑制参数IC50为 (53.04 ± 2.43) μmol·L−1。
 | Figure 2 The morphology of hepatics cells in microscope |
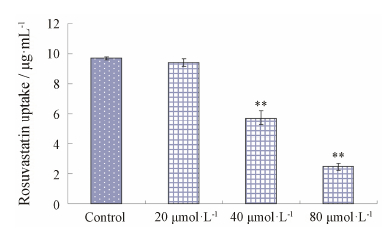 | Figure 3 The effect of Danshensu on rosuvastatin uptake in rat primary hepatocytes. n = 4, x±s. **P < 0.05 vs control |
以携带绿色荧光蛋白 (green fluorescent protein,GFP) 的pGC-FU慢病毒载体系 统作为基因转导的媒介,分别构建OATP1B1*1a-GFP融合基因与OATP1B1*5-GFP融合基因的重组慢病 毒表 达载体,通过观察荧光及Western blot检测GFP蛋白表 达; 实时荧光定量PCR (real-time quantitative PCR,RTQ-PCR) 检测慢病毒滴度; 将携带OATP1B1- GFP融合基因的慢病毒 (Lenti-OATP1B1*1a,Lenti- OATP1B1*5) 及仅携带GFP的慢病毒 (Lenti-GFP) 感染HEK293T,通过观察荧光及Western blot检测目的基因OATP1B1*1a与OATP1B1*5的表 达,建立稳定表 达OATP1B1*1a与OATP1B1*5的HEK293T细胞模型 (图 4,5)。
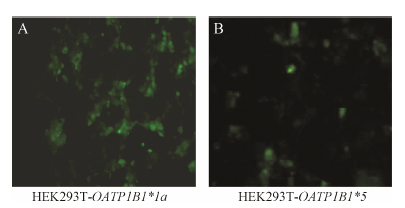 | Figure 4 The fluorescent photos of HEK293T cells after being transfected with pGC-FU-OATP1B1*1a and pGC-FU-OATP1B1*5 |
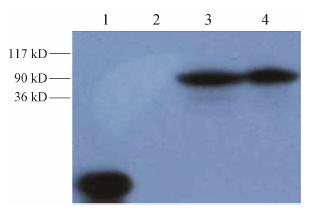 | Figure 5 The expression of OATP1B1 in transgenic cells. 1: Standards; 2: Control; 3: pGC-FU-OATP1B1*5; 4: pGC-FU- OATP1B1*1a |
丹参素在0.1~10 μmol·L−1内对转染OATP1B1*1a基因的HEK293T细胞摄取瑞舒伐他汀表 现出较弱的抑制作用,0.1、1和10 μmol·L−1丹参素对OATP1B1*1a转运瑞舒伐他汀分别减少了 (3.96 ± 3.40) %、(8.22 ± 2.40) % 和 (11.56 ± 3.04) %,与对照组相比差异无统计学意义 (图 6)。
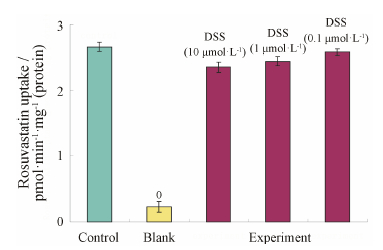 | Figure 6 The effect of Danshensu on rosuvastatin uptake in OATP1B1*1a-HEK 293T. 0: Empty vector-HEK293T. n = 5, x±s |
丹参素在浓度10与1 μmol·L−1时也表 现出明显竞争抑制作用,与对照组相比,转运量明显减少,差异有统计学意义,转运分别减少了 (63.61 ± 3.94) % 和(39.11 ± 4.94) %。因此,丹参素对表 达OATP1B1*5基因的HEK293T细胞摄取瑞舒伐他汀均表 现抑制作用。计算抑制参数IC50为 (3.26 ± 0.54) μmol·L−1 (图 7)。
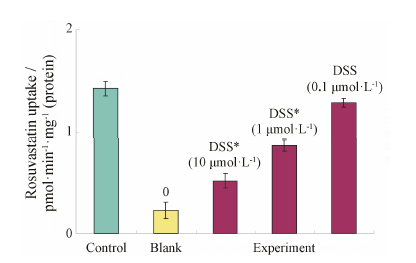 | Figure 7 The effect of Danshensu on rosuvastatin uptake in OATP1B1*5-HEK 293T. 0: Empty vector-HEK293T. n = 5, x±s. P < 0.05 vs control |
OATP1B1转运的底物广泛,并不断有药物被发现是通过该转运体转运进入肝脏,因此,该转运体对这些药物的体内分布与代谢都具有重要的作用。改变转运体介导肝脏摄取可能会导致药物浓度升高,引起毒副作用。早期学者发现环孢素A可抑制OATP1B1介导转运西立伐他汀,引起体内的西立伐他汀浓度升高,改变西立伐他汀在体内的分布[10, 11]。Deng等[12]研究发现silymarin在细胞水平可明显抑制OATP1B1对瑞舒伐他汀汀的摄取 (Ki = 0.93 μmol·L−1)。由于药物浓度的升高可能引起毒副作用的发生,因此,由该转运体引起的药物相互作用应予以重视。
本实验从体内水平、细胞水平与分子水平探讨 中药组分丹参素对OATP1B1介导瑞舒伐他汀转运 的影响机制。结果显示大鼠体内丹参素可明显影响 瑞舒伐他汀的药动学,但其影响机制与OATP1B1的关联性,还需进一步探讨。在所建立的转基因细胞 模型中发现,一定剂量时丹参素对OATP1B1*5基因介导的瑞舒伐他汀转运表 现出竞争抑制作用,而对OATP1B1*1a并无抑制作用。其原因可能是由于基 因突变导致OATP1B1*5的转运体能力降低,因此,在较低剂量的丹参素时,表 现出明显的抑制突变型OATP1B1介导瑞舒伐他汀的转运,而在同样的剂量下,由于野生OATP1B1*1a (非突变) 的转运能力相对较强,并未能表 现出明显抑制OATP1B1介导瑞舒伐他汀的转运。
同时,由于肝脏药物转运体诸多,如其他亚型OATP、人钠依赖牛磺胆酸共转运体 (NTCP) 以及排泄转运体乳腺癌耐药蛋白 (BCRP) 等[9],这些药物转运体均在瑞舒伐他汀的体内转运与排泄中起到不同的作用,因此,丹参素对瑞舒伐汀体内药代动力学的影响是否同时还与这些转运体相关,尚需进一步研究。
| [1] | King A. Risk factors: everything in moderation-binge drinking increases CVD risk [J]. Nat Rev Cardiol, 2011, 8: 62. |
| [2] | Cziraky MJ, Willey VJ, McKenney JM, et al. Statin safety: an assessment using an administrative claims database [J]. Am J Cardiol, 2006, 97: 61C-68C. |
| [3] | Dong BQ, Ge B, Feng X, et al. Compound Danshen Diwan combined with fluvastatin inhibits formation of carotid atherosclerotic plaque [J]. Chin J New Drug (中国新药杂 志), 2009, 18: 1217-1219. |
| [4] | Izzo AA, Di Carlo G, Borrelli F, et al. Cardiovascular pharmacotherapy and herbal medicines: the risk of drug interaction [J]. Int J Cardiol, 2005, 98: 1-14. |
| [5] | Xu DY, Shu J, Huang QY, et al. Evaluation of the lipid lowering ability, anti-inflammatory effects and clinical safety of intensive therapy with Zhibitai, a Chinese traditional medicine [J]. Atherosclerosis, 2010, 211: 237-241. |
| [6] | Wen JH, Yuan Z, Xiong YQ. Study on pharmacokinetics of rosuvastatin and its drug interactions with other drugs [J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2011, 16: 1309-1314. |
| [7] | Gao CY, Chen XY, Zhong DF. Role of transporters in hepatic drug disposition [J]. Acta Pharm Sin (药学学报), 2012, 47: 565-572. |
| [8] | Zhang J, Liu KX. Intestinal absorption and renal excretion mediated by transporters and the relationship with drug-drug interaction [J]. Acta Pharm Sin (药学学报), 2010, 45: 1089- 1094. |
| [9] | Wen JH, Wei XH, Hu JF. The role of OATP1B1 and BCRP in pharmacokinetics and DDI of novel statins [J]. Cardiovasc Ther, 2012, 30: e234-e241. |
| [10] | Shitara Y, Hirano M, Adachi Y, et al. In vitro and in vivo correlation of the inhibitory effect of cyclosporin A on the transporter-mediated hepatic uptake of cerivastatin in rats [J]. Drug Metab Dispos, 2004, 32: 1468-1475. |
| [11] | Mück W, Mai I, Fritsche L, et al. Increase in cerivastatin systemic exposure after single and multiple dosing in cyclosporine-treated kidney transplant recipients [J]. Clin Pharmacol Ther, 1999, 65: 251-261. |
| [12] | Deng JW, Shon JH, Shin HJ, et al. Effect of silymarin supplement on the pharmacokinetics of rosuvastatin [J]. Pharm Res, 2008, 25: 1807-1814. |
 2016, Vol. 51
2016, Vol. 51


