自噬(autophagy) 是细胞通过溶酶体降解内源性底物的重要过程, 具有高度的进化保守性。自噬 在营养缺乏、低氧应激和药物诱导时出现, 对细胞 自我更新和内环境稳态的维持起重要作用。根据溶 酶体接受待降解物质的不同方式, 自噬分为大自噬 (macroautophagy)、小自噬 (microautophagy) 和分子伴侣介导的自噬 (chaperone-mediated autophagy, CMA)。大自噬, 即通常意义上的自噬, 是自噬最常见的类 型, 其特征是围绕细胞质组分形成杯状双层膜结构, 然后形成自噬体, 自噬体的外层膜与溶酶体融合形成单层膜结构的自噬溶酶体, 而自噬体的内膜及内容物被消化。上述过程由自噬相关蛋白 (autophagy- related gene, Atg) 所介导。在小自噬过程中, 胞浆中的生物大分子通过溶酶体膜内陷, 被带到溶酶体进行消化, 小自噬与大自噬最大的区别是小自噬过程中不形成自噬体。而分子伴侣介导的自噬, 主要是通过热休克蛋白73 (hot shock protein 73, HSP73) 和溶酶体相关膜蛋白 (lysosomal associated membrane protein, LAMP) 2A与异常的蛋白分子结合, 将其带到溶酶体中进行消化。大自噬和小自噬从酵母到哺 乳动物均有发现, 而CMA主要发生在哺乳动物系统中。在以上三种自噬过程中, 大自噬能够降解的蛋白最为广泛, 在多种由错误折叠蛋白堆积所引起的疾病中, 均发现有大量的大自噬失调的现象存在。
在正常条件下, 泛素−蛋白酶体途径可以降解细胞代谢产物; 而在营养匮乏时, 大自噬就被激活, 以提供细胞生存所必需的氨基酸和脂肪酸, 维持新陈代谢和能量代谢平衡, 保证细胞的正常生理活动得以进行[1]。自噬可以识别并降解多种物质, 例如蛋白质、脂类、碳水化合物、核酸释放氨基酸、脂肪酸、糖和核苷等[2]。自噬可将糖原颗粒分解为葡萄糖, 并为柠檬酸循环代谢提供丙酮酸[2]。自噬降解产生的氨基酸可以用于新的蛋白质合成, 可以参与中央碳代谢过程, 在肝脏中还可以成为糖质新生的底物[3], 而上述产物促进了柠檬酸的合成, 进而促进了脂质代谢, 并维持了细胞膜的稳定[3]。正是由于大自噬对于维持细胞稳态具有重要的意义, 因此大自噬在肿瘤中的研究也备受瞩目, 以调节自噬活性为目的已经成为肿瘤治疗的一种策略[4]。本文将着重介绍大自噬的调节作用及其在肿瘤的研究进展, 下文中的自噬均特指大自噬。
1 自噬的调节机制自噬是一个多阶段连续进行的过程, 称为自噬流 (autophagy flux)。在起始阶段, 雷帕霉素作用靶点 (mammalian target of rapamycin, mTOR) 复合物去磷酸化后激活激酶 (Unc-51 like autophagy activating kinase 1, ULK1) 复合物, ULK1复合物可以通过磷 酸肌醇-3-激酶 (phosphoinositide 3-kinase, PI3K) 自噬核心复合物依赖与非依赖两种途径促进独立膜结构形成。自噬核心复合物 (autophagic core complex) 主要由多种蛋白质构成, 其中包括B细胞慢性淋巴细胞白血病/淋巴瘤蛋白2 (B-cell CLL/lymphoma 2, Bcl-2)、Beclin-1、III型磷酸肌醇-3-激酶 (class III phosphoinositide 3-kinase, PI3K3C)、磷酸肌醇-3-激酶调节亚基4 (phosphoinositide-3-kinase regulatory subunit 4, PI3KR4) 以及自噬相关基因14 (autophagy related gene 14, Atg14) 等, 当Bcl-2与Beclin-1相互解离后, 自噬核心复合物会被激活, 自噬活化信号向下传递; 独立膜结构上存在着微管相关蛋白轻链3 (microtuble- associated protein light chain 3, LC3) 定位, LC3可与能够识别待降解物质的“货车”受体(如p62等) 结合, 这些受体可以与衰老细胞器及新近发现的细胞内外病原体相关分子模式 (pathogen-associated molecular patterns, PAMPs)、损伤相关分子模式 (damage- associated molecular pattern molecules, DAMPs) 结合, 从而包裹待降解物质形成自噬小体; 自噬小体形成后, 与溶酶体融合形成自噬溶酶体, 使“货物”和自噬体均降解[5] (图 1)。
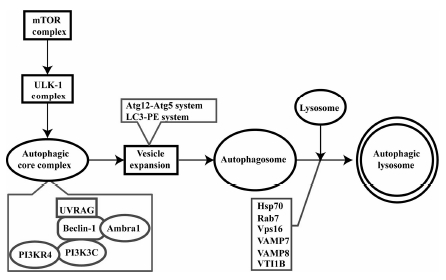
|
Figure 1 The process of autophagic activation |
mTOR是一种进化保守的丝氨酸/苏氨酸蛋白激酶, 是控制细胞生物能量增加或减少的“感受器”, mTOR可以感受生长因子信号转导、细胞的能量状态和应激反应 (如遗传毒性和低氧)[6]。此外, mTOR激酶通过调控下游效应器 (如4E-BP1、Tap42和p70S6K等), 控制多种蛋白的翻译和转录[7]。在哺乳动物中, 氨基酸、葡萄糖和生长因子等均可以调节mTOR的活性[8]。在正常情况 下, mTOR可以抑制细胞中自噬的活化; 而当饥饿、营养匮乏以及受到压力刺激等状态下, mTOR则通过mTOR/Atg1/Atg13信号通路以及mTOR/ULK1/Atg13信号通路影响自噬。Atg1作为mTOR的下游信号, 是连接mTOR信号与自噬通路的关键。在正常状态下, mTOR可以磷酸化Atg13, 并使之与Atg1解离, 抑制自噬流的传导; 在饥饿或雷帕霉素抑制mTOR活性时, Atg13去磷酸化后与Atg1结合, 促进自噬膜结构出现[9]。此外, 在正常状态下, mTOR可以通过与ULK1激酶结构域结合, 磷酸化ULK1与Atg13, 抑制自噬的活化; 而当细胞受到压力刺激时, mTOR与ULK1分离, ULK1与Atg13去磷酸化, 促进下游自噬小体的产生[10]。
1.2 独立膜样结构形成阶段: 自噬核心复合物自噬核心复合物主要由Bcl-2、Beclin-1、PI3K3C、PI3KR4、Atg14以及Ambra1构成。当Beclin-1与Bcl-2家族蛋白结合后, 则可以抑制自噬的活化。在饥饿及其他应激条件下, Bcl-2必须与Beclin-1解离以激活自噬的发生[11]。发生这种解离主要受到以下四种方式调控: ① c-Jun N端激酶 (c-Jun N-terminal kinases, JNK) 介导的Bcl-2磷酸化[11]。② 死亡相关蛋白激酶 (death- associated protein kinase, DAPK) 介导的Beclin-1磷酸化[12]。③ 核蛋白HMGB1 (high-mobility group box 1, HMGB1) 迁移到胞浆[13], 然后激活Beclin-1诱导自噬活化[14]。④ 其他BH3蛋白与Beclin-1竞争结合Bcl-2[15]。
哺乳动物细胞PI3K有三类, 包括I、II和III型。PI3K-I型通过活化下游的Akt/GSK3β通路调节细胞的生长[11], PI3K-I型还可以通过活化mTOR或P70S6K等信号通路抑制自噬的活化[16]。PI3K-III型是酵母细胞Vps34在哺乳动物中的同源物, PI3K-III型与Beclin-1、Vps15等形成自噬核心复合物, 该复合物在自噬小体形成的早期阶段发挥了重要的作用[17]。
1.3 自噬小体形成阶段: 泛素样结合系统自噬核心复合物诱导自噬的活化, 参与独立膜的形成, 而众多自噬相关蛋白被募集于此, 参与自噬小体的形成。在此过程中, 有两条泛素样结合通路Atg12-Atg5通路和LC3-PE通路参与分离膜的延伸过程[18, 19]。在Atg12-Atg5结合系统中, Atg7与Atg12的C-末端结 合形成一个中间复合物, 水解ATP导致Atg12的活 化[18]。随后, 活化的Atg12与Atg10分离, Atg12与Atg5共价结合, 形成终末复合物, 然后再与Atg16非共价结合形成三聚体; 这个三聚体位于分离膜的外膜, 参与了LC3的募集和分离膜的延伸[18]。在LC3- PE结合系统中, LC3初合成时为大分子量的前体蛋白, 由半胱氨酸蛋白酶Atg4切断LC3羧基末端暴露出一个甘氨酸残基, 转化为活性LC3-I型。LC3-I型被Atg7活化, 然后LC3-I型被转移给Atg3; Atg3催化LC3-I与脑磷脂 (phosphatidyl ethanolamine, PE) 共价聚合, 形成LC3-PE (LC3-II型); LC3-II型以Atg5依赖性的方式被转运到自噬体外膜中[19], 进而参与自噬小体形成的过程。
1.4 自噬小体成熟降解阶段双层膜结构的自噬小体形成之后, 需要通过与溶酶体融合, 最终形成自噬溶酶体从而将待降解物质降解, 该过程称为自噬小体的成熟。目前的研究对这一过程的调控机制认识比较有限。最早的研究[20]表明, 热休克蛋白70定位在溶酶体内部可以抑制溶酶体与自噬小体的融合。之后Ganley等[21]发现了Ras相关GTP结合蛋白7 (Ras- related protein Rab-7a, Rab7) 及Vps16是自噬小体 与溶酶体融合的必需分子。而最近的研究[22]表明, N-乙基马来酰亚胺敏感因子连接物复合体 (soluble N- ethylmaleimide-sensitive fusion attachment protein receptors, SNAREs) 家族蛋白中的多个成员就可以影响自噬小体与溶酶体的融合过程, 例如SNAREs小泡相关膜蛋白7 (SNAREs vesicle-associated membrane protein8, VAMP7)、VAMP8以及VTI1B (vesicles transport through interaction with t-SNARE homolog 1B) 等。
2 自噬与肿瘤近年来的大量研究表明自噬与肿瘤密切相关, 自噬可以调节肿瘤的形成、增殖、转移以及能量代谢等诸多方面。同时, 以调节自噬活性为理论依据的抗肿瘤药物已应用于临床治疗, 通过改善自噬活性而抑制肿瘤已经成为了肿瘤治疗的新思路。
2.1 自噬抑制肿瘤的发生与发展Beclin-1是自噬核心复合物中重要的组成部分, 也是自噬能否得以活化的关键, 体外实验表明激活Beclin-1活化自噬可以抑制肿瘤的发生[23]; 进一步的研究发现, Beclin-1的单等位基因缺失在肿瘤发生的过程中起关键作用, 用杂交突变的方式干扰Beclin-1能够降低细胞的自噬水平, 从而诱导一系列自发性肿瘤, 如淋巴癌、肺癌、肝细胞癌和乳腺癌的癌前病变, 并加速乙肝病毒促进肿瘤发生的进程[24]; 此外, 永生化的乳腺上皮细胞在Beclin-1缺陷的小鼠体内具有更强的成瘤性[25]。目前, 关于自噬调节肿瘤发生的分子机制也有了较为明确的研究报道。Degenhardt等[26]直接指出Beclin-1的缺失, 会导致抗凋亡蛋白Bcl-2的表达大量增加, 进而促进肿瘤发生; 同时, 肿瘤细胞在代谢应激的状态下不能发生凋亡, 而是通过坏死途径死亡, 坏死能够激活炎症反应从而促进肿瘤增殖, 而自噬可以阻止坏死的发生, 进而抑制肿瘤的发生。Karantza- Wadsworth等[27]发现, 自噬活性缺失会导致双链DNA发生损伤, 增加代谢应激状态下基因组的不稳定性, 诱导细胞突变, 进一步促进原癌基因的激活而导致肿瘤发生。在乳腺癌中, 磷酸化的角蛋白高表达可以降低Beclin-1的表达, 导致自噬活性被抑制, 进而加剧活性氧自由基 (reactive oxygen species, ROS) 以及DNA损伤, 促进肿瘤的发展[28]。在永生化鼠胚肾细胞中敲除Beclin-1, 导致自噬活性被抑制, 引起ROS堆积, DNA损伤增加, 基因扩增增加, 促进肿瘤的发展; 而在恢复自噬活性后, 自噬可以通过清除堆积的ROS和不稳定的基因组, 抑制肿瘤的发展[29]。同时, 自噬活性增加可以通过降解内质网和高尔基体等细胞器和长寿命蛋白, 使癌变细胞处于蛋白质负平衡的状态, 从而抑制其持续性增殖[30]。此外, 自噬可以通过诱导具有抗肿瘤作用的炎症反应, 抑制肿瘤的转移[31]; 自噬通过诱导转录因子Snail以及Twist的降解, 抑制上皮−间质样转变 (epithelial- mesenchymal transition, EMT) 相关分子的表达[32]。以上结果说明, 自噬可以通过抑制肿瘤的生长、增殖和转移, 抑制肿瘤的发生发展进程。
此外, 多种抑癌基因也可以通过调控自噬活性抑制肿瘤的增殖与转移。在小鼠的肝脏中, 抑癌基因phosphatase and tensin homolog (PTEN) 表达缺失, 可以抑制LC3的活化, 继而抑制自噬的活性[33]。在结肠癌中, PTEN通过抑制PI3K/PKB通路, 激活自噬的发生, 促进物质代谢, 抑制肿瘤生长[34]。此外, 多种抑癌基因tuberous sclerosis complex 1 (TSC1) 和TSC2可以作为mTOR信号通路上游的抑制因子, 可以直接激活自噬的发生[35]。抑癌基因p53可通过多种途径调节细胞自噬水平[36]: 在细胞核中, 抑癌基因p53可通过多种方式上调细胞自噬; 而在细胞质 中, p53对细胞自噬具有负性调节作用, 可抑制细胞自噬的发生。在乳腺癌中, ERM结合蛋白50 (ERM binding protein 50, EBP50) 一方面可以抑制肿瘤的 增殖与转移[37], 另一方面通过与Beclin-1结合直接激活自噬核心复合物[38]。此外, 死亡效应器蛋白家族成员 (death effector domain-containing protein, DEDD) 可以通过与PI3K3C结合稳定自噬核心复合物, 从而激活自噬的活化, 促进EMT分子的降解[32]。上述研究表明, 多种抑癌基因均可以通过影响自噬活性, 发挥其抑制肿瘤增殖及转移的作用。
2.2 自噬促进肿瘤的发生与发展自噬的主要作用是清除降解细胞内受损伤的细胞结构、衰老的细胞器以及不再需要的生物大分子 (如错误折叠蛋白) 等, 为细胞的重建、再生和修复提供原料, 实现细胞内物质的再循环和再利用。自噬的这种性质也可以帮助肿瘤细胞对抗缺氧和营养因子匮乏等不良的生长环境, 从而促进肿瘤的发生发展。在恶性胶质瘤组织中, 缺氧可以促进自噬的活化, 进而激活缺氧诱导因子1/腺苷酸活化蛋白激酶 (hypoxia inducible factor 1/ AMP-activated protein kinase, HIF-1α/AMPK) 信号通路, 从而促进肿瘤细胞生长[39]。胰腺癌细胞系和胰腺癌组织标本中的自噬水平显著高于正常细胞/组织, 而抑制自噬活性可以导致肿瘤体积缩小[40]。在营养匮乏时, 肿瘤细胞通过激活突变的K-Ras或H-Ras上调自噬的活性以维持其自身的氧化代谢活动[41]。此外, 肿瘤细胞还可以利用自噬维持线粒体的功能及能量平衡, 以满足生长及增殖所需要的代谢水平[42]: 一些肿瘤细胞的基础自噬水平本身就呈现异常增高的现象[43]; 而在肿瘤缺氧区, 自噬被激活的现象被认为是肿瘤细胞存活所必需[26]。上述研究表明, 自噬可以有助于维持肿瘤细胞产物合成及代谢的平衡, 是缺乏营养的肿瘤细胞获取能量的主要代谢机制。
3 自噬与肿瘤治疗自噬在多种癌症发生发展中发挥了双重作用: 适度有效的自噬能够清除肿瘤细胞, 维持机体稳态; 而受损的自噬导致细胞生存能力降低, 不能及时清除的细胞内错误折叠蛋白加重细胞内质网应激反应, 加快癌症发展进程。因此, 充分了解细胞自噬活性状况, 在自噬发生的合适阶段给予合适治疗具有潜在的临床实践意义和药物开发意义。
自噬活化剂在肿瘤治疗中得到了一定的应用。雷帕霉素是特异性自噬激动剂, 主要通过抑制mTOR的活性, 激动自噬的活化[44], 而雷帕霉素的多种类似物已经被尝试应用于治疗神经内分泌癌及淋巴癌[45]。此外, 自噬相关程序性死亡也可帮助清除肿瘤细胞: 他莫昔芬可诱导MCF-7细胞发生自噬性死亡[45]; As2O3通过促进Beclin-1表达增加, 诱导自噬性细胞死亡, 延缓淋巴细胞性白血病和多发性骨髓瘤的进展[46]。同时, PI3K抑制剂PI-103则通过激活自噬的活化, 诱导胶质瘤细胞发生凋亡[47]。在肿瘤治疗中被广泛应用的DNA损伤诱导剂可以诱导自噬的活化: 治疗胶质瘤的替莫唑胺可以抑制DNA复制过程, 近来的研究表明替莫唑胺可以通过激活自噬影响肿瘤细胞的存活[4]。
由于自噬在肿瘤发生发展中的双重作用, 自噬抑制剂也被应用于肿瘤治疗中。自噬抑制剂中的代表是PI3K抑制剂及溶酶体抑制剂 (如氯喹及羟化氯喹)。氯喹(羟化氯喹) 的抗肿瘤效果已经在乳腺癌、结肠癌、上皮性卵巢癌、输卵管癌、肾癌、淋巴管肌瘤、黑色素瘤、非小细胞肺癌和胰腺癌等十余种肿瘤中得到体现[48]。在胶质母细胞瘤中联合应用氯喹以及PI3K抑制剂NVP-BEZ235可以增加抗肿瘤的效果[49]。上述研究表明, 正是基于自噬在肿瘤发生发展中的双重作用, 通过调节自噬活性抑制肿瘤发展, 已经逐渐成为治疗肿瘤的新方向。
4 总结综上所述, 自噬是细胞内能量代谢和自我更新的经典机制, 在生物发育和维持机体稳态过程中发挥重要作用。调节自噬活性, 一方面可以打破肿瘤细胞内环境稳态, 进而影响肿瘤细胞的存活与转移; 而另一方面, 肿瘤细胞也可以通过自噬获取能量, 因此自噬有助于维持肿瘤细胞产物合成及代谢的平衡。基于上述特性, 自噬对于肿瘤的发生发展具有双重调控作用 (表 1), 以调节自噬活性为理论依据的抗肿瘤 药物也在临床治疗中得到了一定的应用。然而, 与肿瘤相关的自噬分子机制尚待进一步研究, 与肿瘤治疗相关的自噬调节剂仍然具有局限性。
|
|
Table 1 The correlation between autophagy and tumors |
| [1] | Mathew R, Karp CM, Beaudoin B, et al. Autophagy suppresses tumorigenesis through elimination of p62 [J]. Cell, 2009, 137: 1062-1075. |
| [2] | Rabinowitz JD, White E. Autophagy and metabolism [J]. Science, 2010, 330: 1344-1348. |
| [3] | Singh R, Kaushik S, Wang Y, et al. Autophagy regulates lipid metabolism [J]. Nature, 2009, 458: 1131-1135. |
| [4] | Liu B, Bao JK, Yang JM, et al. Targeting autophagic pathways for cancer drug discovery [J]. Chin J Cancer, 2013, 32: 113-120. |
| [5] | Bhattacharya A, Wei Q, Shin JN, et al. Autophagy is required for neutrophil-mediated inflammation [J]. Cell Rep, 2015, 12: 1731-1739. |
| [6] | Budanov AV, Karin M. p53 target genes sestrin1 and sestrin 2 connect genotoxic stress and mTOR signaling [J]. Cell, 2008, 134: 451-460. |
| [7] | Li Q, Ren J. Chronic alcohol consumption alters mammalian target of rapamycin (mTOR), reduces ribosomal p70s6 kinase and p4E-BP1 levels in mouse cerebral cortex [J]. Exp Neurol, 2007, 204: 840-844. |
| [8] | Kim YC, Guan KL. mTOR: a pharmacologic target for autophagy regulation [J]. J Clin Invest, 2015, 125: 25-32. |
| [9] | Jung CH, Ro SH, Cao J, et al. mTOR regulation of autophagy [J]. FEBS Lett, 2010, 584: 1287-1295. |
| [10] | Kim J, Kundu M, Viollet B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1 [J]. Nat Cell Biol, 2011, 13: 132-141. |
| [11] | Liu H, Mi S, Li Z, et al. Interleukin 17A inhibits autophagy through activation of PIK3CA to interrupt the GSK3B- mediated degradation of BCL2 in lung epithelial cells [J]. Autophagy, 2013, 9: 730-742. |
| [12] | Zalckvar E, Berissi H, Eisenstein M, et al. Phosphorylation of Beclin 1 by DAP-kinase promotes autophagy by weakening its interactions with Bcl-2 and Bcl-XL [J]. Autophagy, 2009, 5: 720-722. |
| [13] | Kang R, Livesey KM, Zeh HJ, et al. HMGB1: a novel Beclin 1- binding protein active in autophagy [J]. Autophagy, 2010, 6: 1209-1211. |
| [14] | Zhu X, Messer JS, Wang Y, et al. Cytosolic HMGB1 controls the cellular autophagy/apoptosis checkpoint during inflammation [J]. J Clin Invest, 2015, 125: 1098-1110. |
| [15] | Molejon MI, Ropolo A, Re AL, et al. The VMP1-Beclin 1 interaction regulates autophagy induction [J]. Sci Rep, 2013, 3: 1055. |
| [16] | Ueno S, Ueno T, Iwao Y. Role of the PI3K-TOR-S6K pathway in the onset of cell cycle elongation during Xenopus early embryogenesis [J]. Dev Growth Differ, 2011, 53: 924- 933. |
| [17] | Funderburk SF, Wang QJ, Yue Z. The Beclin 1-VPS34 complex--at the crossroads of autophagy and beyond [J]. Trends Cell Biol, 2010, 20: 355-362. |
| [18] | Otomo C, Metlagel Z, Takaesu G, et al. Structure of the human ATG12-ATG5 conjugate required for LC3 lipidation in autophagy [J]. Nat Struct Mol Biol, 2013, 20: 59-66. |
| [19] | Martinez J, Malireddi RK, Lu Q, et al. Molecular characterization of LC3-associated phagocytosis reveals distinct roles for Rubicon, NOX2 and autophagy proteins [J]. Nat Cell Biol, 2015, 17: 893-906. |
| [20] | Kroemer G, Jäättelä M. Lysosomes and autophagy in cell death control [J]. Nat Rev Cancer, 2005, 5: 886-897. |
| [21] | Ganley IG, Wong PM, Gammoh N, et al. Distinct autophagosomal-lysosomal fusion mechanism revealed by thapsigargin-induced autophagy arrest [J]. Mol Cell, 2011, 42: 731-743. |
| [22] | Moreau K, Renna M, Rubinsztein DC. Connections between SNAREs and autophagy [J]. Trends Biochem Sci, 2013, 38: 57-63. |
| [23] | Fu LL, Cheng Y, Liu B. Beclin-1: autophagic regulator and therapeutic target in cancer [J]. Int J Biochem Cell Biol, 2013, 45: 921-924. |
| [24] | Liang XH, Jackson S, Seaman M, et al. Induction of autophagy and inhibition of tumorigenesis by Beclin 1 [J]. Nature, 1999, 402: 672-676. |
| [25] | White E. The role for autophagy in cancer [J]. J Clin Invest, 2015, 125: 42-46. |
| [26] | Degenhardt K, Mathew R, Beaudoin B, et al. Autophagy promotes tumor cell survival and restricts necrosis, inflammation, and tumorigenesis [J]. Cancer Cell, 2006, 10: 51-64. |
| [27] | Karantza-Wadsworth V, Patel S, Kravchuk O, et al. Autophagy mitigates metabolic stress and genome damage in mammary tumorigenesis [J]. Genes Dev, 2007, 21: 1621-1635. |
| [28] | Kongara S, Kravchuk O, Teplova I, et al. Autophagy regulates keratin 8 homeostasis in mammary epithelial cells and in breast tumors [J]. Mol Cancer Res, 2010, 8: 873-884. |
| [29] | Mathew R, Kongara S, Beaudoin B, et al. Autophagy suppresses tumor progression by limiting chromosomal instability [J]. Genes Dev, 2007, 21: 1367-1381. |
| [30] | Hait WN, Jin S, Yang JM. A matter of life or death (or both): understanding autophagy in cancer [J]. Clin Cancer Res, 2006, 12: 1961-1965. |
| [31] | Kenific CM, Thorburn A, Debnath J. Autophagy and metastasis: another double-edged sword [J]. Curr Opin Cell Biol, 2010, 22: 241-245. |
| [32] | Lv Q, Wang W, Xue J, et al. DEDD interacts with PI3KC3 to activate autophagy and attenuate epithelial-mesenchymal transition in human breast cancer [J]. Cancer Res, 2012, 72: 3238-3250. |
| [33] | Ueno T, Sato W, Horie Y, et al. Loss of PTEN, a tumor suppressor, causes the strong inhibition of autophagy without affecting LC3 lipidation [J]. Autophagy, 2008, 4: 692-700. |
| [34] | Arico S, Petiot A, Bauvy C, et al. The tumor suppressor PTEN positively regulates macroautophagy by inhibiting the phosphatidylinositol 3-kinase/protein kinase B pathway [J]. J Biol Chem, 2001, 276: 35243-35246. |
| [35] | Kittipongdaja W, Wu X, Garner J, et al. Rapamycin suppresses tumor growth and alters the metabolic phenotype in T-cell lymphoma [J]. J Invest Dermatol, 2015, 135: 2301-2308. |
| [36] | Tasdemir E, Chiara Maiuri M, Morselli E, et al. A dual role of p53 in the control of autophagy [J]. Autophagy, 2008, 4: 810-814. |
| [37] | Yao W, Feng D, Bian W, et al. EBP50 inhibits EGF-induced breast cancer cell proliferation by blocking EGFR phosphorylation [J]. Amino Acids, 2012, 43: 2027-2035. |
| [38] | Liu H, Ma Y, He HW, et al. SLC9A3R1 stimulates autophagy via BECN1 stabilization in breast cancer cells [J]. Autophagy, 2015. DOI: 10.1080/15548627.2015.1074372. |
| [39] | Hu YL, DeLay M, Jahangiri A, et al. Hypoxia-induced autophagy promotes tumor cell survival and adaptation to antiangiogenic treatment in glioblastoma [J]. Cancer Res, 2012, 72: 1773-1783. |
| [40] | Yang S, Wang X, Contino G, et al. Pancreatic cancers require autophagy for tumor growth [J]. Genes Dev, 2011, 25: 717- 729. |
| [41] | Guo JY, Chen HY, Mathew R, et al. Activated Ras requires autophagy to maintain oxidative metabolism and tumorigenesis [J]. Genes Dev, 2011, 25: 460-470. |
| [42] | White E, Mehnert JM, Chan CS. Autophagy, metabolism, and cancer [J]. Clin Cancer Res, 2015, 21: 5037-5046. |
| [43] | Yang A, Rajeshkumar NV, Wang X, et al. Autophagy is critical for pancreatic tumor growth and progression in tumors with p53 alterations [J]. Cancer Discov, 2014, 4: 905-913. |
| [44] | Ballou LM, Lin RZ. Rapamycin and mTOR kinase inhibitors [J]. J Chem Biol, 2008, 1: 27-36. |
| [45] | Meric-Bernstam F, Gonzalez-Angulo AM. Targeting the mTOR signaling network for cancer therapy [J]. J Clin Oncol, 2009, 27: 2278-2287. |
| [46] | Qian W, Liu J, Jin J, et al. Arsenic trioxide induces not only apoptosis but also autophagic cell death in leukemia cell lines via up-regulation of Beclin-1 [J]. Leuk Res, 2007, 31: 329- 339. |
| [47] | Yang ZJ, Chee CE, Huang S, et al. The role of autophagy in cancer: therapeutic implications [J]. Mol Cancer Ther, 2011, 10: 1533-1541. |
| [48] | Li X, Xu HL, Liu YX, et al. Autophagy modulation as a target for anticancer drug discovery [J]. Acta Pharmacol Sin, 2013, 34: 612-624. |
| [49] | Cerniglia GJ, Karar J, Tyagi S, et al. Inhibition of autophagy as a strategy to augment radiosensitization by the dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor NVP-BEZ235 [J]. Mol Pharmacol, 2012, 82: 1230- 1240. |
 2016, Vol. 51
2016, Vol. 51


