2. 山西大学化学化工学院, 山西太原 030006
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China
黄芪是我国传统补益中药材,性微温,具有补气固表、利尿生津、托毒排脓和敛疮生肌的作用。《中国药典》2010年版规定,黄芪来源为豆科植物蒙古 黄芪[Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge) Hsiao] 或膜荚黄芪 [Astragalus membranaceus (Fisch.) Bge] 的干燥根,主产于山西、内蒙、甘肃和黑龙江等地; 红芪为豆科植物多序岩黄芪 (Hedysarum polybotrys Hand.-Mazz.) 的干燥根,主产于甘肃陇南地区[1]。传统中医理论认为两者的性味、归经、功效和主治基本相同,我国西北一些地方曾将红芪作为黄芪使用[2],台湾、港、澳及东南亚一些地区有药用红芪的习惯,认为红芪是黄芪的优质品种[3]。1977年版《中国药典》曾将红芪与蒙古黄芪、膜荚黄芪作为正品黄芪的三大来源之一,但之后的各版药典将其单列为红芪。
近年来,众多学者对黄芪和红芪的黄酮类、皂苷类等次级代谢产物进行了深入的比较研究。红芪中主要含有芒柄花素和芒柄花苷,其他异黄酮类成分种类丰富但含量均较低; 黄芪中则主要含有毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素等六种异黄酮类成分。其中,芒柄花素和芒柄花苷是黄芪和红芪的共有成分。黄芪主要含有环阿尔廷型四环三萜皂苷类成分和较少量的齐墩果烷型三萜皂苷; 红芪主要含有齐墩果烷型的大豆皂苷类成分[4]。
DNA条形码技术已成为新兴的中药材物种鉴别手段。2011年中国植物条形码工作组 (Chinese Plant BOL Group) 研究发现,ITS序列具有最高的物种分辨率,将ITS/ITS2序列作为种子植物的核心DNA条形码[5]。DNA分子标记技术可在分子水平上利用基因序列间的变异位点对物种进行分析和比较,如羌活[6]、山茱萸[7]、党参[8]、花椒[9]等。代谢组学是近年来出现的继基因组学、蛋白组学之后的一种新型的组学技术,具有整体观的研究思路。其中植物代谢组学以植物提取物为研究对象,特别适合于中药材等复杂体系的分析,近年来已成功应用于中草药的品质评价和化学组成比较,如款冬花[10]、黄芪[11]、厚朴[12]和人参[13]等。
由于基因型决定化学表现型,本研究拟采用ITS/ITS2序列分析结合1H NMR代谢组学技术对黄芪和红芪进行遗传学和化学组成的系统比较,揭示二者的相似性和差异性,为阐明两者相似功效的物质基础、合理用药和资源利用奠定了基础。目前蒙古黄芪是商品黄芪药材的主要来源。因此,本研究中黄芪选择3个主产区的蒙古黄芪。
材料与方法 样品来源本研究采用的黄芪和红芪样品来源及详细信息见表 1。样品经山西大学秦雪梅教授鉴定,黄芪样品为蒙古黄芪 [A. membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao] 的干燥根,红芪样品为多序岩黄芪 (H. polybotrys Hand.-Mazz.) 的干燥根。样品均保存在山西大学中医药现代研究中心。
|
|
Table 1 The samples of A. membranaceus var. mongholicus and H. polybotrys |
Bruker 600-MHz AVANCE III NMR Spectrometer (600.13 MHz质子频率,德国布鲁克公司600兆核磁仪)。XP基因扩增仪 (杭州博日科技有限公司),ZF-258全自动凝胶成像分析系统 (上海嘉鹏科技有限公司)。分析纯甲醇,分析纯氯仿,娃哈哈纯净水,NMR试剂重水 (Norell,Landisville,USA),氘代甲醇、氘代氯仿 (99.8%,Merck,Germany),氘代氢氧化钠 (Armar,Switzerland),氘代三甲基硅烷丙酸钠盐 (TSP,Cambridge Isot ope Laboratories Inc.,MA)。
ITS序列测定将每份药材样品各取三株,称样量为200 mg,加入液氮研磨后,利用CTAB植物基 因组DNA快速提取试剂盒法提取总DNA。ITS扩增、测序引物正向ITS5F为5'-GGAAGTAAAAGTCGTA ACAAGG-3',反向ITS4R为5'-TCCTCCGCTTATTG ATATGC-3'。PCR反应体积为25 μL,体系内包含2× EasyTaq PCR Super Mix 12.5 μL、ITS5F和4R各1 μL、模板DNA 2 μL,用双蒸水补足反应体系的体积。扩增程序: 93 ℃变性5 min,再进行35个循环 (93 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s),最后72 ℃ 延伸5 min。PCR产物在全自动凝胶成像仪上成像,并由上海Sunny公司完成双向测序。测序峰图利用CodonCode Aligner V 3.7.1 (CodonCode Co.,USA) 校对拼接,去除引物区。通过NCBI的BLAST功能对截取后待鉴定样品的ITS序列进行检索,综合考虑score值、coverage值和evalue值鉴定样品基源。ITS序列采用基于隐马尔可夫模型的HMMer注释方法去除两端5.8 S和28 S区段即可获得ITS2 间隔区序列。采用DNAMAN 软件 (Demo Version 4.0,USA) 将测得的黄芪和红芪的序列进行比对及同源性分析。
样品制备参照本课题组建立的方法[10],精密称取液氮研磨后的药材粉末各200 mg,置于10 mL离心管中,分别加蒸馏水及甲醇各1.5 mL,氯仿3 mL,涡旋混匀1 min,超声提取25 min,室温下离心 (3 500 r·min−1) 25 min,提取液分为两相,分别减压浓缩蒸干。于测定前用氘代试剂溶解,其中甲醇水相层用氘代甲醇400 μL与缓冲重水 (取12.5 mg TSP和0.3~0.325 g KH2PO4溶于25 mL D2O中,以1 mol·L−1氘代氢氧化钠溶液调节pH 6.0) 400 μL溶解,氯仿相部分用氘代氯仿 800 μL溶解,溶解液分别转移至1.5 mL离心管中,离心(13000 r·min−1) 10 min,分别移取上清液600 μL于5 mm核磁管中待测。每份药材样品平行备样3份。
1H NMR测定样品在25 ℃下于600 MHz NMR仪上测定,扫描次数为64,谱宽12 345.7 Hz,脉冲时间14 μs,采样时间2.654 s,弛豫时间1.0 s,采样数据点65 536,FID分辨率0.188 Hz,采样间隔40.5 μs,相位调节、基线调节及峰校正均为手动。甲醇水相提取物核磁测定采用noesygppr1d序列压制水峰,用氘代甲醇进行锁场,内标为TSP。氯仿相提取物核磁测定采用zg 30序列,用氘代氯仿锁场,内标为TMS。
数据分析核磁图谱采用MestReNova (version 8.0.1,Mestrelab Research,Santiago de Compostella,Spain) 进行处理。核磁图谱经过定标、相位、基线校准后,以δ0.04积分段对甲醇水相化学位移区间δ 0.03~6.19进行积分,其中δ4.71~4.95 (残余水峰) 和δ3.27~3.39 (残余甲醇峰) 不进行积分。将归一 化后的积分数据导入SIMCA-P 13.0 (Umetrics,Umea,Sweden) 软件中进行主成分分析 (principal component analysis,PCA),再用偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA) 和正交偏最小二乘法判别分析(orthogonal PLS-DA),找出差异代谢产物。对差异代谢产物相对峰面积进行t检验,分析显著性差异代谢产物。
结果与分析 1 黄芪、红芪ITS碱基序列的比较分析9份不同来源黄芪样品的ITS序列长度均为 601 bp,在NCBI网站上将测得序列在线BLAST后结果显示: 样品SX-1碱基序列为蒙古黄芪KJ999352,其余8个样品碱基序列为蒙古黄芪KJ999353.1,覆 盖率与相似度均为100%; 两种序列高度相似,仅有1个位点 (474 bp处) 存在差异,即KJ999353.1为C,KJ999352为T。黄芪样品来源于山西、甘肃和内蒙三个产地,其中甘肃和内蒙的栽培黄芪与山西2个野生黄芪的ITS序列完全一致,可见不同产地和种植方式黄芪的ITS/ITS2序列变异较小,说明ITS/ITS2序列用于黄芪药材的鉴定具有较好的稳定性。
不同来源的3份红芪的ITS序列长度为615~616 bp,在NCBI网站上将测得序列在线BLAST后结果显示: 样品RQ-1碱基序列为多序岩黄芪KJ999375.1,样品RQ-2、RQ-3碱基序列为多序岩黄芪KF032294.1,覆盖率与相似度均为100%。红芪的2个单倍型共有4个位点存在差异 (表 2)。
|
|
Table 2 The intraspecific variable sites in the ITS sequence of H. polybotrys. aThe site base deletion |
黄芪与红芪的ITS碱基序列输入DNAMAN后对齐长度为616,两者共有508个位点相同,占总ITS碱基长度的82.47%; 共有103个位点存在差异,占总ITS碱基长度的16.72%。黄芪G+C含量为53.31%,红芪G+C含量为52.32%。可见,两者虽然为不同属的植物,但ITS区间的碱基序列具有较高的相似性。ITS可以进一步分为ITS1、ITS2和5.8S三个片段。二者在这三个片段的序列对比结果见表 3。在ITS1区,虽然两者的碱基序列长度不同,但有183个位点的碱基是相同的,占总ITS1碱基长度的76.57%,共有53个差异位点存在差 异,占总ITS1碱基长度的22.18%,该区间黄芪的G+C含量高于红芪。5.8S序列进化缓慢且保守,在生物种间变化小,两者的5.8S区间碱基长度一致,均为164 bp,G+C含量均为51.22%,仅有两个位点存在差异 (241 bp和244 bp),有162个位点保持一致,占5.8S碱基长度的98.78%。两者的ITS2区有163个位点相同,占总ITS2碱基长度的76.53%,共有48个位点存在差异,占总ITS2碱基长度的22.54% ,黄芪的G+C含量低于红芪。两者差异位点的具体信息见表 4,可看出在差异位点中,(红芪) T-C(黄芪)、(红芪) C-T (黄芪) 出现的概率最高,约为28.16%; (红芪) A-C (黄芪)、(红芪) C-A (黄芪) 出现的概率最低,约为5.83%。
|
|
Table 3 Sequence characteristics of ITS/ITS2 of A. membranaceus var. mongholicus and H. polybotrys |
|
|
Table 4 The variable sites in the ITS sequence between A. membranaceus var. mongholicus and H. polybotrys. aBase is expressed as: H. polybotrys − A. membranaceus var.mongholicus; “−” means the site base deletion |
采用氯仿−甲醇−水 (2∶1∶1) 的两相提取法分别得到黄芪、红芪的甲醇水相和有机相提取物。通过标准品对照、文献报道数据以及BMRB数据库中的标准物质对照,共指认出34个化合物 (表 5)。
|
|
Table 5 1H NMR (600MHz,J in Hz) assignments of major metabolites in HQ and RQ. aFrom HQ,bFrom RQ |
由图 1可见,黄芪与红芪的甲醇水相图谱在 (δ 6.19~δ 0.00) 区间较为相似,在有机酸和氨基酸区 (δ 3.10~δ 0.00),二者均含有缬氨酸、丙氨酸、精氨酸、柠檬酸、天冬酰胺等物质信号,其中琥珀酸 (2.45,s) 仅能在黄芪图谱中检测到; 在碳水化合物区 (δ 6.19~δ 3.10),二者均主要含有蔗糖,以及少量的葡萄糖、鼠李糖和半乳糖等。在芳香区 (δ 9.55~δ 6.19),二者则存在较大差异,黄芪中含有腺嘌呤 (8.22,s; 8.28,s)、毛蕊异黄酮苷 (7.26,dd,J = 2.4,9.0 Hz; 7.31,d,J= 2.4 Hz; 8.17,d,J= 8.4 Hz; 8.31,s) 和芒柄花苷 (7.05,d,J = 2.4 Hz; 7.26,dd ,J = 2.4,9.0 Hz; 7.31,d,J = 2.4 Hz; 7.53,d,J = 9.0 Hz; 8.18,d,J = 8.14 Hz; 8.32,s),而红芪在同样的位置观测不到上述物质信号。从红芪图谱中可直观看出富马酸 (6.53,s) 信号明显高于黄芪中的该物质峰信号,红芪在该区间特有的信号为6.36,d,J = 16.2 Hz; 7.14,t,J = 7.3 Hz; 7.22,s; 7.65,d,J = 7.8 Hz; 7.72,d,J = 7.8 Hz; 8.13,s,但上述信号归属的物质未知。
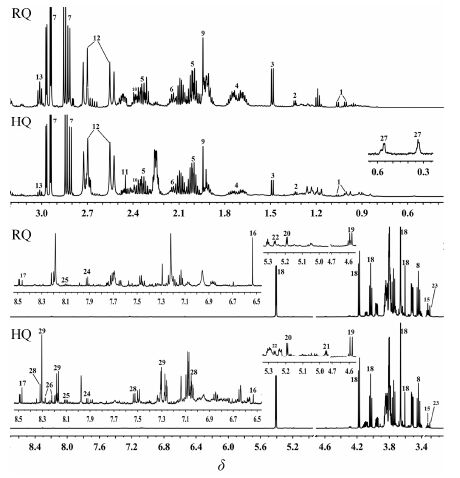
|
Figure 1 1H NMR spectra of aqueous methanol extracts in A. membranaceus var.mongholicus (HQ) and H. polybotrys (RQ) |
氯仿相提取物为低极性成分,从图 2中可看出黄芪与红芪的氯仿相图谱中主要含脂肪酸类 (1.2~1.3,m; 1.6,m; 2.36,t,J = 7.5 Hz; 2.77,t,J = 6.6 Hz; 5.35,m) 和黄酮类苷元,但二者黄酮苷元的种类不同。红芪含有3-甲氧基-4-羟基-反式苯丙烯酸正十八醇酯[14] (6.36,d,J= 15.6 Hz; 7.61,d,J= 15.6 Hz) 和3-羟基- 9-甲氧基紫檀烷[15] (3.53,m; 3.77,s; 4.24,dd,J = 10.9,5.0 Hz; 5.49,d,J= 6.8 Hz; 7.13,d,J= 8.8 Hz; 7.39,d,J= 8.4 Hz); 而黄芪中的黄酮苷元类成分为8,2'-羟基- 7,4'-甲氧基异黄烷[16] (6.35,d,J = 2.4 Hz; 6.39,dd,J = 8.4,3.0 Hz; 6.44,d,J = 8.4 Hz; 6.78,d,J= 9.0 Hz; 6.94,d,J= 8.4 Hz)。
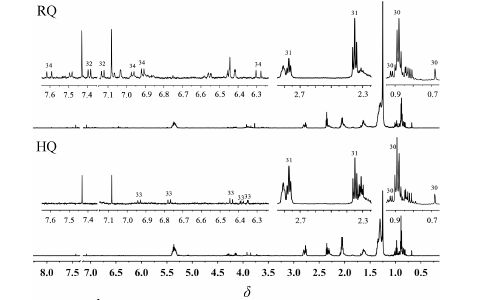
|
Figure 2 1H NMR spectra of chloroform extracts in HQ and RQ |
由于黄芪和红芪二者甲醇水相的氨基酸、有机酸 和糖区相似,因此采用多元统计分析方法对这一位移区间 (δ 6.19~δ 0.00) 进行深入分析。在PCA得 分散点图 (图 3a) 中,第1主成分和第2主成分共解释了55.4%(PC1: 34.4%,PC2: 21.0%) 的原始变量信息,二者既有部分重叠,又有一定分离趋势,说明黄芪与红芪在该区域既有相似性,又存在一定差异性。虽然样品RQ-1、SX-1与种内其他样品的ITS序列不同,但在化学组成上与种内其他样品无显著性差异。为了进一步确定黄芪与红芪在这一区间的化学差异,需要采用有监督的PLS-DA分析进一步放大组间差异,而缩小组内差异。排列实验模型验证结果 (图 3b) 显示,模型虽然较差,但仍然有效 (R2X = 0.689,R2Y = 0.932,Q2 = 0.871),进一步说明二者既存在相似性 又有差异性。OPLS-DA分析的S-plot图 (图 3d) 和VIP > 1对应的变量显示黄芪和红芪在丙氨酸、精氨酸、乙酸、γ-氨基丁酸、谷氨酸、谷氨酰胺、蔗糖、尿苷和牛磺酸的含量上可能存在一定差异。然后以TSP为内标对两者的18个共有化合物做进一步t检验分析,结果如图 4所示,这些成分在红芪中含量均高于黄芪,其中缬氨酸、牛磺酸、尿苷和麦芽糖具有显著性差异 (P < 0.05); 丙氨酸、谷氨酸、谷氨酰胺、γ-氨基丁酸、柠檬酸和苹果酸具有极显著性差异 (P < 0.01)。
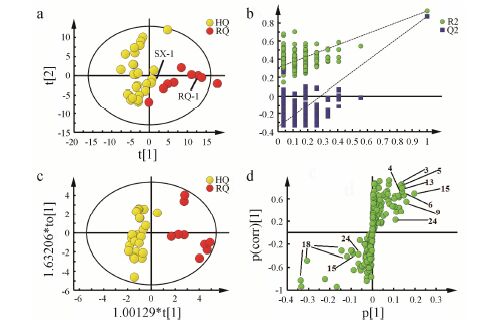
|
Figure 3 PCA score plot (a),permutation test model validation plot (b),OPLS-DA score plot (c) and loading S-plot (d) between HQ and RQ of aqueous methanol extracts |
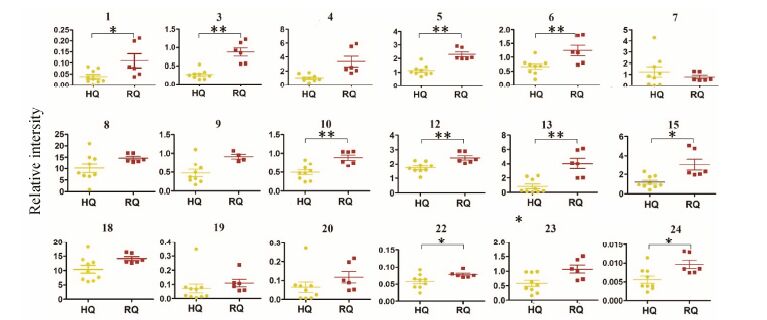
|
Figure 4 Quantitative comparisons of the intensive polar compounds in HQ and RQ. Y axis expressed as relative intensity against the peak area of the internal standard TSP at δ 0. P < 0.05,**P < 0.01 |
本文采用ITS/ITS2分子标记方法对黄芪与红芪的ITS序列进行了比较,二者的ITS碱基序列一致性为82.47%,差异位点占16.72%。黄芪与红芪同科不同属,但两者ITS序列相同位点远多于差异位点,说明二者在植物学上亲缘关系密切。此外,本研究还以核磁图谱中鉴定的34个化合物为指标对二者进行了
全面比较,结果显示二者初级代谢产物差异较小,仅存在物质含量的不同; 次级代谢产物差异较大,主要体现在化学成分种类的不同。已有研究表明红芪和黄芪的皂苷类成分存在较大差异,黄芪以阿尔廷型四环三萜皂苷类为主,而红芪以齐墩果烷型的大豆皂苷类成分为主[4]; 对于黄酮类成分,黄芪中毛蕊异黄酮苷的含量高出红芪约10倍,而红芪的芒柄花素含量约为黄芪的3倍[17],另外红芪还含有特征的黄酮类成分3-羟基-9-甲氧基紫檀烷[18]。本研究显示,黄芪与红芪在黄酮类和皂苷类成分上的差异与文献报道一致; 但由于核磁共振的灵敏度较低,两者的核磁共振指纹中均未检测到芒柄花素,后续的研究中还应结合液质联用等技术手段进一步分析两者的次级代谢产物差异。此外,本研究在红芪的极性成分核磁指纹中发现的若干特征信号也有待于进一步鉴定。虽然黄芪和红芪的黄酮类成分种类不同,但苷元的母体化学结构相近,在体内相关酶的作用下很可能会发生相互转化,因而可能发挥相似的功效。因此,黄酮类成分结构与黄芪、红芪功效的相关性也值得进一步深入研究。之前对黄芪和红芪的化学比较大多限于次级代谢产物,本研究揭示了两者在初级代谢产物 上的相似性和差异性。已有研究显示黄芪和红芪中的γ-氨基丁酸 (GABA) 具有显著的降压活性,红芪中GABA含量高于黄芪,其降压活性也强于黄芪[19]。鉴于黄芪与红芪具有相似的功效,但在次级代谢产物上存在较大差异,因此,两者所含初级代谢产物与功效的相关性值得进一步研究。除了小分子化合物外,多糖也是黄芪的重要活性成分,虽有研究显示红芪总多糖含量高于黄芪总多糖的含量[20],但总多糖指标难以反映两者在多糖结构上的差异性和相似性,因此,后续的研究还应采用糖谱等技术[21, 22]对两者的多糖进行结构分析比较。
本课题组前期曾采用核磁共振代谢组学技术结合ITS2分子标记技术对恒山黄芪与川黄芪的差异性进行了比较[11]。与前期工作相比,本研究不仅关注了黄芪与红芪的差异性,而且针对红芪曾作为黄芪法定代用药材的现象分析了两者的相似性。通过两者的化学相似性对黄芪的功效贡献成分进行了推测; 在对两者的分子标记比较方面,本研究从序列长度、碱基顺序、G+C含量等指标对两者的ITS片段 (ITS1+ 5.8S+ITS2) 进行了比较,从分子标记角度深入揭示了黄芪和红芪的差异性和相似性。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China(中华人民共和国药典)[S]. Part 1. Beijing:China Medical Science Press, 2010:283-284, 142. |
| [2] | Yang Z, Liu JM, Wang FH, et al. Studies on chemical constituents of Hedysarum polybotrys Hand.-Mazz[J]. China J Chin Mater Med(中国中药杂志), 1992, 17:615-616. |
| [3] | Li GM, Wang WN, Hu MK, et al. Studies on pharmacog-nosy of Hedysarum polybotrys[J]. China J Chin Mater Med(中药通报), 1987, 12:453-455. |
| [4] | Zheng SS. Comparative Study on the Chemical Constituents of Hedysari Radix and Astragali Radix(中药红芪、黄芪化 学成分比较研究)[D]. Shanghai:Shanghai University of Traditional Chinese Medicine, 2011. |
| [5] | China Plant BOL. Comparative analysis of a large dataset indicates that internal transcribed spacer(ITS) should be incorporated into the core barcode for seed plants[J]. Proc Natl Acad Sci USA, 2011, 108:19641-19646. |
| [6] | Xin TY, Yao H, Luo K, et al. Stability and accuracy of the identification of Notopterygii Rhizoma et Radix using the ITS/ITS2 barcodes[J]. Acta Pharm Sin(药学学报), 2012, 47:1098-1105. |
| [7] | Hou DY, Song JY, Yao H, et al. Molecular identification of Corni Fructus and its adulterants by ITS/ITS2 sequences[J]. Chin J Nat Med(中国天然药物), 2013, 11:121-127. |
| [8] | Zhao S, Xin TY, Hou DY, et al. Identification of Codonopsis Radix and its adulterants using the ITS/ITS2 barcodes[J]. Mod Tradit Chin Med Mater-World Sci Technol(世界科学技术:中医药现代化), 2013, 15:421-427. |
| [9] | Hou DY, Song JY, Yang P, et al. Application Study of ITS/ITS2 Barcodes in Identification of Zanthoxmli Pericarpium[J]. Chin Pharm J(中国药学杂志), 2014, 49:534-538. |
| [10] | Zhi HJ, Qin XM, Sun HF, et al. Metabolic fingerprinting of Tussilago farfara L. using 1H NMR spectroscopy and multivariate data analysis[J]. Phytochem Anal, 2012, 23:492-501. |
| [11] | He P, Li ZY, Fan SC, et al. Differences between Hengshan-huangqi and Chuanhuangqi based on metabolomics and ITS2 sequences[J]. Acta Pharm Sin(药学学报), 2013, 48:1595-1601. |
| [12] | Zhao JP, Bharathi A, Michael C, et al. Metabolomic differen-tiation of Maca(Lepidium meyenii) accessions cultivated under different conditions using NMR and chemometric analysis[J]. Planta Med, 2012, 78:90-101. |
| [13] | Yang SO, Shin YS, Hyun SH, et al. NMR-based metabolic profiling and differentiation of ginseng roots according to cultivation ages[J]. J Pharm Biomed Anal, 2012, 58:19-26. |
| [14] | Hai LS, Zhang QY, Zhao YY, et al. Studies on chemical constituents from root of Hedysarum polybotrys[J]. China J Chin Mater Med(中国中药杂志), 2004, 29:432-434. |
| [15] | Hai LS, Liang H, Zhao YY, et al. Studies on chemical constituents from root of Hedysarum polybotrys[J]. China J Chin Mater Med(中国中药杂志), 2002, 27:843-845. |
| [16] | Ma XF. Studies on the Chemical Constituents of Astra-galus membranaceus Bge. var. Mongholicus(Bge.) Hsiao(蒙古黄芪的化学成分研究)[D]. Shenyang:Shenyang Pharmaceutical University, 2003. |
| [17] | Zhang WL, Choi RCY, Zhan JYX, et al. Can Hedysari Radix replace Astragali Radix in Danggui Buxue Tang, a Chinese herbal decoction for woman aliment?[J]. Phytomedicine, 2013, 20:1076-1081. |
| [18] | Pan JX, Liu W, Wei D, et al. Studies on chemical constitu-ents of Hedysarum polybotrys Hand.-Mazz[J]. J Beijing Univ Health Sci, 1984, 16:248-250. |
| [19] | Hiroshi H, Funyaama S, Endo K. Hypotensive principle of Astragalus and Hedysarum roots[J]. Planta Med, 1976, 30:297-302. |
| [20] | Liu J, Hu XG, Yang Q, et al. Comparison of the immunoregu-latory function of different constituents in Radix Astragali and Radix Hedysari[J]. Biomed Res Int, 2010, 2010:479426. |
| [21] | Guan J, Zhao J, Feng K, et al. Comparison and characteriza-tion of poly saccharides from natural and cultured Cordyceps using saccharide mapping[J]. Anal Bioanal Chem, 2011, 399:3465-3474. |
| [22] | Guan J, Li SP. Discrimination of polysaccharides from traditional Chinese medicines using saccharide mapping-Enzymatic digestion followed by chromatographic analysis[J]. J Pharm Biomed Anal, 2010, 51:590-598. |
 2015, Vol. 50
2015, Vol. 50


